Похожие презентации:
d30a878c70874ef0b0f62f177028f49d
1.
ВЫВОД:☺ Число (ē) на последнем
энер. уровне равно номеру
группы (элементы гл.
подгрупп);
2.
☺ У элементов побочнойподгруппы идёт заполнение предпоследнего энер.
уровня(-d-орбитали), а на
последнем находится
всегда два ( ē);
3.
☺ Каждый атом стремитсязавершить свой энерг.
уровень, максимум (ē) дол-
жно быть равно 8ē !!!;
(инертные газы)
4. Тема: Степень окисления. С.О.
02.12.2025г5.
6.
+1-1
7.
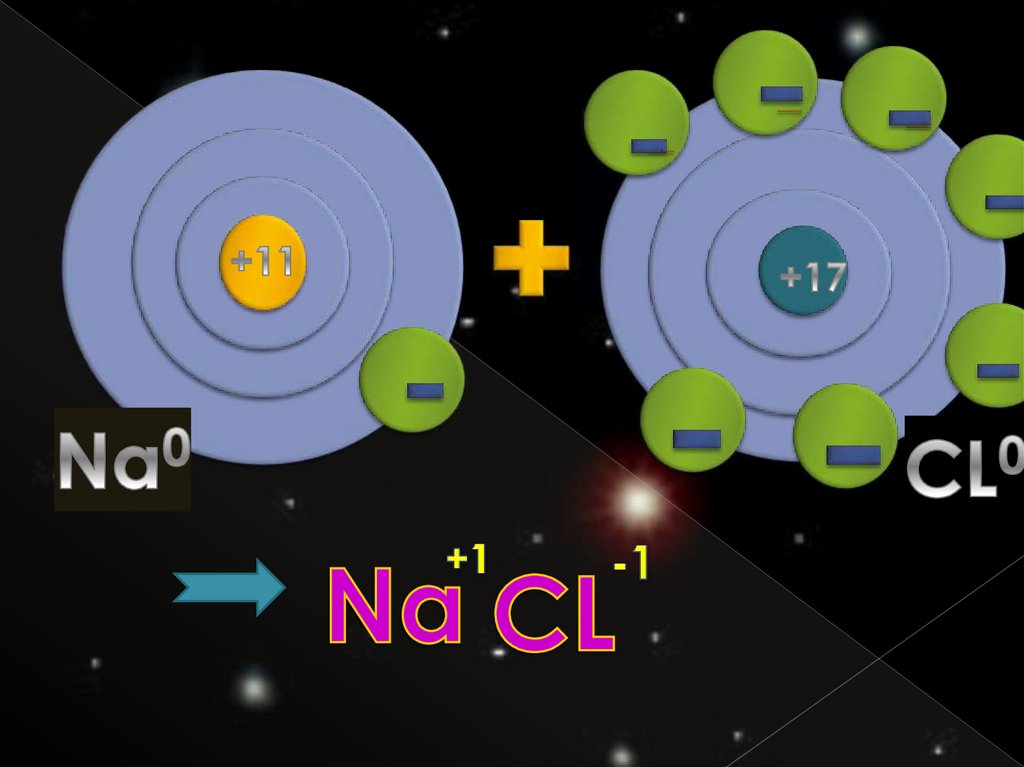
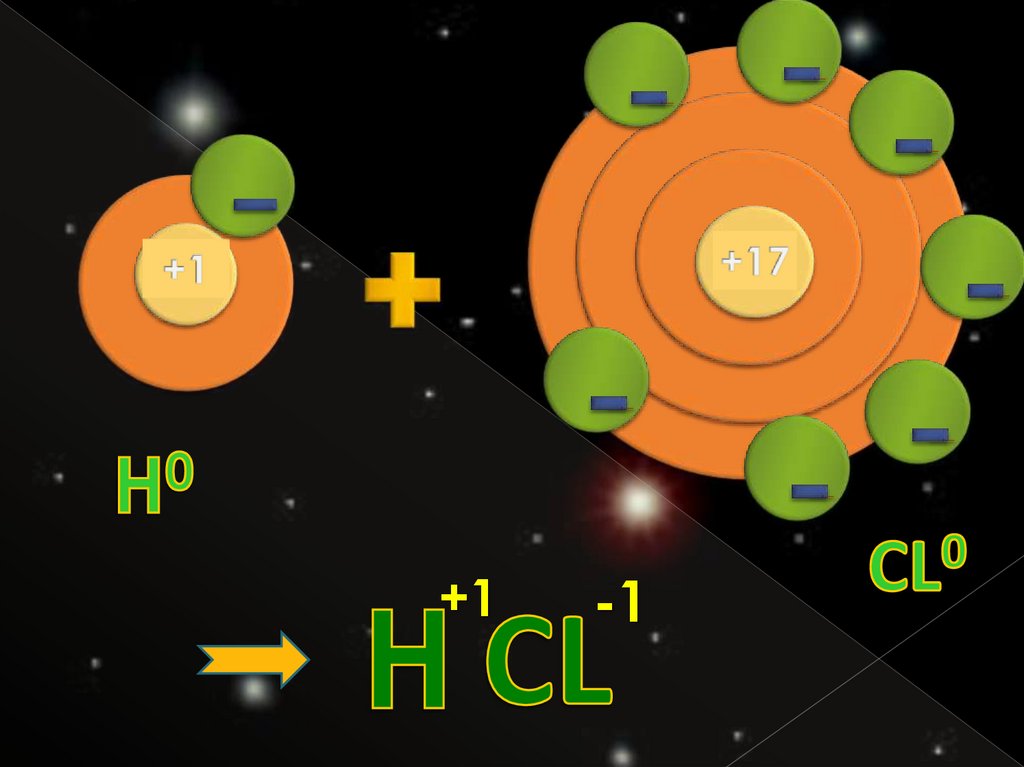
Степень окисления – этоусловный заряд атомов химического элемента в соедине-
нии, вычисленный на основе
предположения, что все
соединения состоят только из
ионов.
8.
☺ Численное значениеС.О. элемента, численно
равно заряду иона.
☺ Правильная запись:
Заряд иона Al3+
+3
Степень окисления Al
9.
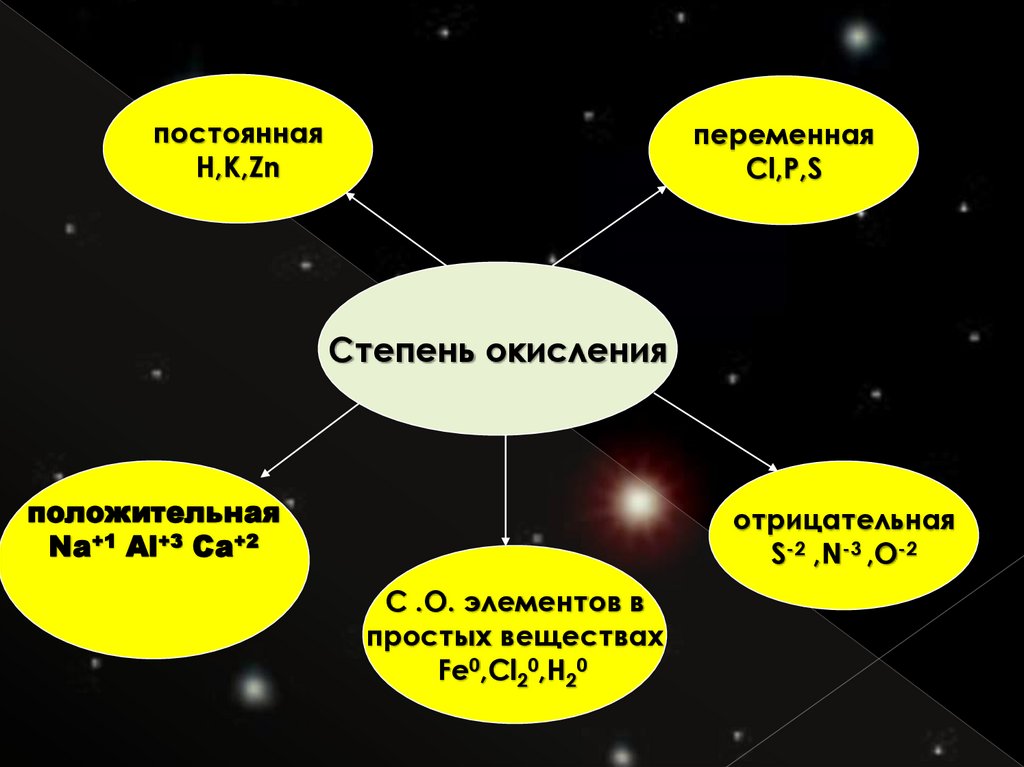
постояннаяH,K,Zn
переменная
Cl,P,S
Степень окисления
положительная
Na+1 Al+3 Ca+2
отрицательная
S-2 ,N-3 ,O-2
С .О. элементов в
простых веществах
Fe0,Cl20,H20
10.
Алгоритм определениястепени окисления
(С.О.)
11.
ПОСТОЯННУЮ С.О.ИМЕЮТ ВЕЩЕСТВА
1.У свободных атомов
(инертные газы), и у простых
веществ С.О. всегда равна
нулю.
0
0
0
0
Например: He ; S ; P ; Ar ;
Mg0; Na0; Ca0;
12.
2.Молекулы простых газообразных веществ состоятиз двух атомов со С. О.
равной нулю;
0
0
0
Например: H2 ; N2 ; O2 ;
0
0
0
0
0
F2 ; Cl2 ; Br2 ; I2 ; O3 ;
13.
3.В соединенияхпостоянную С.О. имеют
атомы: 1)Все Ме имеют
только положительную
С.О.(ее максимальное
значение равно номеру
группы):
14.
а)Ме главной подгруппыI группы = +1. ( Li, Na, K, Rb,
Cs.);
б)Ме главной подгруппы II
группы = +2.(Be, Mg, Ca, Sr,
Ba.);
в) Алюминий = +3;
15.
4.Кислород всегда имеет С.О.= -2 (исключение O+2F2-1 и
пероксиды Na2+1O2-1; H2+1O2-1);
5.Водород всегда имеет
С.О. = +1 (исключение с
+1
-1
Ме Н );
16.
6.Самый электроотрицательный элемент фтор, онимеет во всех соединениях
С. О. = -1 т.е. F-1;
7. Высшая положительная
(+) С.О. элемента равна
номеру группы.
17.
8. Низшая отрицательная(-) С.О. элемента равна
(номер группы минус 8)
18.
9.В СОЕДИНЕНИЯХСУММА ВСЕХ С.О. РАВНА
НУЛЮ
Например: Определить
С.О. в соединениях- 1)Н2О;
2)Н2SO4; 3)Cu(OH)2;
4)NH3; 5)Al2(CO3)3 6)CaO
7)CuCl2
19.
+1-2
H2 O
2×(+1)+ 1×(-2)=0
+1
+6
-2
x
-2×4=-8
H2 S O4
+1×2=+2
(+1×2) + (+6) + (-8) =0
20.
Cu+2(O-2H+1)2 +2(-2+1)×2=0N-3H+13 -3+(+1×3)=0
Al+32 (C+4 O-23)3
(+3×2)+[(+4)+(-2×3)]×3=0
Ca+2O-2
+2-2=0
+2
-1
Cu Cl 2
+2+(-1×2)=0
21.
☺ С.О. – это составлениеформул бинарных
(состоящих из двух
элементов) соединений и
правильное их название.
22.
☺ При составлении формулбинарных соединений на
первое место ставится
элемент с (+)С.О.
на второе место элемент с
(-)С.О.
23.
Например: составитьформулу соединений между
элементами
1)Na и O;
2)Al и S;
3)Ca и O;
4)C и Н;
5)N и O;
1)Na+12O-2
+3
-2
2)Al 2S 3
3)Ca+2O-2
4)C-4Н+14
5)N+52O-25
24.
ДОМА:1)Расставить С.О. и подписатьназвания:1)Al2S3; 2)Al2O3; 3)H2S;
4)CaS; 5) SO2; 6)SO3;7)Mn2O7;
8)MnO3;9)CuH2; 10)Mn2O3 ;
11)Al4C3; 12)Ca3N2; 13)OF2;
14)H2O2; 15)Na4Si;
16)Mg3P2 ;
17)NO2; 18)FeCl3; 19)FeO;
25.
2)Расставить C.О. и подписатьназвания в соединениях: 1)H2SO3;
2)Fe(OH)3;3)H3PO4;4)Fe(OH)2;
5)NH4NO3; 6)KOH; 7)Na2SiO3;
8)Mg(NO3)2;9)HClO; 10)AlPO4;
11)CuSO4; 12) (NH4)2CO3;
13)Ca3(PO4)2; 14) BaSO4;
26.
05.12.2025г.Тема урока
окислительновосстановительные
реакции
«О.В.Р.»
27.
Цель урока:• закрепить понятия “С.О.”,
процессы “окисления”,
“восстановления”;
• закрепить навыки в составлении
уравнений ОВР методом
электронного баланса;
• научить прогнозировать
продукты ОВР.
• работать с алгоритмом
«Составление ОВР»
28.
29.
Атомы, молекулы илиионы,отдающие электроны
, называются
восстановителями. Во время
реакции они окисляются.
Отдаёт, Окисляется,
Восстановитель.
30.
Атомы, молекулы или ионы,присоединяющие электроны
,называются
окислителями. В ходе реакции
они восстанавливаются.
Принимает, Восстанавливается,
Окислитель.
31.
ОКИСЛЕНИЕ – ОТДАЧАЭЛЕКТРОНОВ (повышение с.о.)
1) S0 – 4ē = S+4
2) S-2 -2ē = S0
ВОССТАНОВЛЕНИЕ-ВЗЯТИЕ
ЭЛЕКТРОНОВ (понижение с.о.)
1)S0 + 2ē = S-2
2)S+6 + 2ē= S+4
32.
Проверка д/задания:ДОМА:1)Расставить С.О. и подписать
названия:1)Al2S3; 2)Al2O3; 3)H2S; 4)CaS;
5) SO2; 6)SO3;7)Mn2O7; 8)MnO3;9)CuH2;
10)Mn2O3 ; 11)Al4C3; 12)Ca3N2; 13)OF2;
14)H2O2; 15)Na4Si;
18)FeCl3; 19)FeO;
16)Mg3P2 ;
17)NO2;
33.
ДОМА: Расставить С.О. уатомов хим. элементов в
соединениях в
следующих уравнениях
хим. реакций:
34.
1)Hg+KMnO4 + HCl=HgCl2 + KCl+ MnO2 + H 2O;
2)Hg + FeCl3 = HgCl2+ FeCl2; Д
О
3) CuSO4 + Fe = FeSO4 + Cu;
4) Na + H3PO4 = Na3PO4 + H2; М
А
5) CuO + H2 = Cu + H2O;
6) KClO3 + H3PO3 = H3PO4+KCl;
7) K2Cr2O7 + K2S + H2SO4 =
Cr2(SO4)3 + S + K2SO4 + H2O;
35.
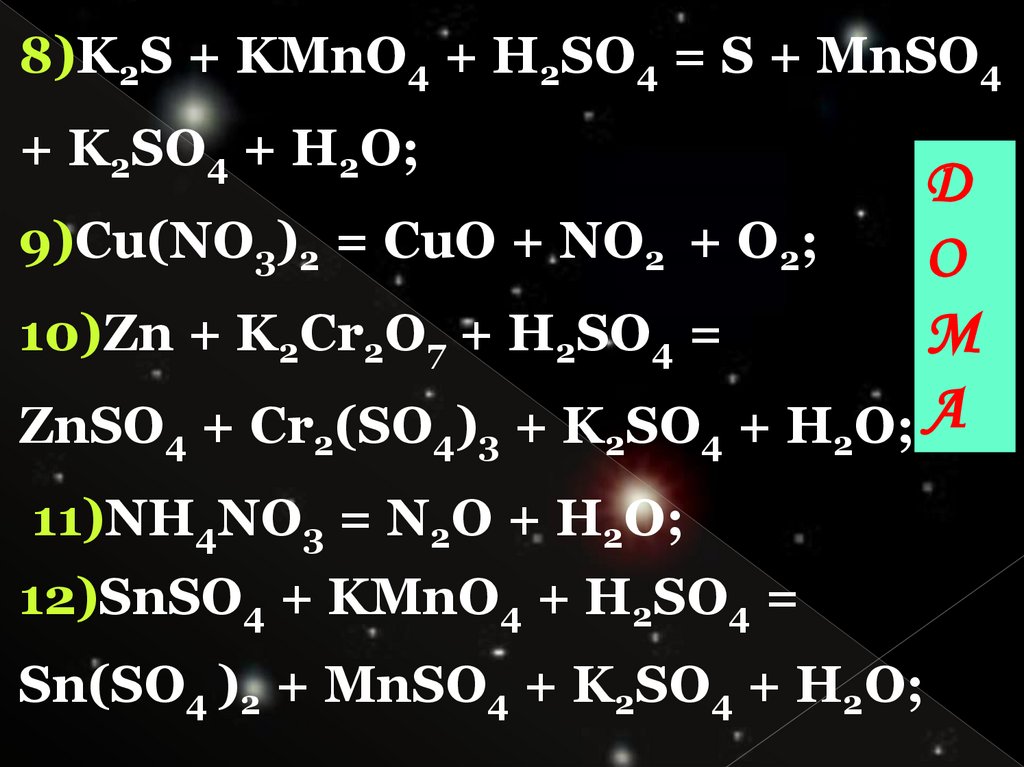
8)K2S + KMnO4 + H2SO4 = S + MnSO4+ K2SO4 + H2O;
Д
9)Cu(NO3)2 = CuO + NO2 + O2;
О
10)Zn + K2Cr2O7 + H2SO4 =
М
ZnSO4 + Cr2(SO4)3 + K2SO4 + H2O; А
11)NH4NO3 = N2O + H2O;
12)SnSO4 + KMnO4 + H2SO4 =
Sn(SO4 )2 + MnSO4 + K2SO4 + H2O;
36.
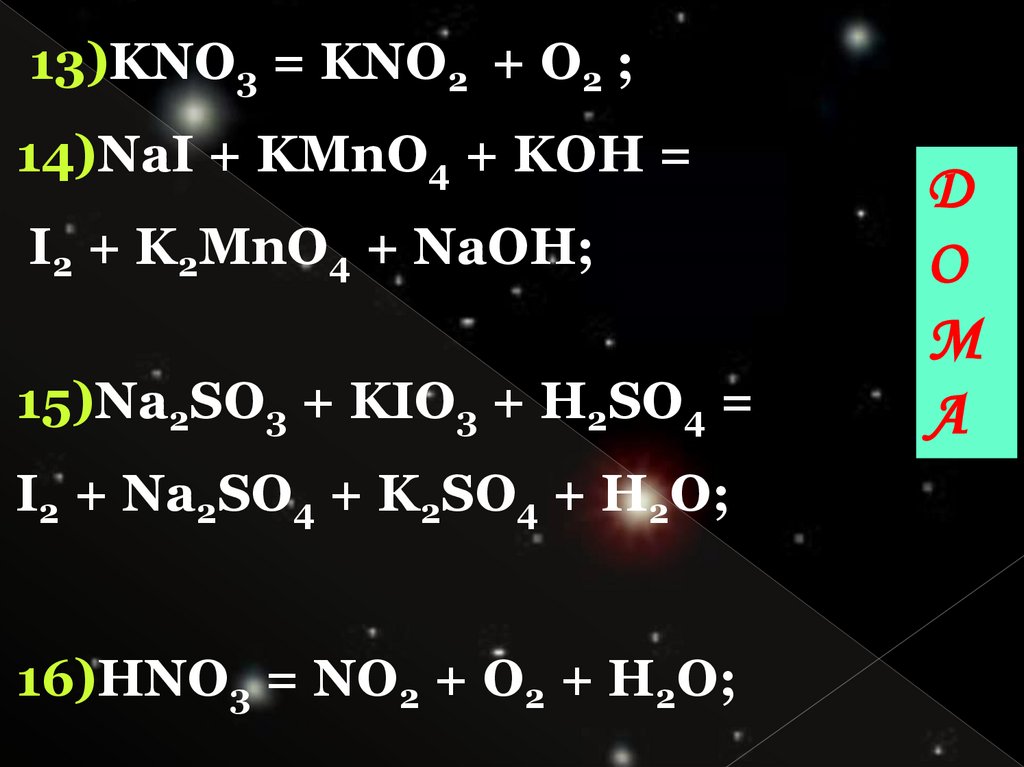
13)KNO3 = KNO2 + O2 ;14)NaI + KMnO4 + KOH =
I2 + K2MnO4 + NaOH;
15)Na2SO3 + KIO3 + H2SO4 =
I2 + Na2SO4 + K2SO4 + H2O;
16)HNO3 = NO2 + O2 + H2O;
Д
О
М
А
37.
Алгоритмсоставления
О.В.Р.
38.
1.Записываем уравнение реакции ирасставляем С.О. у всех элементов,
которые участвуют в реакции:
+1 +4 -2
+1 +7 -2
+1 +6 -2
Na2SO3 + KMnO4 + H 2SO4 =
+1 +6 -2
+2 +6 -2
+1 +6 -2
+1 -2
= Na 2SO 4+ MnSO4 + K2SO4+H2O
39.
2.Подчёркиваем, выделяематомы у которых
изменилась С.О., до и после
реакции…
40.
+1 +4 -2+1 +7 -2
+1 +6 -2
Na2SO3 + KMnO4 + H 2SO4 =
+1 +6 -2
+2 +6 -2
+1 +6 -2
=Na 2SO 4+MnSO4 + K2SO4
+1 -2
+H2O
41.
3.Составляем электронные уравнения процессов окисления ивосстановления:
+4
+6
S -2ē = S
тдаёт,
кисление,
осстановитель.
+7
+2
Mn +5 ē = Mn
ринимает,
осстановление,
кислитель.
42.
4. Для определения числаотданных и принятых (ē)
воспользуемся шкалой ОВР.
отдаёт, окисляется,
восстановитель
І І І І І І І І І
-4 -3 -2 -1 0 +1 +2 +3 +4
принимает, восстанавливается,
окислитель
43.
5.В электронных уравненияхподбираем такие коэффициенты ,чтобы число электронов ,
которые отдает восстановитель
(S),было равно числу электро-
нов, которые присоединяет
окислитель (Mn), т.е. наступает :(электронный баланс)
44.
НОК=10+4
+6
S - 2ē = S
+
коэффициенты
5 окис-ние,
восс-ль.
Mn+7 + 5ē = Mn+2 2 восс-ние,
окис-ль.
+4
+7
+6
+2
5S +2Mn = 5S + 2Mn
45.
6.Перенести эти коэффициентыв схему реакции, затем
подобрать коэффициенты
перед формулами других
соединений в реакции:
5Na2SO3 + 2KMnO4 + 3H 2SO4 =
= 5Na 2SO 4+ 2MnSO4 +
K2SO4+3H2O
46.
00
+1 -2
2 H2 + O2 = 2H2 O
0–2
+1
4
H
ē
=
2
H
2 2
2
ОК-НИЕ, ВОС-ЛЬ
O20+ 4
4 ē = 2O-2
1
ВОС-НИЕ, ОК-ЛЬ
47.
ЗАПОМНИТЬ!!!Галогены (Hal) F2;Cl2;Br2;I2;
Hal02 +2ē = 2Hal-1
2Hal-1 -2ē = Hal02
H02-2ē = 2H+1
2H+1 +2ē = H02
H 2+1 2H+1
48.
O02 +4ē = 2O-22O-2 - 4ē = O02
N02 +6ē = 3N-3
2N-3 - 6ē = N02
















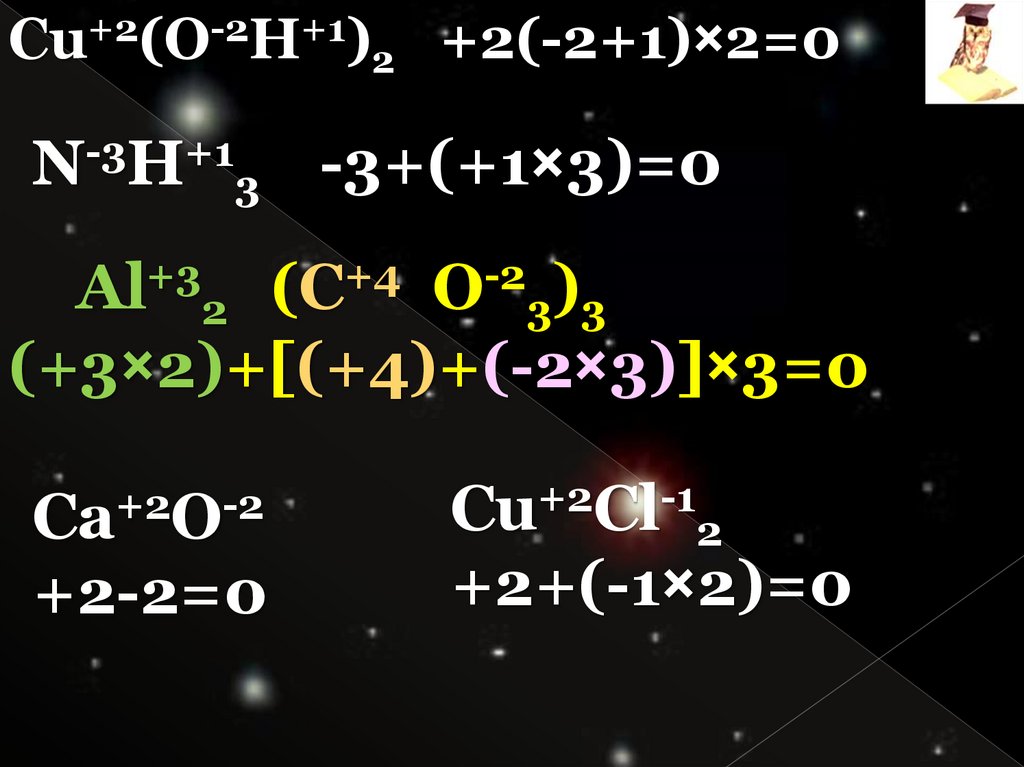













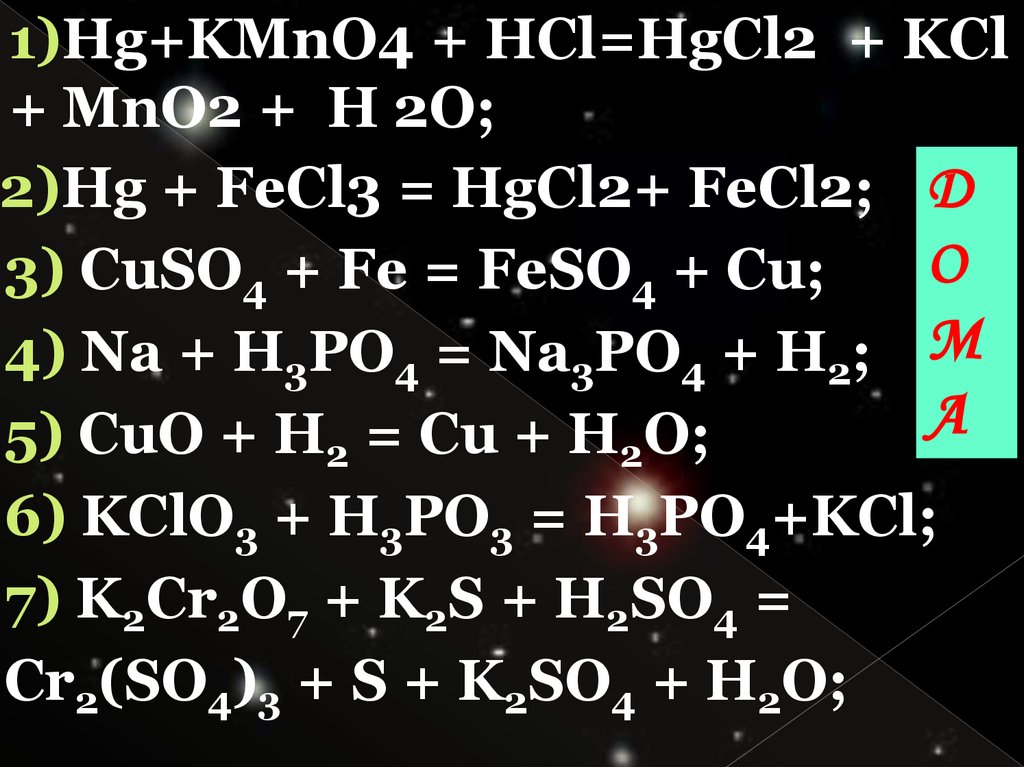














 Химия
Химия








