Похожие презентации:
ОВР – окислительно-восстановительные реакции. Тема 4
1.
2.
ОВР – окислительновосстановительные реакцииЭто реакции, которые происходят с
изменением степени окисления (СО)
реагирующих веществ
3.
В процессе ОВР восстановитель - отдаёт электроны,то есть окисляется;
окислитель присоединяет электроны, то есть
восстанавливается.
Причём любая окислительно-восстановительная
реакция представляет собой единство двух
противоположных превращений — окисления и
восстановления, происходящих одновременно.
• Окисление — процесс отдачи электронов, с
увеличением степени окисления.
• Восстановление - процесс присоединения
электронов атомом вещества, при этом его степень
окисления понижается.
4.
отдачи ē – окисления (зарядувеличивается)
Процесс
присоединения ē – восстановления (заряд
уменьшается)
отдающий ē - восстановитель
Химический элемент
принимающий ē - окислитель
5.
Процесс окисления (ок-я);Химический элемент – восстановитель (в-ль);
Процесс восстановления (в-ния);
Химический элемент – окислитель (ок-ль)
6.
• В ОВР электроны от одних атомов, молекул илиионов переходят к другим.
Процесс отдачи электронов — окисление.
При этом степень окисления повышается:
H20 - 2ē →
H20 - 2ē →2H+
S2- - 2ē →
S2- - 2ē → S0
Al0 - 3ē →
Al0 - 3ē → Al3+
Fe2+ - ē →
Fe2+ - ē → Fe3+
7.
Процесс присоединения электронов —восстановление.
При восстановлении степень окисления
понижается:
O20 + 4ē →
O20 + 4ē → 2O2Mn7+ + 5ē →
Mn7+ + 5ē → Mn2+
Mn4+ + 2ē →
Mn4+ + 2ē → Mn2+
Cr6+ + 6ē →
Cr6+ + 6ē → Cr0
8.
Окислительно-восстановительная реакциямежду водородом и фтором
+ 0
0
H2 + F2 → 2H F
Разделяется на две:
1) Окисление:
H20 - 2ē → 2H+ восстановитель (в-ль)
2) Восстановление:
0
F2 + 2ē → 2 F
окислитель (ок-ль)
9.
Задание для студентов1. Укажите окислитель или восстановитель:
S2- →S0 ……
Mg2+ →Mg0,
5+
3N
→N ,
0
5+
Р
→P ,
Al3+ →Al0.
10.
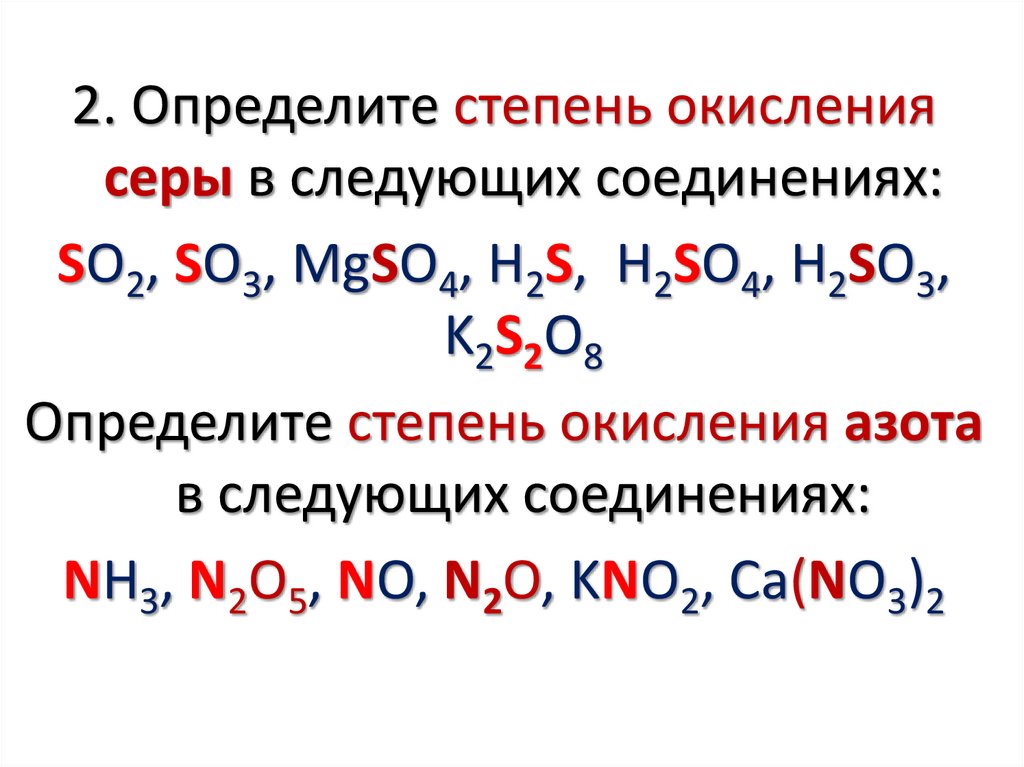
2. Определите степень окислениясеры в следующих соединениях:
SO2, SO3, MgSO4, H2S, H2SO4, H2SO3,
K2S2O8
Определите степень окисления азота
в следующих соединениях:
NH3, N2O5, NO, N2O, KNO2, Ca(NO3)2
11.
Al + O2 = Al2O3Al0 + O02 = Al2+3O3-2
Алюминий отдает электроны (приобретает
положительную степень окисления),
а кислород – принимает электроны (приобретает
отрицательную степень окисления).
Чтобы получить степень окисления +3, атом
алюминия должен отдать 3 электрона.
Молекула кислорода, чтобы превратиться в
кислородные атомы со степенью окисления -2,
должна принять 4 электрона:
Al0 - 3ē → Al3+
O20 + 4ē → 2O2-
12.
Al0 - 3ē → Al3+ 4O20 + 4ē → 2O2- 3
Чтобы количество отданных и принятых электронов
выровнялось,
первое уравнение надо умножить на 4,
а второе – на 3.
Для этого достаточно переместить числа отданных и
принятых электронов против верхней и нижней
строчки так, как показано на схеме вверху.
4Al + 3O2 = 2Al2O3
13.
Задания для студентов:1. Ознакомьтесь с формой написания ОВР
2. Расставьте коэффициенты в ОВР методом
электронного баланса.
Число ē отданных восстановителем = числу ē
принятых окислителем.
14.
++4
0
0
Si + NaOH + H 2O = Na2Si O3 + H 2
+
+4
0
0
Si + 2NaOH + H 2O = Na2Si O3 + 2H 2
15.
Cu0 + HN+5O3 = Cu+2(NO3)2 + N+2O + H2OCu0 - 2ē → Cu2+ 3 в-ль
N+5 + 3ē → N2+ 2 ок-ль
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
16.
N-3H3 + O02 →N+2O-2 + H2ON-3 - 5ē →N+2 4 в-ль
O20 + 4ē → 2O-2 5 ок-ль
4NH3 + 5O2 → 4NO + 6H2O
17.
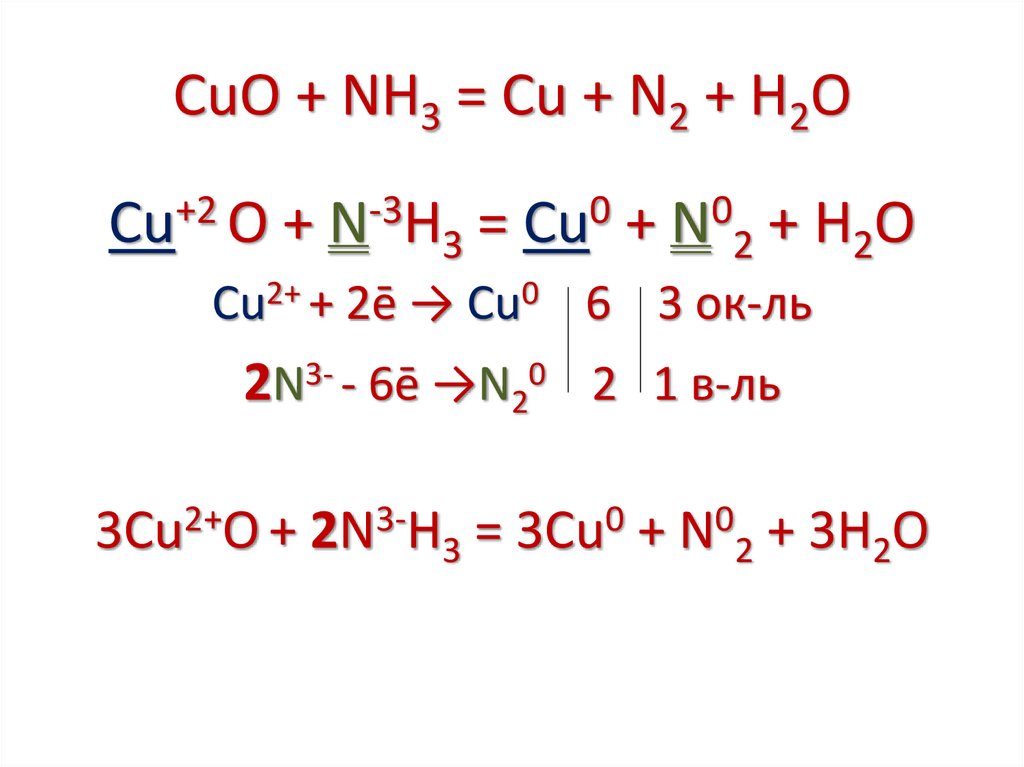
CuО + NH3 = Cu + N2 + H2OCu+2 О + N-3H3 = Cu0 + N02 + H2O
Cu2+ + 2ē → Cu0 6 3 ок-ль
2N3- - 6ē →N20 2 1 в-ль
3Cu2+О + 2N3-H3 = 3Cu0 + N02 + 3H2O
18.
Подберите коэффициенты методомэлектронного баланса. Укажите
окислитель и восстановитель в:
- реакциях окисления;
- реакциях взаимодействия
металлов с кислотами.
19.
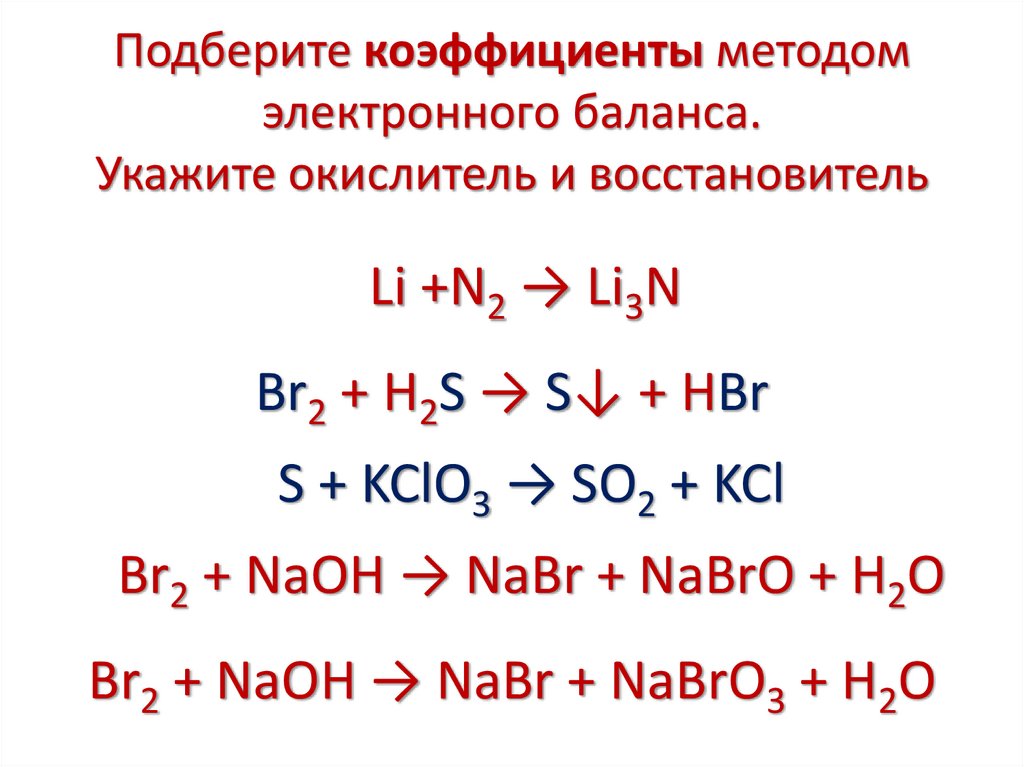
Подберите коэффициенты методомэлектронного баланса.
Укажите окислитель и восстановитель
Li +N2 → Li3N
Br2 + H2S → S↓ + HBr
S + KClO3 → SO2 + KCl
Br2 + NaOH → NaBr + NaBrO + H2O
Br2 + NaOH → NaBr + NaBrO3 + H2O
20.
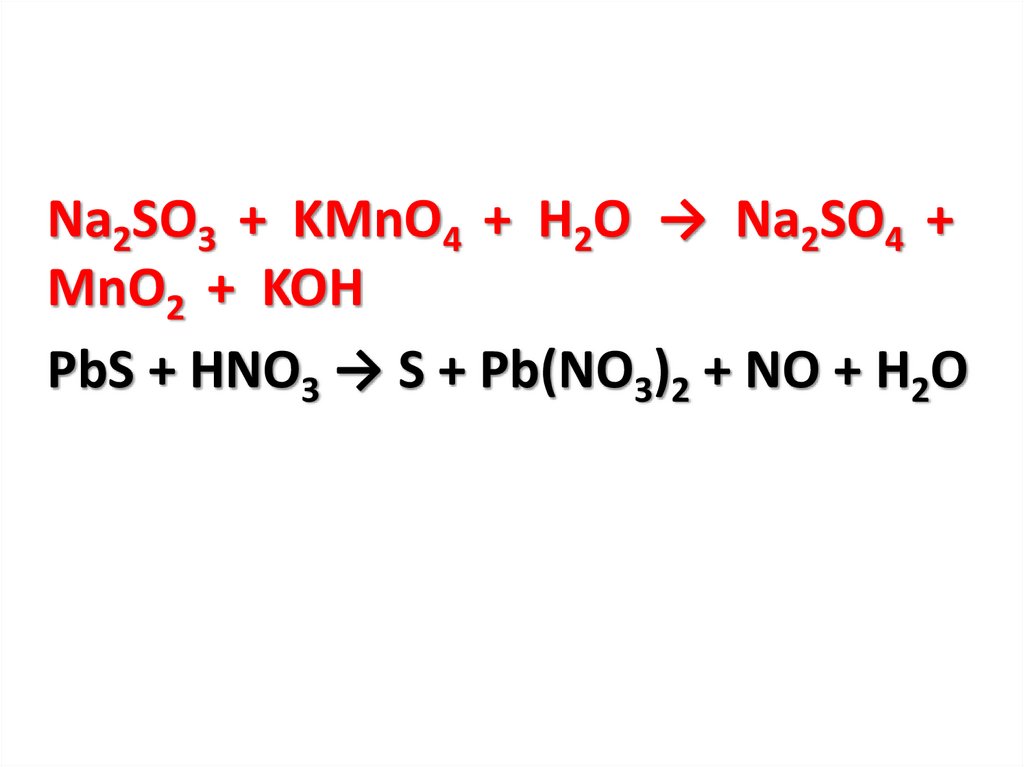
Na2SO3 + KMnO4 + H2O → Na2SO4 +MnO2 + KOH
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
21.
Подберите коэффициенты методом электронногобаланса. Укажите окислитель и восстановитель;
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2
+ KOH
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
22.
Подберите коэффициенты методом электронногобаланса. Укажите окислитель и восстановитель;
H2SO3 + I2 + H2O → H2SO4 + HI
MnSO4 + NaBiO3 + H2SO4 → HMnO4 + Bi2(SO4)3 + Na2SO4 + H2O
NaCrO2 + H2O2 + NaOH → Na2CrO4 + H2O
Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H2O
NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O
K2Cr2O7 + FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
MnSO4 + KMnO4 + H2O → MnO2 + K2SO4 + KOH
K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + K2SO4 + H2O
CrCl3 + KClO3 + KOH → K2CrO4 + KCl + H2O
23.
7.8.
9.
10.
11.
12.
13.
14.
KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O
Na2CrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O
FeCl3 + KI → FeCl2 + I2 + KCl
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + H2O + MnSO4
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O
K2Cr2O7 + HBr → Br2 + CrBr3 + KBr + H2O
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
KMnO4 + H2SO4 + KJ → J2 + K2SO4 + MnSO4 + H2O
MnSO4 + K2S2O8 + H2SO4 → HMnO4 + K2SO4 + H2O
24.
15.16.
17.
18.
19.
20.
21.
22.
CrCl3 + Br2 + KOH → K2CrO4 + KBr + KCl + H2O
KMnO4 + HNO2 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O
Cr2(SO4)3 + K2S2O8 + H2O → K2Cr2O7 + K2SO4 + H2SO4
MnSO4 + KClO3 + KOH → K2MnO4 + KCl + K2SO4 + H2O
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + MnSO4 + K2SO4 +
H2O
Cr2(SO4)3 + H2O2 + KOH → K2CrO4 + H2O + K2SO4
Mn(NO3)2 + NaBiO3 + HNO3 → HMnO4 + Bi(NO3)3 + NaNO3 + H2O
CrCl3 + Br2 + KOH → K2CrO4 + KBr + H2O + KCl
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
FeCl3 + KI → FeCl2 + I2 + KCl
NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O
25.
Связи между классами неорганическихсоединений
Связь, основанная на получении веществ
одного класса из веществ другого класса,
называется генетической
(генезис – происхождение).
Металл
Неметалл
↓
↓
Основной оксид
Кислотный оксид
↓
↓
Основание
→
Соль
←
Кислота
26.
27.
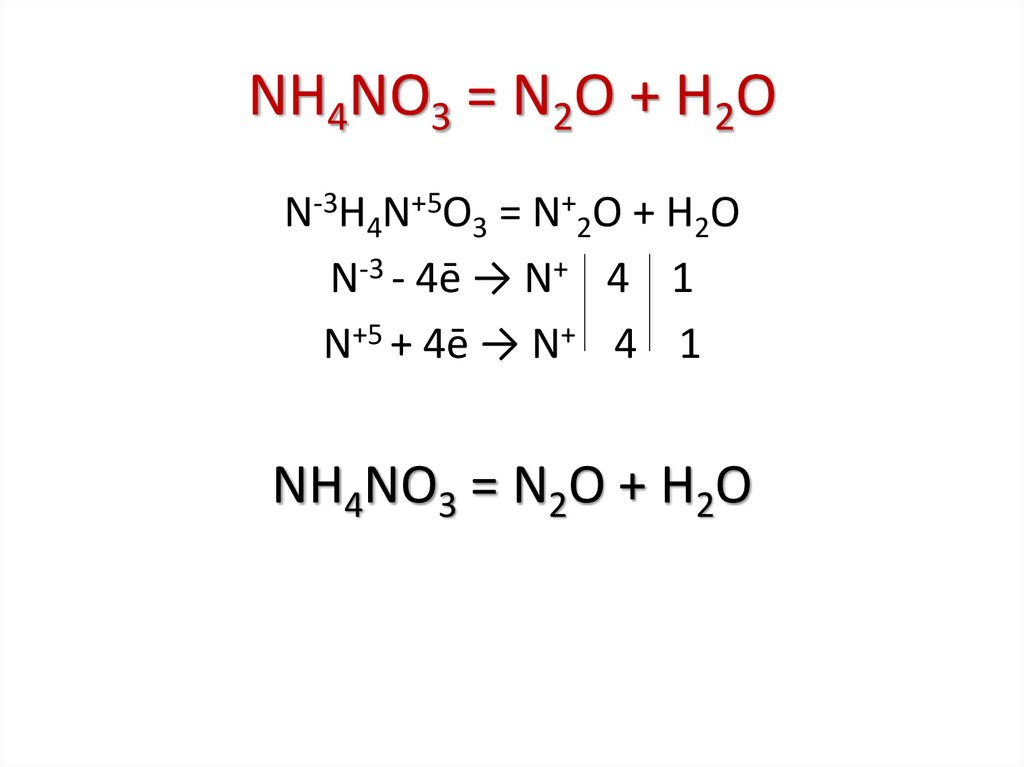
NH4NO3 = N2O + H2ON-3H4N+5O3 = N+2O + H2O
N-3 - 4ē → N+ 4 1
N+5 + 4ē → N+ 4 1
NH4NO3 = N2O + H2O





















 Химия
Химия








