Похожие презентации:
Семинар 7_Общая химия
1.
Семинар 7 «Общая химия»2.
Ионное произведение водыВода, как слабый электролит, незначительно диссоциирует на ионы H+ и OH-:
H2O ⇌ H+ + OH- (1)
В действительности свободный ион H+ в водных растворах не существует. Он присоединяется к
молекулам воды, образуя сложные ионы H3O+, H5O2+ и т.д. Однако для краткости гидратированный
ион водорода почти всегда обозначают H+.
Константа равновесия реакции (1) равна произведению активностей ионов H+ и OH- (активность воды
равна 1): Kв = α(H+)·α(OH-). Эту константу называют ионным произведением воды.
При стандартных условиях Kв = 10-14, равновесие сильно смещено влево.
Поэтому активности ионов можно считать равными их равновесным
концентрациям, т.о. получаем Kв = [H+]·[OH-].
Произведение растворимости воды зависит от температуры и не зависит от
концентраций ионов H+ и OH- в растворе.
2
3.
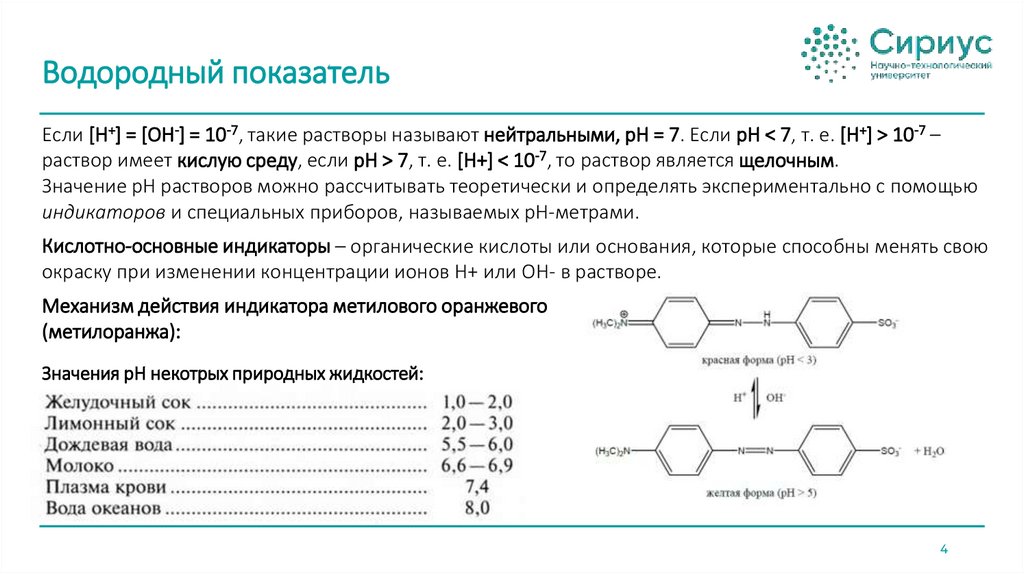
Водородный показательКонцентрация ионов H+ в водных растворах может изменятся примерно от 10 моль/л
(концентрированная соляная кислота) до 10-15 моль/л (концентрированные растворы щёлочи).
Вычисления с такими сильно различающимися значениями громоздки и неудобны, поэтому
концентрации ионов H+ заменяют логарифмическими величинами, или так называемым
водородным показателем.
Водородный показатель pH представляет собой отрицательный десятичный логарифм активности ионов
водорода в растворе:
pH = -






















 Химия
Химия








