Похожие презентации:
1_Кислоты_ЛО_ДОРАБ
1.
§16. Кислоты.2.
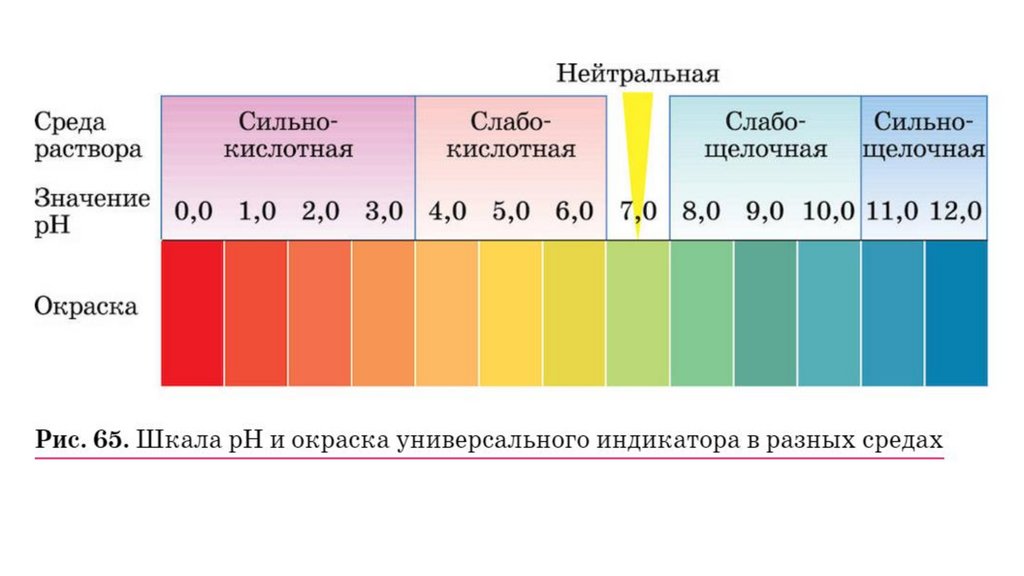
Цель урока:Формирование понятий «кислотная среда», «щелочная
среда», «нейтральная среда», «шкала pH». Формирование
умений экспериментально различать кислоты и щелочи с
помощью индикаторов; описывать свойства отдельных
представителей кислот.
Проблемный вопрос урока:
По каким признакам можно классифицировать
кислоты?
3.
4.
5.
6.
7.
8.
9.
10.
11.
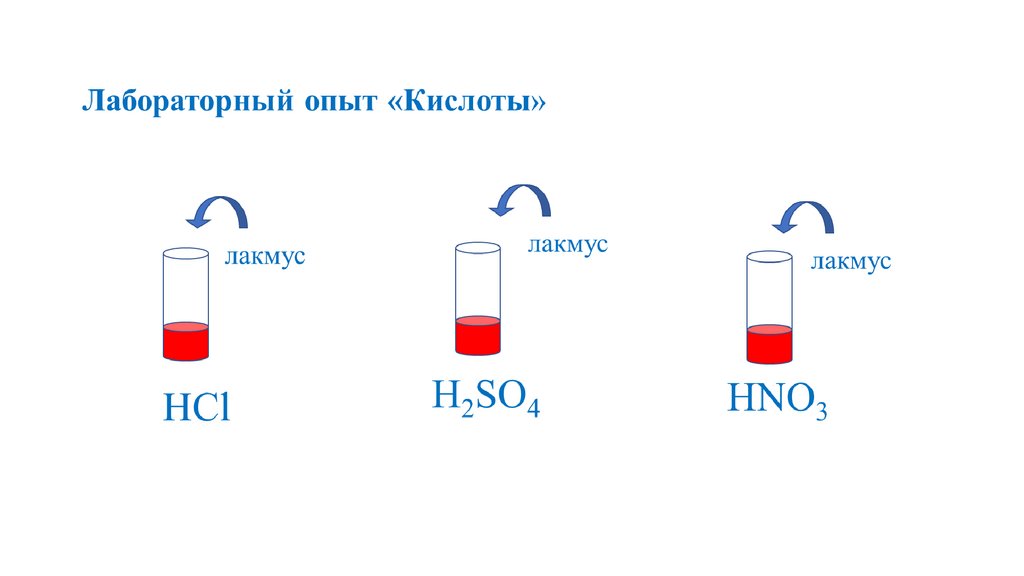
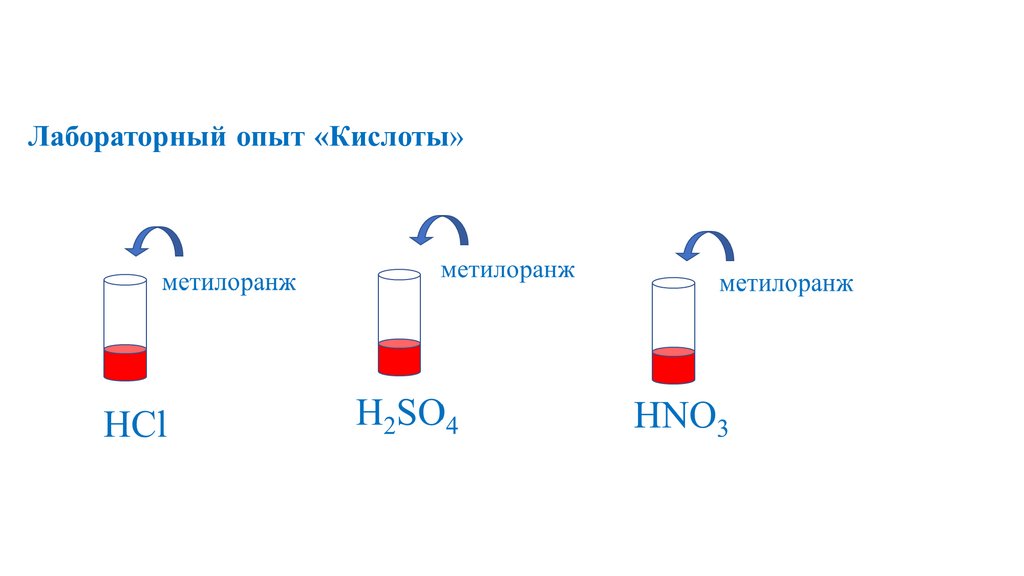
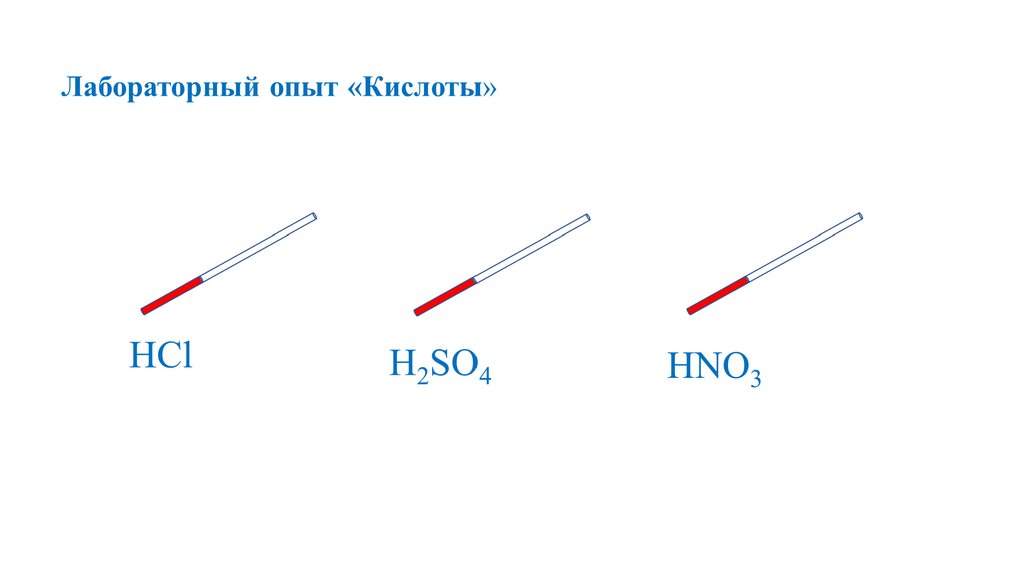
Кислоты12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
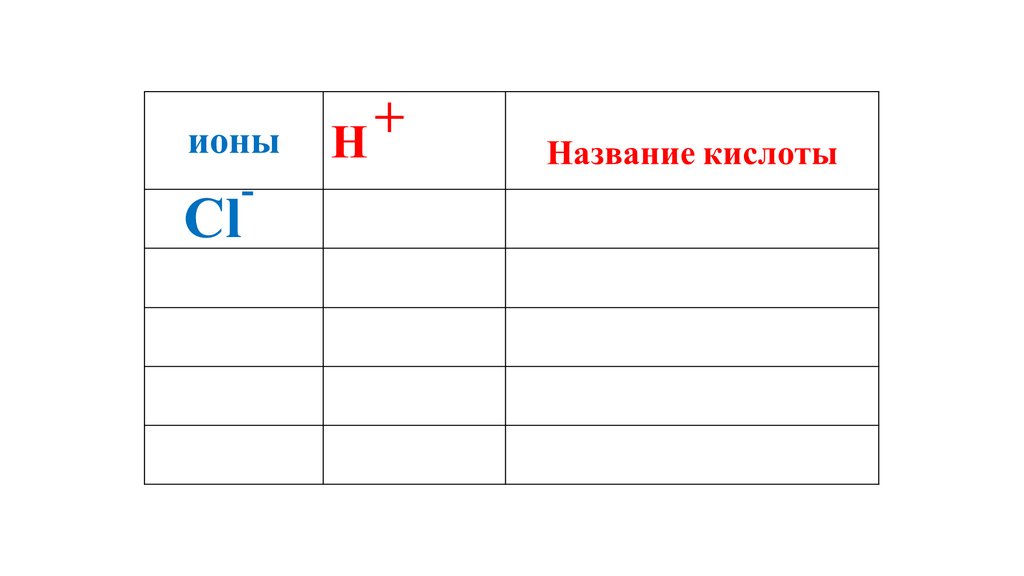
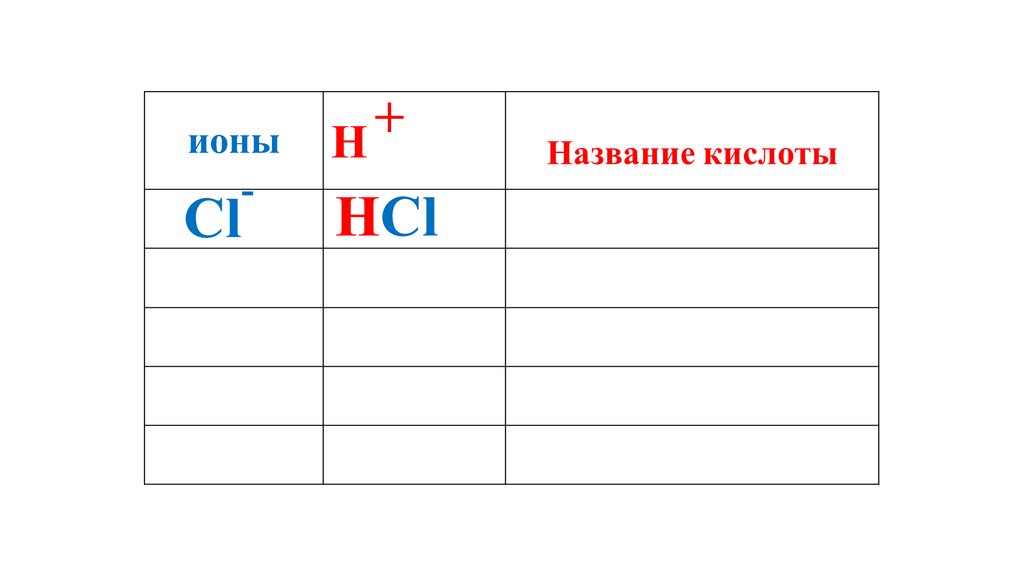
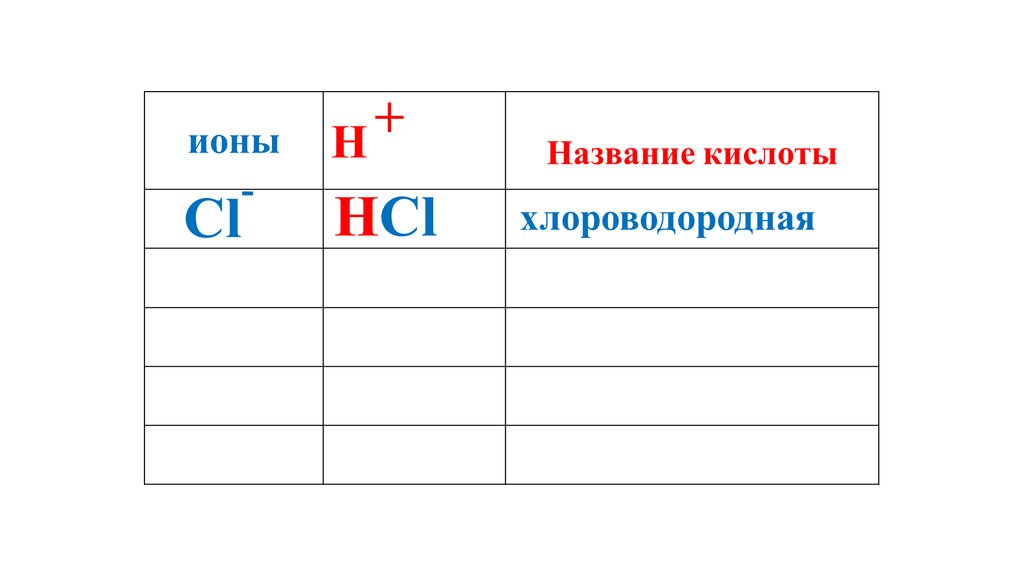
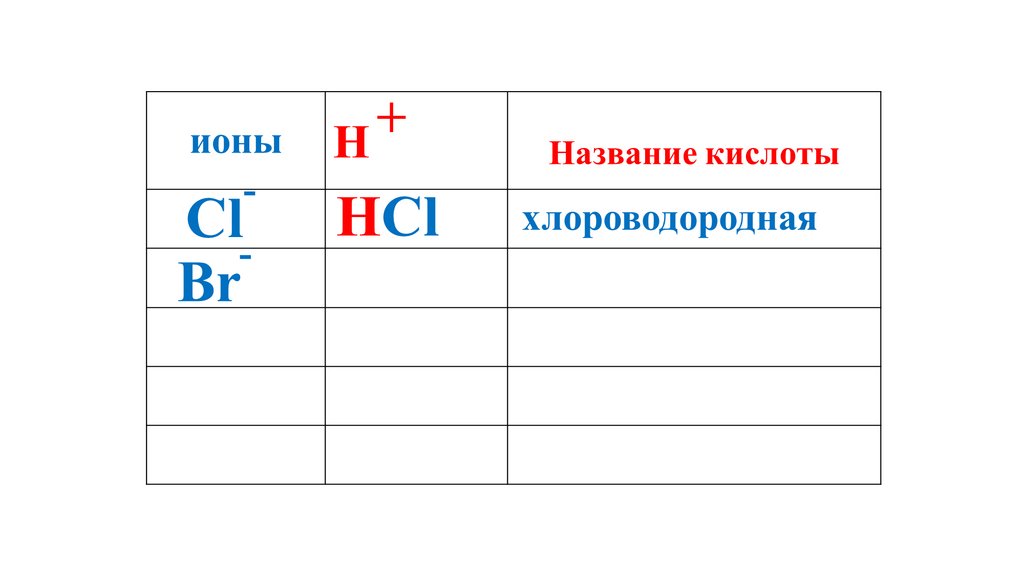
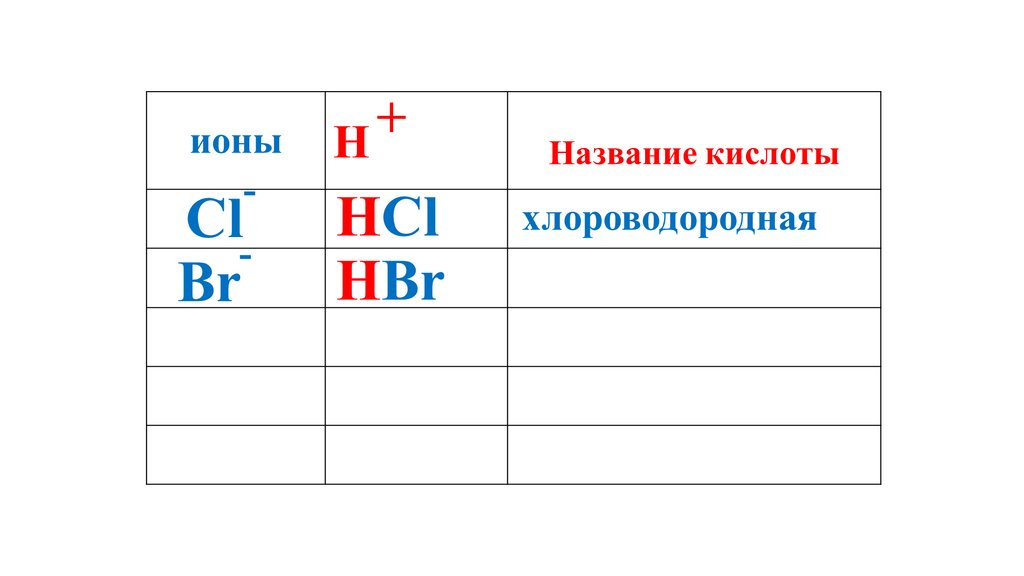
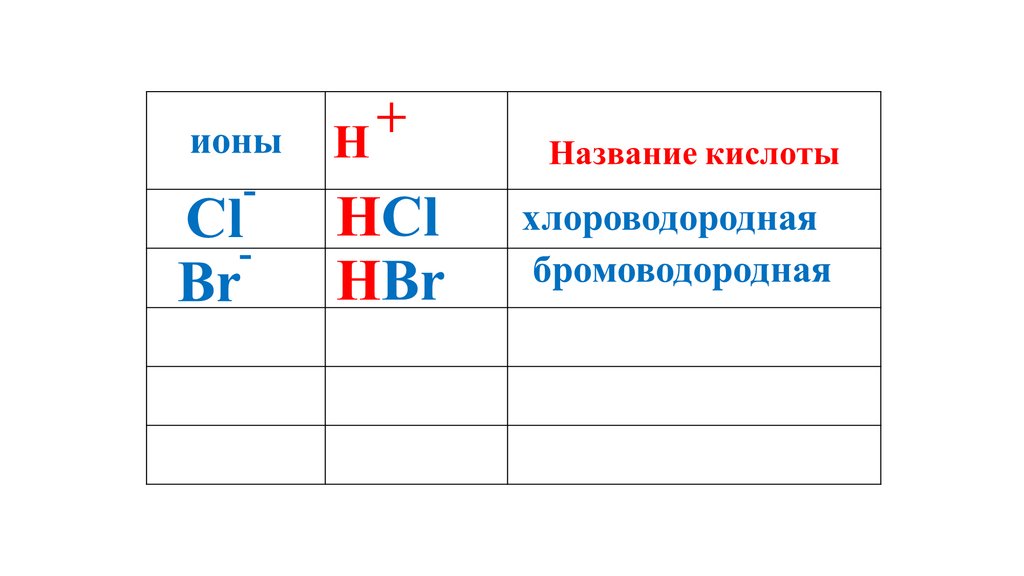
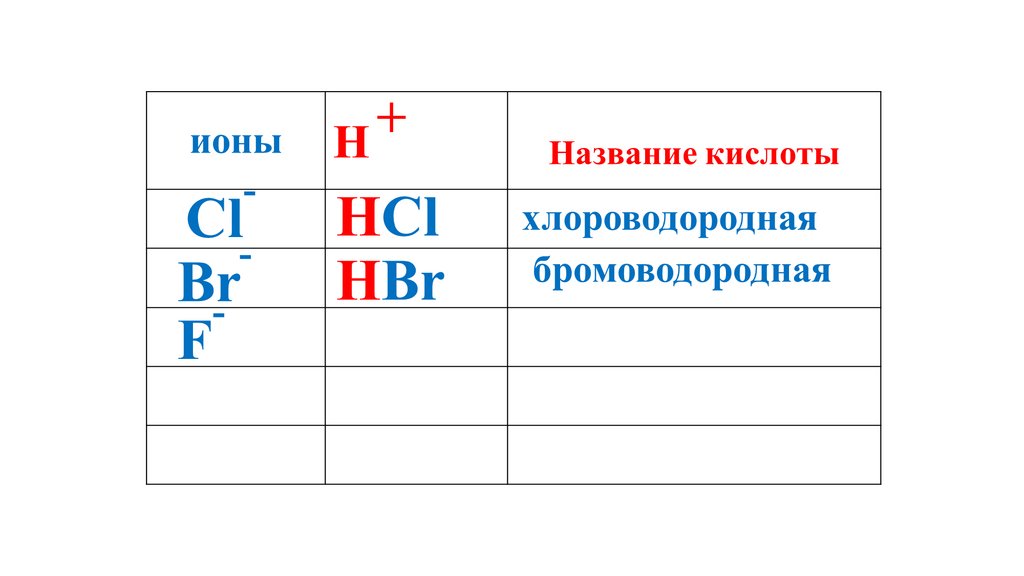
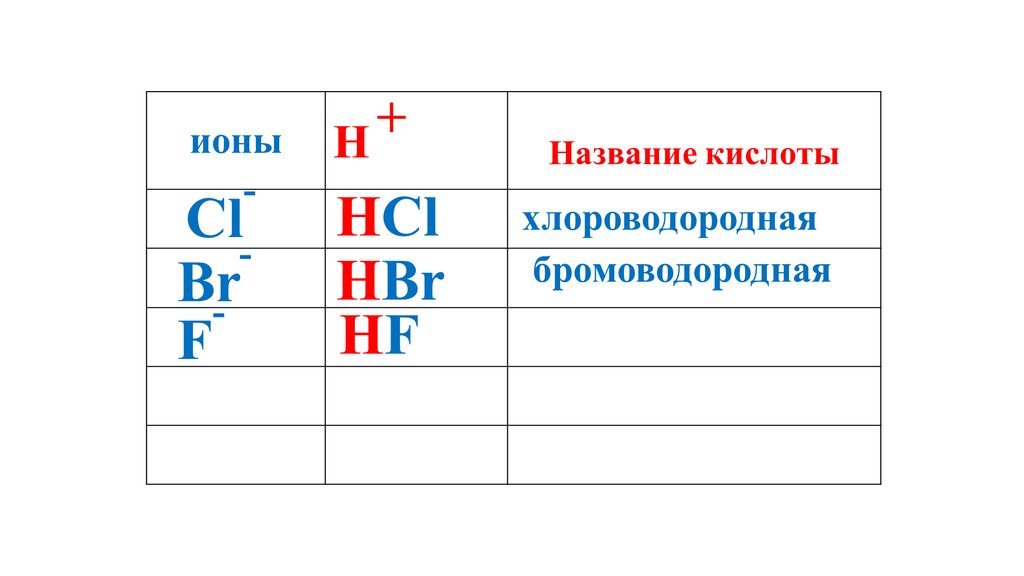
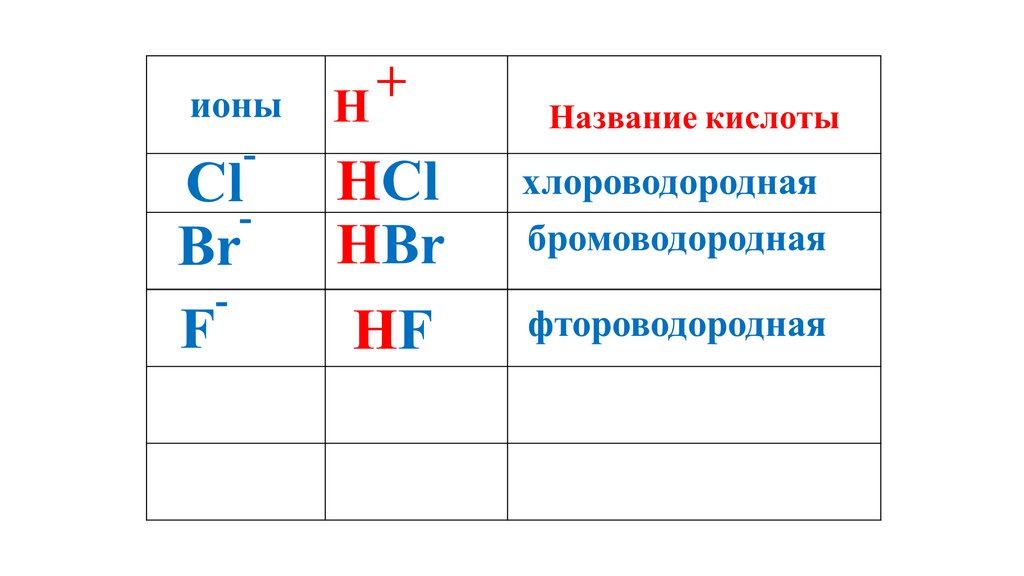
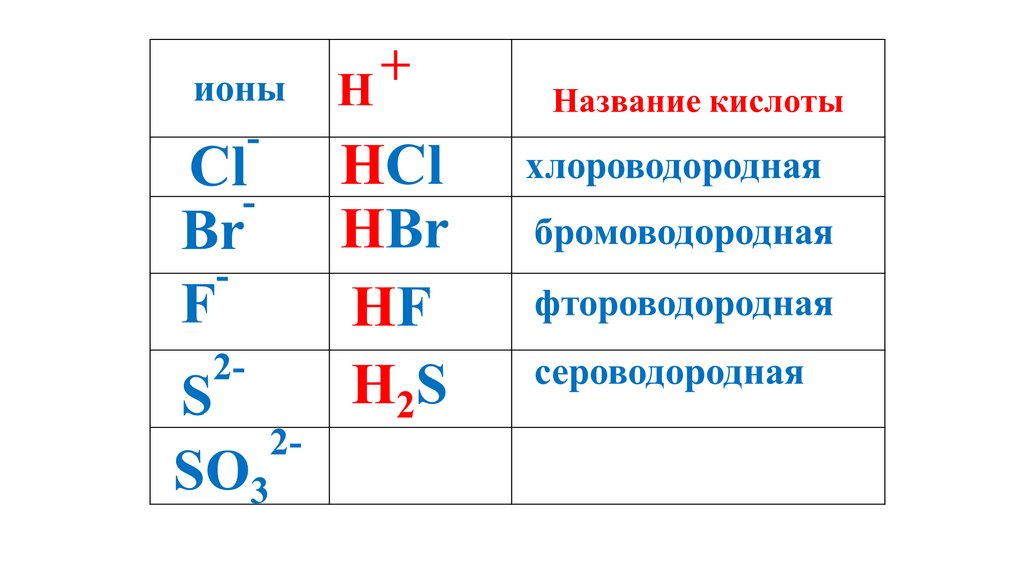
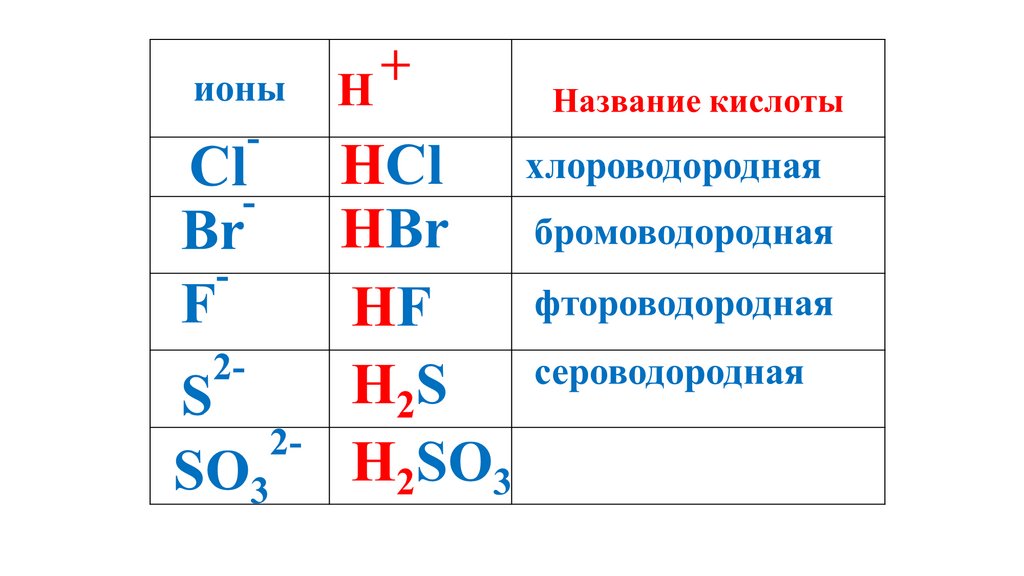
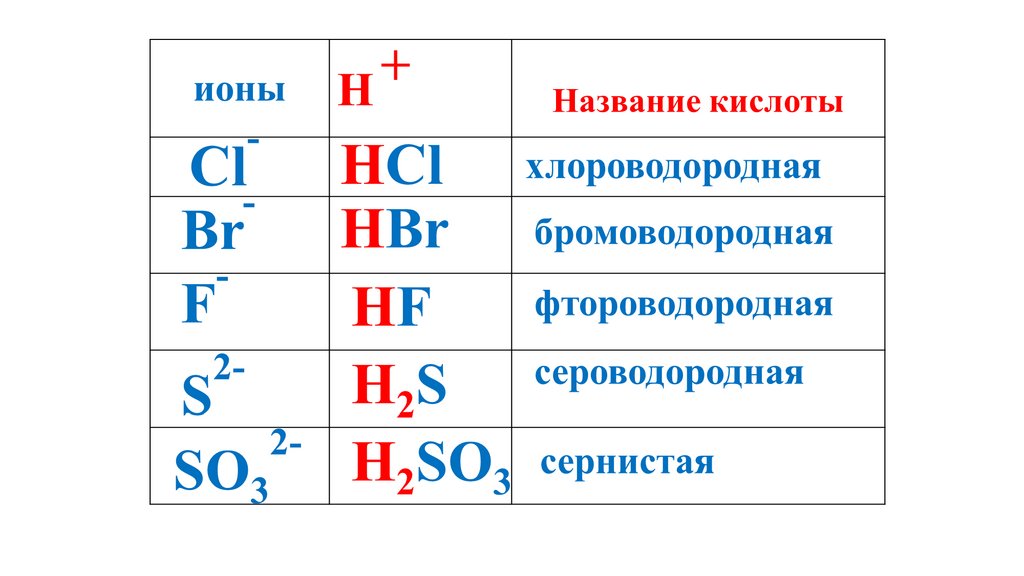
+ионы
H
24
H2SO4
серная
H2CO3
угольная
H2SiO3
кремниевая
H3PO4
фосфорная
CH3COOH
уксусная
SO
2CO3
2SiO 3
34
PO
-
CH3COO
Название кислоты
29.
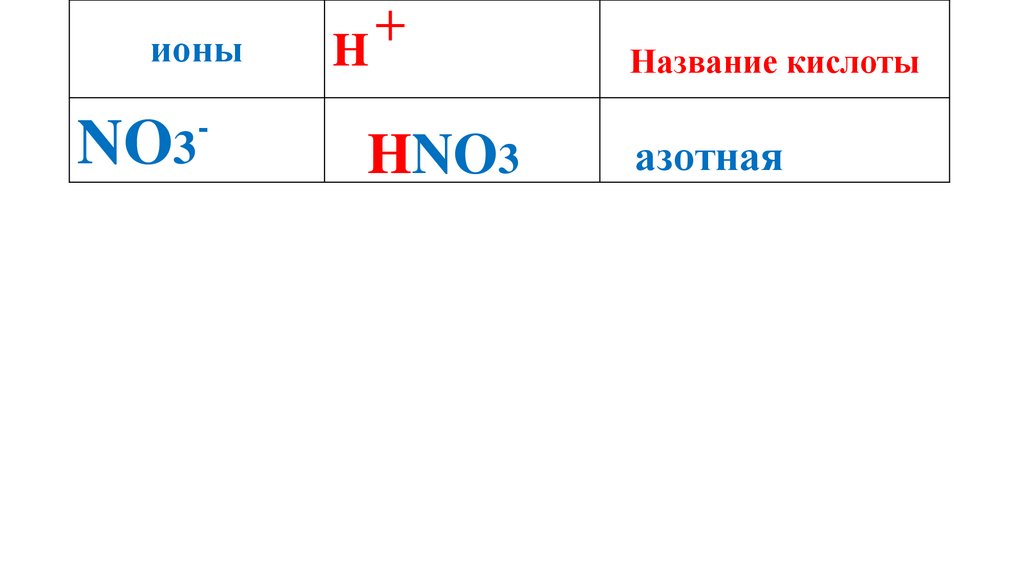
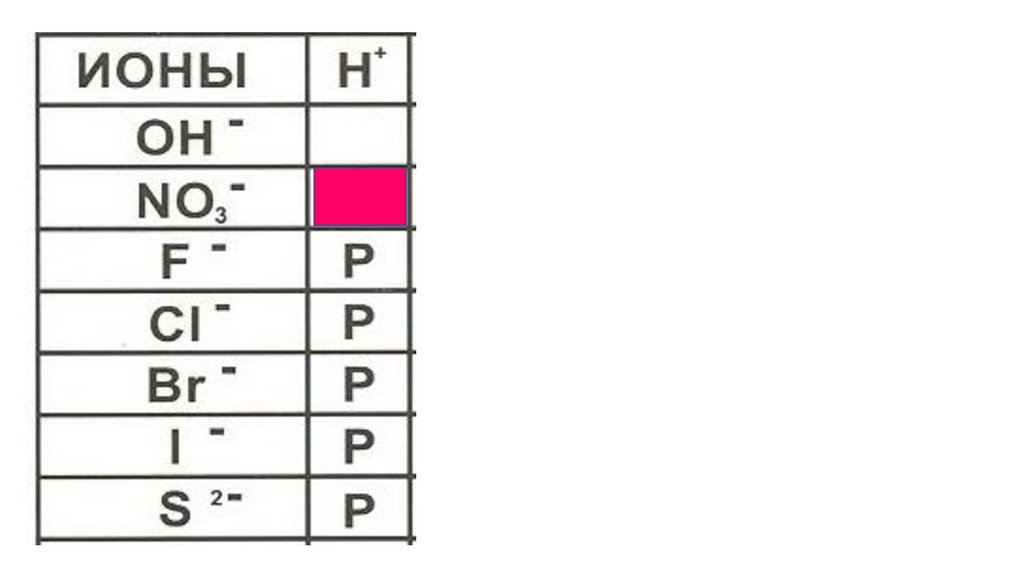
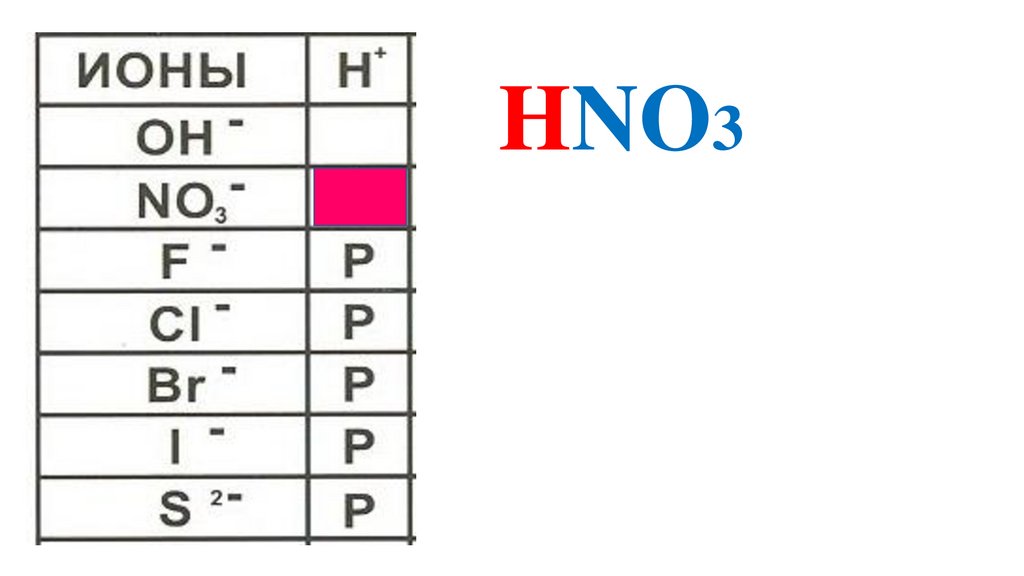
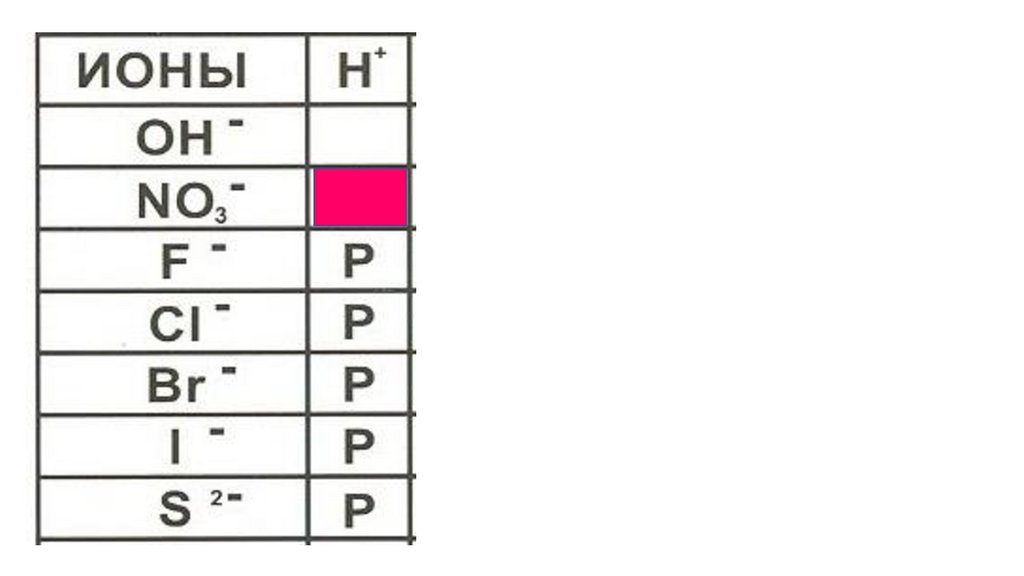
ионыNO3
-
H
+
HNO3
Название кислоты
азотная
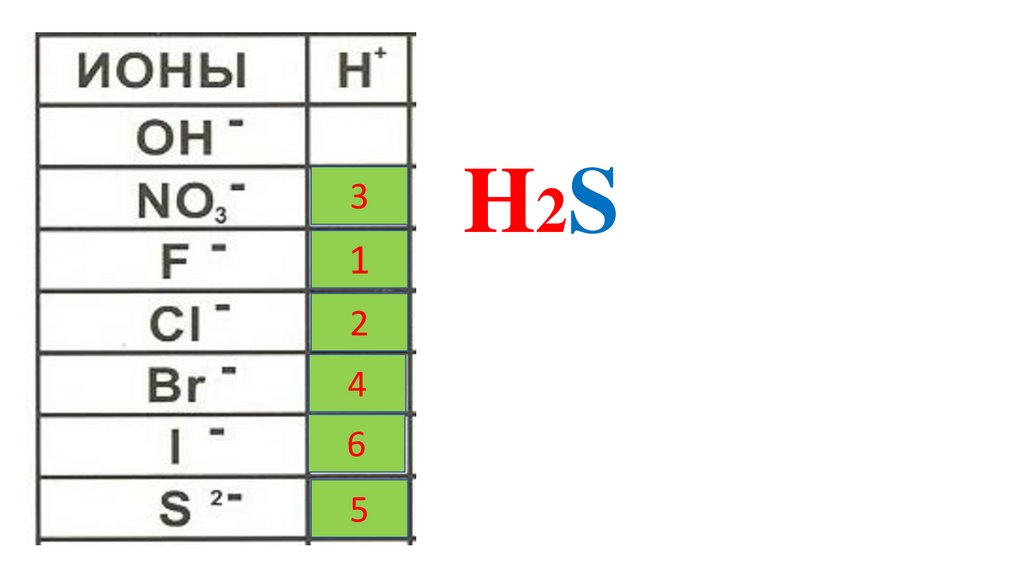
30.
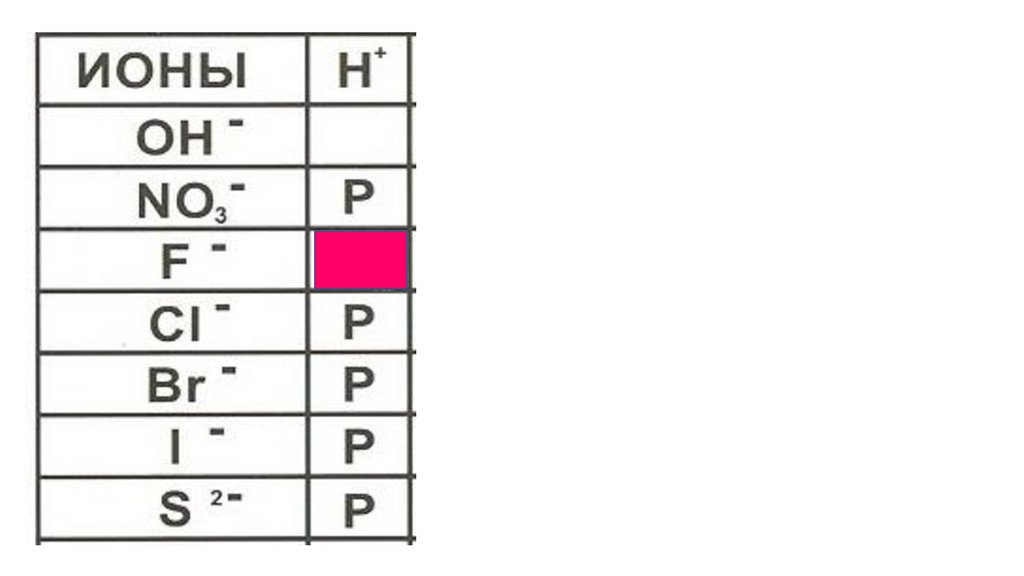
31
2
4
6
5
HI
HNO
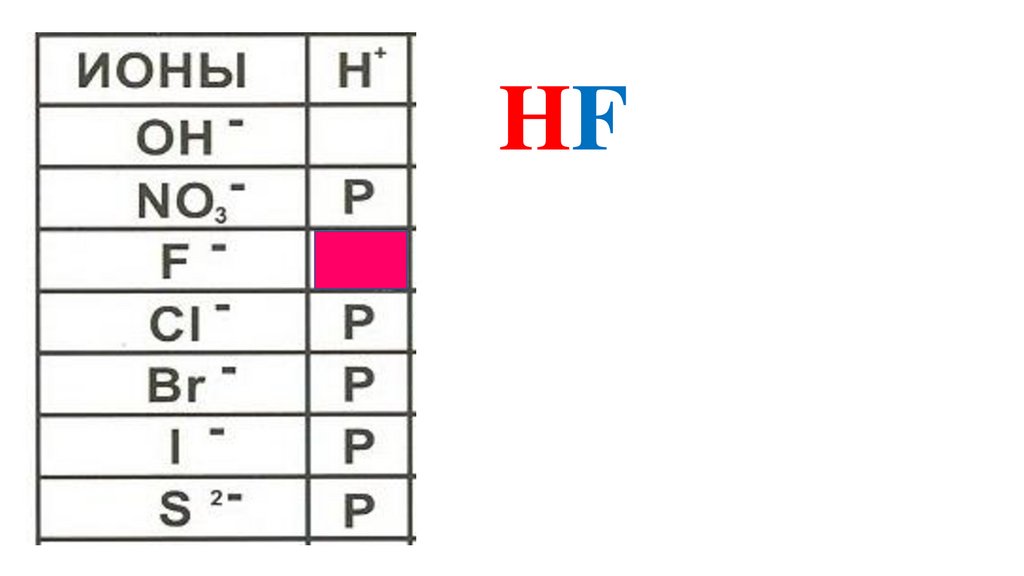
HF
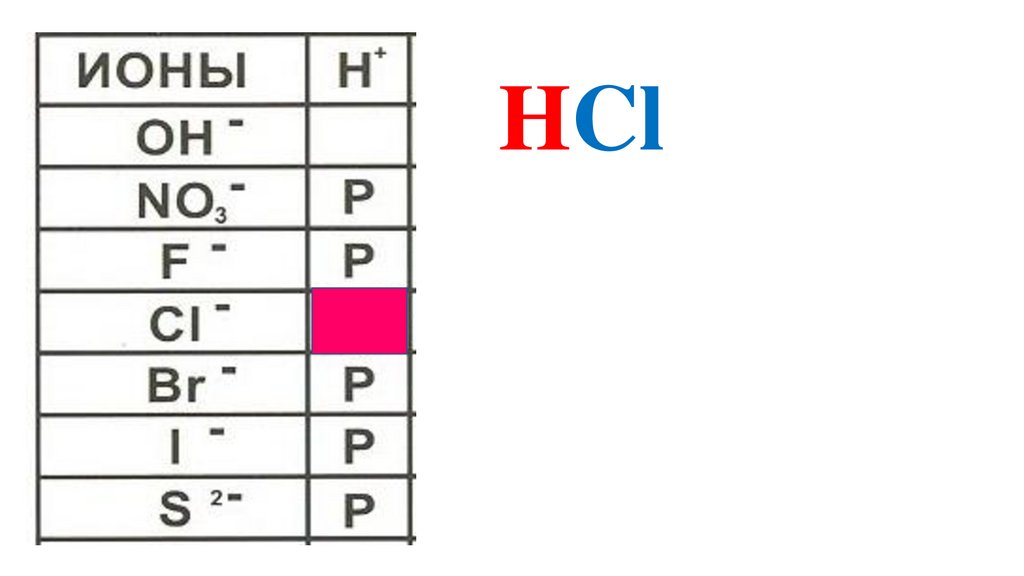
HCl
HBr
H
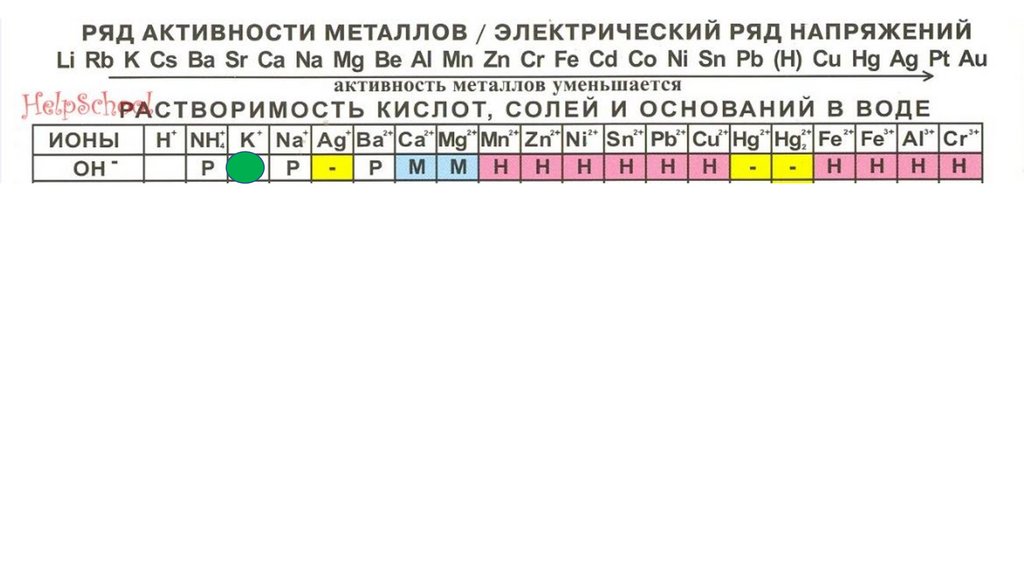
2S 3
31.
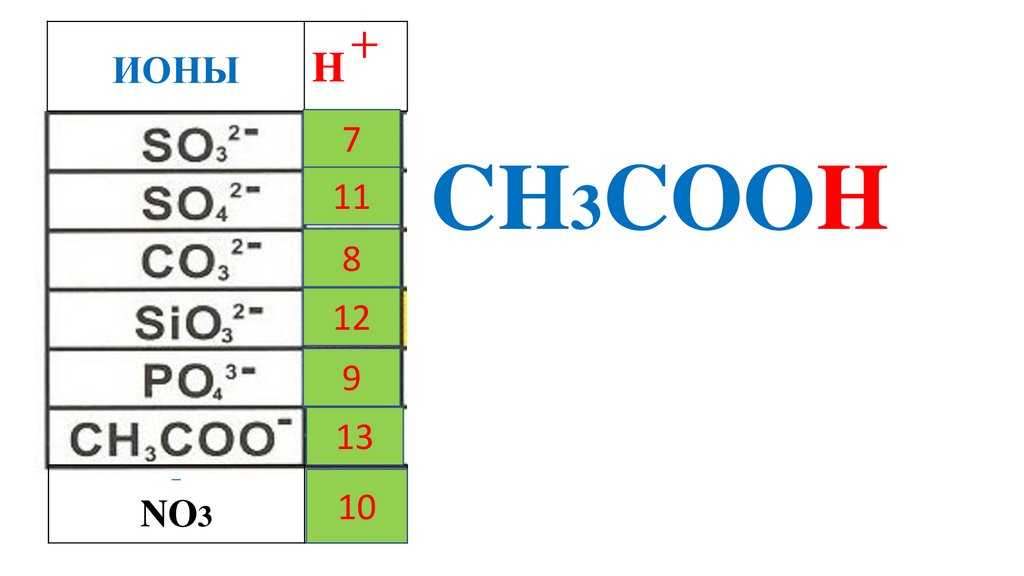
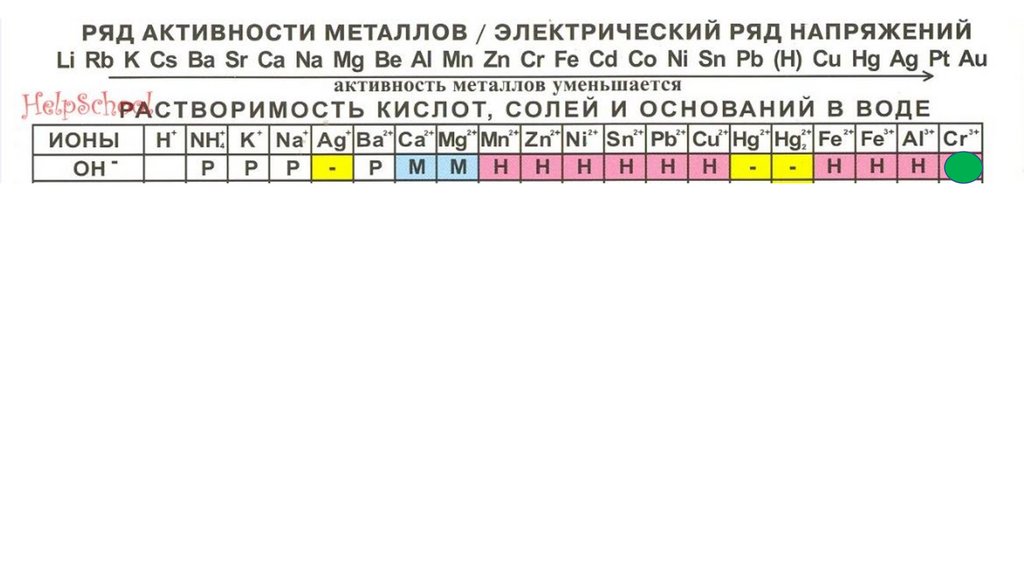
ИОНЫH
+
7
11
8
12
9
13
−
NO3
p
10
H
2
CO
3
2
SO
3
3
PO
4
HNO
3
H
2
SO
4
2SiO
3
CH
3COOH
32.
Составление формулкислот
33.
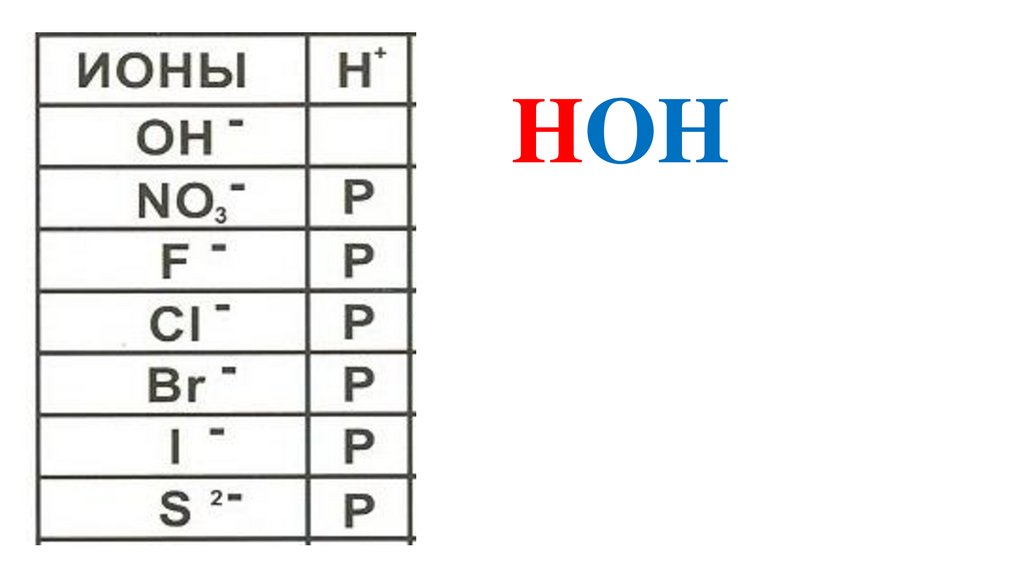
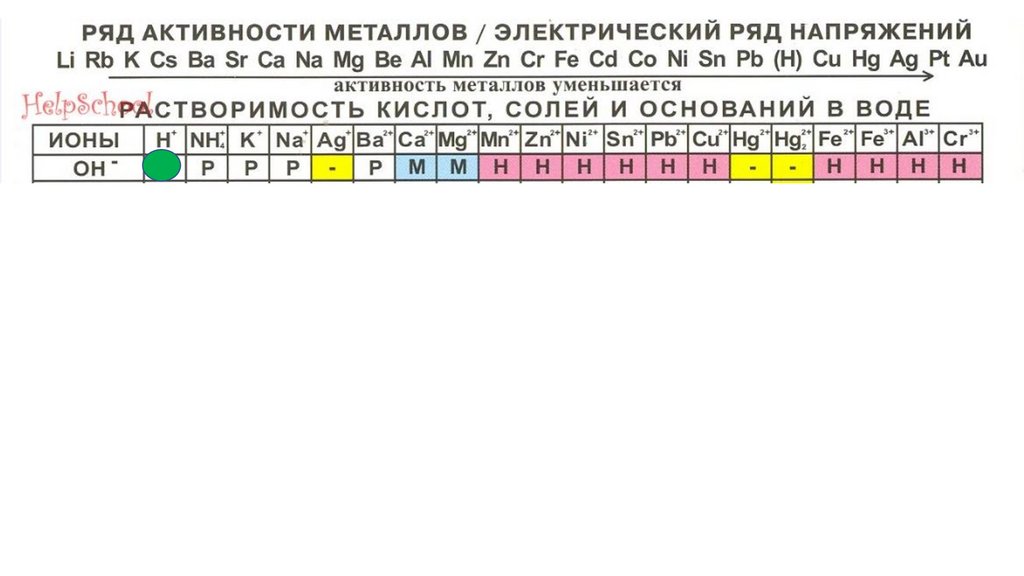
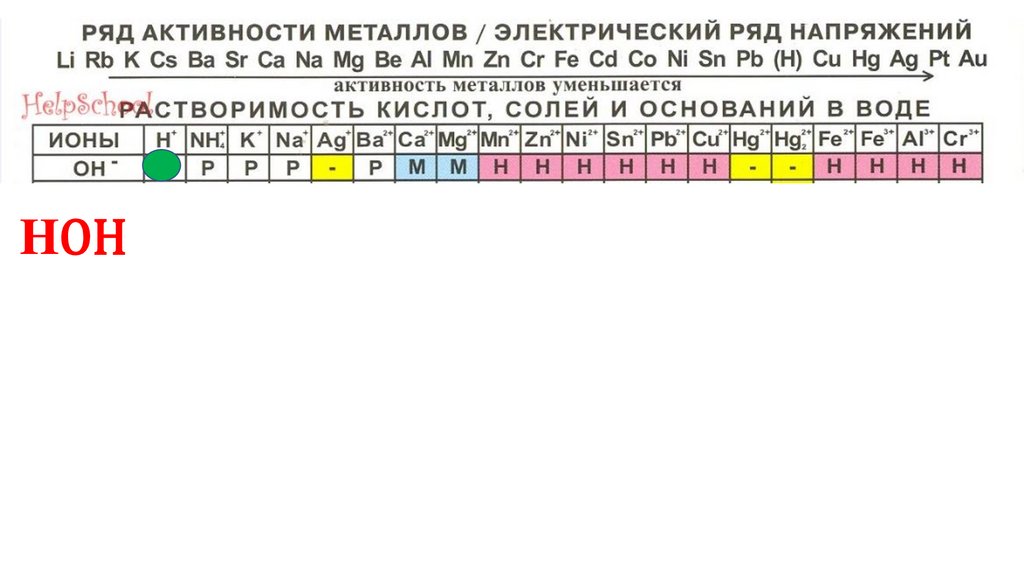
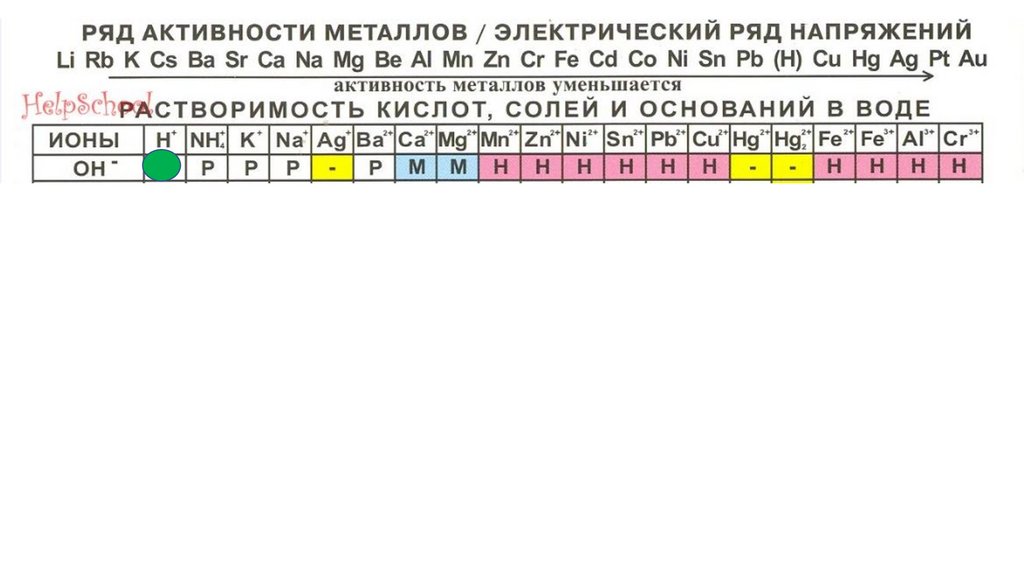
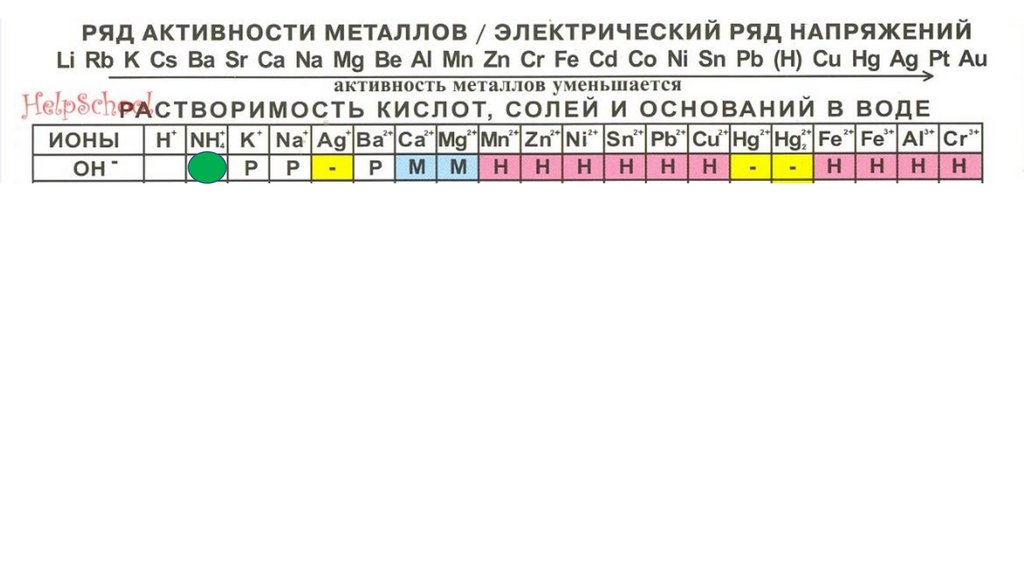
HOH34.
HOHHOH
35.
HOH36.
HNO337.
HNO338.
HNO339.
HF40.
HF41.
HF42.
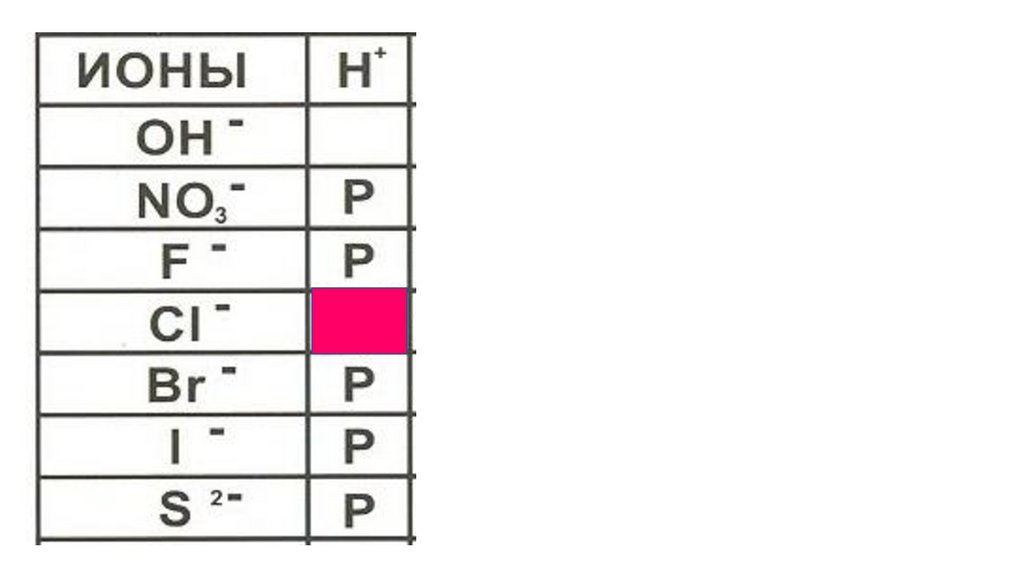
HCl43.
HCl44.
HCl45.
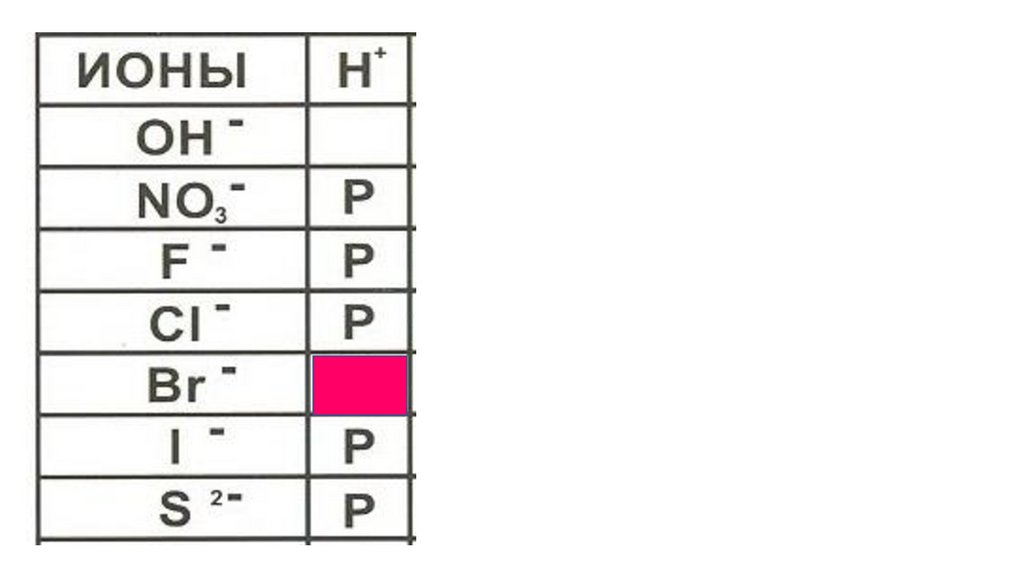
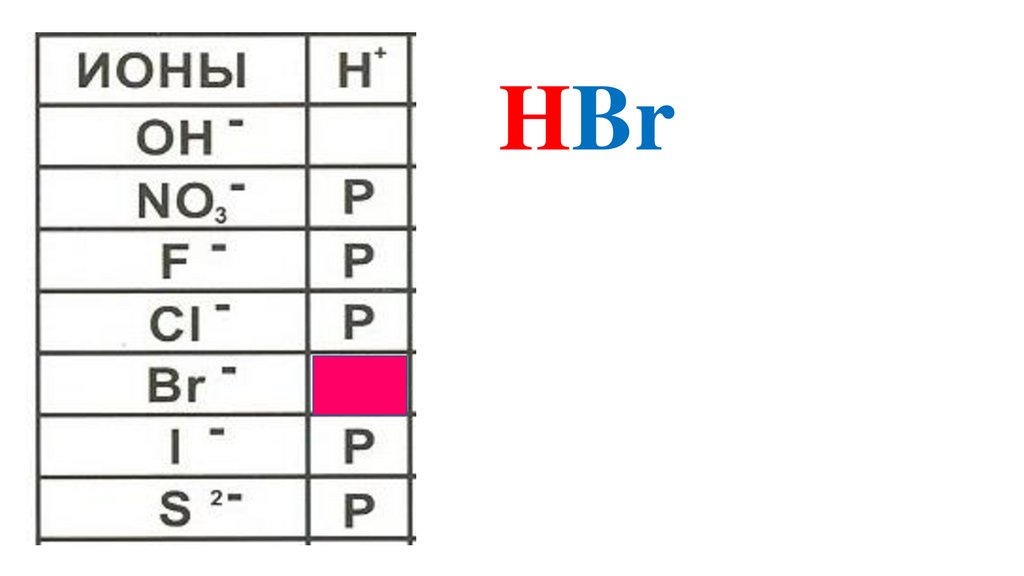
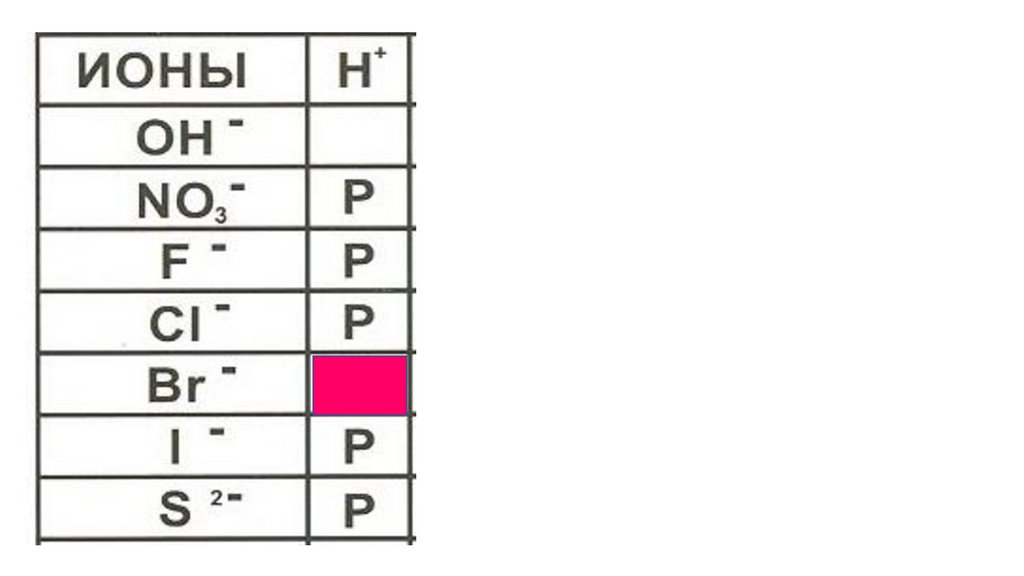
HBr46.
HBr47.
HBr48.
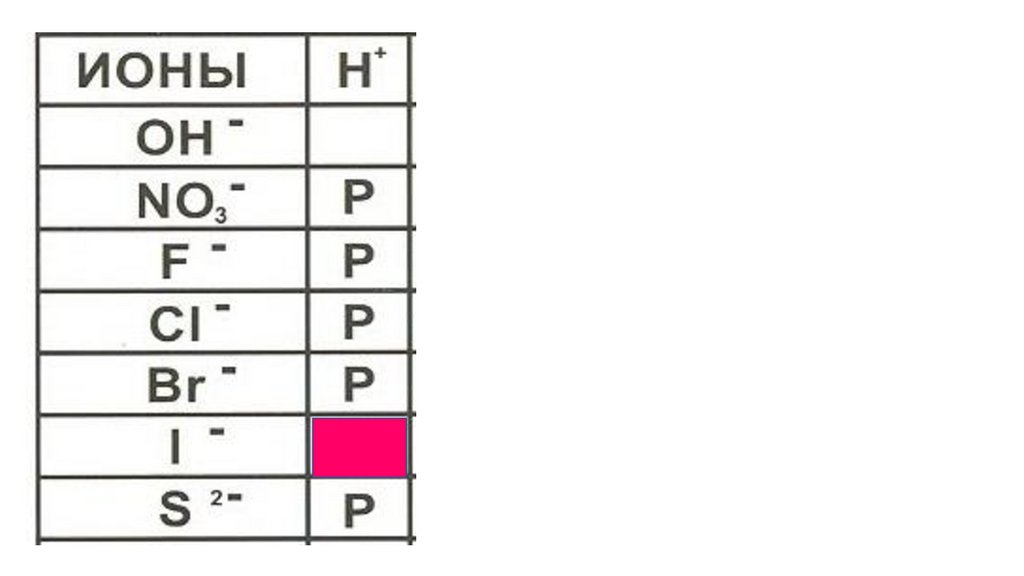
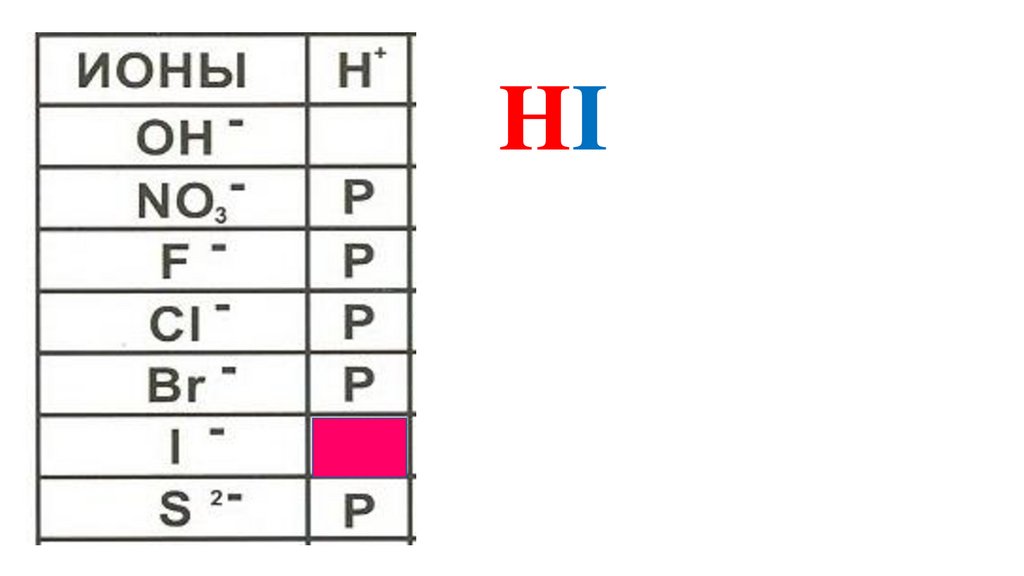
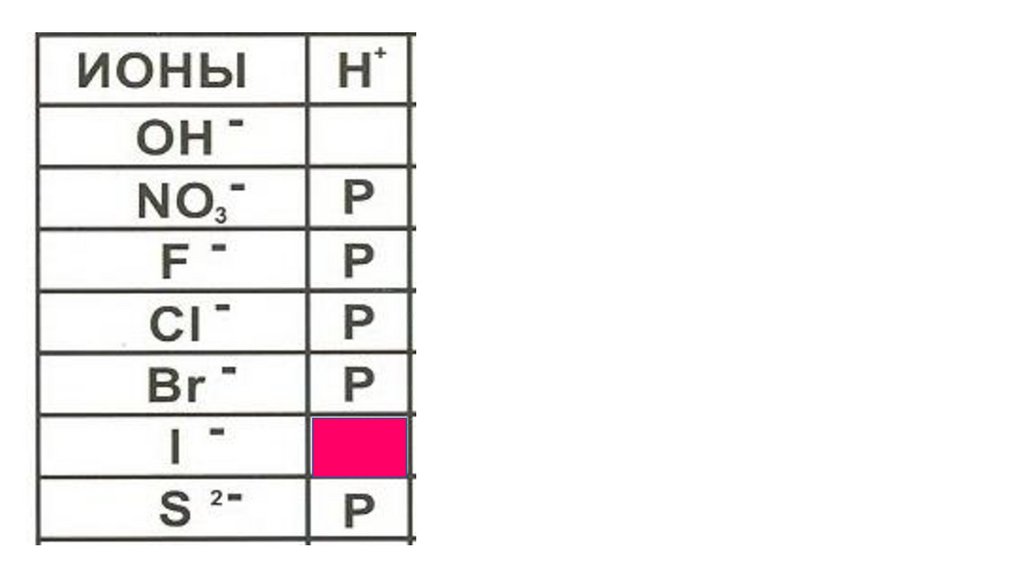
HI49.
HI50.
HI51.
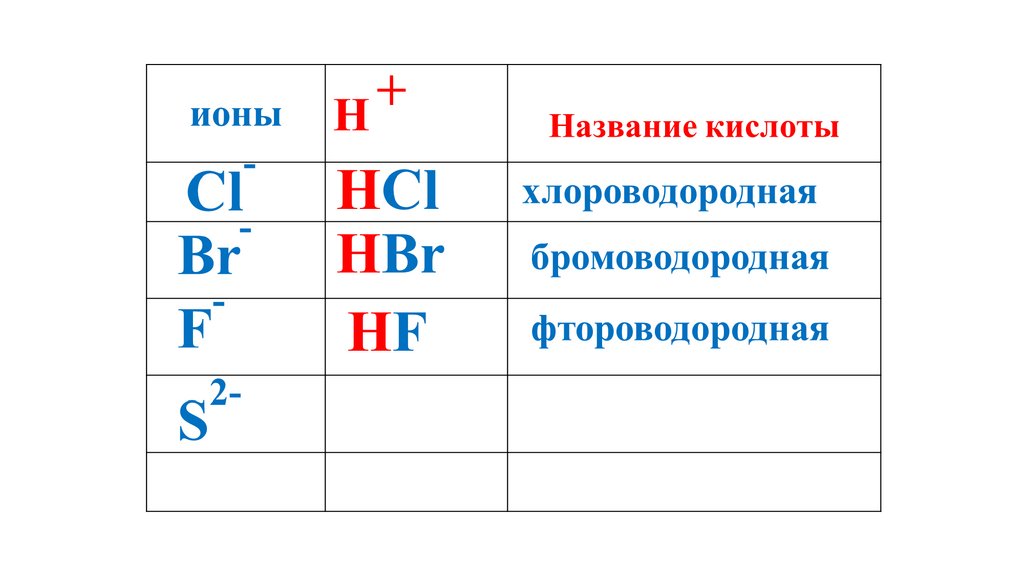
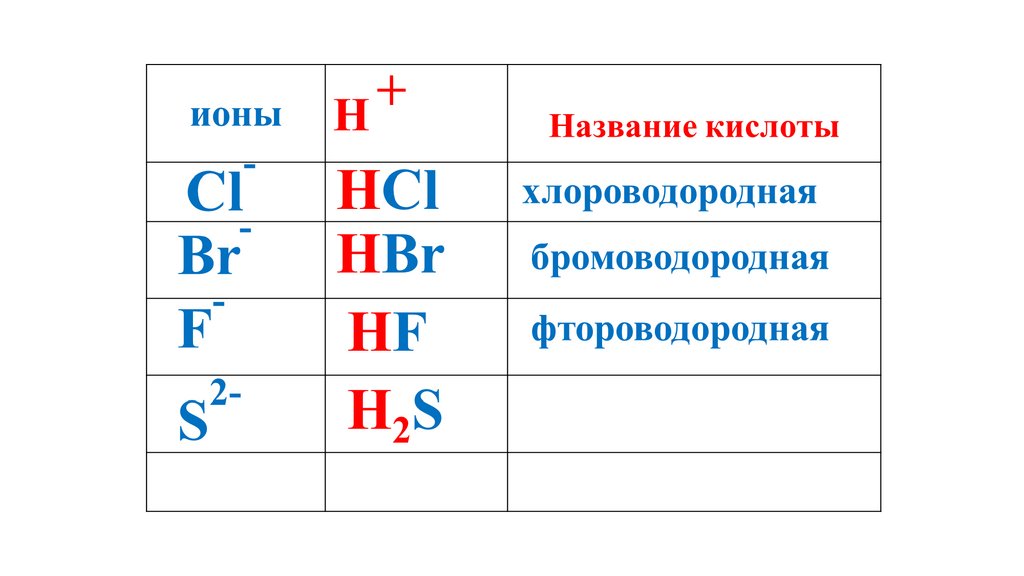
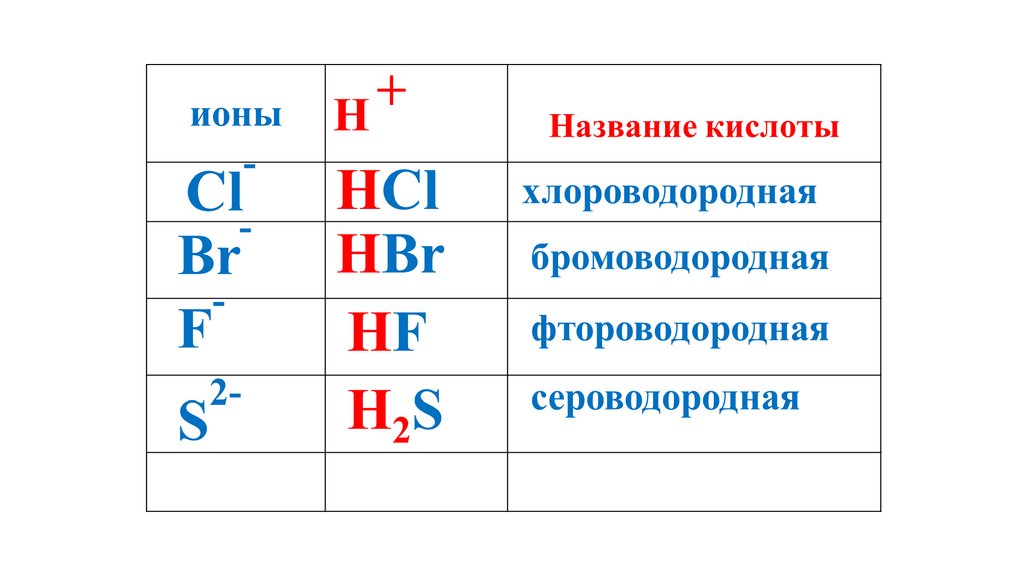
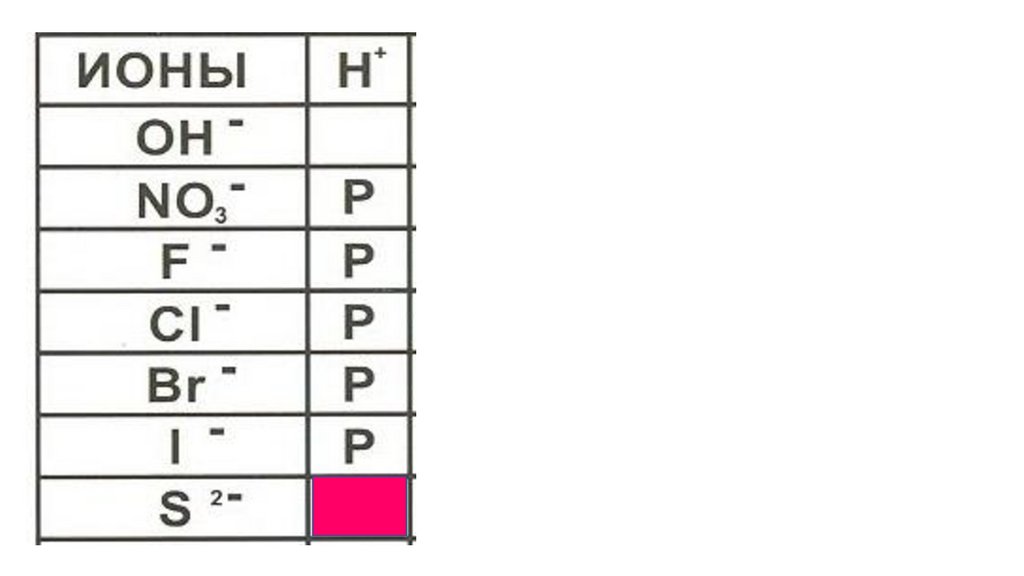
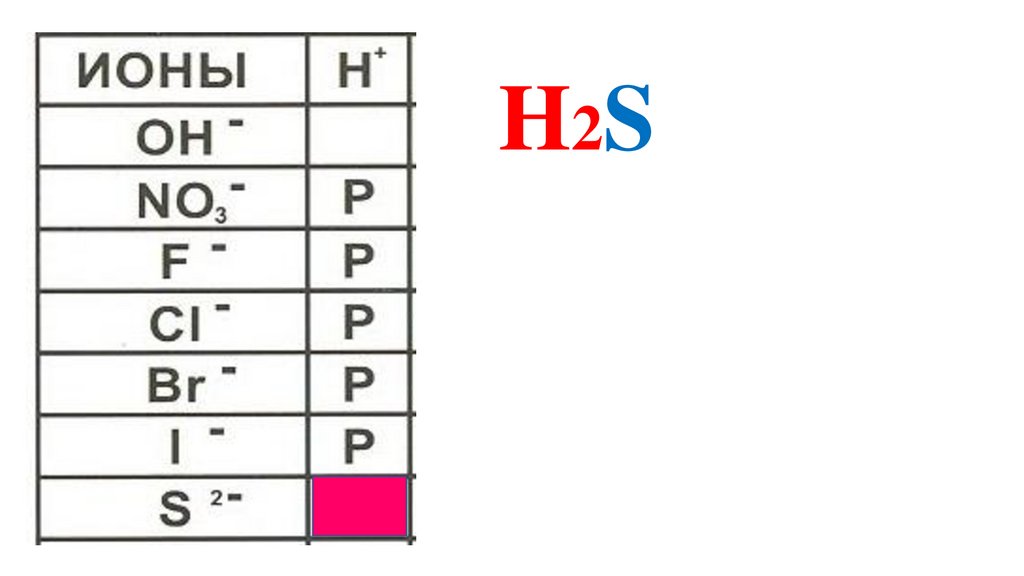
H2S52.
H2S53.
ИОНЫH
+
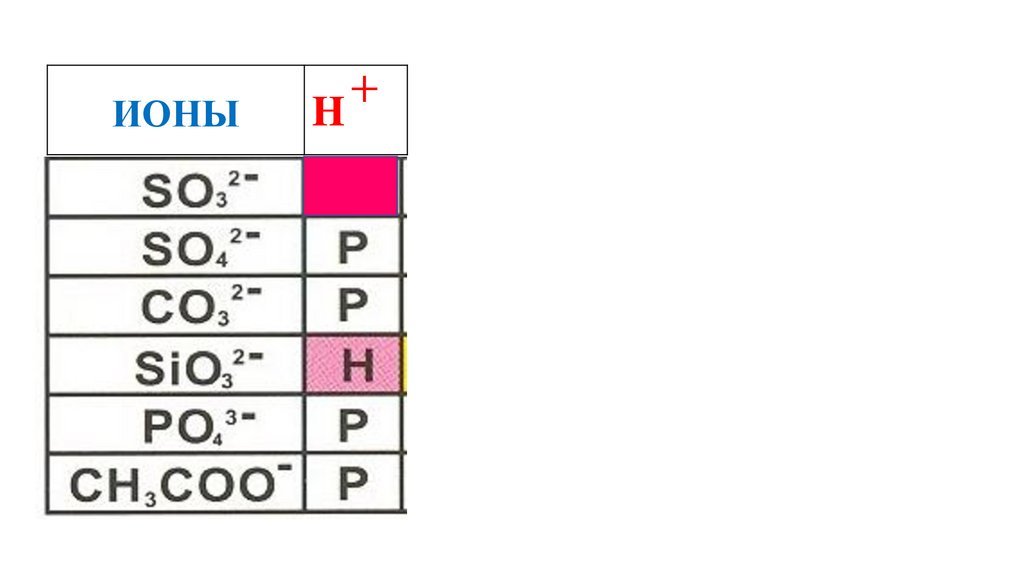
H2SO3
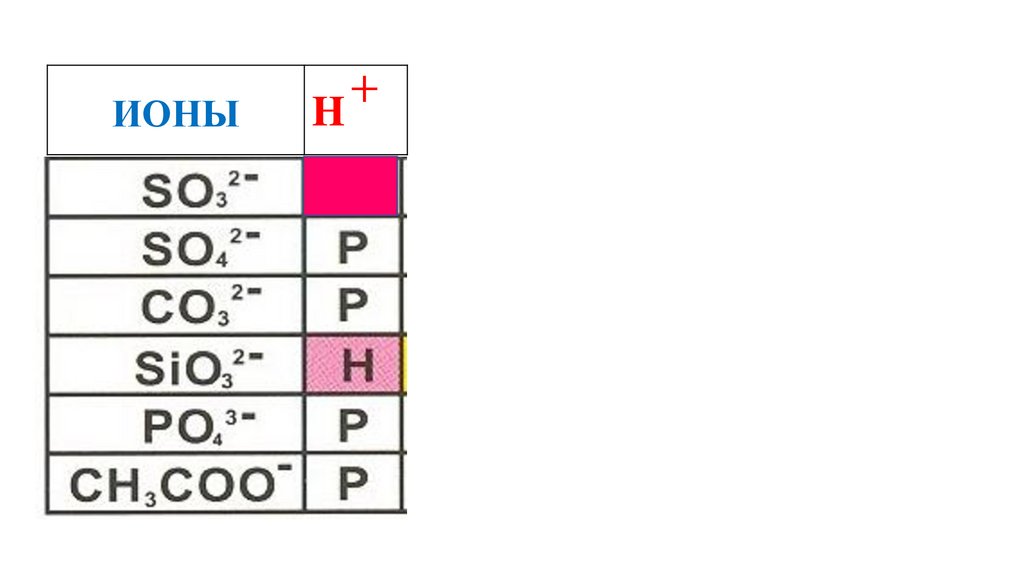
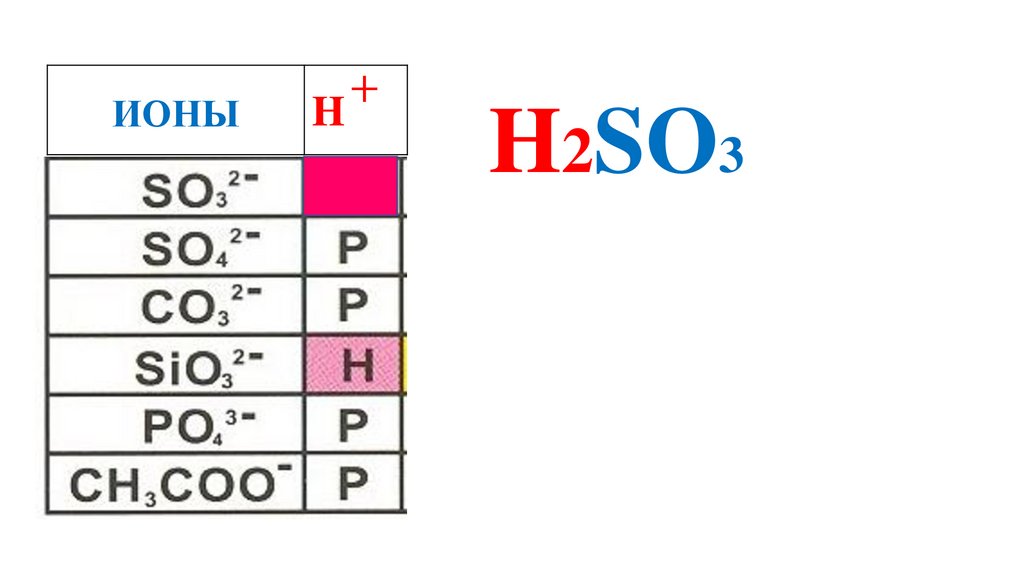
54.
ИОНЫH
+
H2SO3
55.
ИОНЫH
+
H2SO3
56.
ИОНЫH
+
H2SO3
57.
ИОНЫH
+
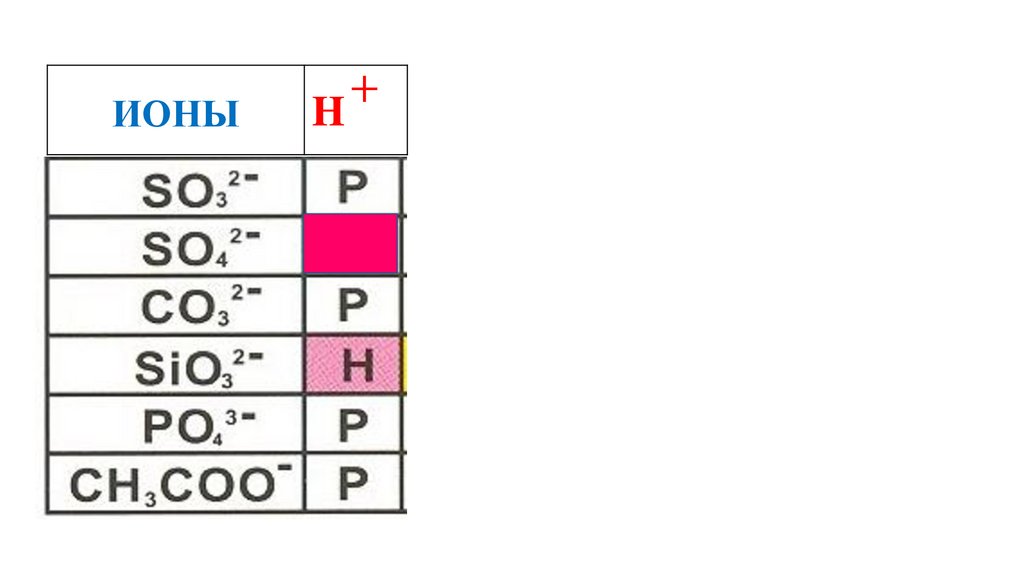
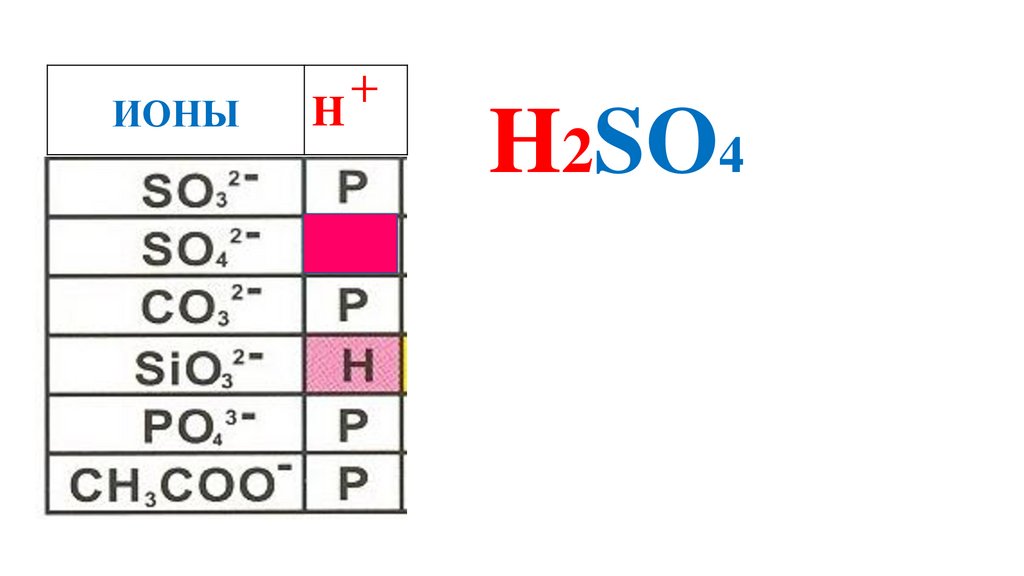
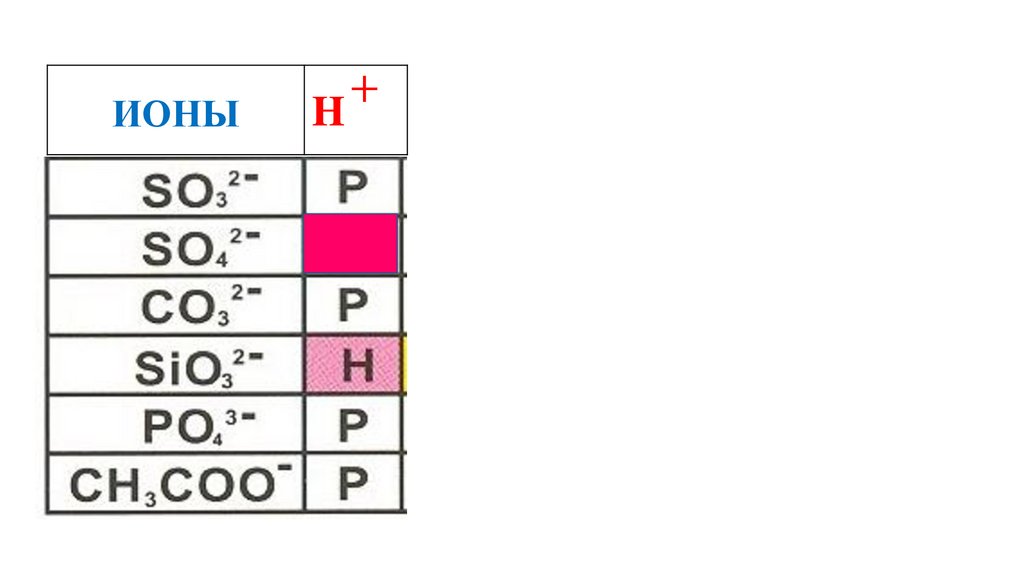
H2SO4
58.
ИОНЫH
+
H2SO4
59.
ИОНЫH
+
H2SO4
60.
ИОНЫH
+
H2CO3
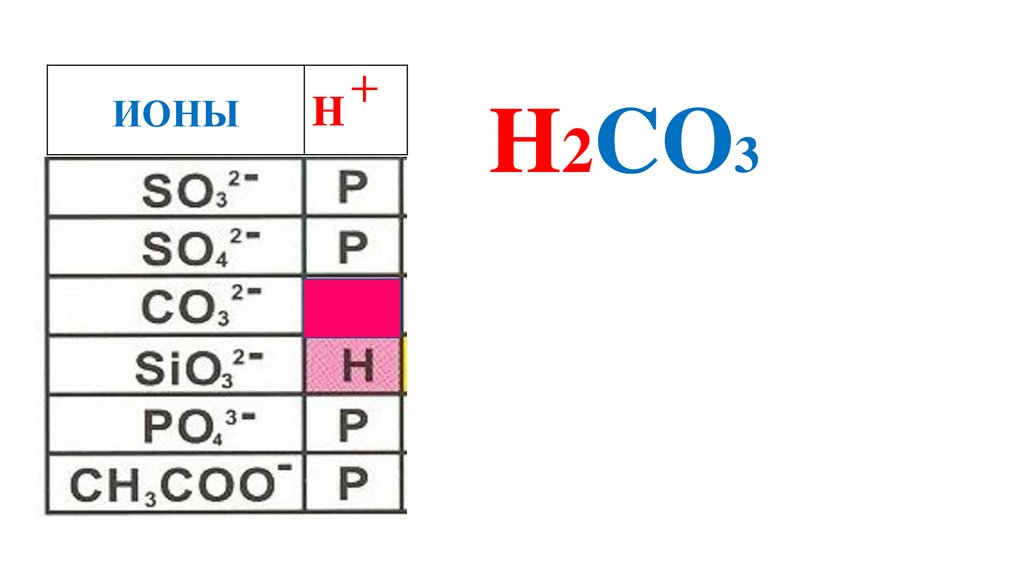
61.
ИОНЫH
+
H2CO3
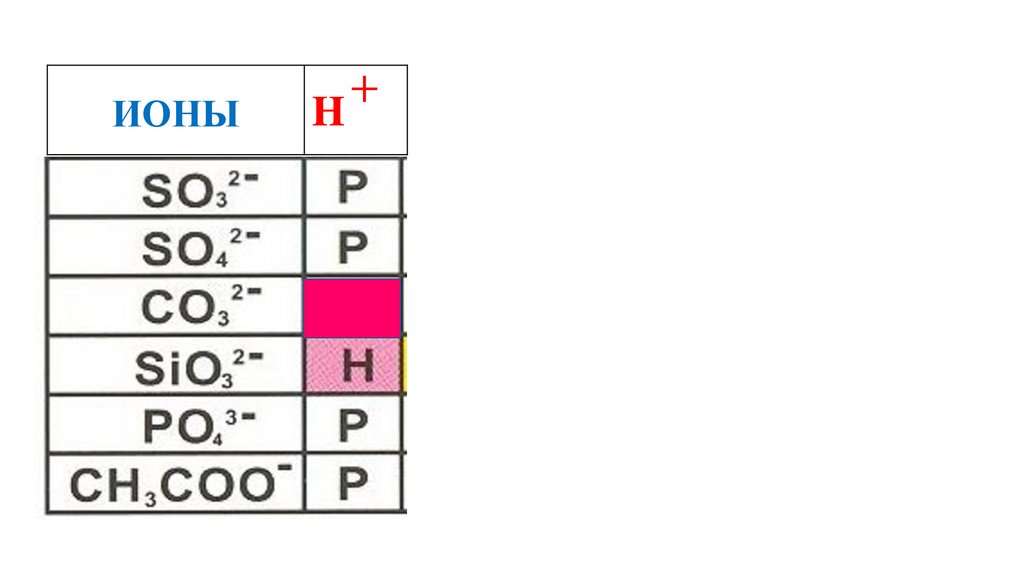
62.
ИОНЫH
+
H2CO3
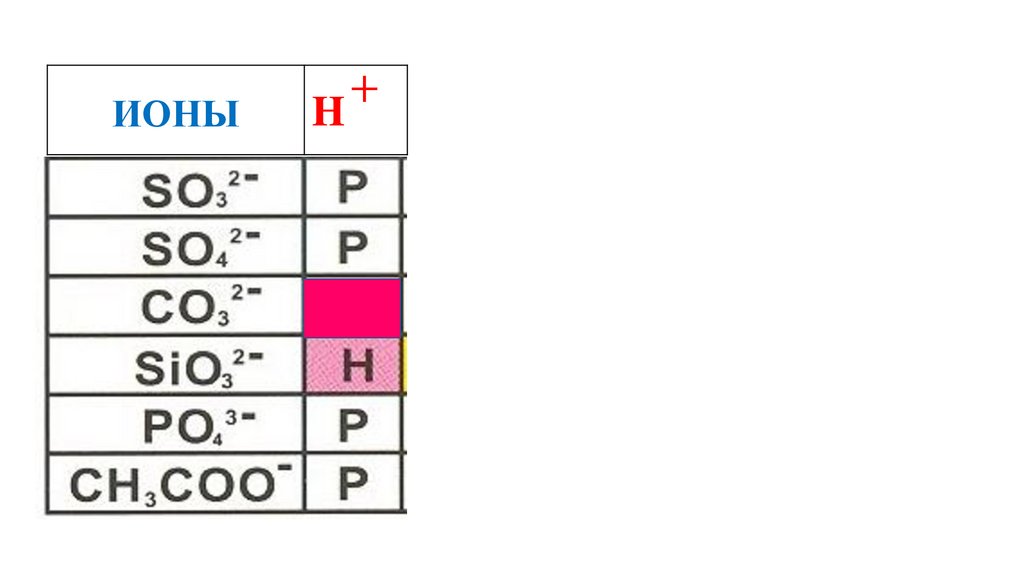
63.
ИОНЫH
+
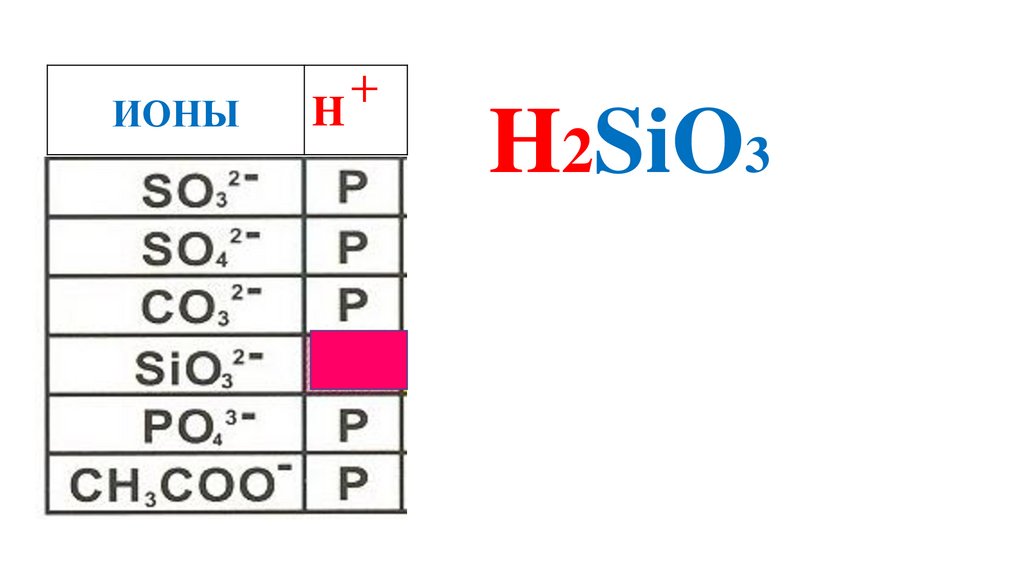
H2SiO3
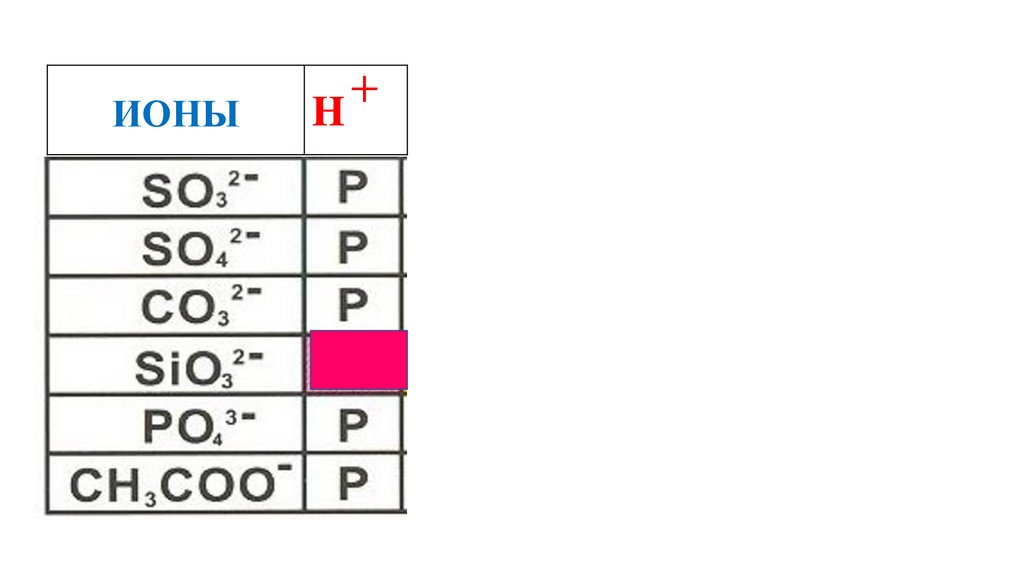
64.
ИОНЫH
+
H2SiO3
65.
ИОНЫH
+
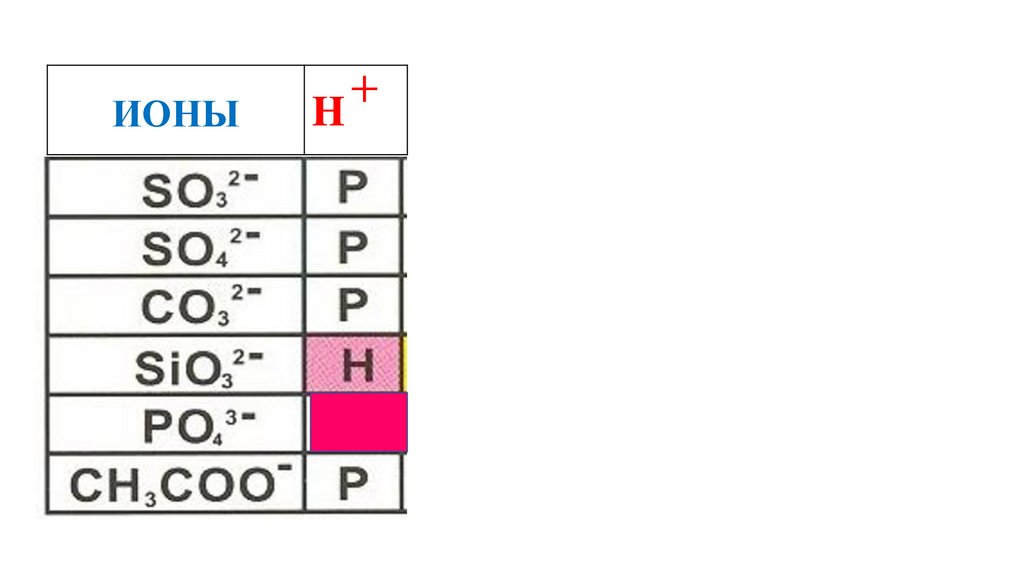
H3PO4
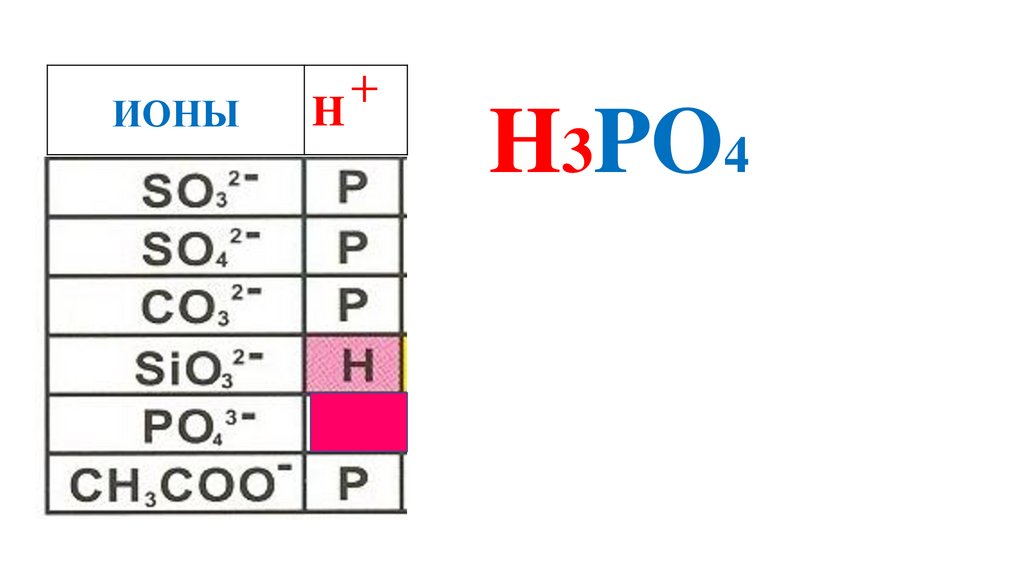
66.
ИОНЫH
+
H3PO4
67.
ИОНЫH
+
H3PO4
68.
ИОНЫH
+
H3PO4
69.
ИОНЫH
+
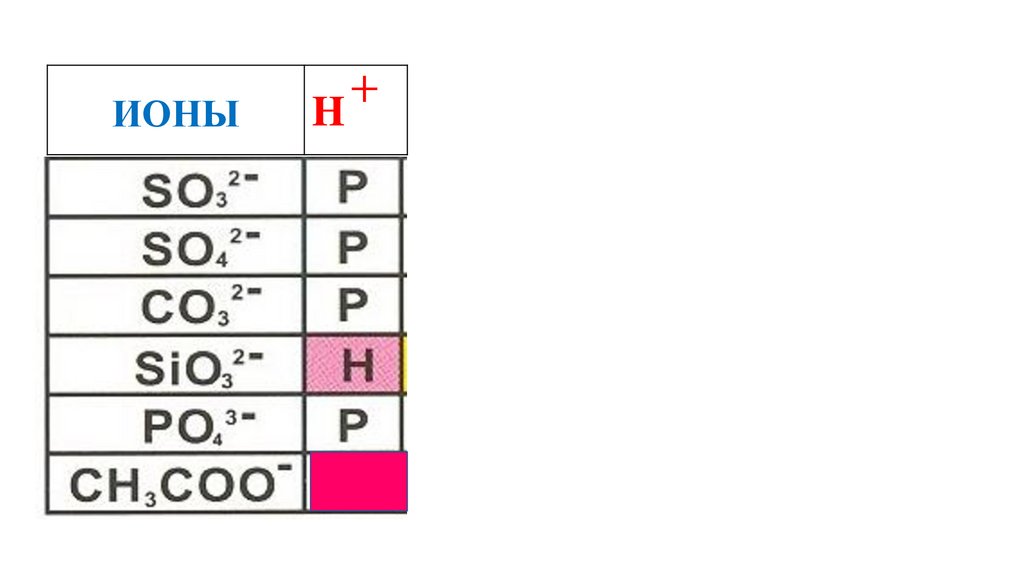
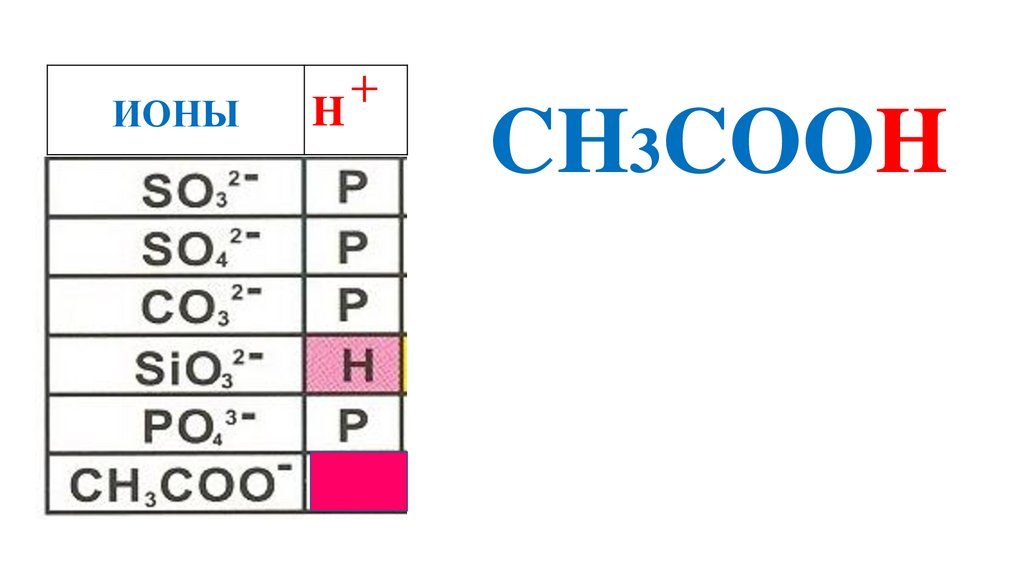
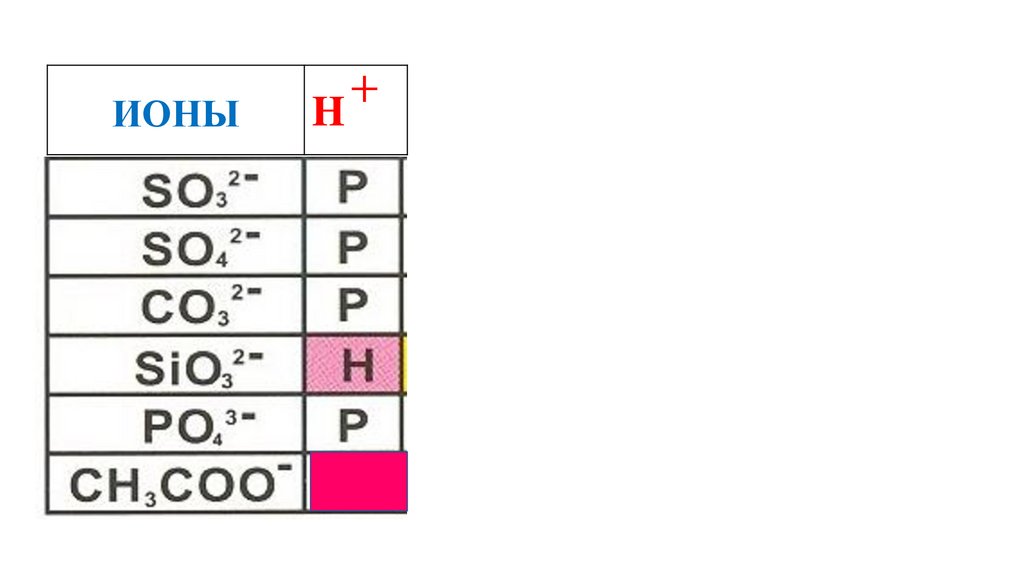
CH3COOH
70.
ИОНЫH
+
CH3COOH
71.
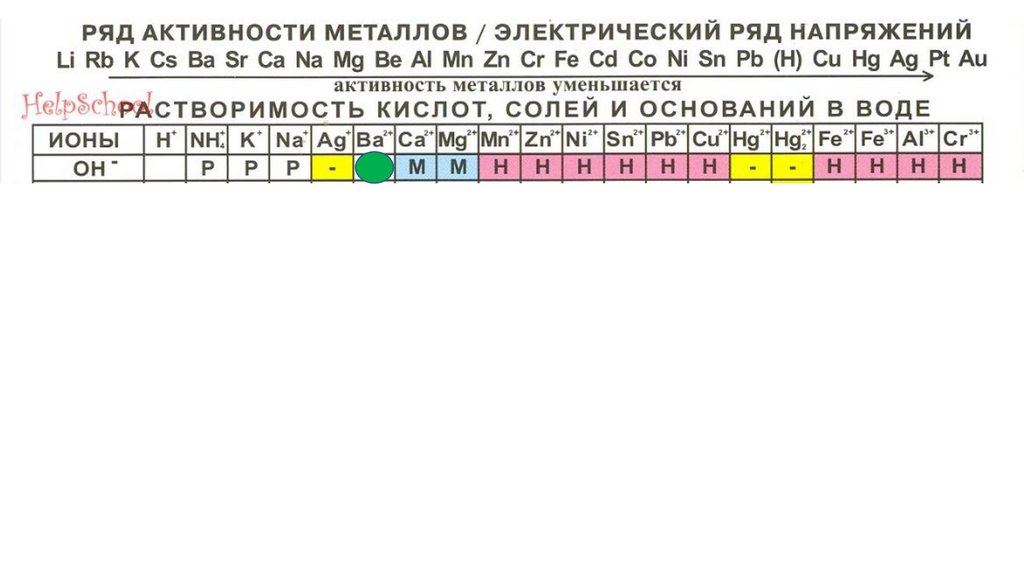
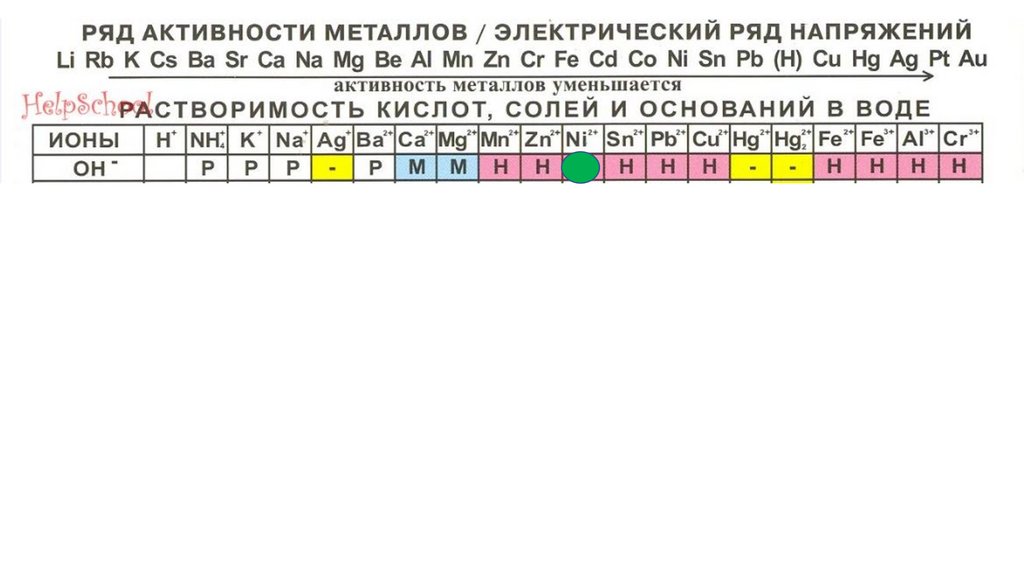
Составление формулоснований
72.
HOH73.
HOH74.
HOH75.
HOH76.
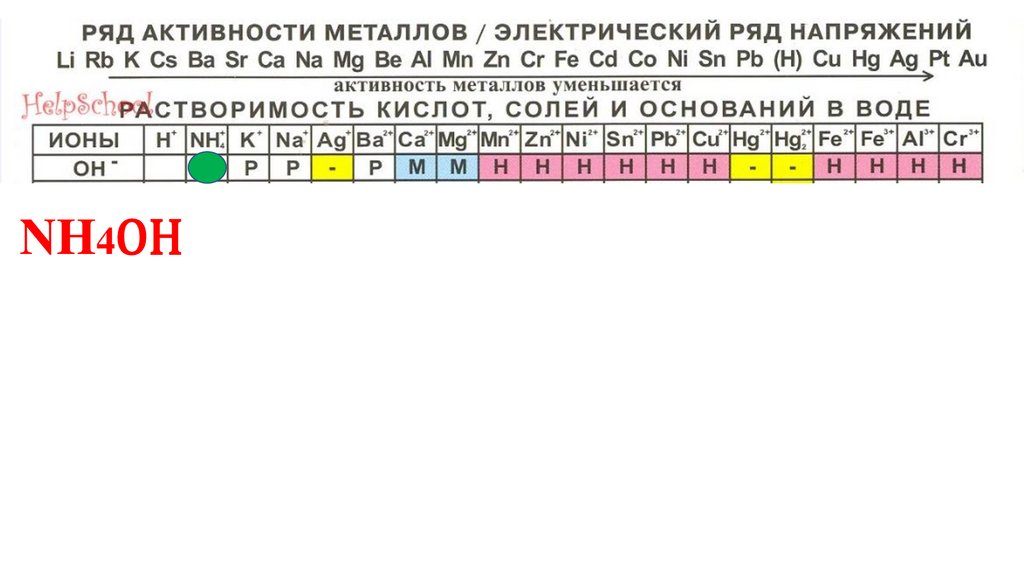
NH4OH77.
NH4OH78.
NH4OH79.
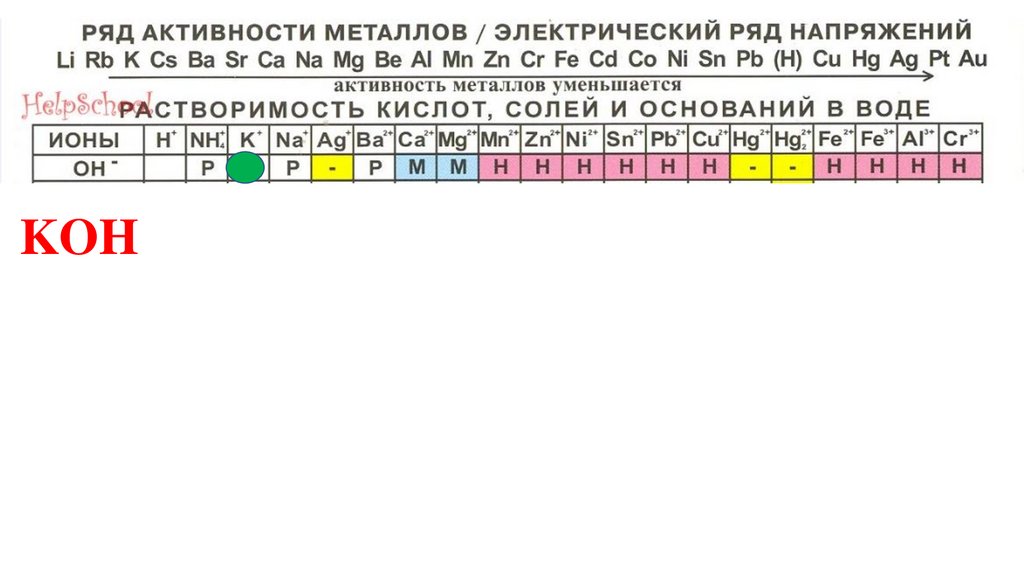
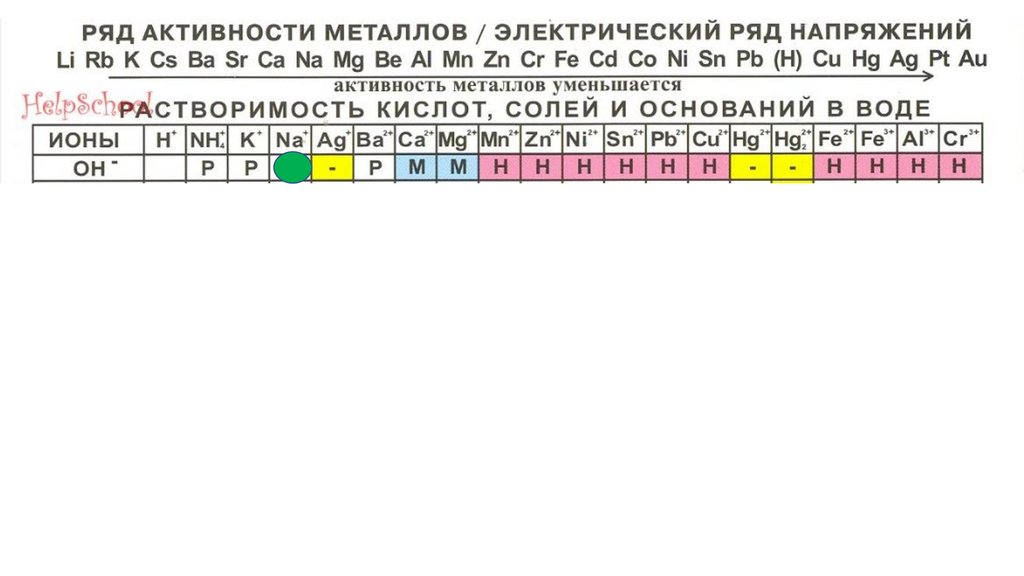
KOH80.
81.
82.
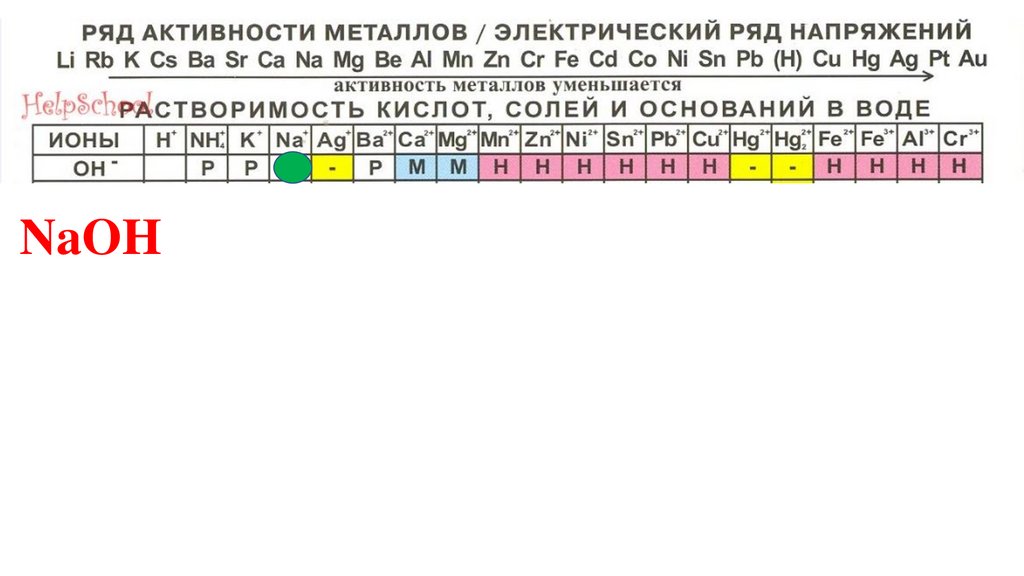
NaOH83.
NaOH84.
NaOH85.
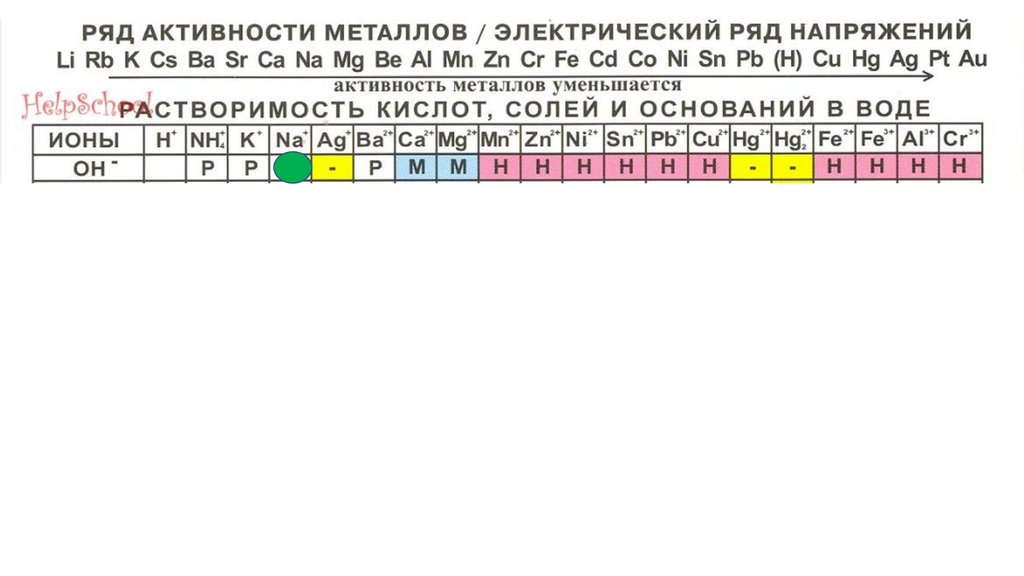
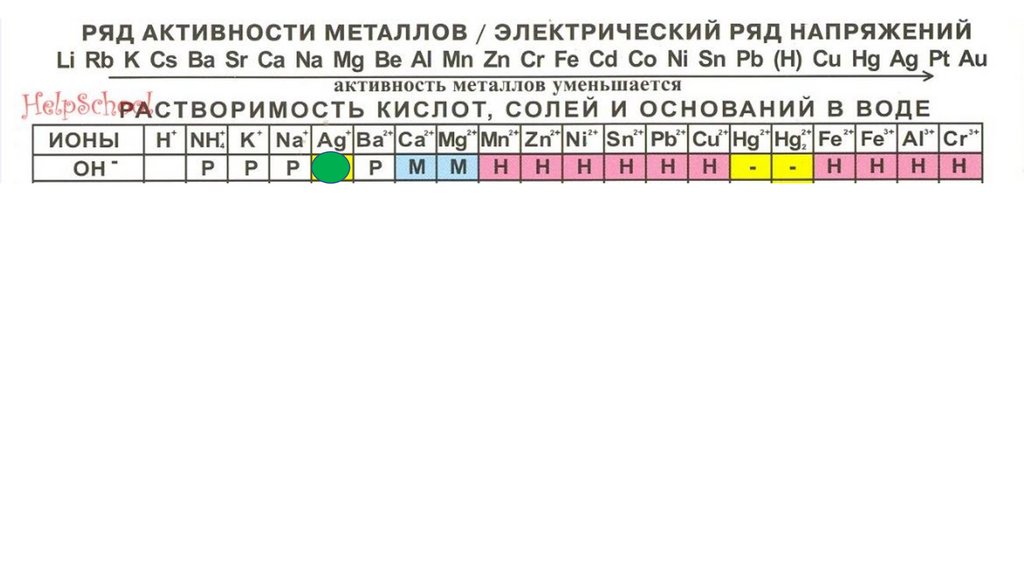
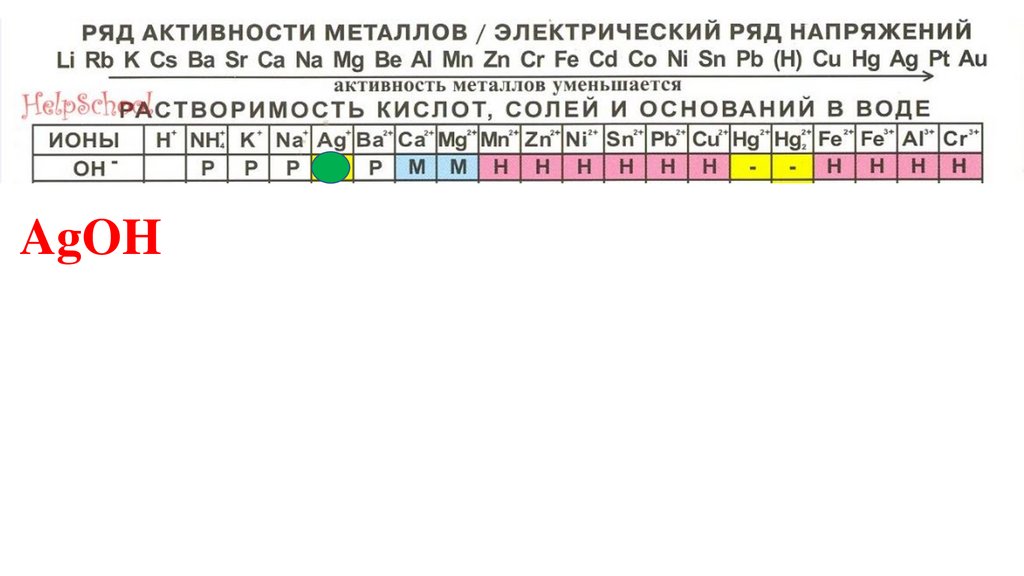
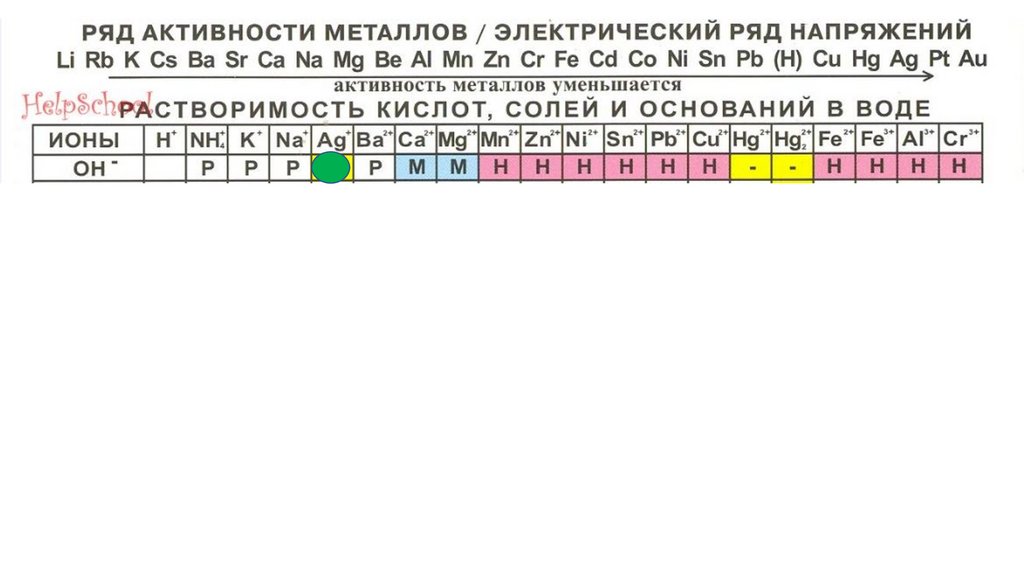
AgOH86.
AgOH87.
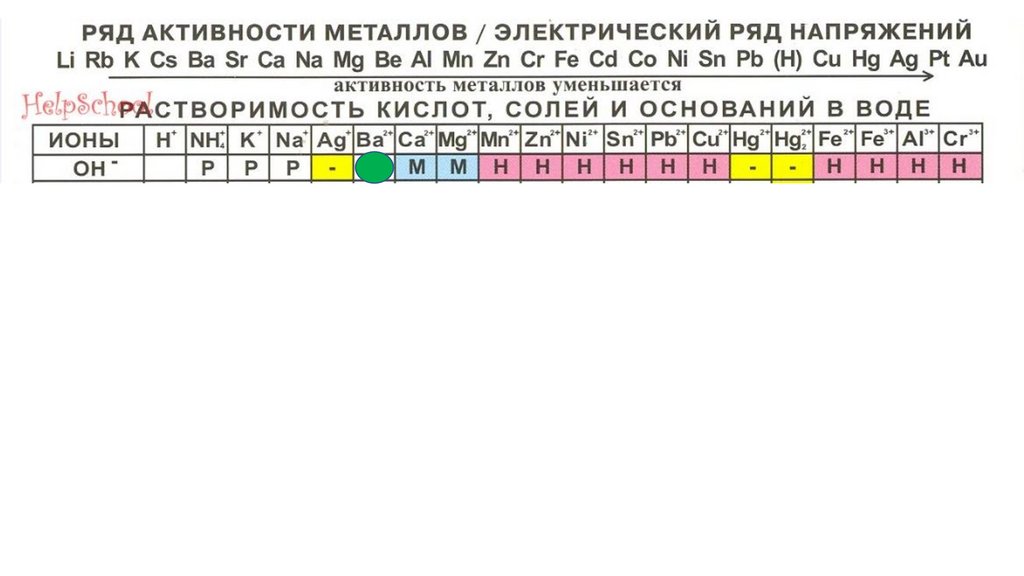
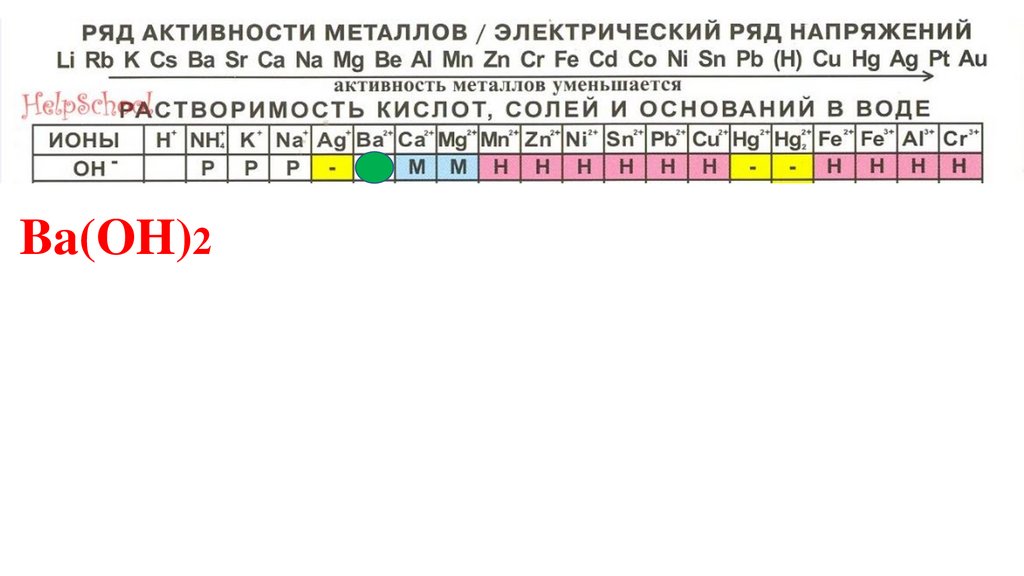
Ba(OH)288.
Ba(OH)289.
Ba(OH)290.
Ba(OH)291.
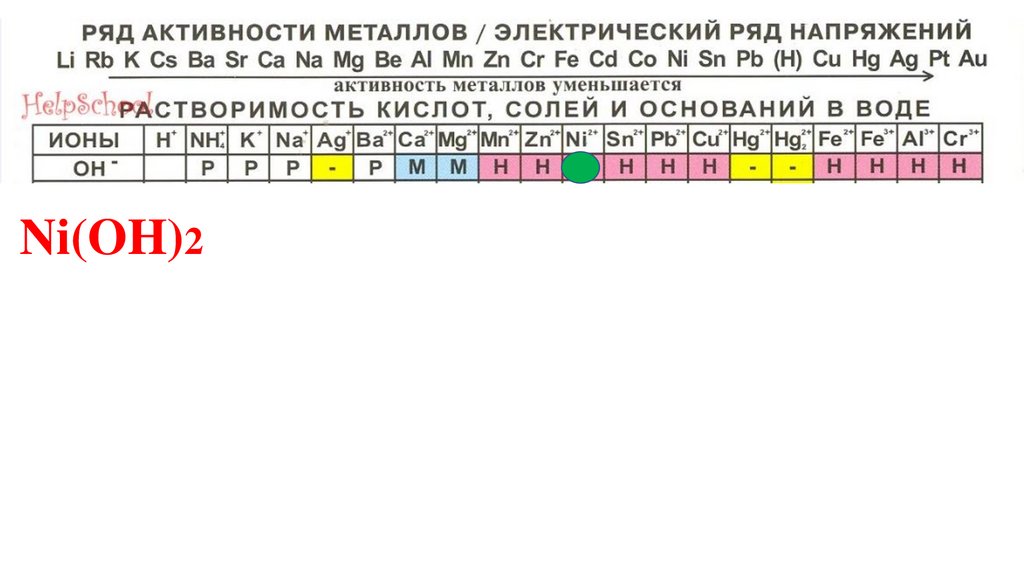
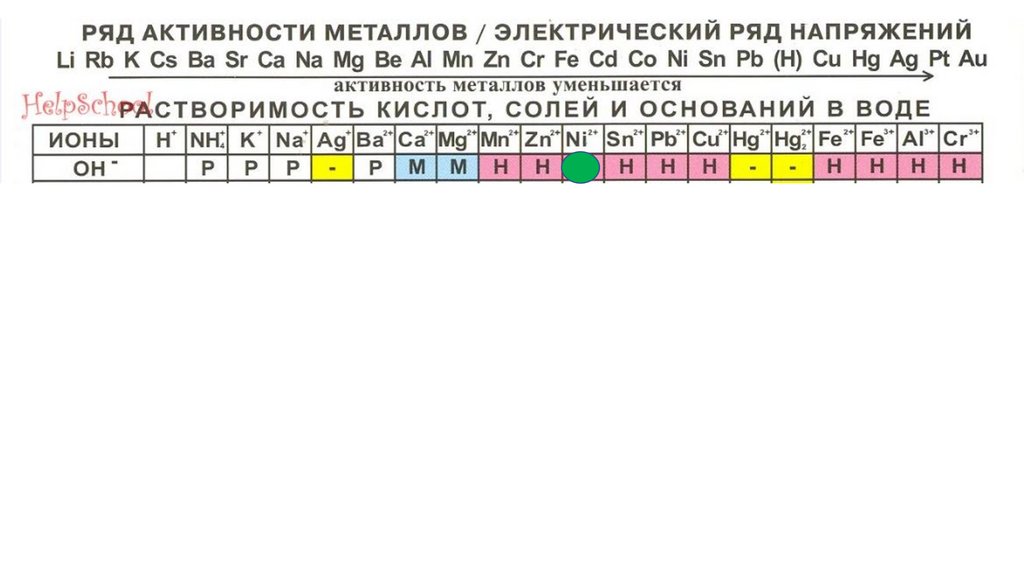
Ni(OH)292.
Ni(OH)293.
Ni(OH)294.
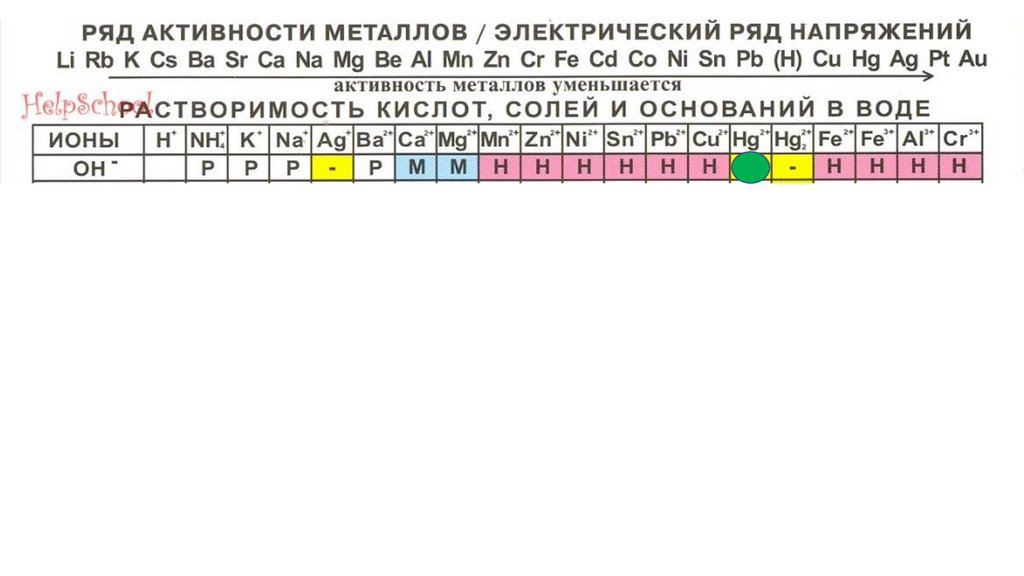
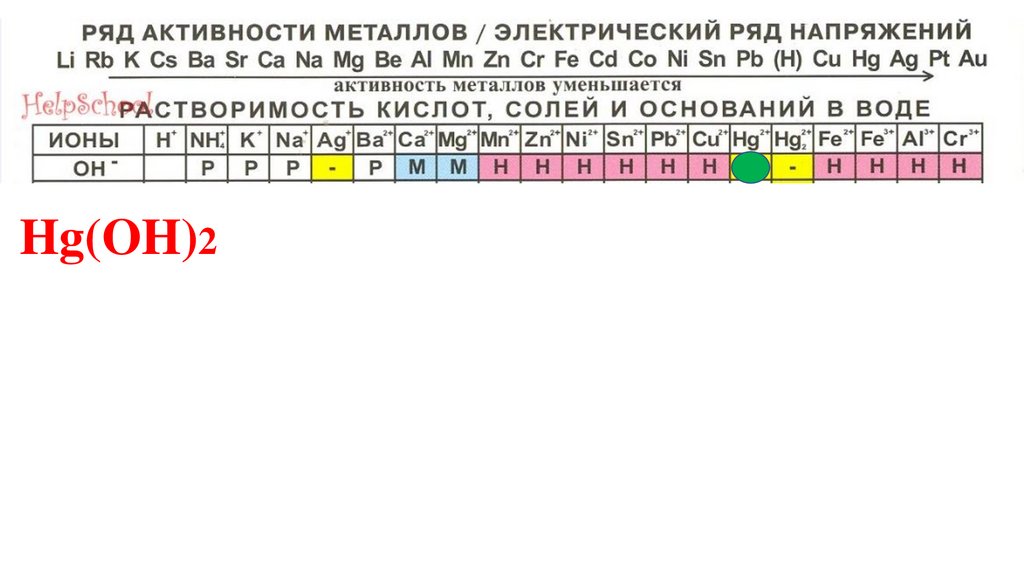
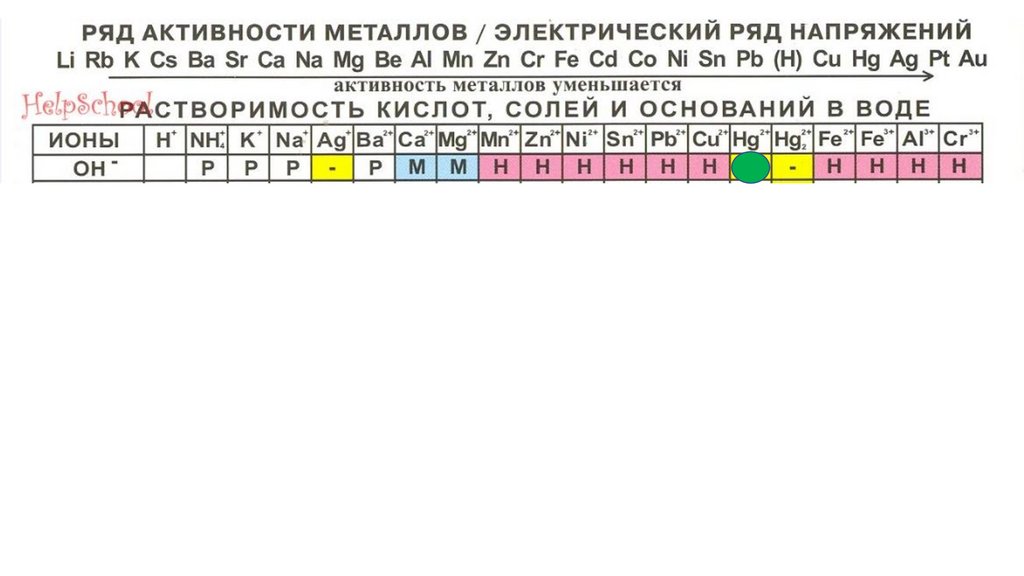
Hg(OH)295.
Hg(OH)296.
Hg(OH)297.
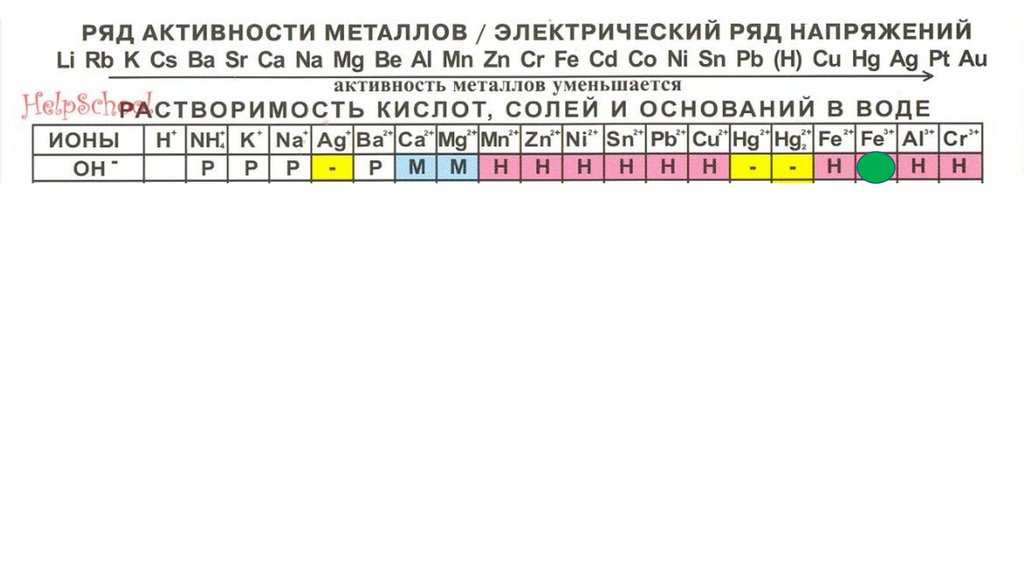
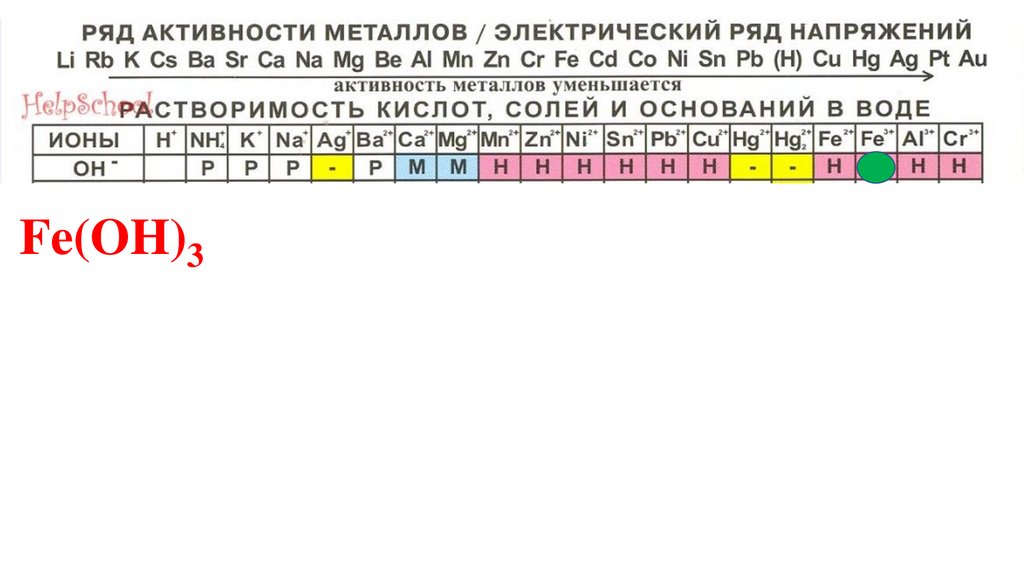
Fe(OH)398.
Fe(OH)399.
Fe(OH)3100.
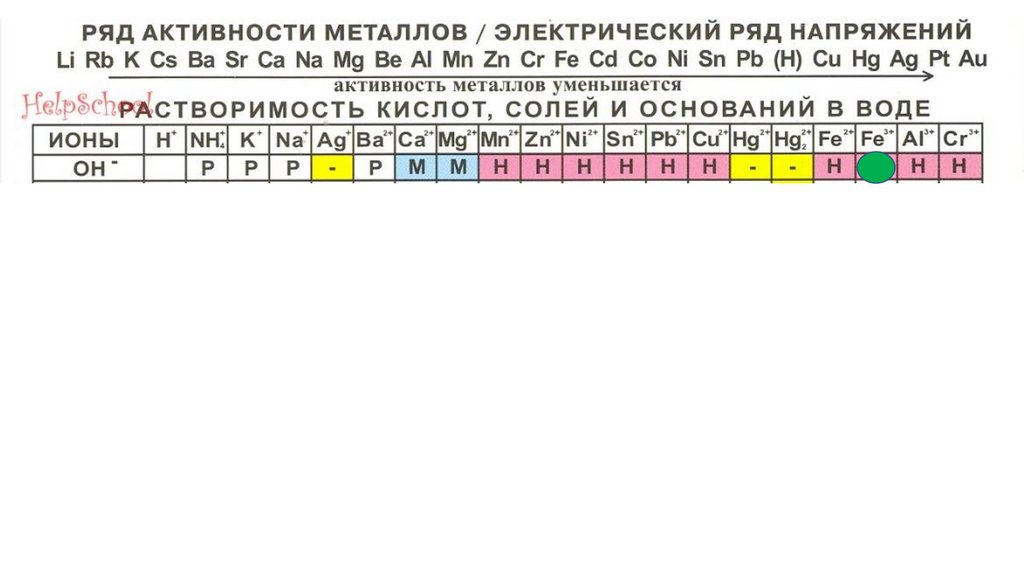
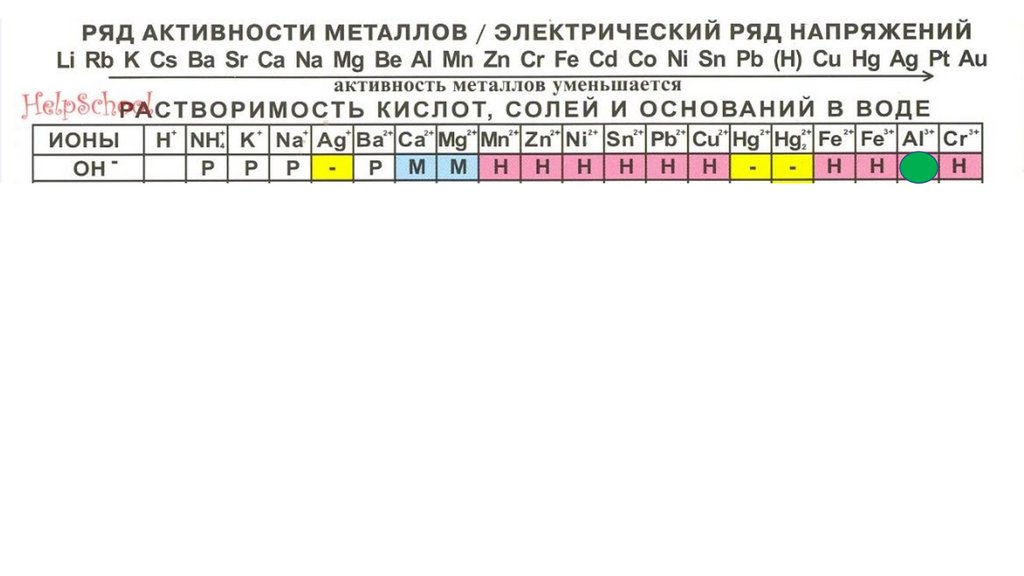
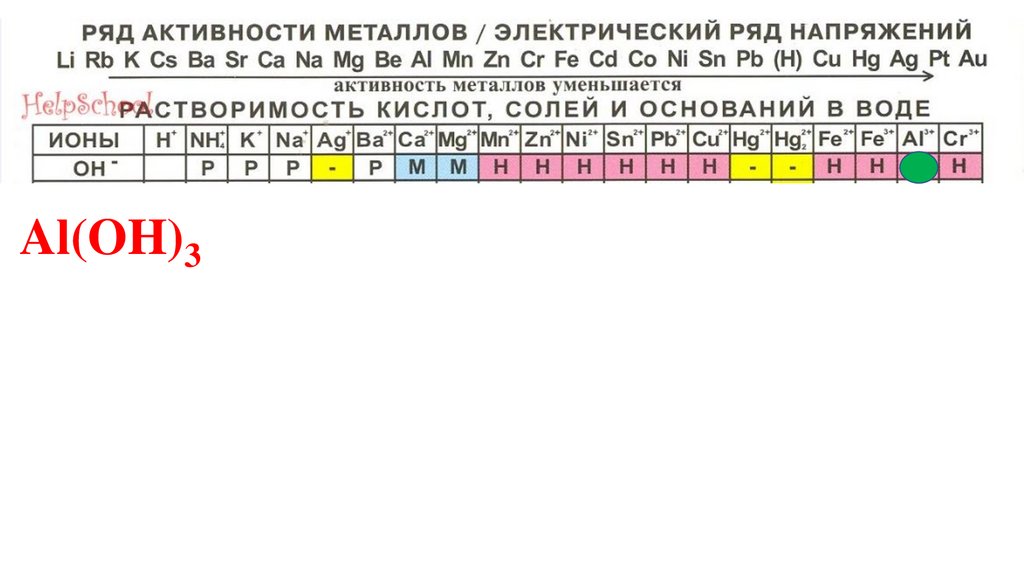
Al(OH)3101.
Al(OH)3102.
Al(OH)3103.
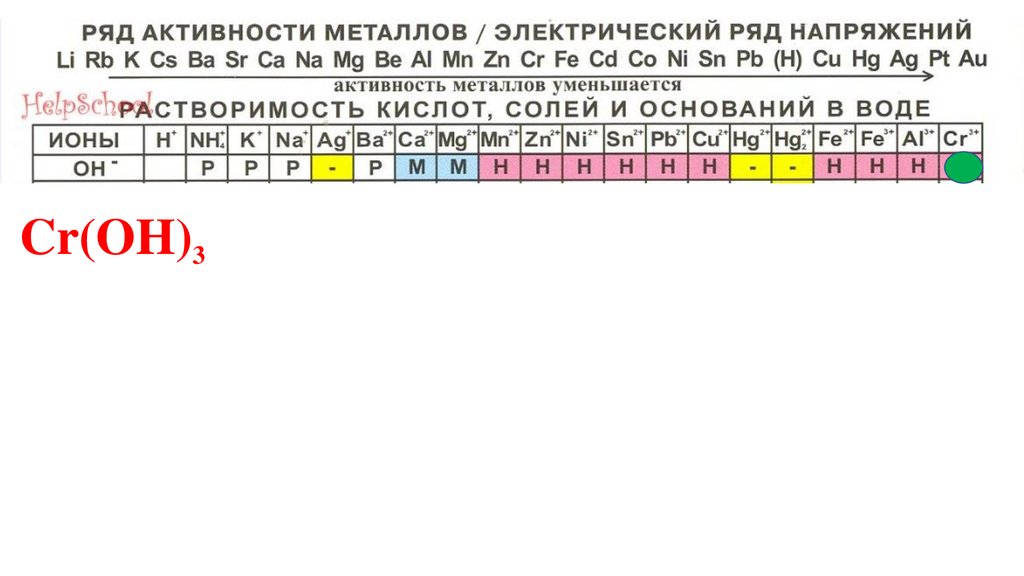
Cr(OH)3104.
Cr(OH)3105.
Э -3.Обобщение и систематизацияЧто такое кислоты? Каков их состав? По каким
признакам их можно классифицировать?
IV. Подведение итогов
Домашнее задание: § 16, упр.№ 1-5 после § 16












 Химия
Химия








