Похожие презентации:
Уравнение состояния идеального газа
1.
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА.ГАЗОВЫЕ ЗАКОНЫ
2. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА.
Состояние данной массы газахарактеризуется тремя
макроскопическими параметрами:
• Давление Р
• Объем V
• Температура T
3. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА.
Уравнение, которое связываетвсе три макроскопические
параметры (P, V, T), называется
уравнением состояния
идеального газа.
4. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА.
Это уравнение впервые былополучено Клапейроном, затем
уточнено Менделеевым и
получило название уравнение
Менделеева-Клапейрона
5. Клапейрон Бенуа Поль Эмиль
• (26.I.1799–28.I.1864)• Французский физик,
член Парижской АН
(1858). Окончил
Политехническую
школу в Париже (1818).
В 1820–30 работал в
Петербурге в институте
инженеров путей
сообщения.
6. Менделеев Дмитрий Иванович
• (8.II.1834–2.II.1907)• Русский ученыйэнциклопедист.. В 1874
вывел общее уравнение
состояния идеального
газа, обобщив уравнение
Клапейрона(уравнение
КлапейронаМенделеева).
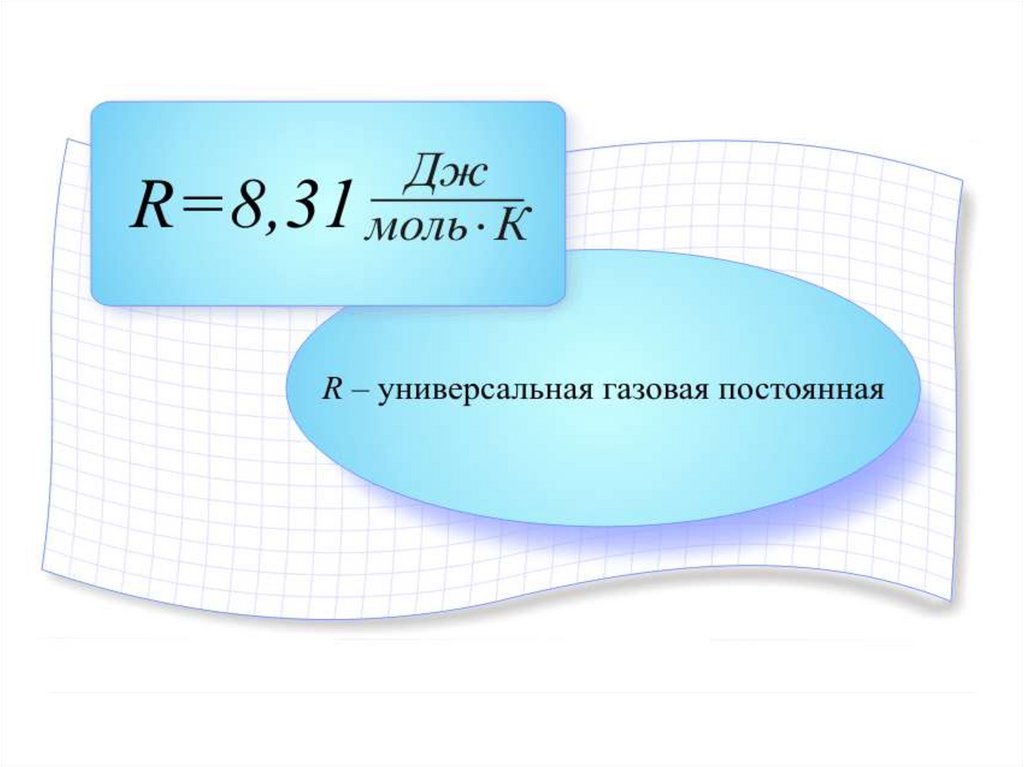
7. УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА
8.
9.
10. ГАЗОВЫЕ ЗАКОНЫ
Количественные зависимости между двумяпараметрами газа при неизменном значении
третьего параметра называют
газовыми законами.
11. изопроцессы
Процессы, протекающиепри неизменном
значении одного из
параметров, называют
изопроцессами.
12. Существует три вида изопроцессов
• Изотермический• Изобарный
• Изохорный
13. Изотермический процесс
• Процесс изменения состояниясистемы при постоянной
температуре называют
изотермическим
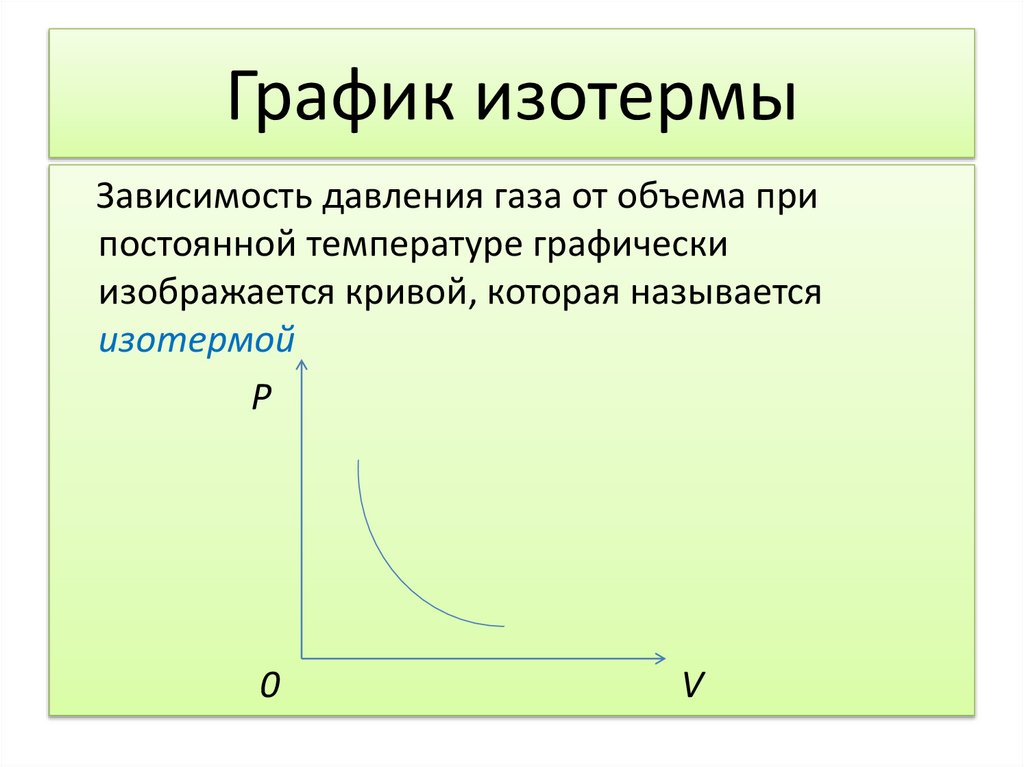
14. График изотермы
Зависимость давления газа от объема припостоянной температуре графически
изображается кривой, которая называется
изотермой
Р
0
V
15. Закон Бойля-Мариотта
при• Для газа данной массы произведение
давление газа на его объем
постоянно, если температура газа не
меняется.
16. К этому выводу пришёл английский учёный Роберт Бойль в 1662 г. и французский физик Э.Мариотт в 1676г.
17. Закон Бойля-Мариотта
18. Изобарный процесс
• Процесс изменения состояниясистемы при постоянном
давлении называют
изобарным
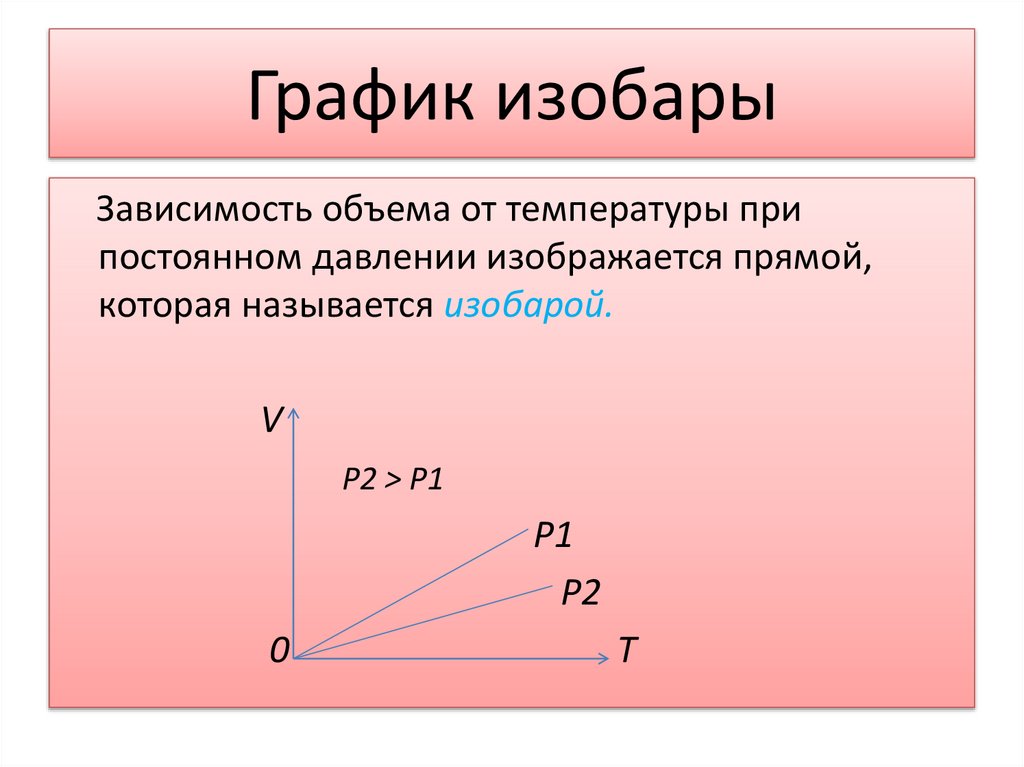
19. График изобары
Зависимость объема от температуры припостоянном давлении изображается прямой,
которая называется изобарой.
V
P2 > P1
P1
P2
0
T
20. Закон Гей-Люссака
при
• Для газа данной массы
отношение объема к температуре
постоянно, если давление газа не
меняется.
21. Этот закон экспериментально был открыт в 1802г. Французским учёным Гей-Люссаком
22. Закон Гей-Люссака
V1T1
V2
T2
23. Изохорный процесс
• Процесс изменения состояниясистемы при постоянном
объеме называют изохорным
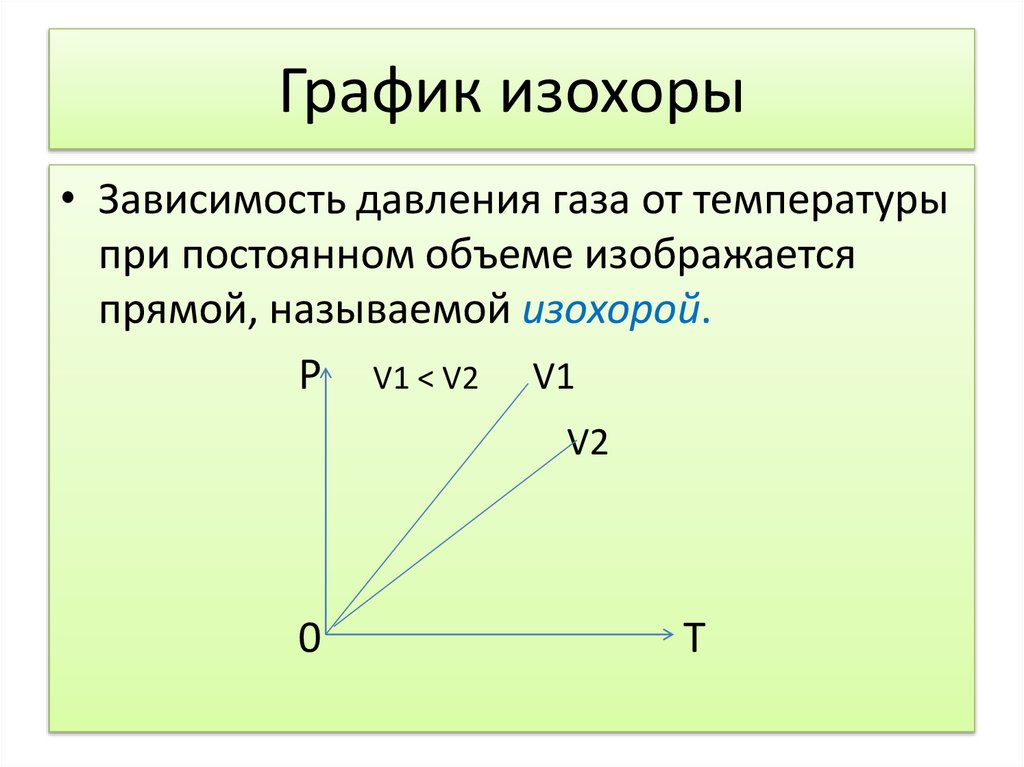
24. График изохоры
• Зависимость давления газа от температурыпри постоянном объеме изображается
прямой, называемой изохорой.
P V1 < V2 V1
V2
0
Т
25. Закон Шарля
при
• Для газа данной массы отношение
давления к температуре
постоянно, если объем не
меняется.
26. Эту зависимость экспериментально установил в 1787г. французский физик Шарль
27. Закон Шарля
28. Задача № 1
Газ сжат изотермически от объема 8 л до объема 6л. Каким было первоначальное давление газа, если
после сжатия оно стало равно 1,6 кПа?
29. Задача № 2
Газ, занимающий объем 2 л при температуре 280 К,изобарно расширяется до объема 3 л. Какой станет
температура газа?
30. Задача № 3
Газ при температуре 27°С и давлении 5 МПаизохорно охладили, после чего давление стало
равно 4 МПа. До какой температуры охладили газ?
31. Задача № 4
Найти массу водорода в баллоне объемом 2 л поддавлением 8,31 МПа при температуре 17°С.
32. Задача № 5
При температуре 0°С и давлении 10 кПа газзанимает объем 5 л. Каким будет объем газа при
давлении 20 кПа и температуре 25°С?




























 Физика
Физика








