Похожие презентации:
Азотсодержащие соединения
1. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
2. КЛАССИФИКАЦИЯ
• КЛАССИФИКАЦИЯв эту группу соединений объединяют несколько
классов:
•Амины
•Аминокислоты
•Нитросоединения
2
3. АМИНЫ
Амины могут быть рассмотрены как производныеаммиака.
H
.. N
H
H
Аминами называют органические соединения,
которые получают замещением атомов водорода в
аммиаке углеводородными радикалами.
3
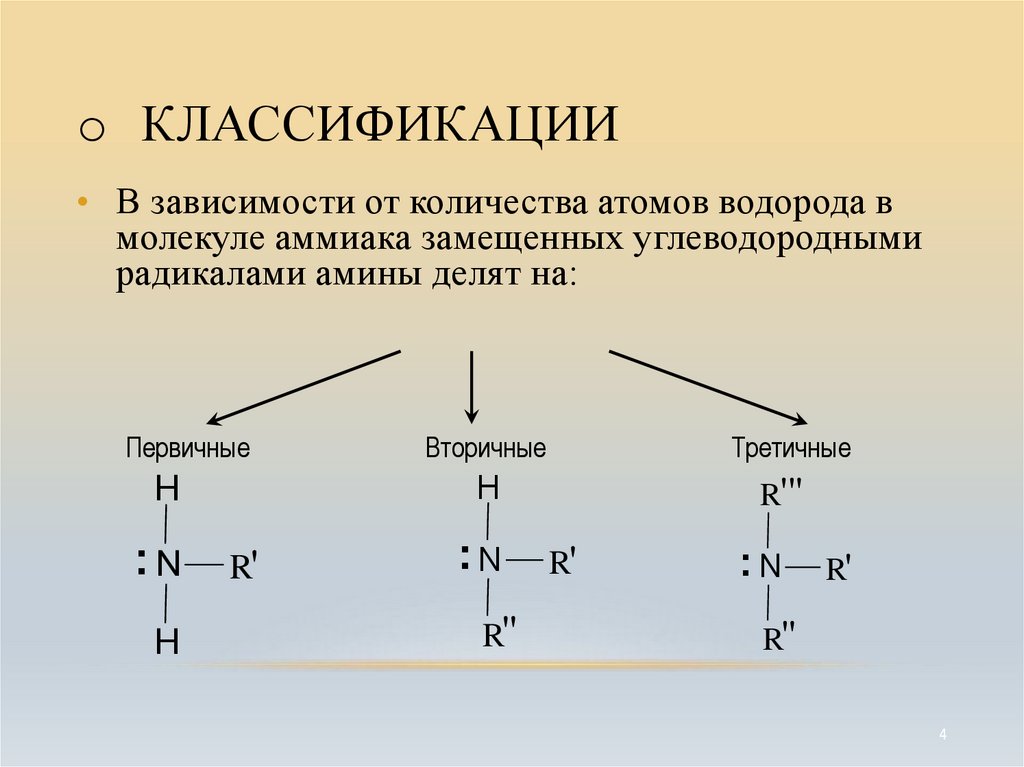
4. КЛАССИФИКАЦИИ
o КЛАССИФИКАЦИИ• В зависимости от количества атомов водорода в
молекуле аммиака замещенных углеводородными
радикалами амины делят на:
Первичные
H
.. N R'
H
Вторичные
Третичные
H
R'"
.. N R'
.. N R'
R"
R"
4
5. НОМЕНКЛАТУРА
o НОМЕНКЛАТУРА• Рациональная.
Название амина строят из двух слов: названия
углеводородных радикалов по радикальной
номенклатуре и слова «амин».
• Международная
Употребляется для построения названий только
первичных аминов. В основе лежит название
углеводорода и приставка «амино-» перед которой
цифрой указывают положение аминогруппы.
Иногда вместо приставки используют суффикс
«амин».
5
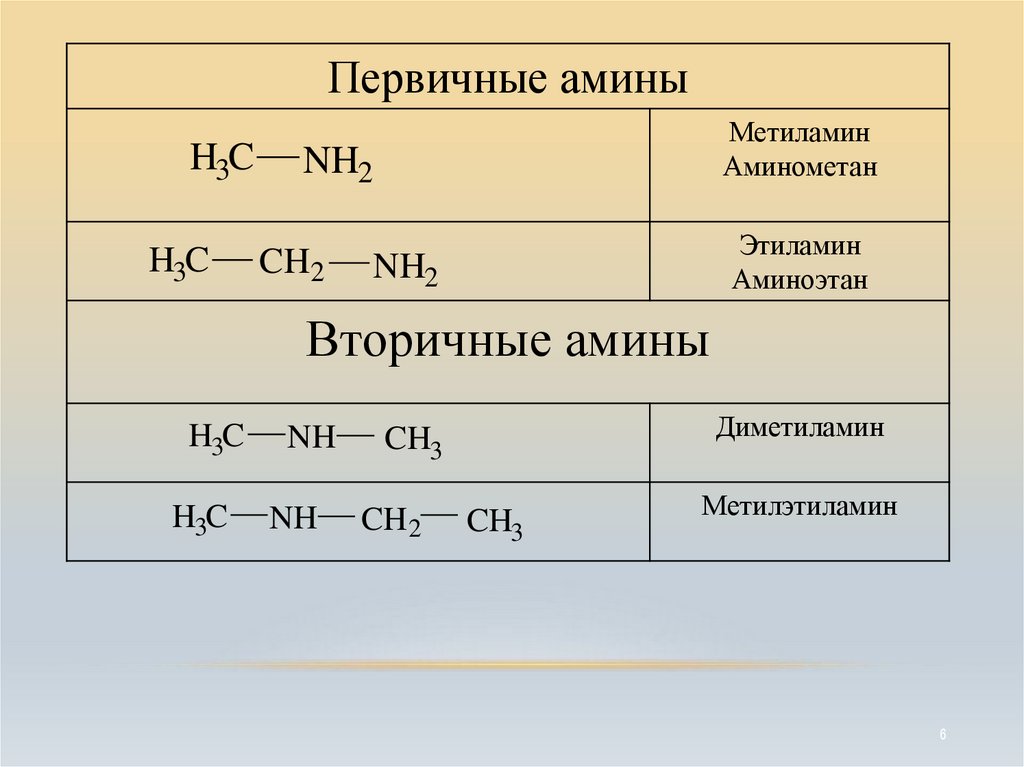
6.
Первичные аминыH3C
H3C
Метиламин
Аминометан
NH2
CH2
Этиламин
Аминоэтан
NH2
Вторичные амины
H3C
NH
CH3
H3C
NH
CH 2
Диметиламин
CH3
Метилэтиламин
6
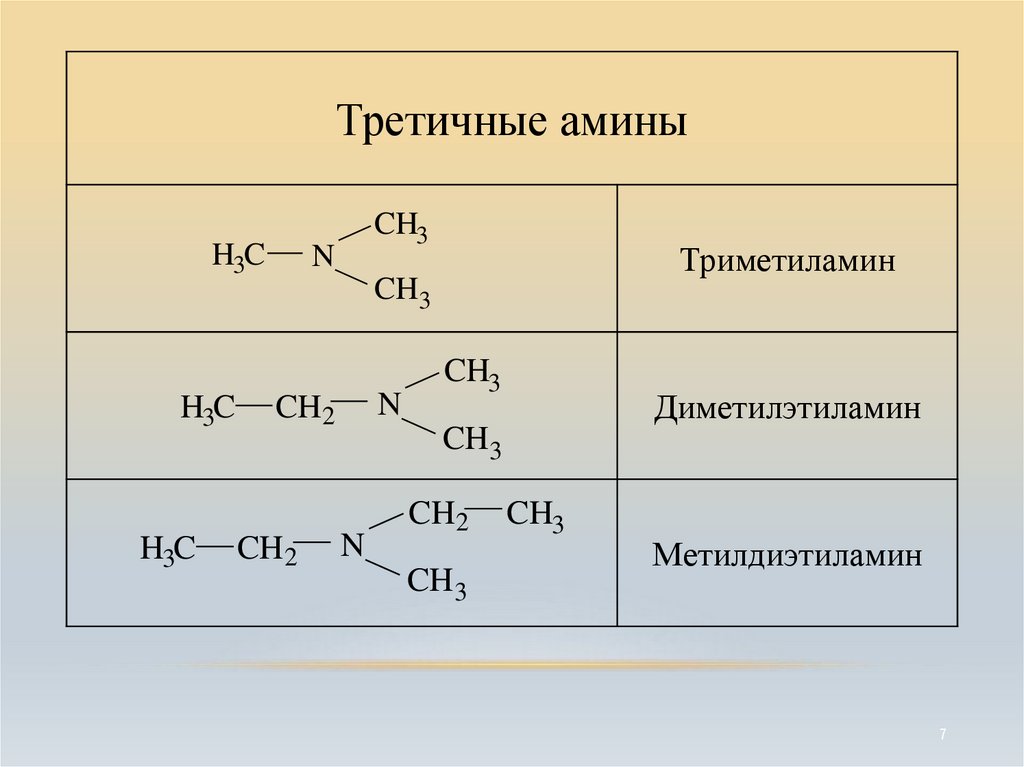
7.
Третичные аминыH3C
H3C
H3C
CH3
N
Триметиламин
CH3
N
CH2
CH2
CH3
Диметилэтиламин
CH3
N
CH 2
CH 3
CH3
Метилдиэтиламин
7
8. ФИЗИЧЕСКИЕ СВОЙСТВА
o ФИЗИЧЕСКИЕ СВОЙСТВАМетиламин, диметиламин, триметиламин
представляют собой газы. Остальные низшие амины
– жидкости. Высшие амины – твердые вещества.
Амины обладают неприятным запахом
«селедочного рассола», который у низших выражен
ярче, а у высших – слабее (или отсутствует).
Низшие амины (первые представители)
довольно хорошо растворимы в воде (подобно
аммиаку), их растворы имеют основную реакцию
среды.
8
9. СПОСОБЫ ПОЛУЧЕНИЯ
o СПОСОБЫ ПОЛУЧЕНИЯ• В 1850 году немецкий ученый Гофман впервые
получил амин в результате химической реакции
взаимодействия галогенпроизводного
углеводорода с избытком аммиака
H3CCl + 2 NH3
H3C
NH2 + NH4Cl
Избыток аммиака нужен для получения чистого амина.
При недостатке аммиака всегда образуется смесь.
9
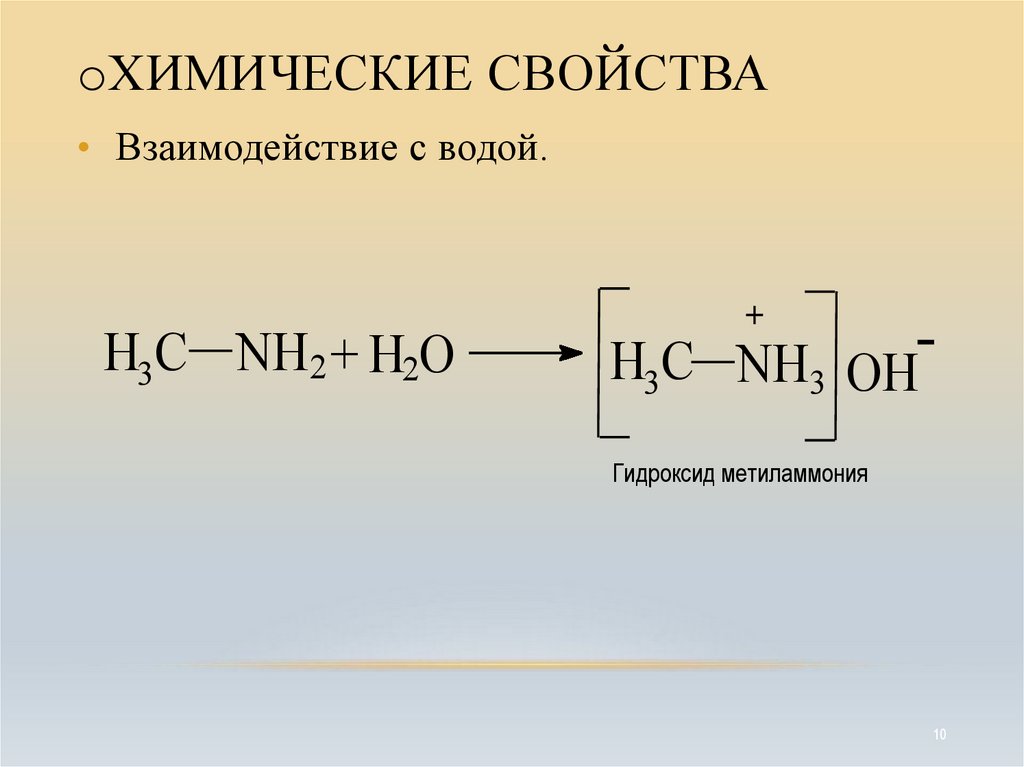
10. ХИМИЧЕСКИЕ СВОЙСТВА
oХИМИЧЕСКИЕ СВОЙСТВА• Взаимодействие с водой.
H3C NH2 + H2O
+
H3C NH3 OHГидроксид метиламмония
10
11.
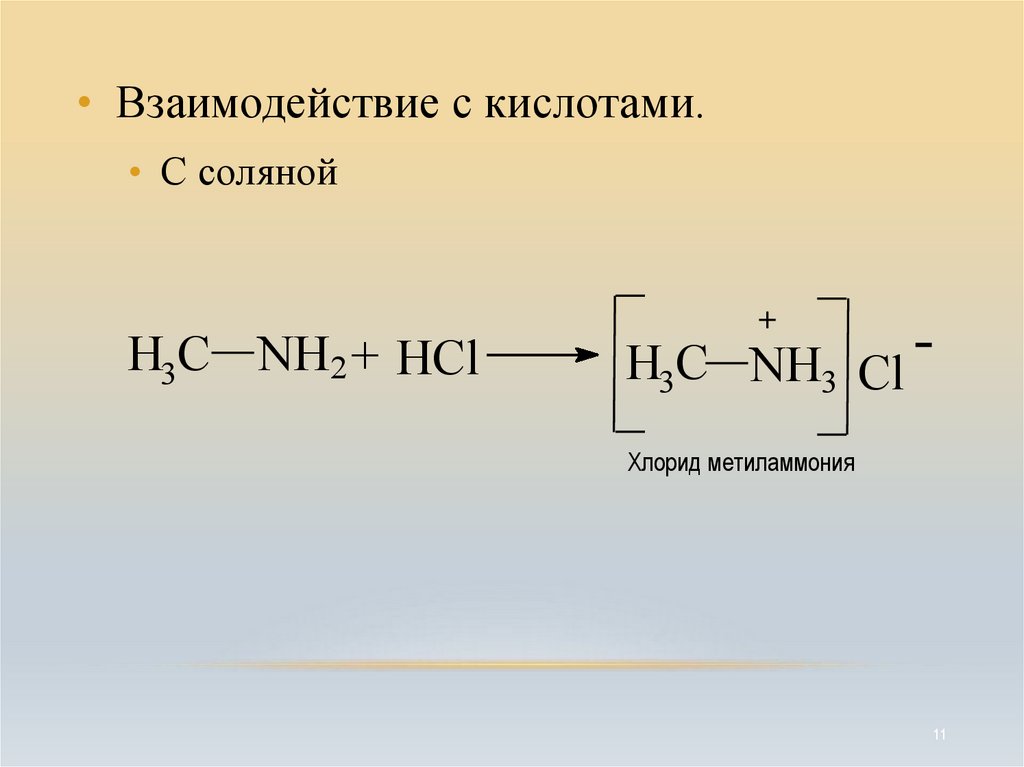
• Взаимодействие с кислотами.• С соляной
H3C NH2 + HCl
+
H3C NH3 Cl Хлорид метиламмония
11
12. АРОМАТИЧЕСКИЕ АМИНЫ
13.
Это соединения, в молекулах которыхаминогруппа связана с бензольным кольцом.
Простейшим представителем и родоначальником
анилиновых красителей является
NH2
анилин
фениламин
аминобензол
бензоламин
13
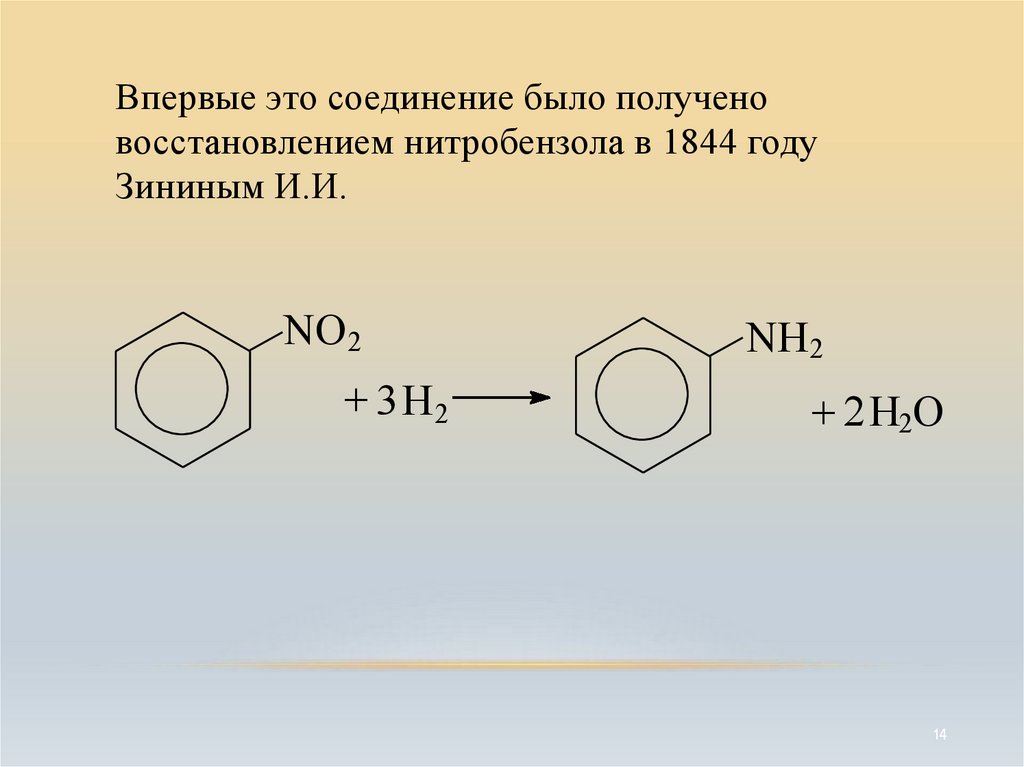
14.
Впервые это соединение было полученовосстановлением нитробензола в 1844 году
Зининым И.И.
NO2
+ 3 H2
NH2
+ 2H2O
14
15. ФИЗИЧЕСКИЕ СВОЙСТВА
o ФИЗИЧЕСКИЕ СВОЙСТВААнилин – бесцветная, быстро
буреющая на воздухе, жидкость.
Плохо растворяется в воде.
15
16. ХИМИЧЕСКИЕ СВОЙСТВА
o ХИМИЧЕСКИЕ СВОЙСТВАобусловлены как аминогруппой, так и
бензольным кольцом. Аминогруппа –
заместитель электроннодонорный и
свойства анилина обусловленные
бензольным кольцом следующие:
16
17. АМИНОКИСЛОТЫ
18.
Аминокислотаминазывают такие
производные карбоновых
кислот, которые можно
получить замещением
одного или нескольких
атомов водорода в радикале
кислоты аминогруппами.
18
19. НОМЕНКЛАТУРА
o НОМЕНКЛАТУРА• Международная: правила построения названий
такие же как для карбоновых кислот только с
указанием в префиксе наличия, количества и
положения аминогрупп.
• РАЦИОНАЛЬНАЯ: положение аминогрупп
указывается буквами греческого алфавита +
слово «амино» + название карбоновой кислоты
по рациональной номенклатуре.
19
20. ПОЛУЧЕНИЕ
o ПОЛУЧЕНИЕ• α-Аминокислоты
получают из природных веществ и синтетически
• Белки при гидролизе в водных растворах в
присутствии кислот, щелочей или ферментов
распадаются на смесь α-аминокислот, из
которой различными способами можно
выделить индивидуальные кислоты.
• Для синтеза аминокислот исходными
веществами могут быть α-галогенкарбоновые
кислоты, альдегиды, галогенуглеводороды.
20
21. ФИЗИЧЕСКИЕ СВОЙСТВА
o ФИЗИЧЕСКИЕ СВОЙСТВААминокислоты – бесцветные
кристаллические вещества, обладающие
высокими показателями температуры плавления.
Не летучи. Плавятся с разложением. Хорошо
растворяются в воде и плохо растворяются в
органических растворителях. Обладают
оптической активностью.
21
22. ХИМИЧЕСКИЕ СВОЙСТВА
o ХИМИЧЕСКИЕ СВОЙСТВА• РЕАКЦИИ КАРБОКСИЛЬНОЙ ГРУППЫ
• Взаимодействие с гидроксидами
• щелочными
H2N
CH 2
C
O
+ KOH
OH
H2N
CH 2
C
O
+ H2O
OK
22
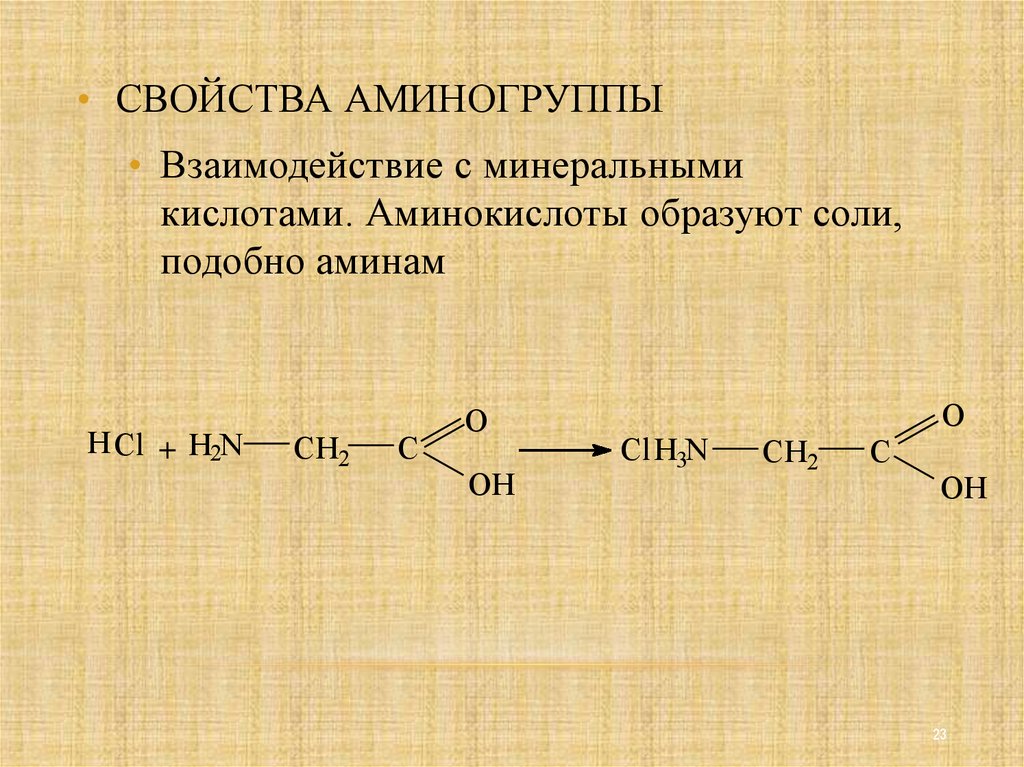
23.
• СВОЙСТВА АМИНОГРУППЫ• Взаимодействие с минеральными
кислотами. Аминокислоты образуют соли,
подобно аминам
H Cl + H2N
CH2
C
O
OH
Cl H3N
O
CH2
C
OH
23
24.
• СПЕЦИФИЧЕСКИЕ СВОЙСТВААМИНОКИСЛОТ
• Отношение к воде. Электролитическая
диссоциация. В водных растворах молекулы
аминокислот ведут себя как биполярные
ионы
• Моноаминомонокарбоновые кислоты
(рН=7)
H2N
CH2
C
O
+ H2O
OH
+
HO + H3N
-
CH2
-
COO + H +
24
25.
α-аминокислоты участвуют в синтезебелка.
В состав белковых тел входят и такие
аминокислоты, которые кроме аминогрупп содержат и
другие функциональные группы.
По своей значимости для организма все
аминокислоты делятся на:
Заменимые (синтезируются в организме)
Незаменимые (запас пополняется только с
пищей)
25
26. БЕЛКИ
Белками, или белковыми веществами, называютвысокомолекулярные органические соединения, молекулы которых
построены из остатков α-аминокислот, связанных между собой
пептидными связями. Количество последних может колебаться
очень сильно и достигать иногда нескольких тысяч.
Структура белков очень сложная. Отдельные пептидные
цепи или их участки могут быть связаны между собой
дисульфидными , солевыми или водородными связями.
• Солевые связи образуются между свободными аминогруппами
(например, концевая аминогруппа, расположенная на одном конце
полипептидной цепи или ε-аминогруппа лизина) и свободными
карбоксильными группами (концевая карбоксильная группа цепи
или свободные карбоксильные группы двухосновных аминокислот);
• Водородные связи могут возникать между атомом кислорода
карбонильной группы и атомом водорода аминогруппы, а также за
счет гидроксогрупп оксиаминокислот и кислорода пептидных групп.
26
27. БЕЛКИ
Различают первичную, вторичную, третичную ичетвертичную структуры белковых молекул.
Все белки, независимо от того к какой группе они
относятся и какие функции выполняют, построены из
относительно небольшого набора (обычно 20)
аминокислот, которые расположены в различной, но
всегда строго определенной для данного вида белка
последовательности.
Белки подразделяют на протеины и протеиды.
Протеины – простые белки, состоящие только из
остатков аминокислот.
Альбумины – обладают сравнительно небольшой
молекулярной массой, хорошо растворимы в воде, при
нагревании свертываются.
27
28. БЕЛКИ
Глобулины – не растворимы в чистой воде, норастворимы в теплом 10%-ном растворе NaCl.
Проламины – незначительно растворимы в воде, но
растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной
щелочи.
Протамины – совершенно не содержат серы.
Протеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту
(козеин).
28
29. БЕЛКИ
Пртеиды – сложные белки, в состав которых наряду саминокислотами входят углеводы, липиды,
гетероциклические соединения, нуклеиновые кислоты,
фосфорная кислота.
Липопротеиды – гидролизуются на простой белок и
липиды. (зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и
высокомолекулярные углеводы. (слизистые выделения
животных).
Хромопротеиды – гидролизуются на простые белки и
красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки
(обычно протамины) и нуклеиновые кислоты
29






















 Химия
Химия








