Похожие презентации:
Азотсодержащие органические соединения
1. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
амины,аминоспирты,
амиды,
аминокислоты
2. Амины
- органические соединения, содержащиев своём составе аминогруппу –NH2 или
замещённую аминогруппу (-NHR или
NR2)
- производные аммиака, в котором один
или несколько атомов водорода
замещены углеводородными
радикалами
3.
В зависимости от числа атомов водорода,замещенных углеводородными радикалами,
амины:
NH2
- первичные: CH3 NH2
метиламин
- вторичные:
- третичные:
CH3 NH C2H5
анилин
метилэтиламин
CH3 N C2H5
C6H5
метилэтилфениламин
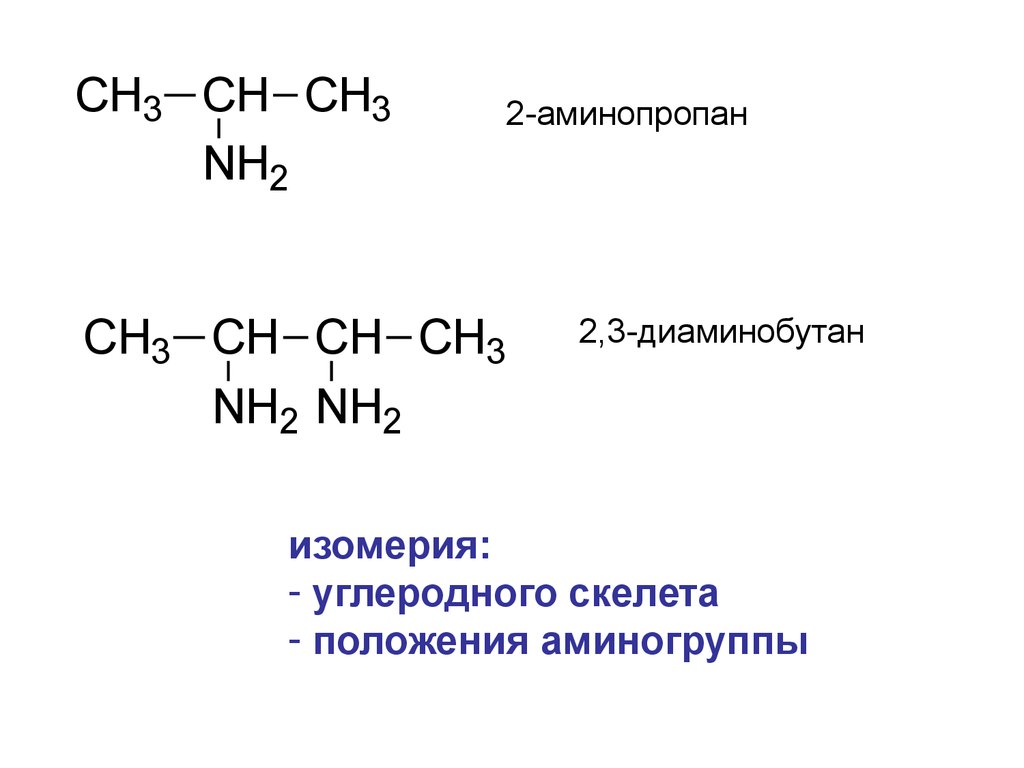
4.
CH3 CH CH3NH2
2-аминопропан
CH3 CH CH CH3
NH2 NH2
2,3-диаминобутан
изомерия:
- углеродного скелета
- положения аминогруппы
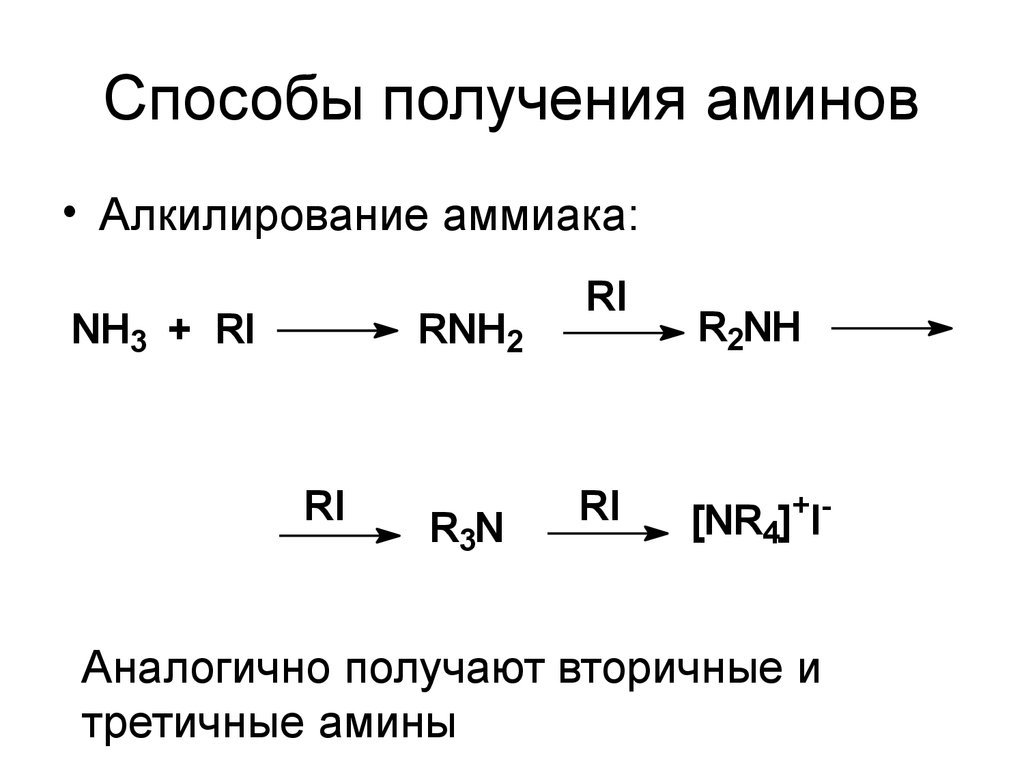
5. Способы получения аминов
• Алкилирование аммиака:NH3 + RI
RNH2
RI
R3N
RI
RI
R2NH
[NR4]+I-
Аналогично получают вторичные и
третичные амины
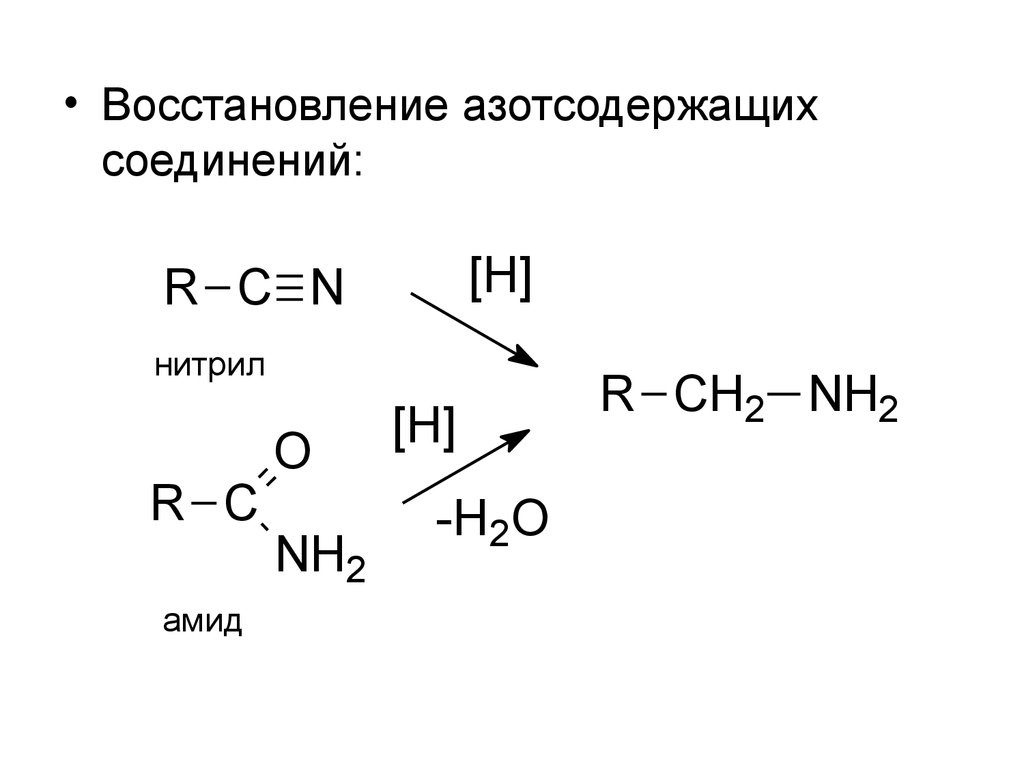
6.
• Восстановление азотсодержащихсоединений:
[H]
R C N
нитрил
R C
амид
O
NH2
[H]
-H2O
R CH2 NH2
7.
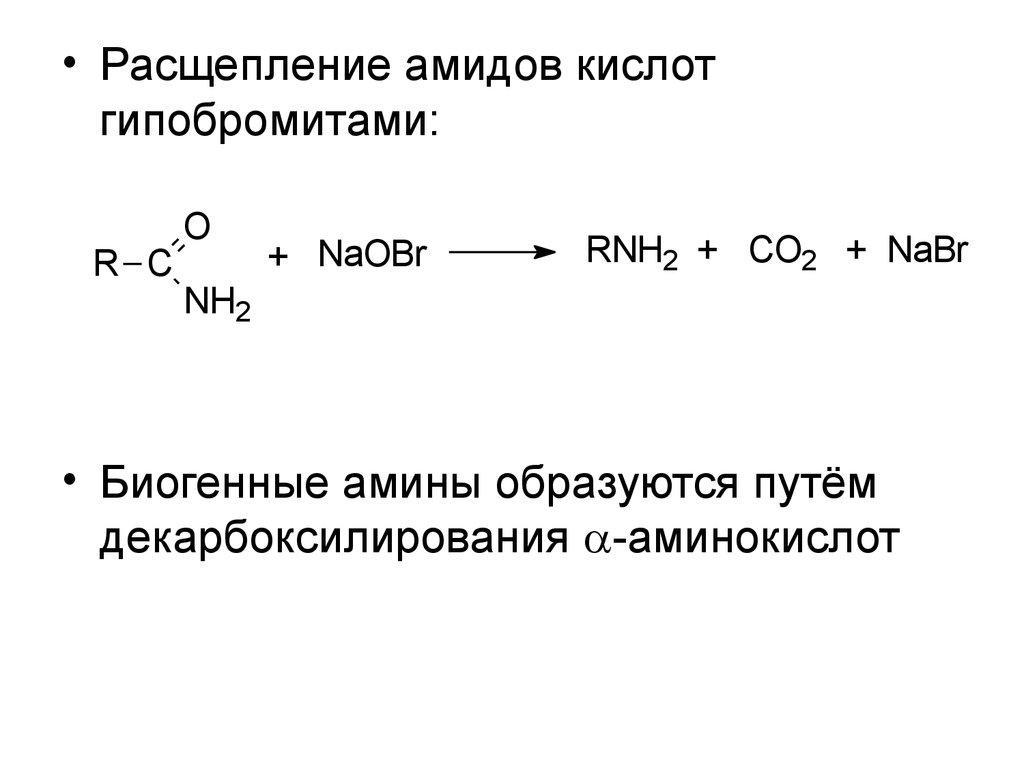
• Расщепление амидов кислотгипобромитами:
R C
O
+ NaOBr
RNH2 + CO2 + NaBr
NH2
• Биогенные амины образуются путём
декарбоксилирования -аминокислот
8.
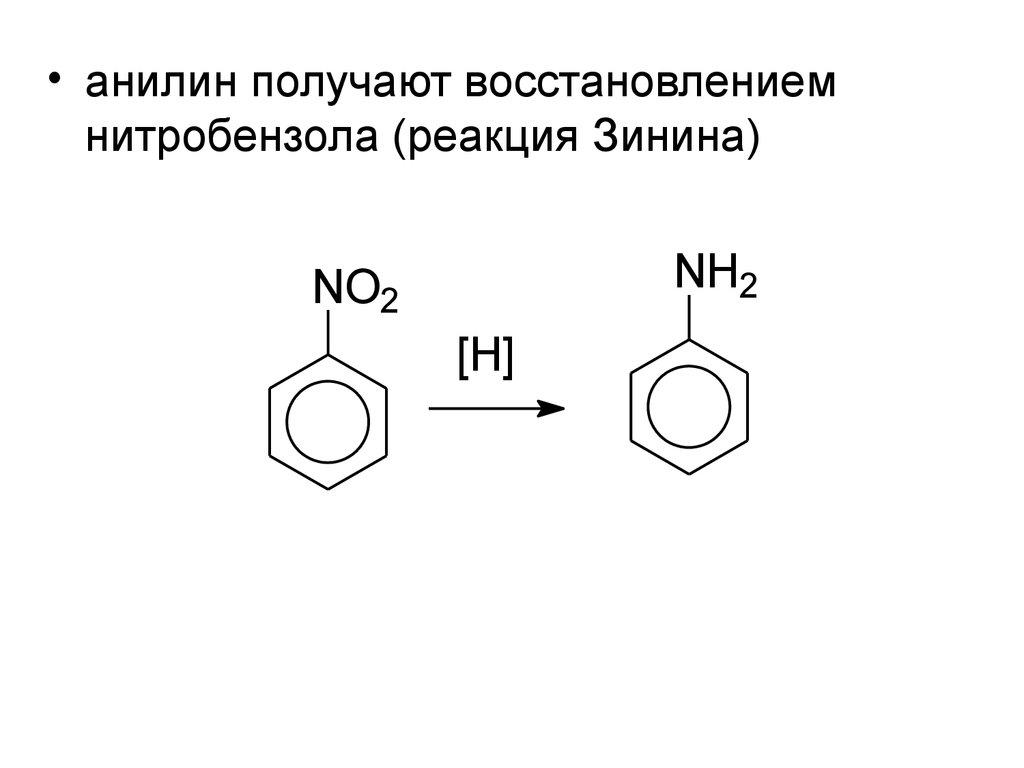
• анилин получают восстановлениемнитробензола (реакция Зинина)
NH2
NO2
[H]
9. Химические свойства
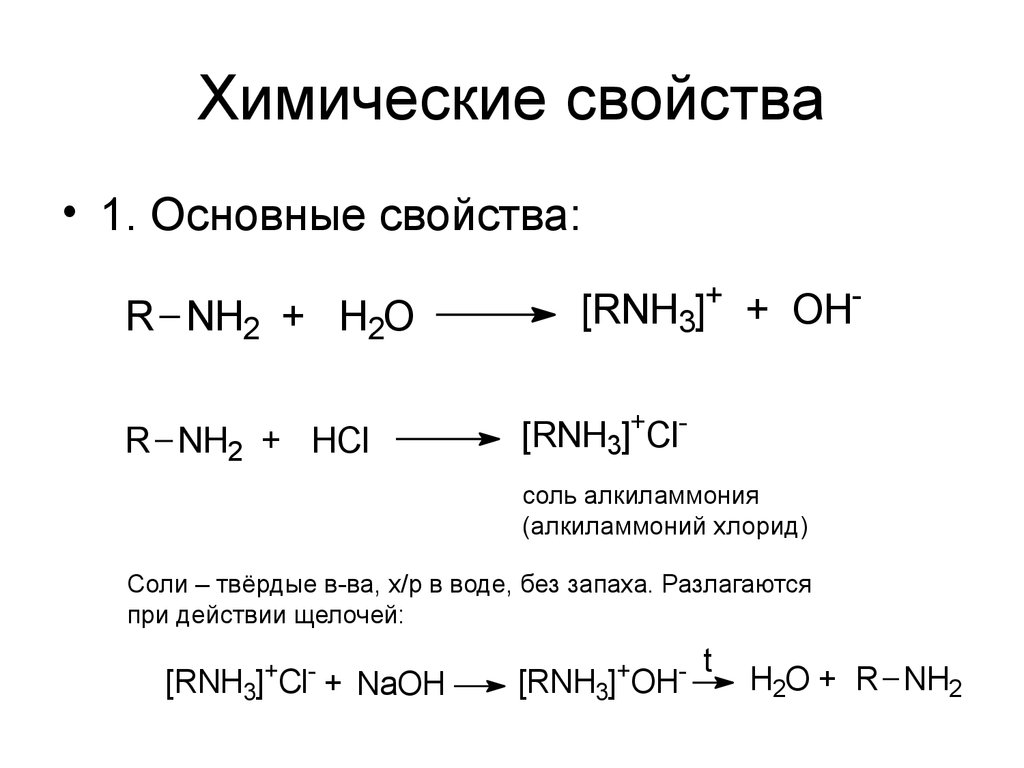
• 1. Основные свойства:R NH2 + H2O
R NH2 + HCl
[RNH3]+ + OH[RNH3]+Clсоль алкиламмония
(алкиламмоний хлорид)
Соли – твёрдые в-ва, х/р в воде, без запаха. Разлагаются
при действии щелочей:
[RNH3]+Cl- + NaOH
[RNH3]+OH-
t
H2O + R NH2
10.
• Амины жирного ряда обладают болеевыраженными основными свойствами,
чем аммиак.
• У аминов ароматического ряда
основные свойства слабые.
Наличие основных свойств
доказывается реакцией образования
солей при взаимодействии с кислотами:
C6H5NH2 + HCl
[C6H5NH3]+Clсолянокислый анилин
11.
• 2. Взаимодействие с азотистойкислотой
проходит с образованием различных
продуктов для аминов разного строения.
Это качественная реакция, позволяющая
различить первичный, вторичный,
третичный амины.
12.
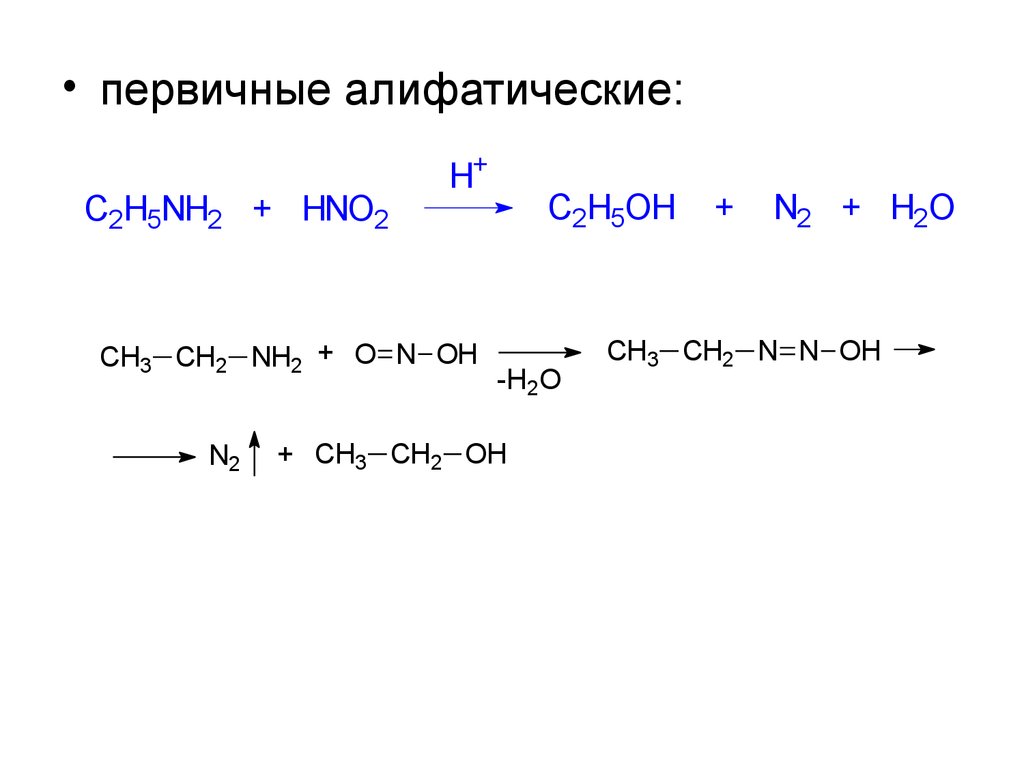
• первичные алифатические:C2H5NH2 + HNO2
H+
CH3 CH2 NH2 + O N OH
N2
C2H5OH
-H2O
+ CH3 CH2 OH
+
N2 + H2O
CH3 CH2 N N OH
13.
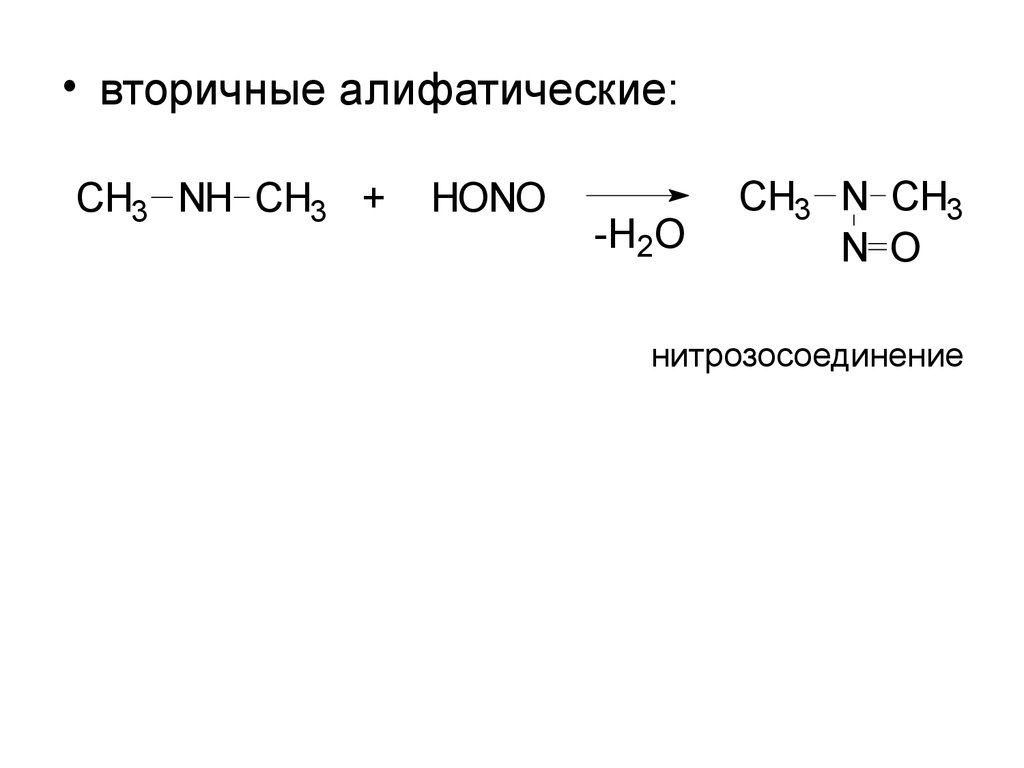
• вторичные алифатические:CH3 NH CH3 +
HONO
-H2O
CH3 N CH3
N O
нитрозосоединение
14.
• первичные ароматическиеN N OH
NH2
+ O N OH
-H2O
15.
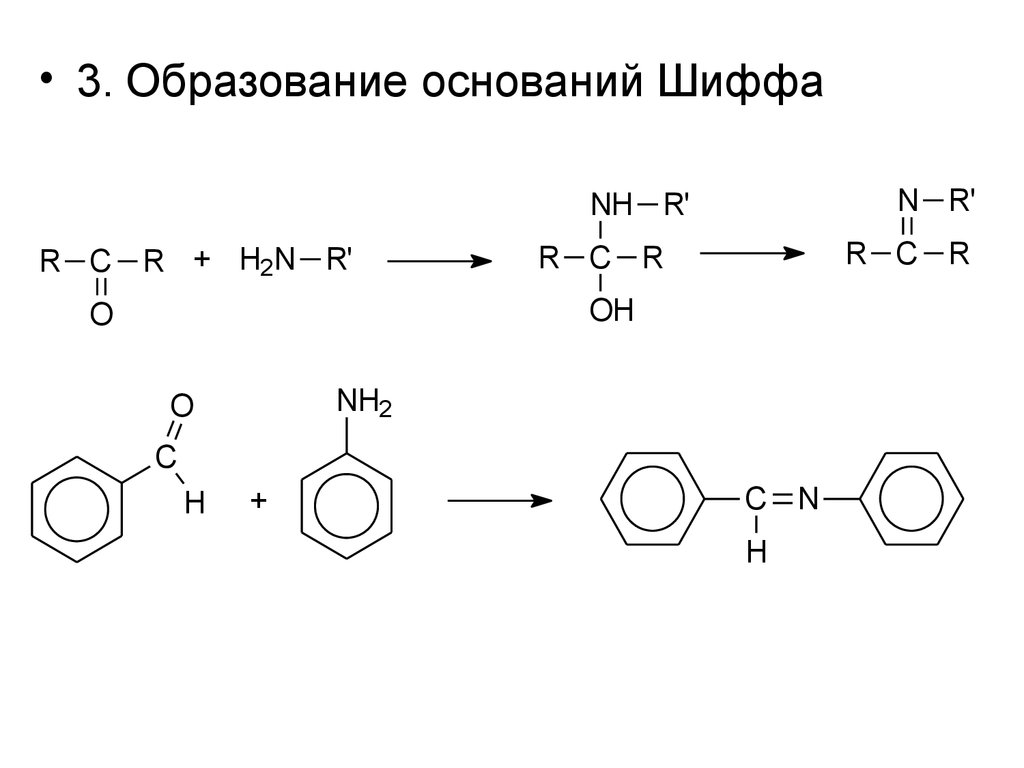
• 3. Образование оснований ШиффаN R'
NH R'
R C R + H2N R'
R C R
R C R
OH
O
NH2
O
C
H
+
C N
H
16.
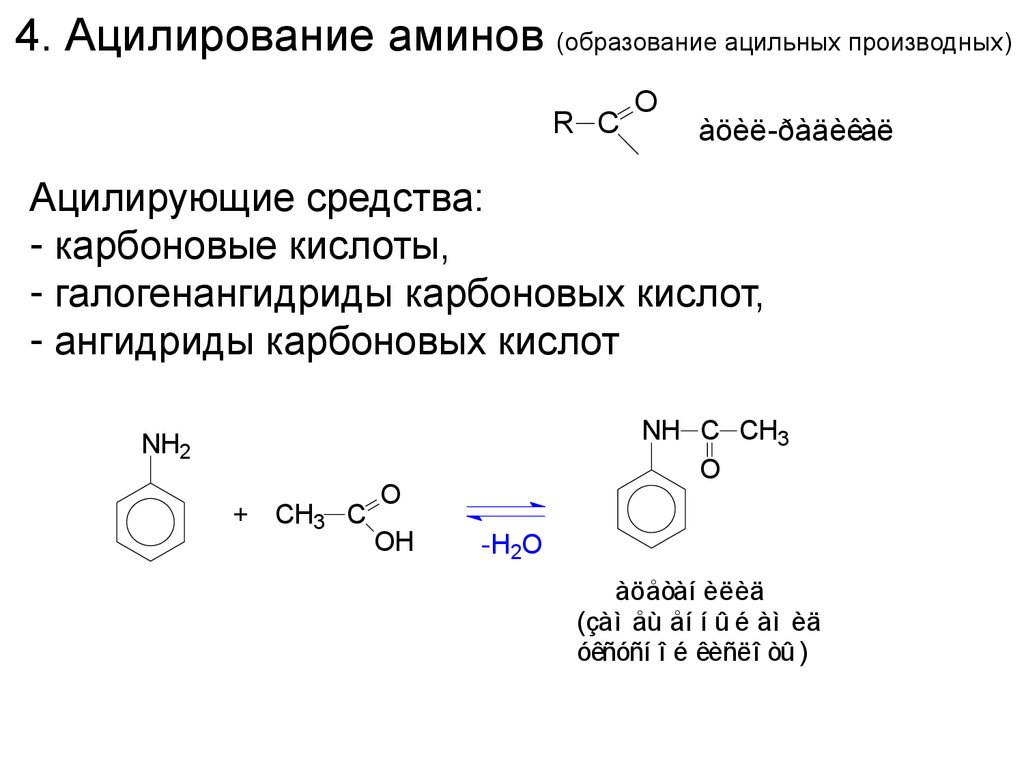
4. Ацилирование аминов (образование ацильных производных)R C
O
àöèë-ðàäèêàë
Ацилирующие средства:
- карбоновые кислоты,
- галогенангидриды карбоновых кислот,
- ангидриды карбоновых кислот
NH C CH3
O
NH2
+ CH3 C
O
OH
-H2O
àöåòàí èëèä
(çàì åù åí í û é àì èä
óêñóñí î é êèñëî òû )
17.
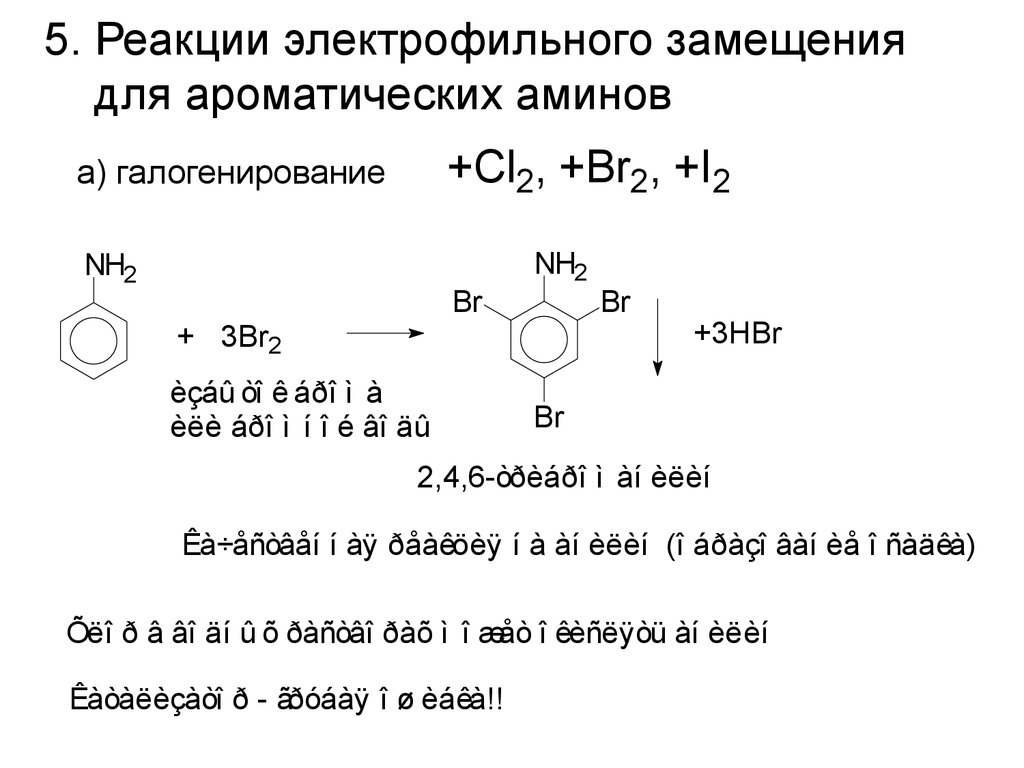
5. Реакции электрофильного замещениядля ароматических аминов
+Cl2, +Br2, +I2
а) галогенирование
NH2
Br
NH2
+ 3Br2
èçáû òî ê áðî ì à
èëè áðî ì í î é âî äû
Br
+3HBr
Br
2,4,6-òðèáðî ì àí èëèí
Êà÷åñòâåí í àÿ ðåàêöèÿ í à àí èëèí (î áðàçî âàí èå î ñàäêà)
Õëî ð â âî äí û õ ðàñòâî ðàõ ì î æåò î êèñëÿòü àí èëèí
Êàòàëèçàòî ð - ãðóáàÿ î ø èáêà!!
18.
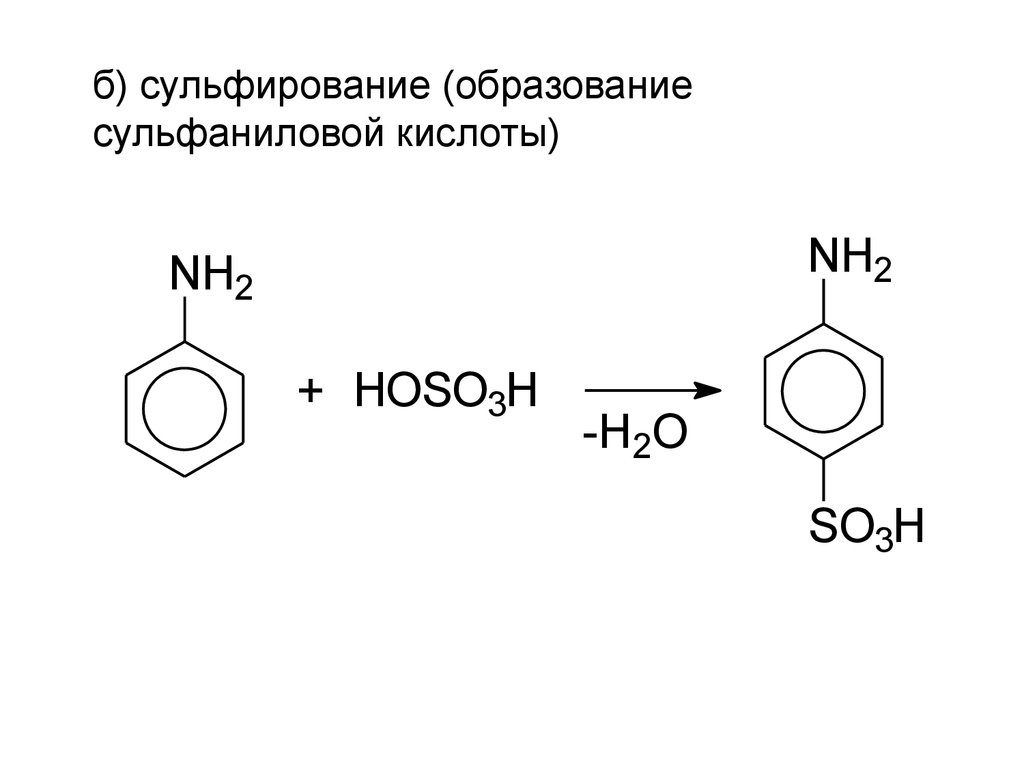
б) сульфирование (образованиесульфаниловой кислоты)
NH2
NH2
+ HOSO3H
-H2O
SO3H
19.
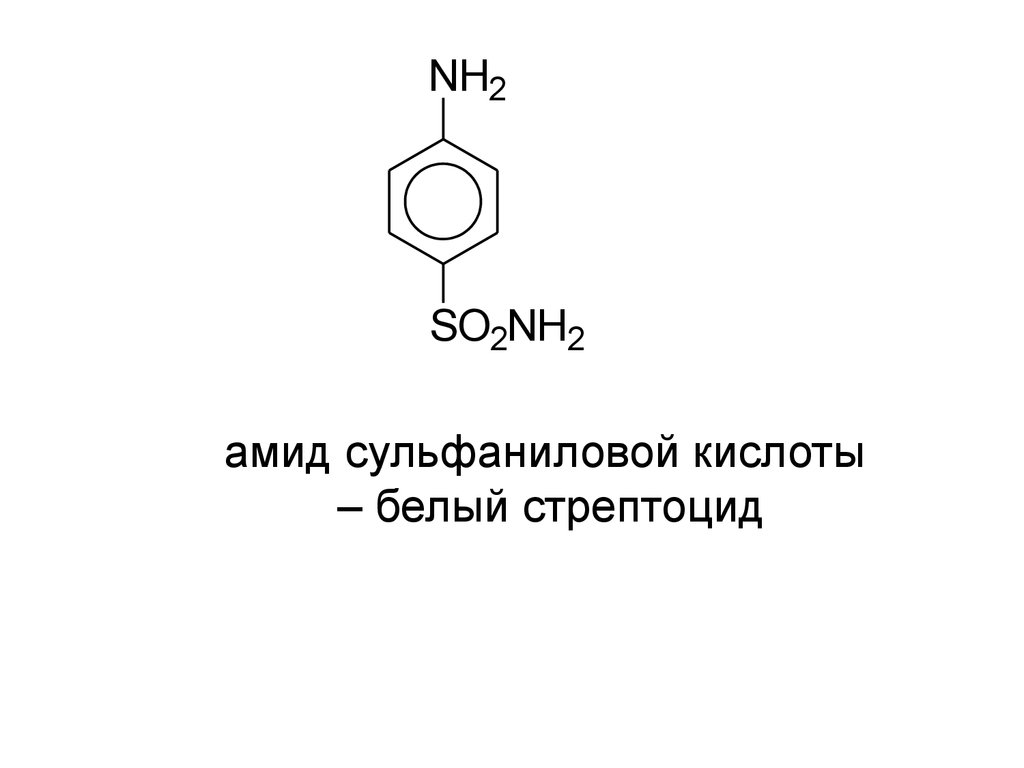
NH2SO2NH2
амид сульфаниловой кислоты
– белый стрептоцид
20.
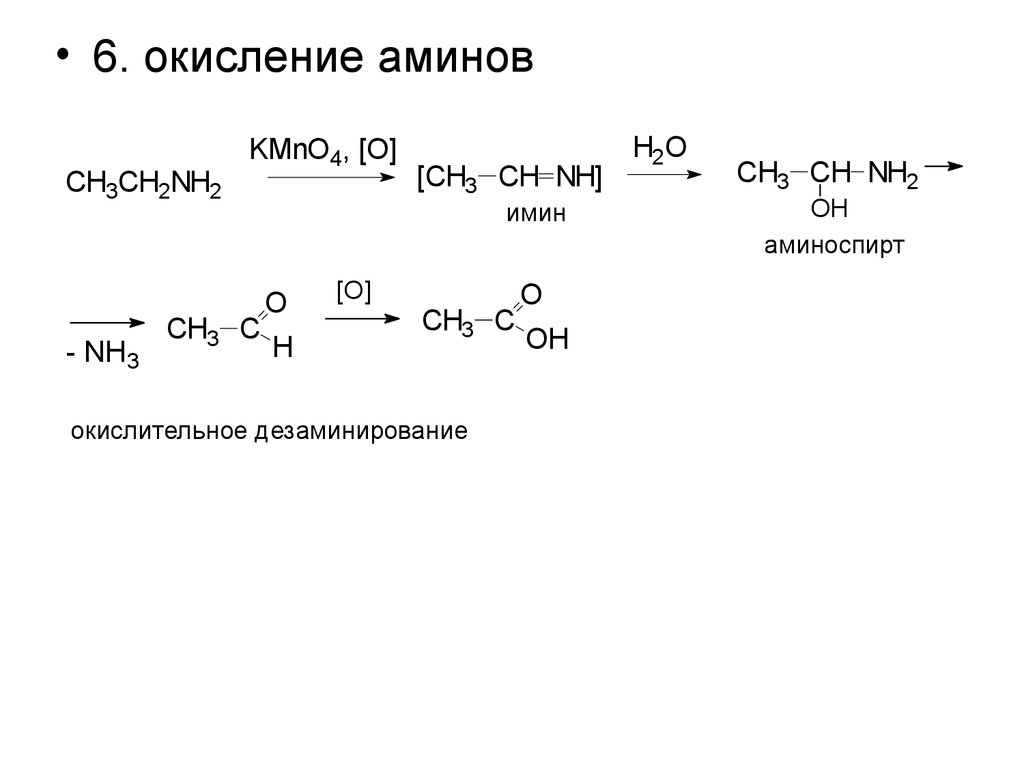
• 6. окисление аминовCH3CH2NH2
- NH3
KMnO4, [O]
CH3 C
[CH3 CH NH]
имин
O
H
[O]
CH3 C
окислительное дезаминирование
O
OH
H2O
CH3 CH NH2
OH
аминоспирт
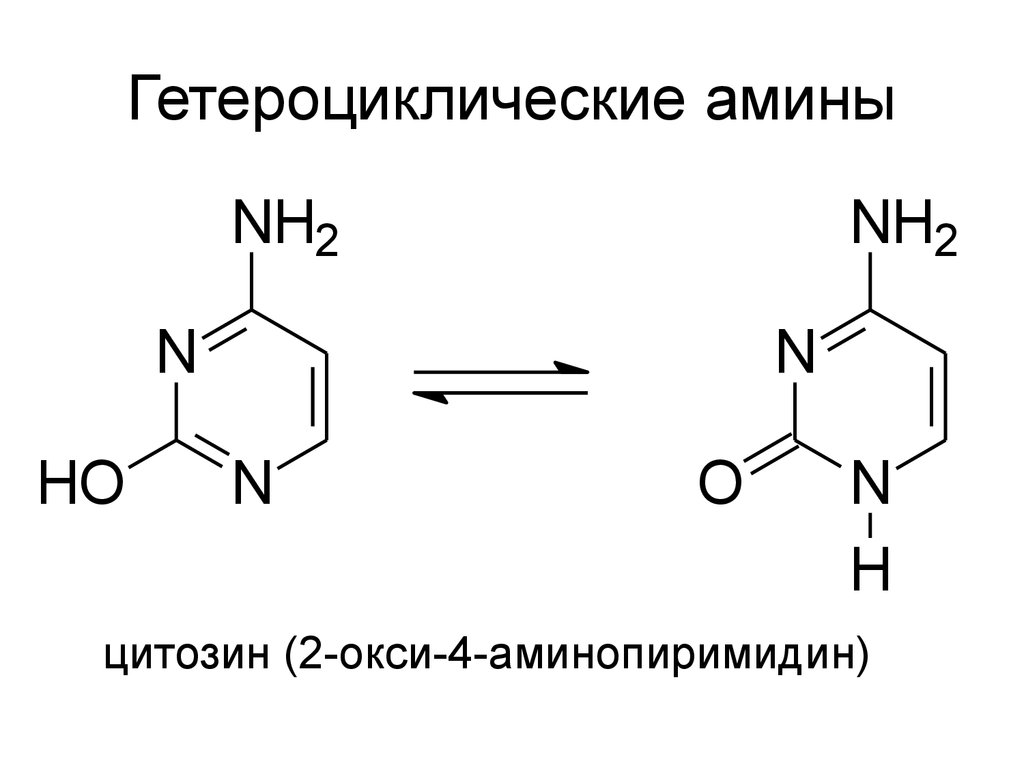
21. Гетероциклические амины
NH2NH2
N
HO
N
N
O
N
H
цитозин (2-окси-4-аминопиримидин)
22.
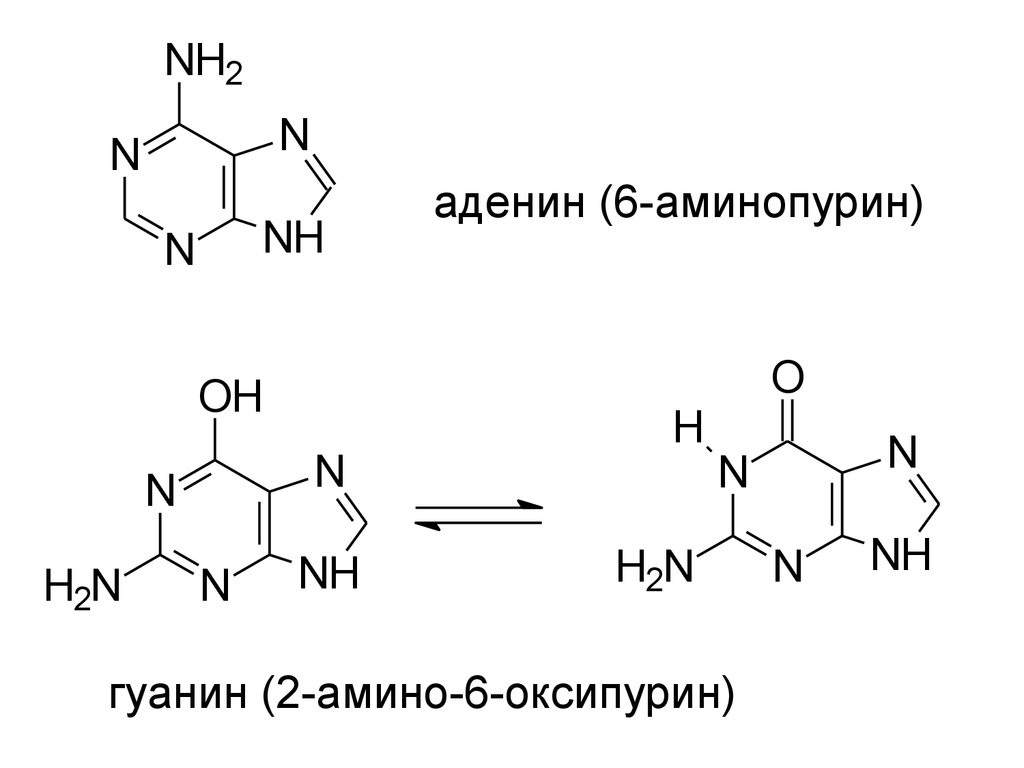
NH2N
N
NH
N
O
OH
N
N
H2N
N
аденин (6-аминопурин)
NH
H
N
N
H2N
гуанин (2-амино-6-оксипурин)
N
NH
23.
NH2OH
HNO2
N
N
NH
N
N
N
NH
N
гипоксантин
OH
OH
N
N
H2N
N
+ N2 + H2O
NH
HNO2
N
N
HO
N
NH
ксантин
+ N2 + H2O
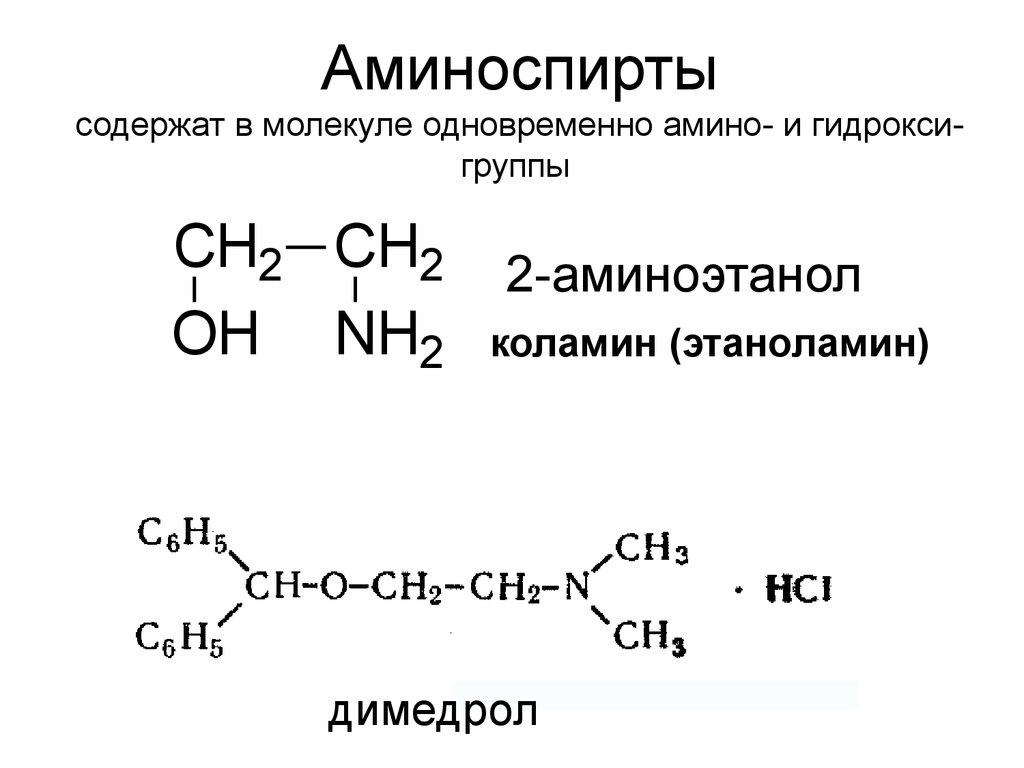
24. Аминоспирты содержат в молекуле одновременно амино- и гидрокси-группы
Аминоспиртысодержат в молекуле одновременно амино- и гидроксигруппы
CH2 CH2
OH NH2
2-аминоэтанол
коламин (этаноламин)
холин (триметил- -гидроксиэтилгидрат аммония):
CH
3
+
2
N CH3 OH
CH3
H2C CH2
OH
димедрол
25.
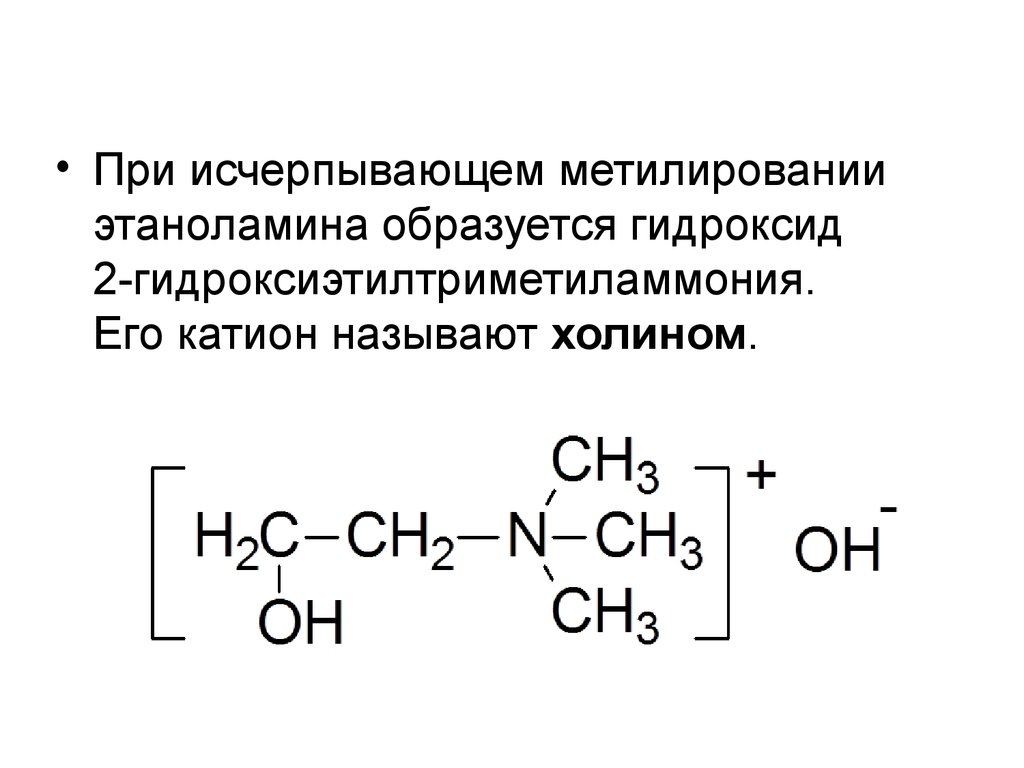
• При исчерпывающем метилированииэтаноламина образуется гидроксид
2-гидроксиэтилтриметиламмония.
Его катион называют холином.
26.
• Холин – структурный элемент сложныхлипидов. Имеет большое значение как
витаминоподобное вещество,
регулирующее жировой обмен. В
организме холин может образовываться
из аминокислоты серина.
27.
H2C CH2OH
CH3 +
N CH3 OH
CH3
-H2O
CH3
+
H2C CH N CH3
OH
CH3
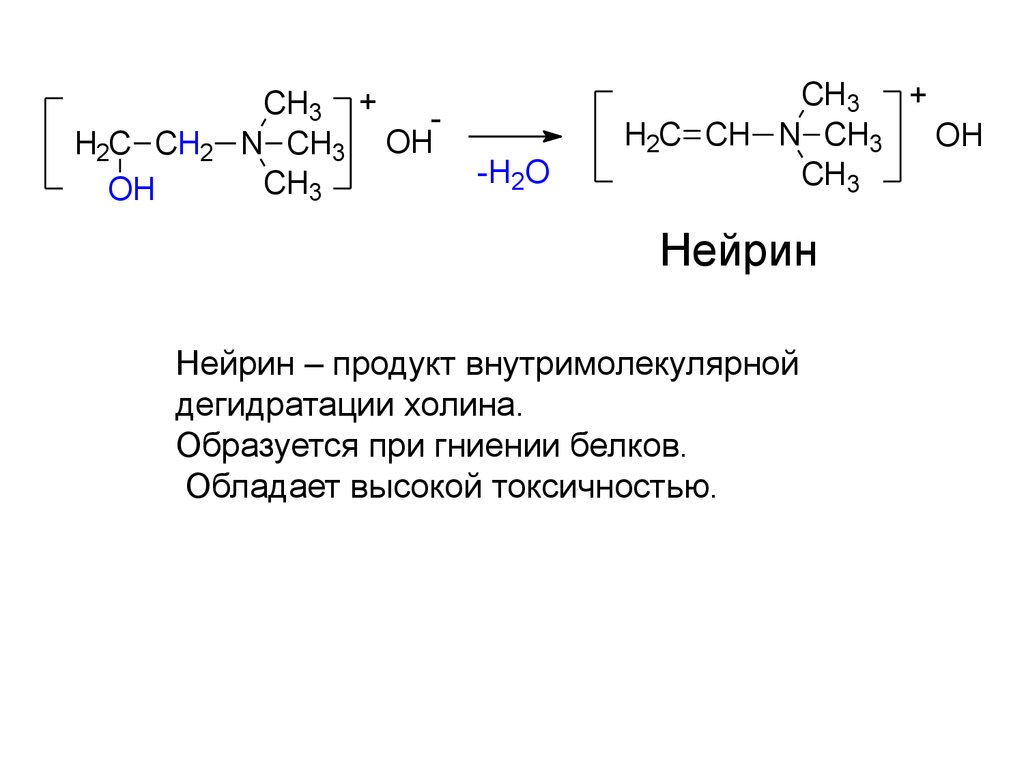
Нейрин
Нейрин – продукт внутримолекулярной
дегидратации холина.
Образуется при гниении белков.
Обладает высокой токсичностью.
28.
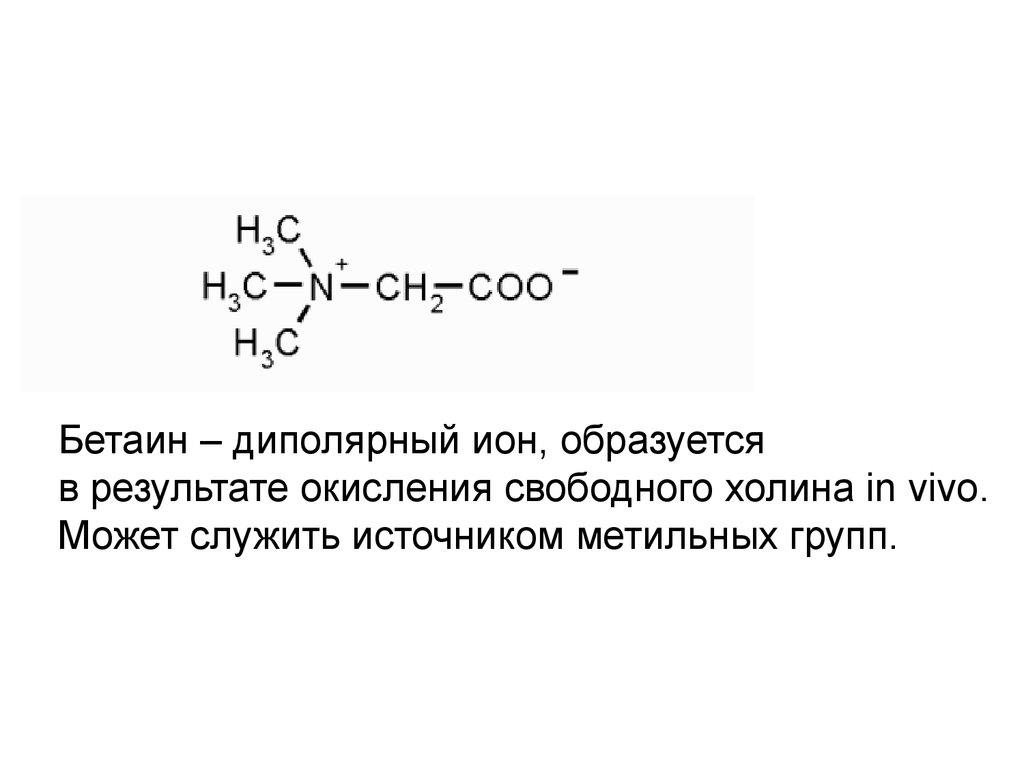
Бетаин – диполярный ион, образуетсяв результате окисления свободного холина in vivo.
Может служить источником метильных групп.
29.
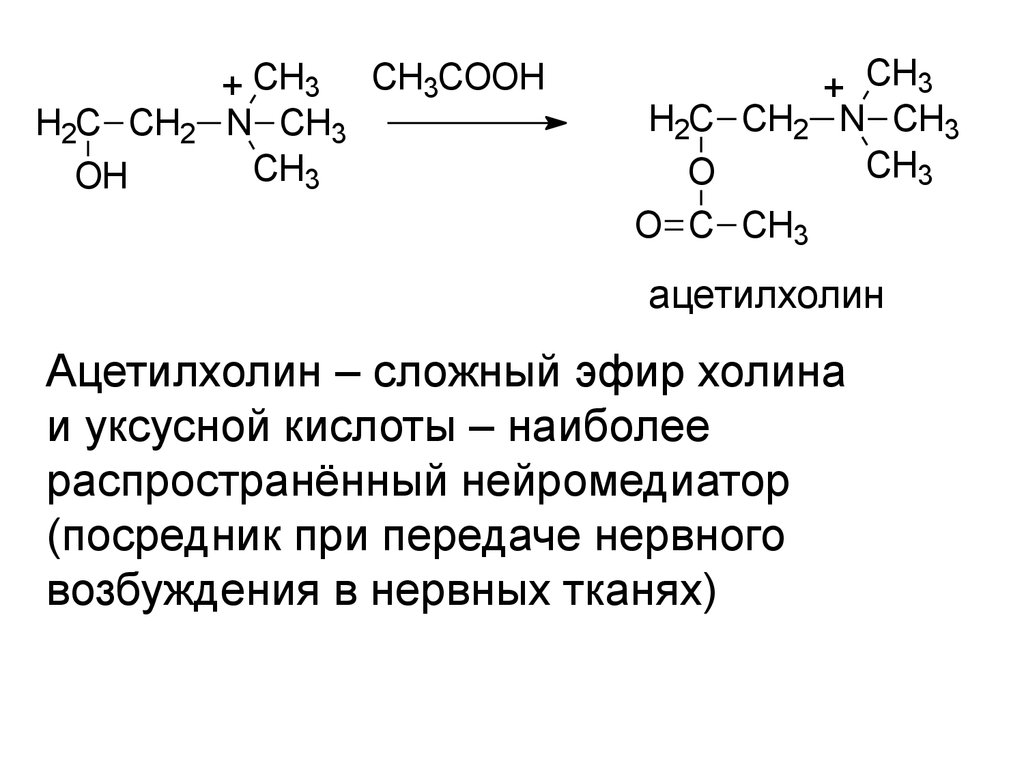
H2C CH2OH
+ CH3 CH3COOH
N CH3
CH3
+ CH3
H2C CH2 N CH3
CH3
O
O C CH3
ацетилхолин
Ацетилхолин – сложный эфир холина
и уксусной кислоты – наиболее
распространённый нейромедиатор
(посредник при передаче нервного
возбуждения в нервных тканях)
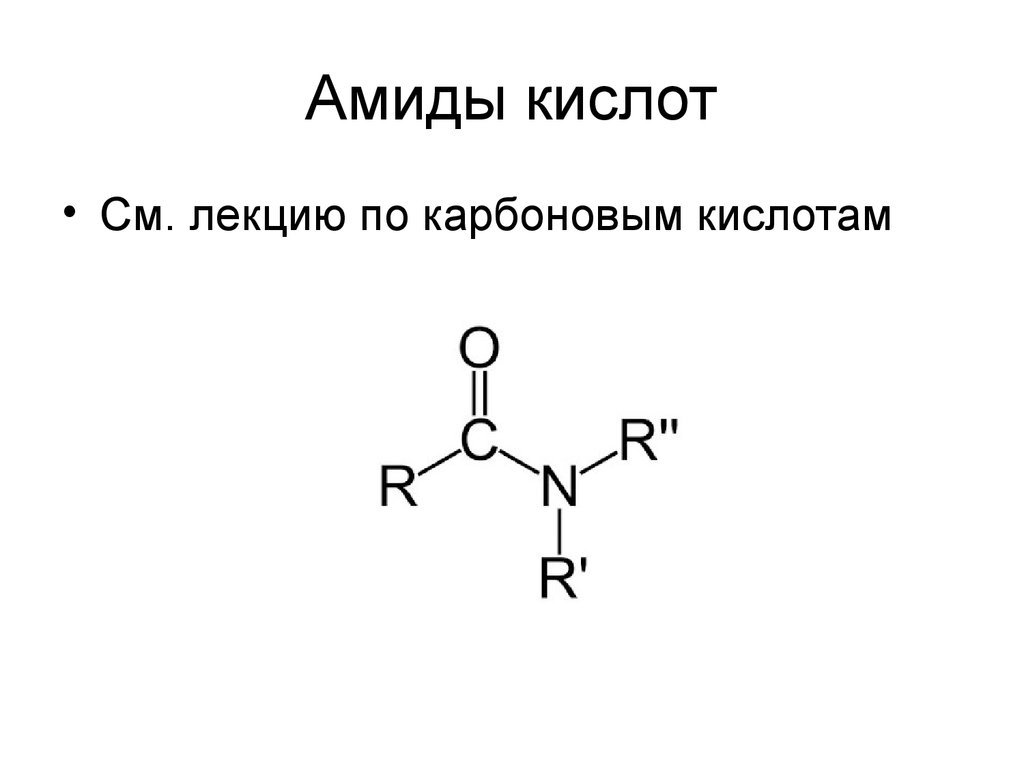
30. Амиды кислот
• См. лекцию по карбоновым кислотам31. мочевина
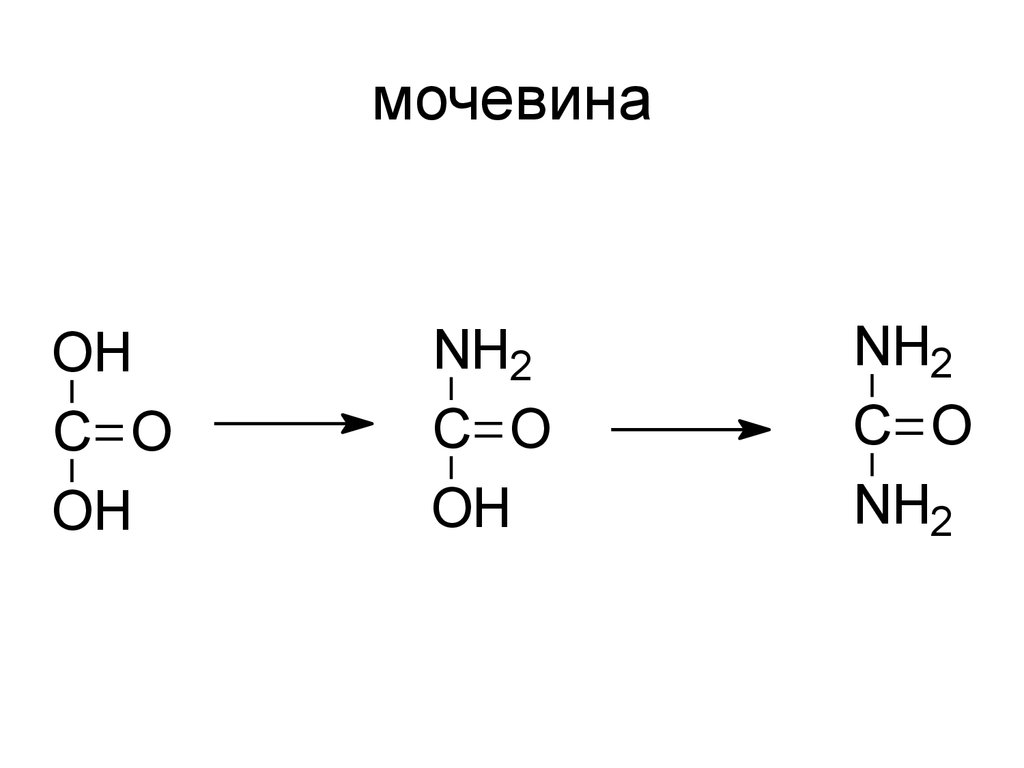
OHC O
OH
NH2
C O
OH
NH2
C O
NH2
32.
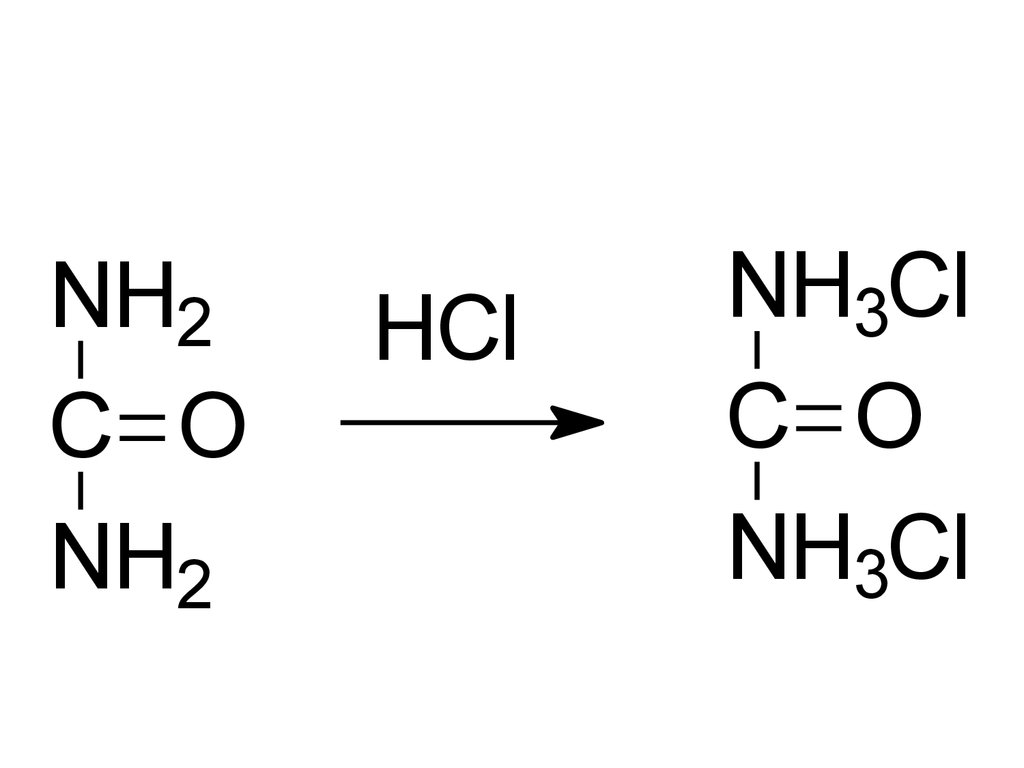
NH2C O
NH2
HCl
NH3Cl
C O
NH3Cl
33.
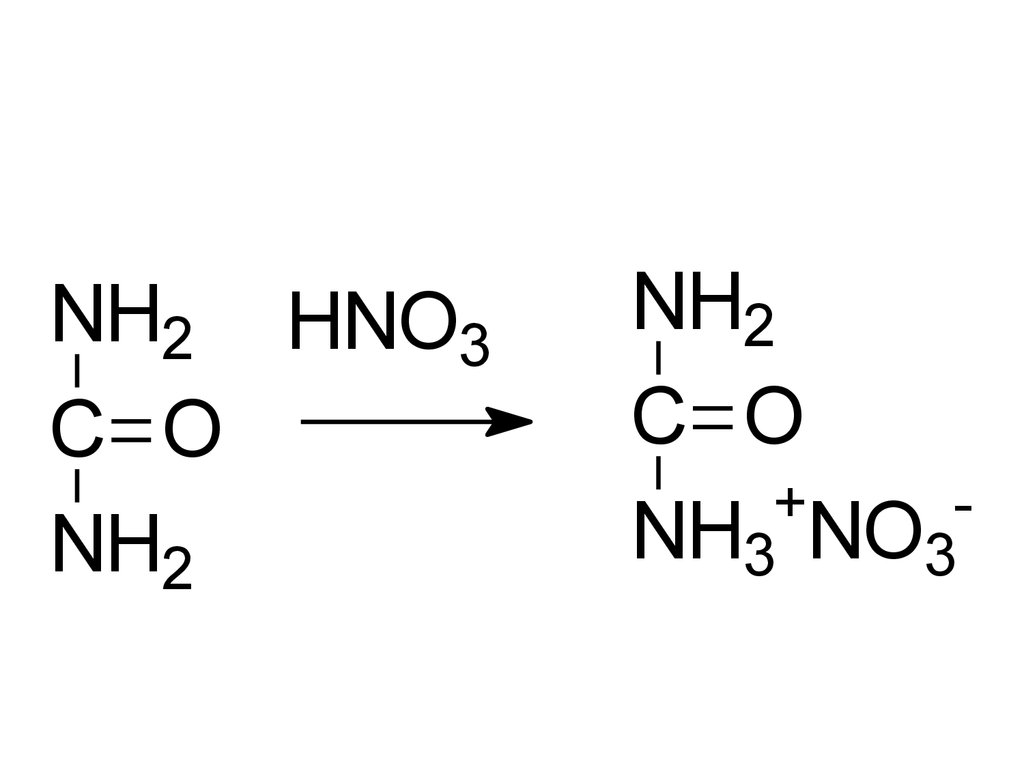
NH2 HNO3C O
NH2
NH2
C O
+
NH3 NO3
34.
NH2C O
NH2
2H2O
OH
C O + 2 NH3
OH
35.
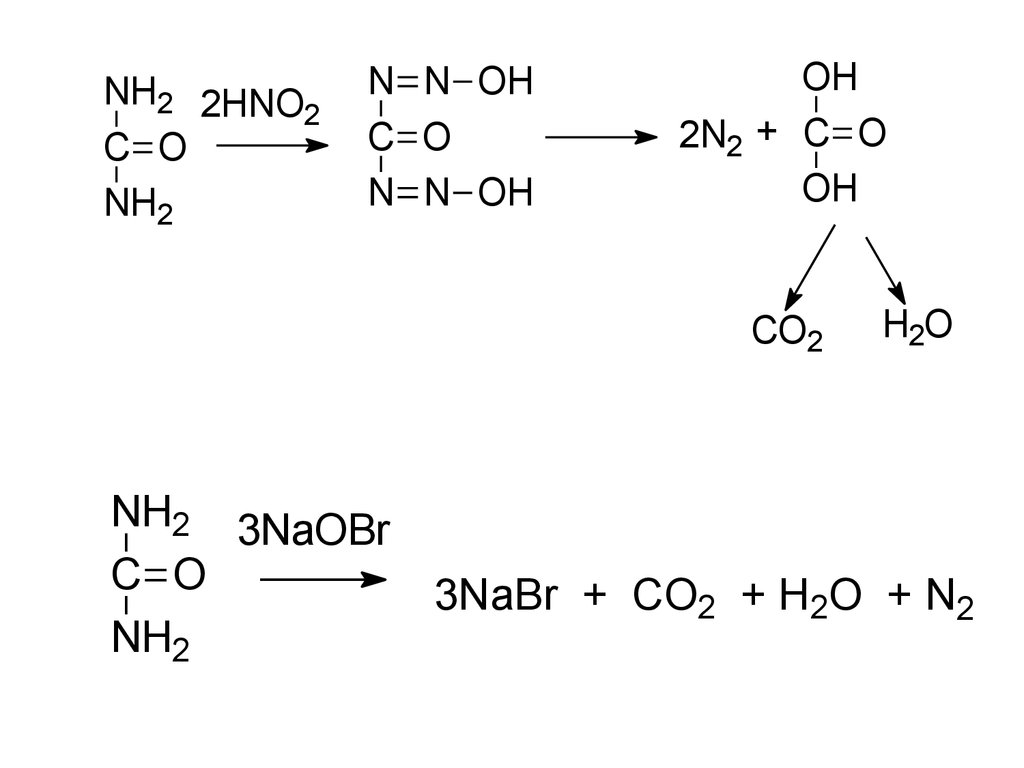
NH2 2HNO2
C O
NH2
N N OH
C O
N N OH
OH
2N2 + C O
OH
CO2
NH2 3NaOBr
C O
NH2
H2O
3NaBr + CO2 + H2O + N2
36.
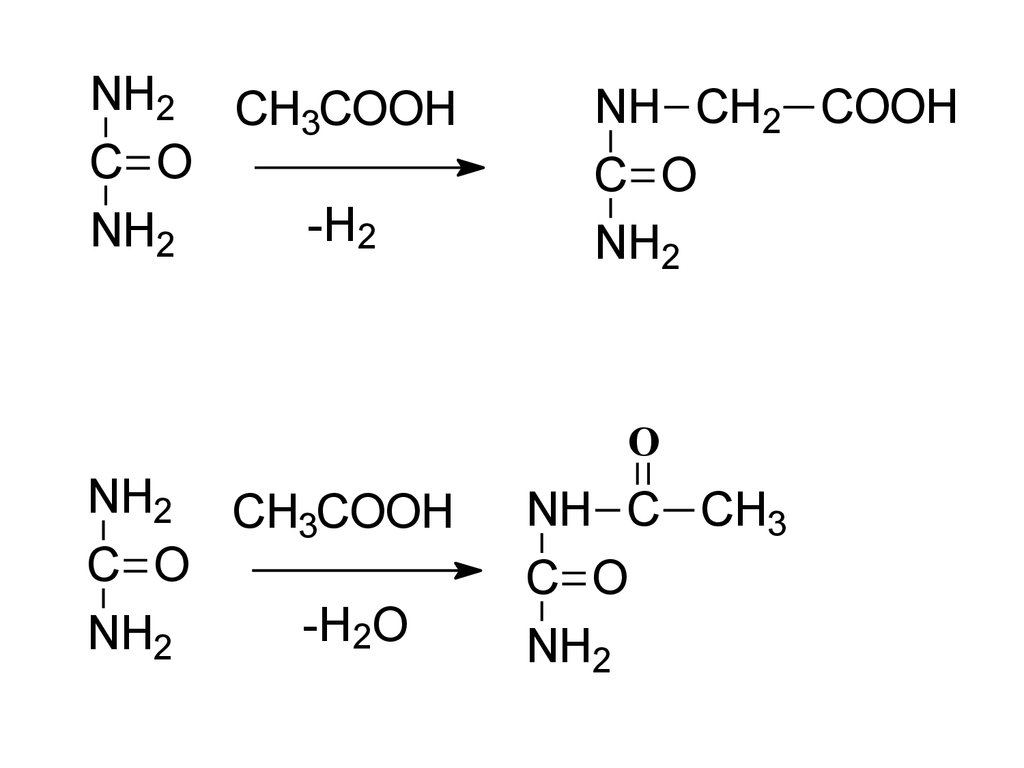
NH2 CH COOH3
C O
-H2
NH2
NH CH2 COOH
C O
NH2
O
NH2 CH COOH
3
C O
-H2O
NH2
NH C CH3
C O
NH2
37.
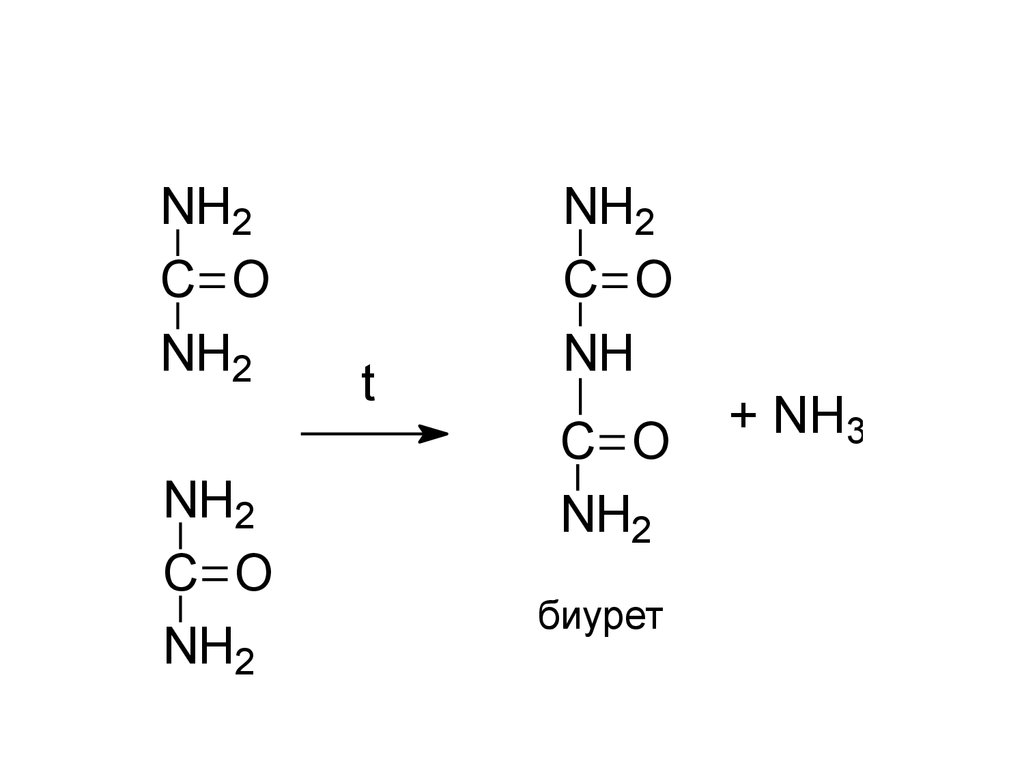
NH2C O
NH2
NH2
C O
NH2
t
NH2
C O
NH
C O
NH2
биурет
+ NH3
38. АМИНОКИСЛОТЫ
39.
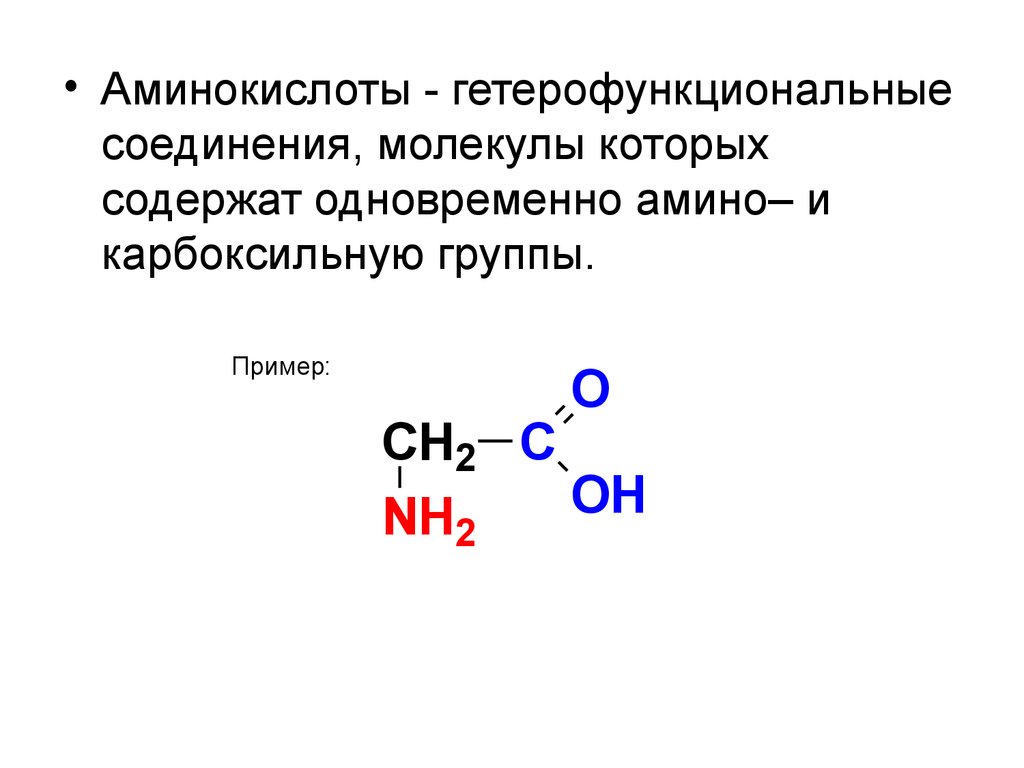
• Аминокислоты - гетерофункциональныесоединения, молекулы которых
содержат одновременно амино– и
карбоксильную группы.
Пример:
O
CH2 C
OH
NH2
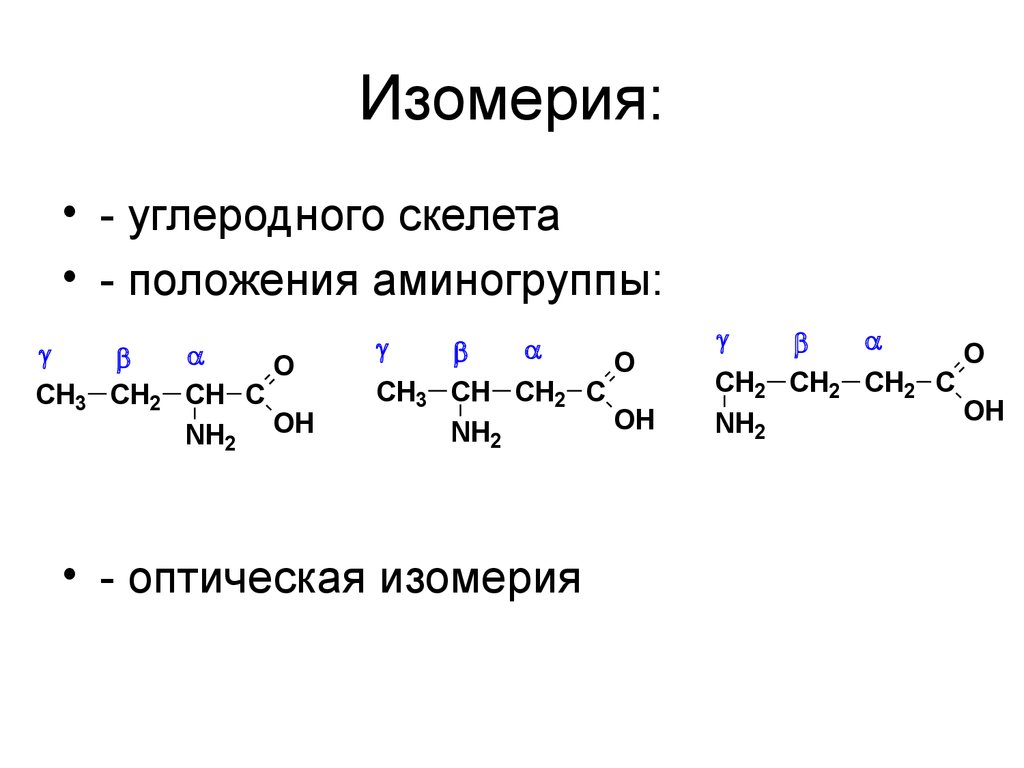
40. Изомерия:
• - углеродного скелета• - положения аминогруппы:
O
CH3 CH2 CH C
NH2 OH
CH3
O
CH CH2 C
OH
NH2
• - оптическая изомерия
CH2
NH2
O
CH2 CH2 C
OH
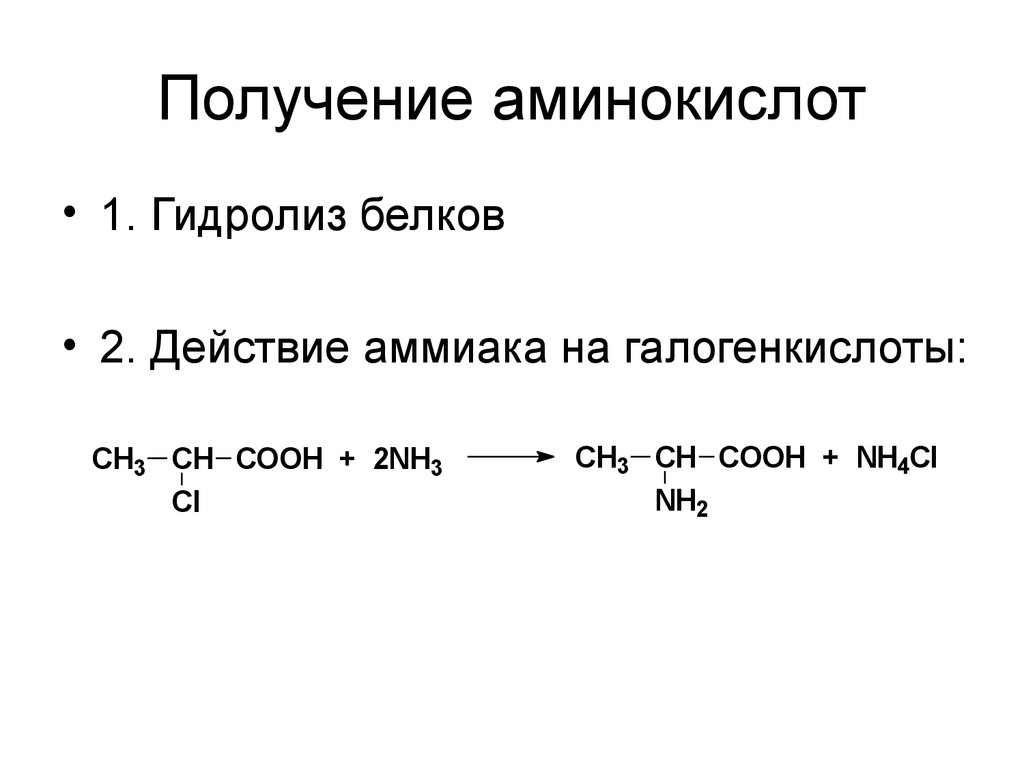
41. Получение аминокислот
• 1. Гидролиз белков• 2. Действие аммиака на галогенкислоты:
CH3 CH COOH + 2NH3
Cl
CH3 CH COOH + NH4Cl
NH2
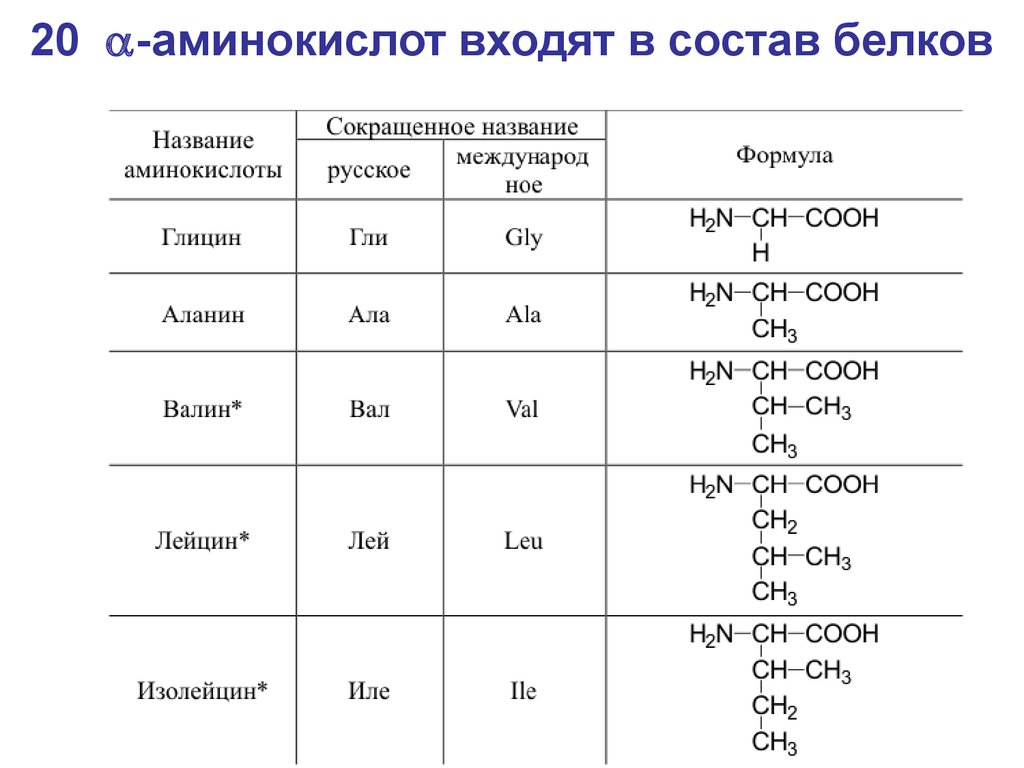
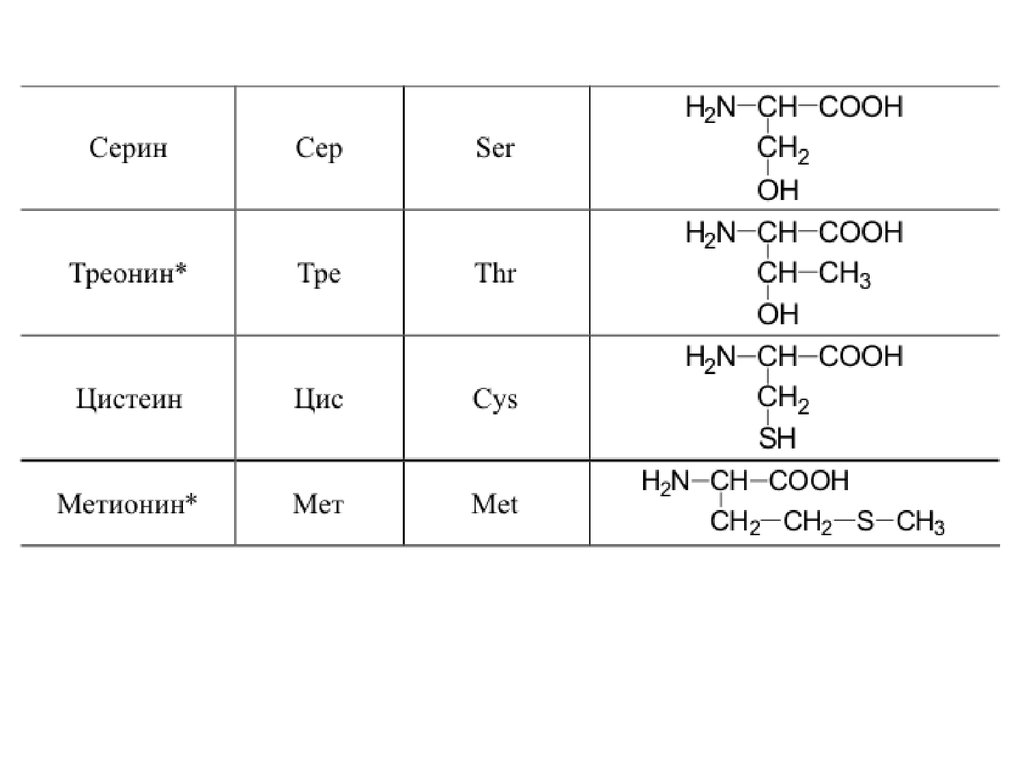
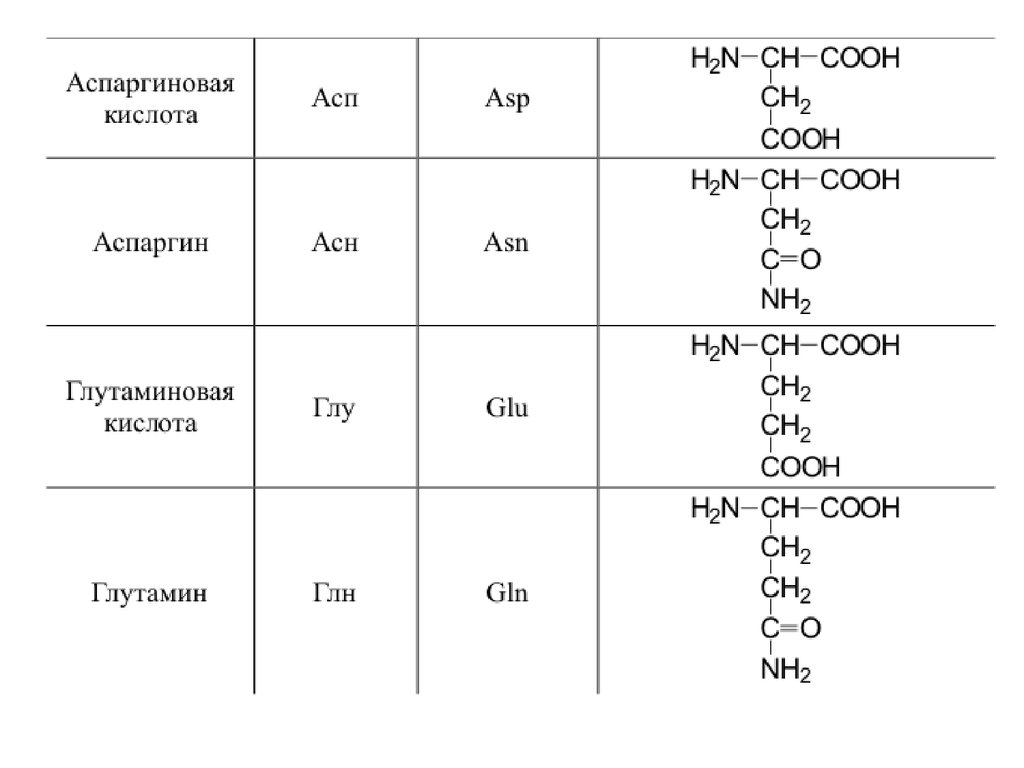
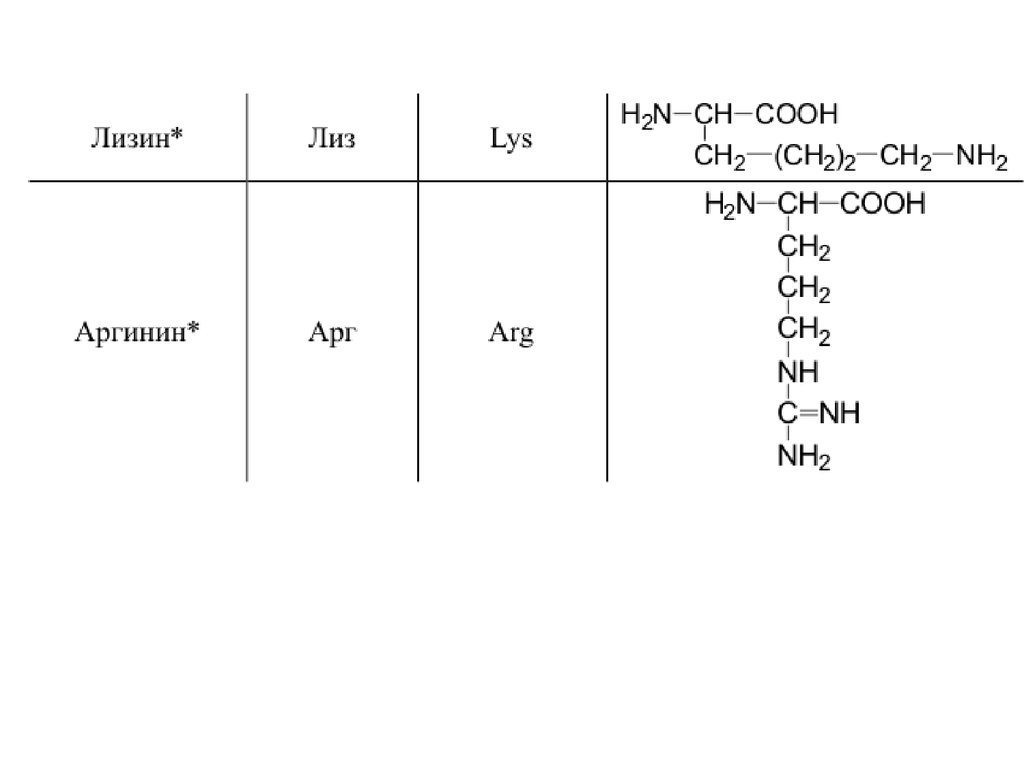
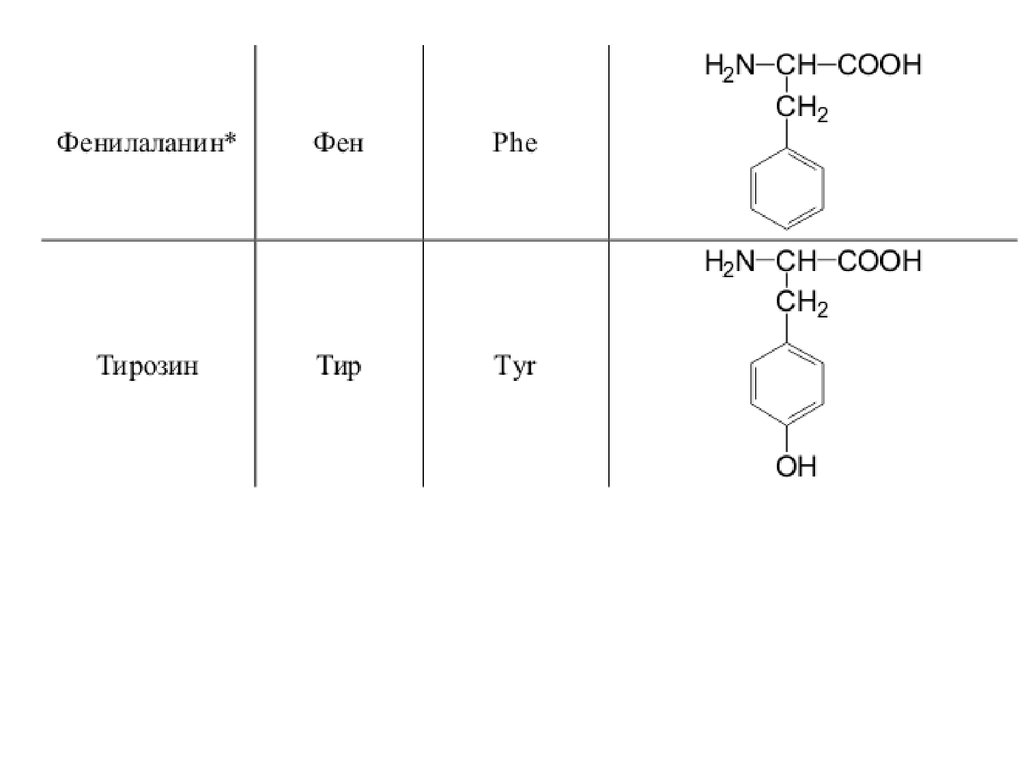
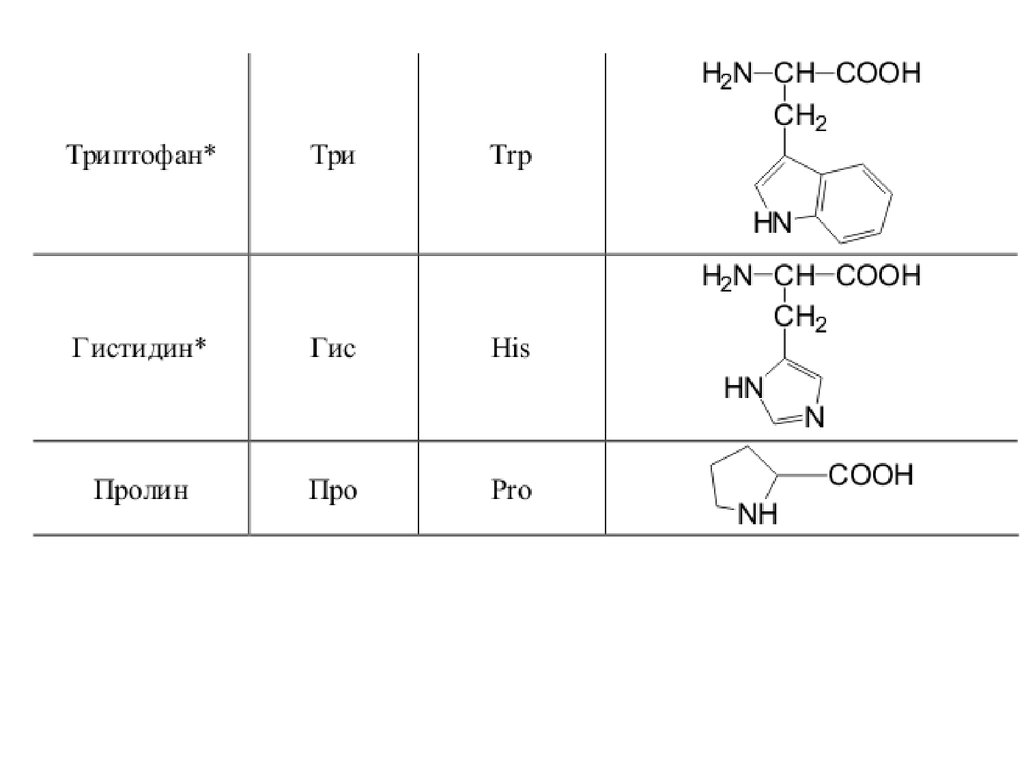
42. 20 a-аминокислот входят в состав белков
20 -аминокислот входят в состав белков43.
44.
45.
46.
47.
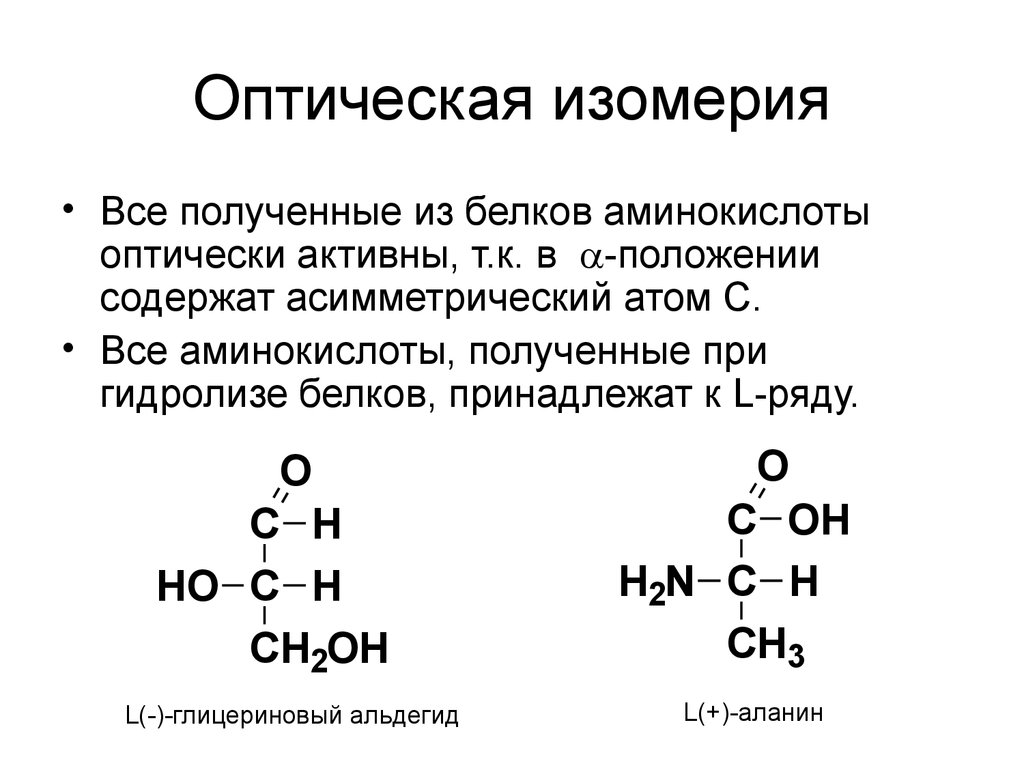
48. Оптическая изомерия
• Все полученные из белков аминокислотыоптически активны, т.к. в -положении
содержат асимметрический атом С.
• Все аминокислоты, полученные при
гидролизе белков, принадлежат к L-ряду.
O
C H
HO C H
CH2OH
L(-)-глицериновый альдегид
O
C OH
H2N C H
CH3
L(+)-аланин
49. Физические и химические свойства аминокислот
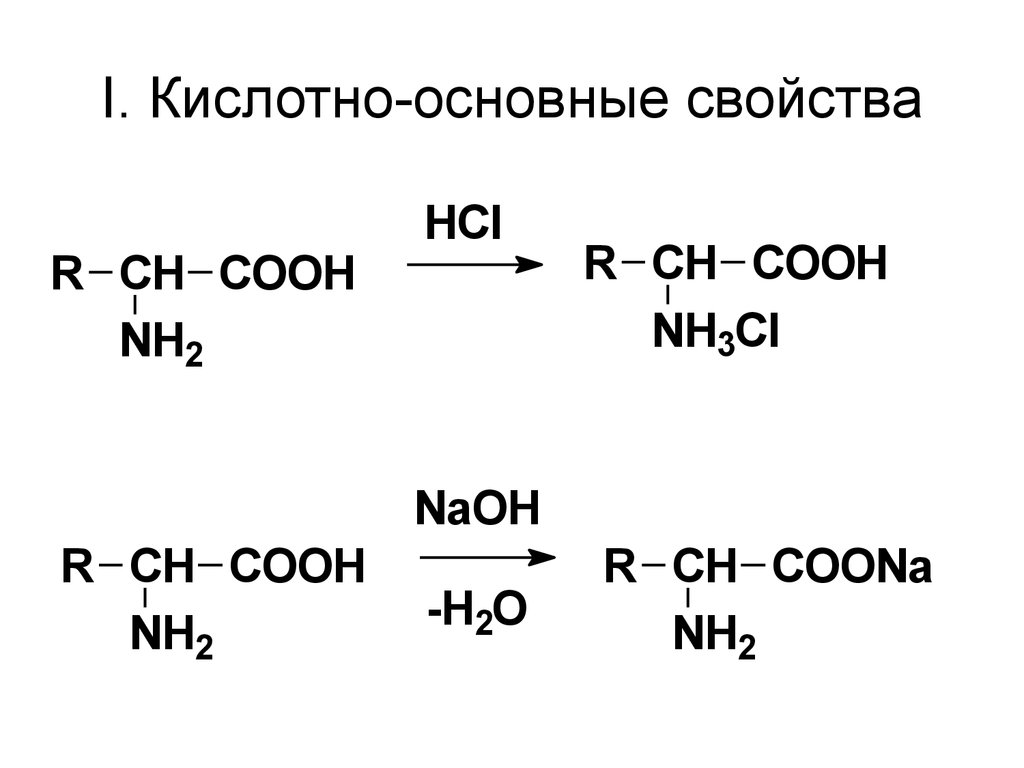
50. I. Кислотно-основные свойства
R CH COOHNH2
HCl
R CH COOH
NH3Cl
NaOH
R CH COOH
NH2
-H2O
R CH COONa
NH2
51.
Высокая температура плавления,
легкость кристаллизации, высокие
дипольные моменты и хорошая
растворимость аминокислот в воде
объясняются их ионным характером:
H2N CHR COOH
H3N+ CHR COO-
Способность -аминокислот
растворяться в воде является важным
фактором обеспечения их биологического
функционирования – с ней связаны
всасываемость -аминокислот, их транспорт
в организме и т. п.
52.
• В твёрдом состоянии -аминокислотысуществуют в виде диполярных ионов; в
водном растворе – в виде равновесной смеси
диполярного иона, катионной и анионной
форм (обычно используемая запись строения
-аминокислоты в неионизированном виде
служит лишь для удобства).
H2N CHR COOанион
OH-
H3N+ CHR COOдиполярный ион
H+
H3N+ CHR COOH
катион
53.
• Положение равновесия, т.е.соотношение различных форм
аминокислоты, в водном растворе
при определённых значениях рН
существенно зависит от строения
радикала, главным образом
наличия в нём ионогенных групп,
играющих роль кислотных и
основных центров.
54.
• Значение рН, при которомконцентрация диполярных ионов
максимальна, а минимальные
концентрации катионных и анионных
форм -аминокислоты равны,
называется изоэлектрической точкой
(pI).
55.
II. Все реакции карбоновых кислот,протекающие за счёт карбоксильной
группы (-COOH), т.е. они образуют:
• соли (с металлами, оксидами и
гидроксидами металлов),
• эфиры,
• ангидриды,
• галогенангидриды,
• амиды,
• амины (реакцией декарбоксилирования)
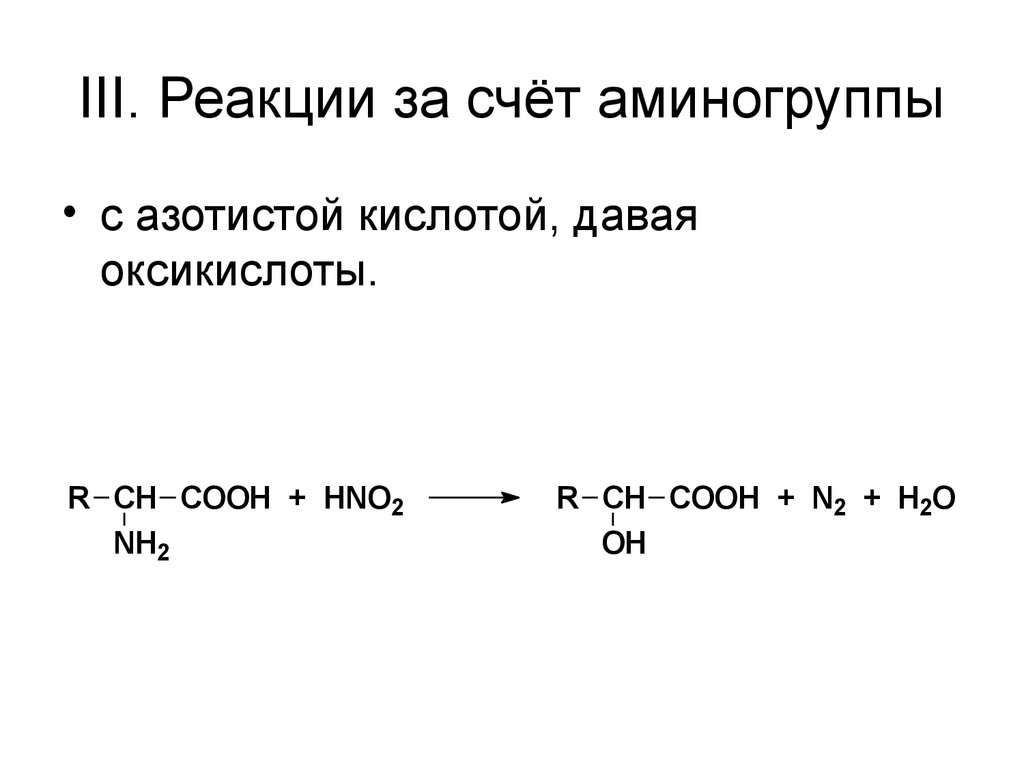
56. III. Реакции за счёт аминогруппы
• с азотистой кислотой, даваяоксикислоты.
R CH COOH + HNO2
NH2
R CH COOH + N2 + H2O
OH
57.
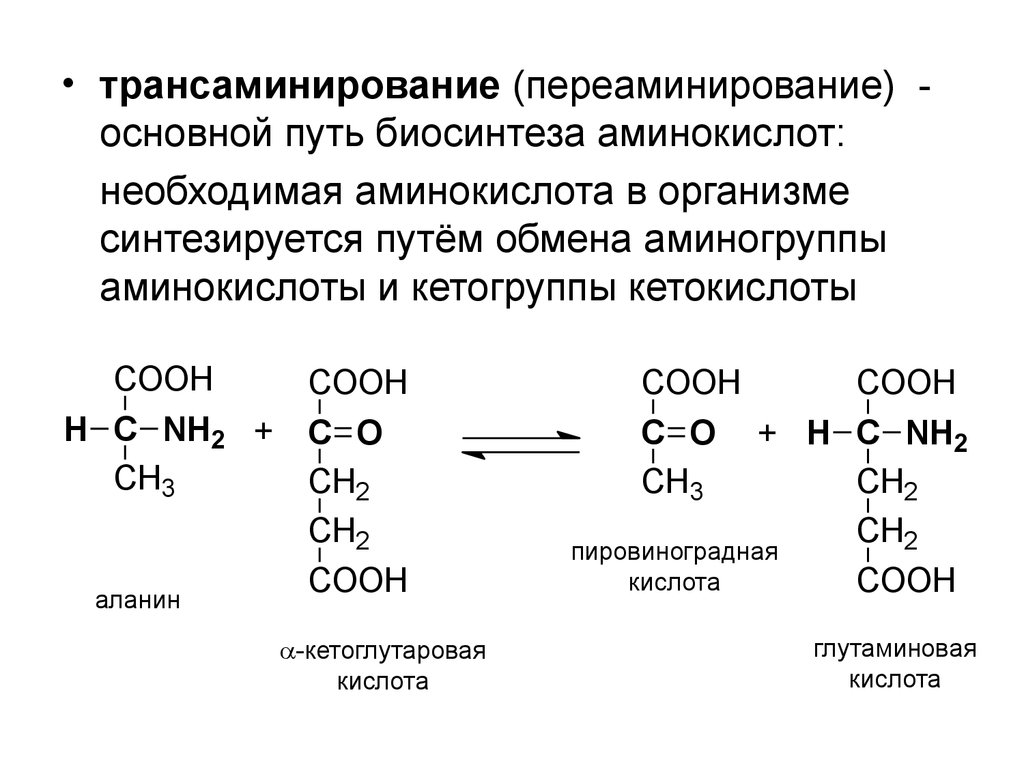
• трансаминирование (переаминирование) основной путь биосинтеза аминокислот:необходимая аминокислота в организме
синтезируется путём обмена аминогруппы
аминокислоты и кетогруппы кетокислоты
COOH
H C NH2 +
CH3
аланин
COOH
C O
CH2
CH2
COOH
-кетоглутаровая
кислота
COOH
COOH
C O + H C NH2
CH3
CH2
CH2
пировиноградная
кислота
COOH
глутаминовая
кислота
58.
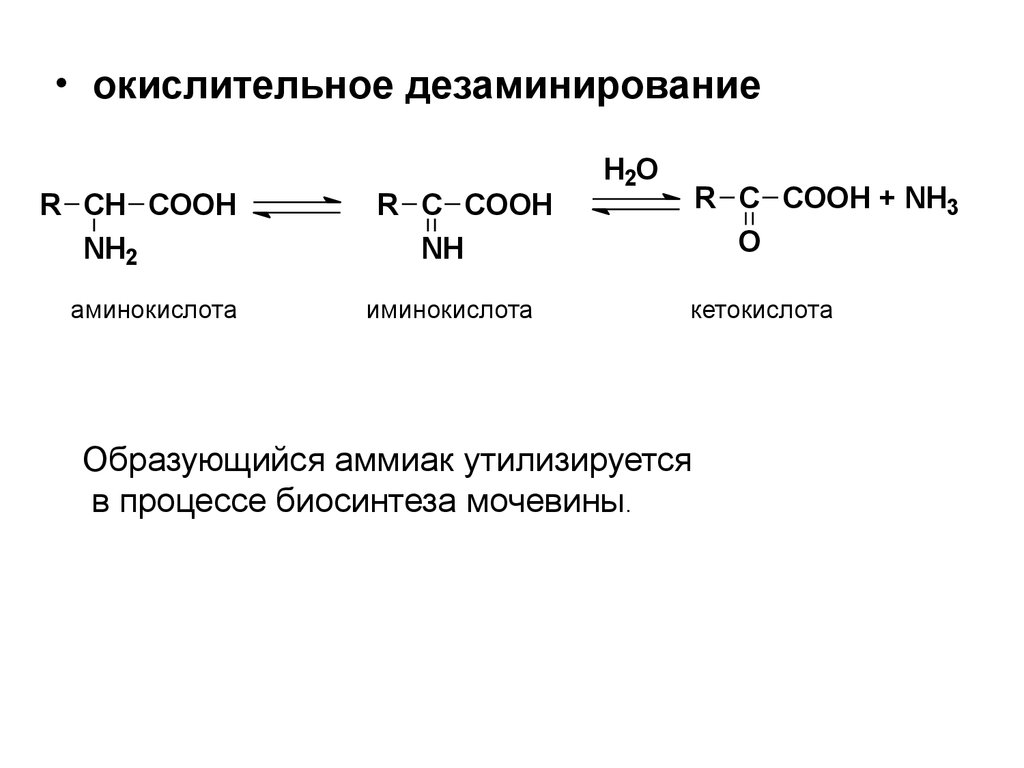
• окислительное дезаминированиеR CH COOH
NH2
аминокислота
R C COOH
NH
иминокислота
H2O
R C COOH + NH3
O
кетокислота
Образующийся аммиак утилизируется
в процессе биосинтеза мочевины.
59.
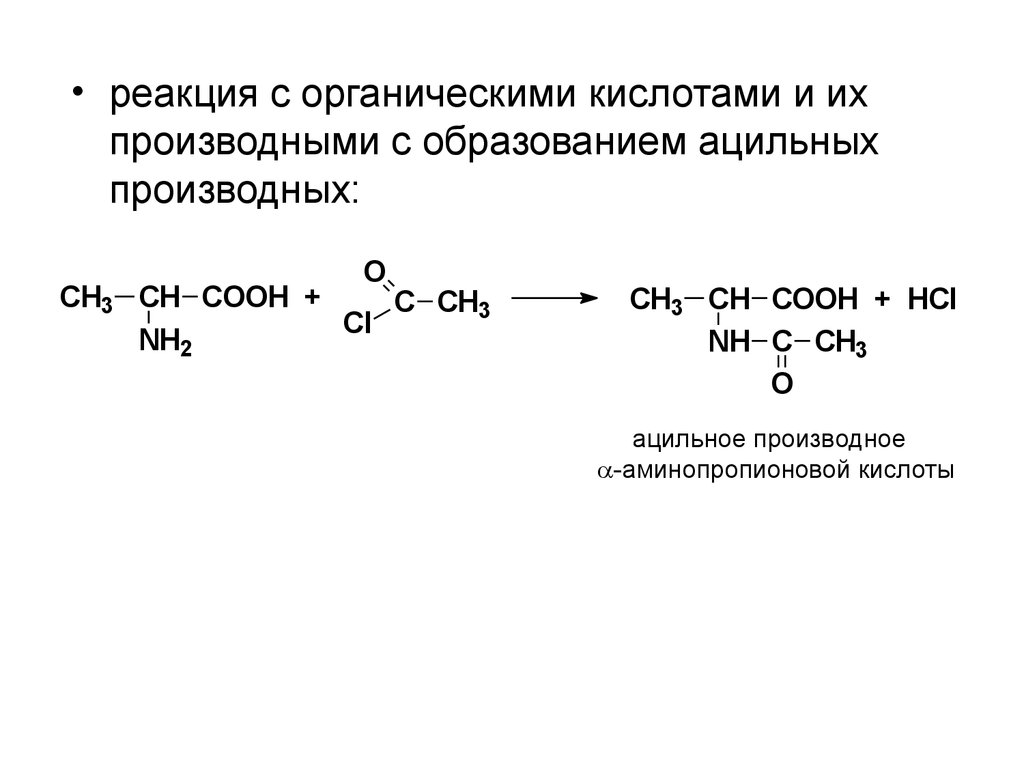
• реакция с органическими кислотами и ихпроизводными с образованием ацильных
производных:
O
CH3 CH COOH +
C CH3
Cl
NH2
CH3 CH COOH + HCl
NH C CH3
O
ацильное производное
-аминопропионовой кислоты
60.
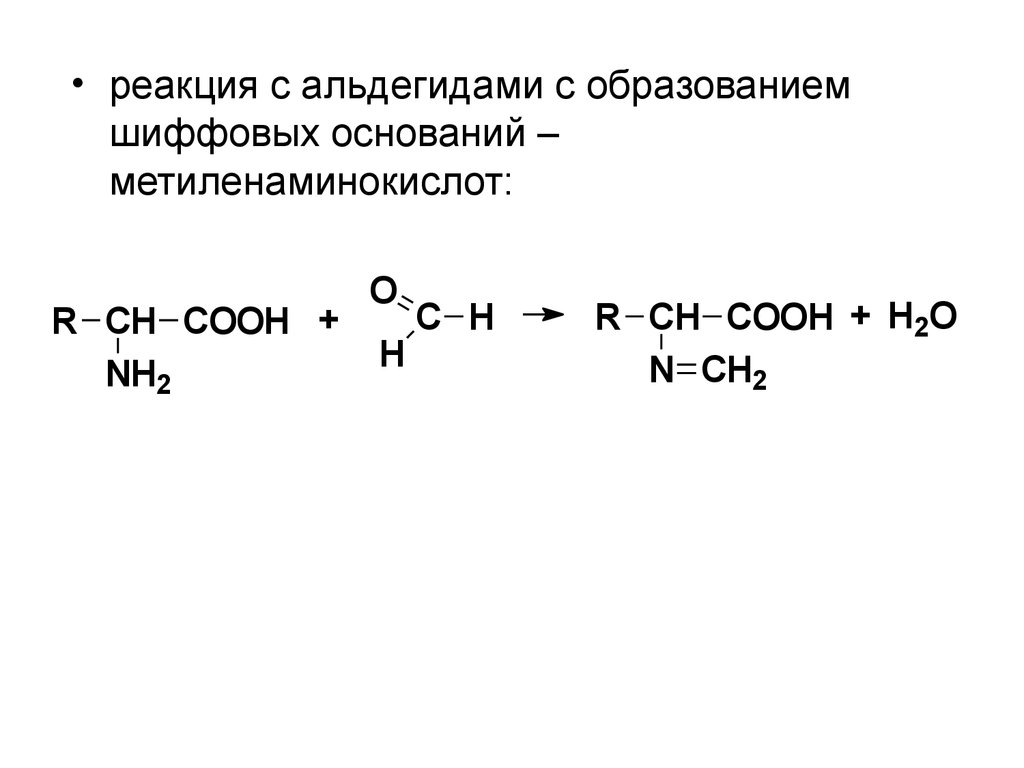
• реакция с альдегидами с образованиемшиффовых оснований –
метиленаминокислот:
R CH COOH +
NH2
O
H
C H
R CH COOH + H2O
N CH2
61. IV. Специфические свойства аминокислот
• Образование пептидов. Одновременноеприсутствие в молекулах α–аминокислот аминной и
карбоксильной групп обусловливает их способность
вступать в реакции поликонденсации, которые
приводят к образованию пептидных (амидных) связей
между мономерными звеньями. В результате такой
реакции образуются пептиды, полипептиды и белки.
O
H2N CH C OH +
R1
O
H HN CH C OH +
R2
O
O
O
H2N CH C NH CH C NH CH C
R1
R2
R3
пептидные связи
O
O
H HN CH C OH + ...... H HN CH C OH
Rn
R3
...
O
HN CH C OH
Rn
62. Номенклатура пептидов
N-концевой аминокислотный остаток (имеющийсвободную аминогруппу) пишут с левой стороны
формулы, а С-концевой аминокислотный остаток
(имеющий свободную карбоксильную группу) с
правой стороны:
+
H3NCH2CONHCHCONHCHCOOCH3
CH2C6H5
Gly-Ala-Phe
трипептид глицилаланилфенилаланин
63.
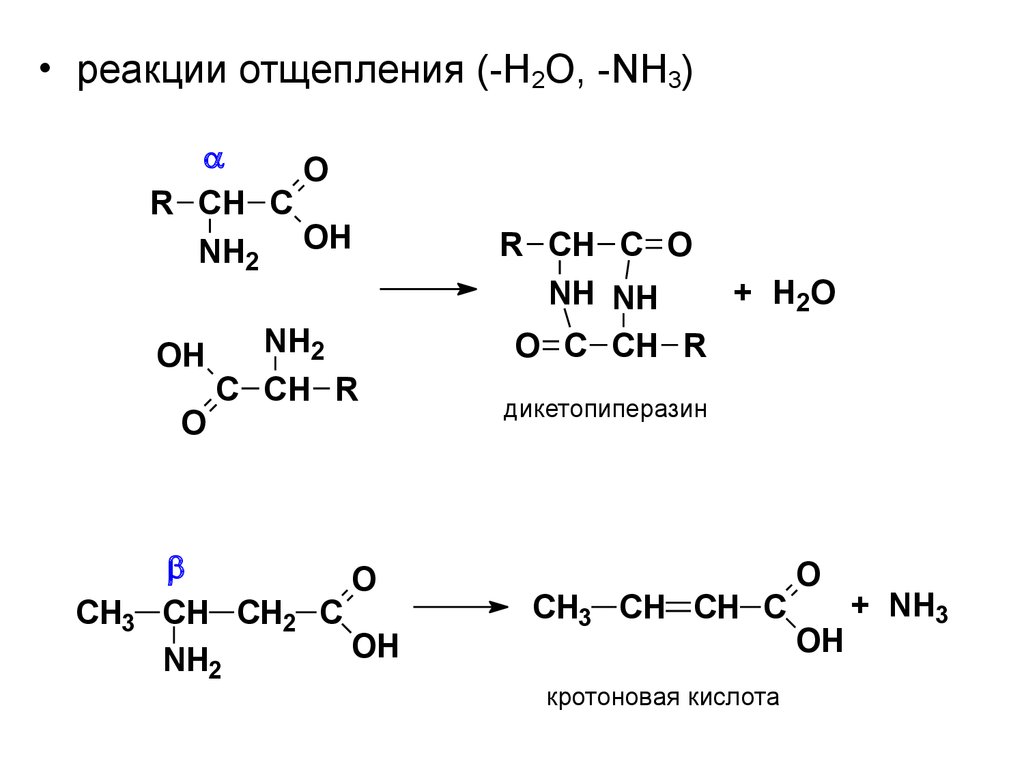
• реакции отщепления (-H2O, -NH3)O
R CH C
NH2 OH
OH
O
CH3
NH2
C CH R
O
CH CH2 C
OH
NH2
R CH C O
+ H2O
NH NH
O C CH R
дикетопиперазин
CH3 CH CH C
кротоновая кислота
O
OH
+ NH3


















 Химия
Химия








