Похожие презентации:
1_ФГОС_АЗОТ_мой
1.
§16.Азот.2.
Цель урока:Формирование умений характеризовать строение атомов
и молекул азота, его физические и химические свойства,
получение и применение; описывать биологическую роль
азота и его круговорот в природе.
Проблемный вопрос урока:
Какими особыми свойствами обладает азот как простое
вещество? Каково биологическое значение азота? Как
осуществляется круговорот азота в природе?
3.
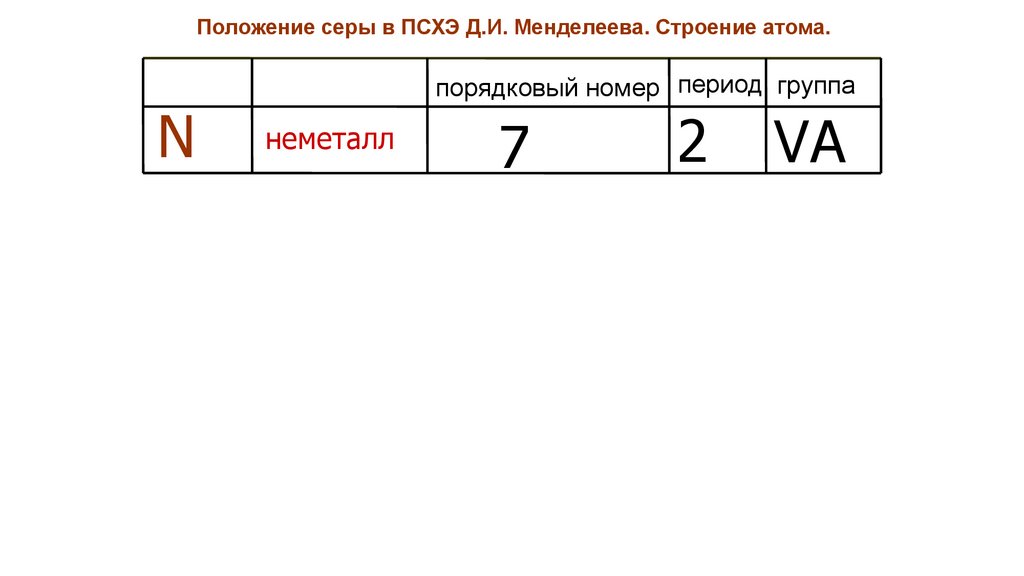
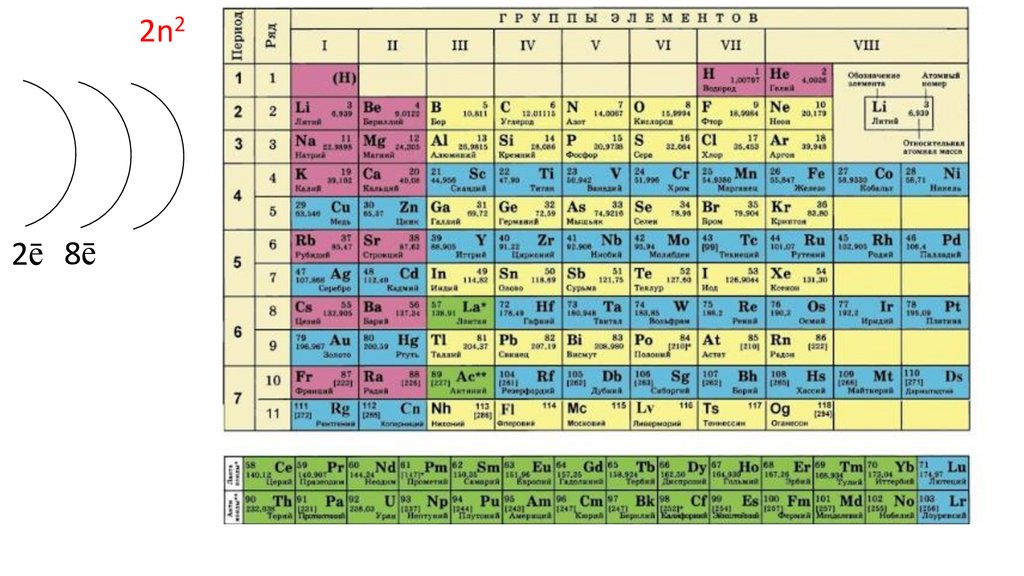
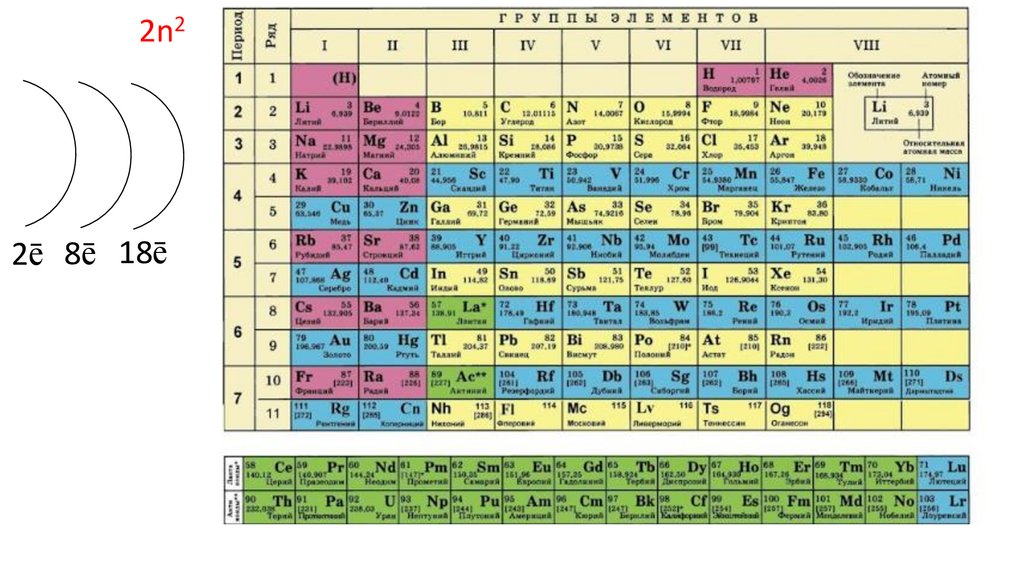
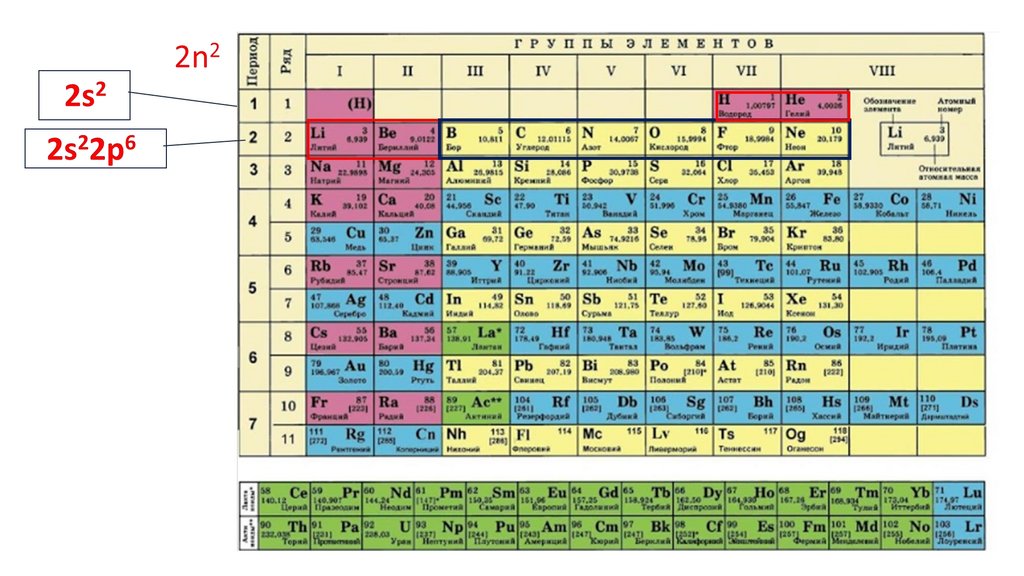
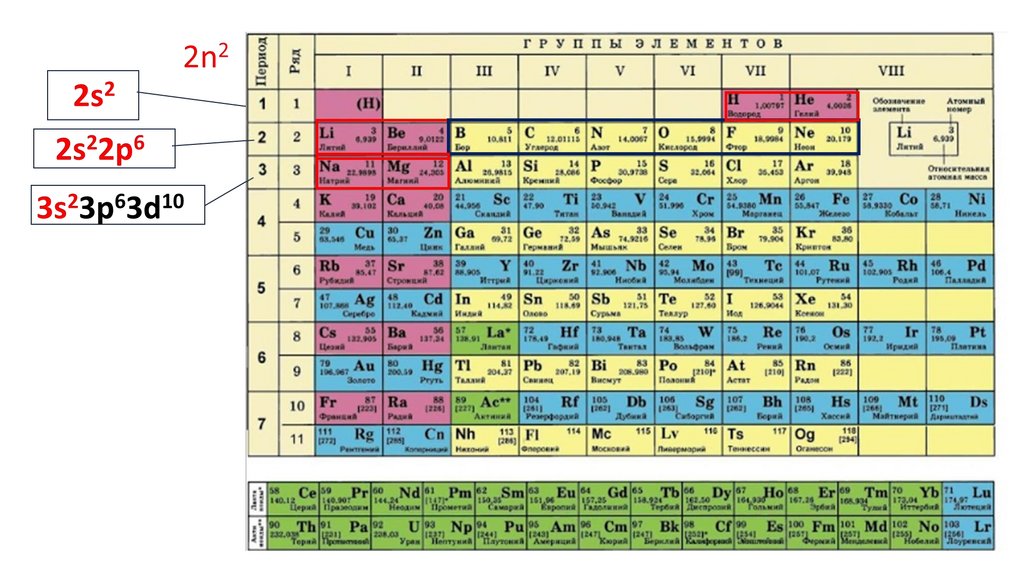
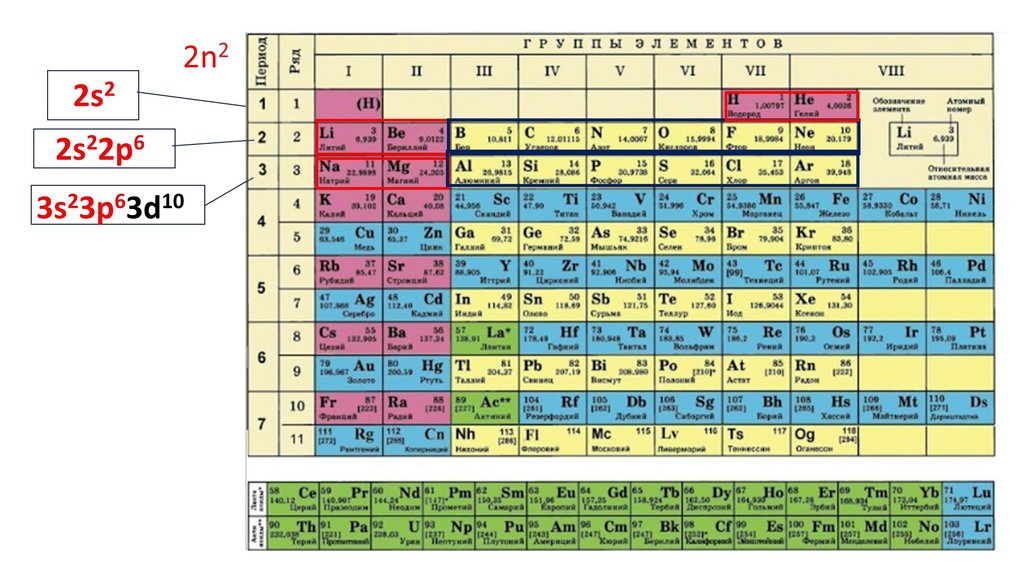
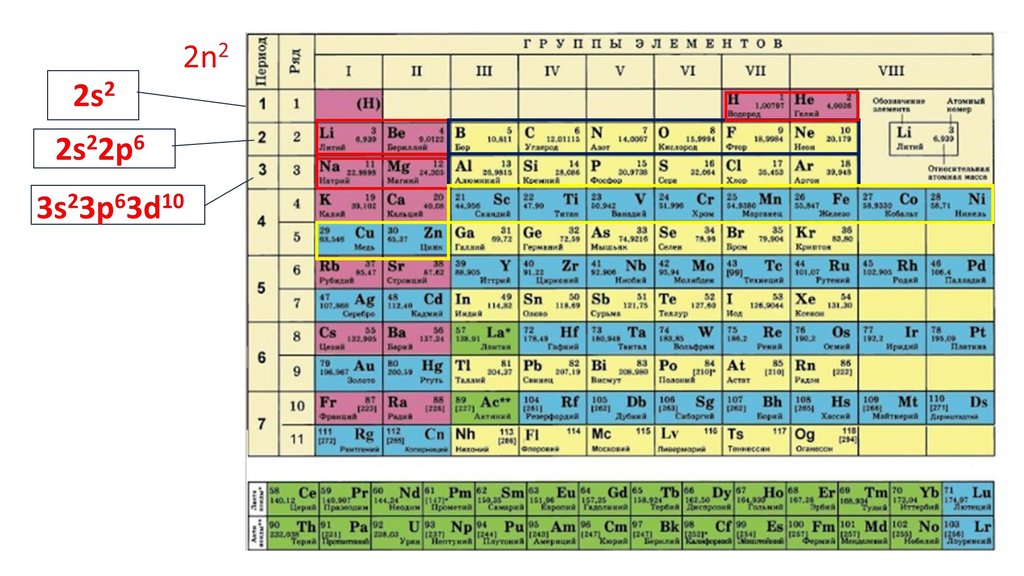
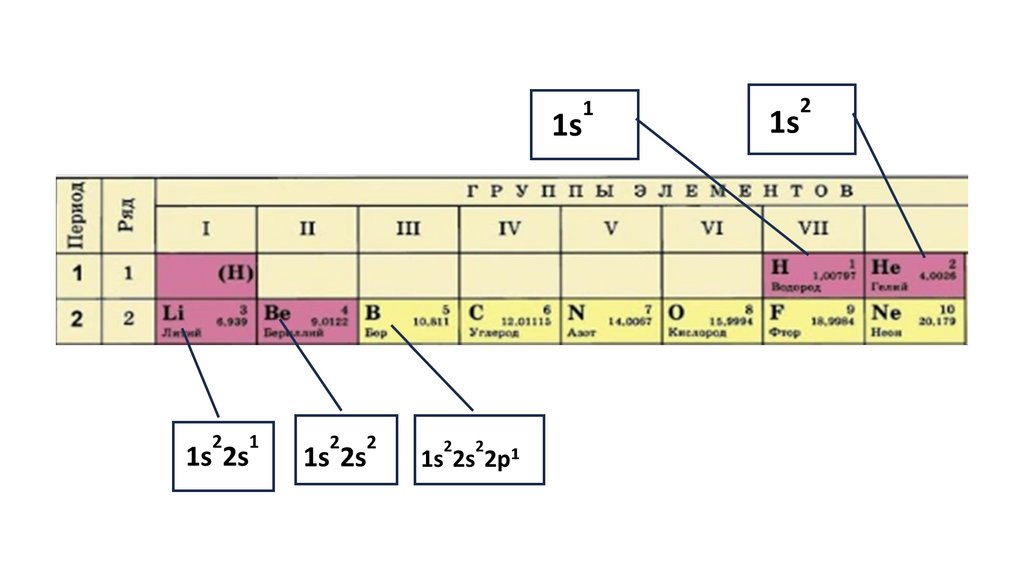
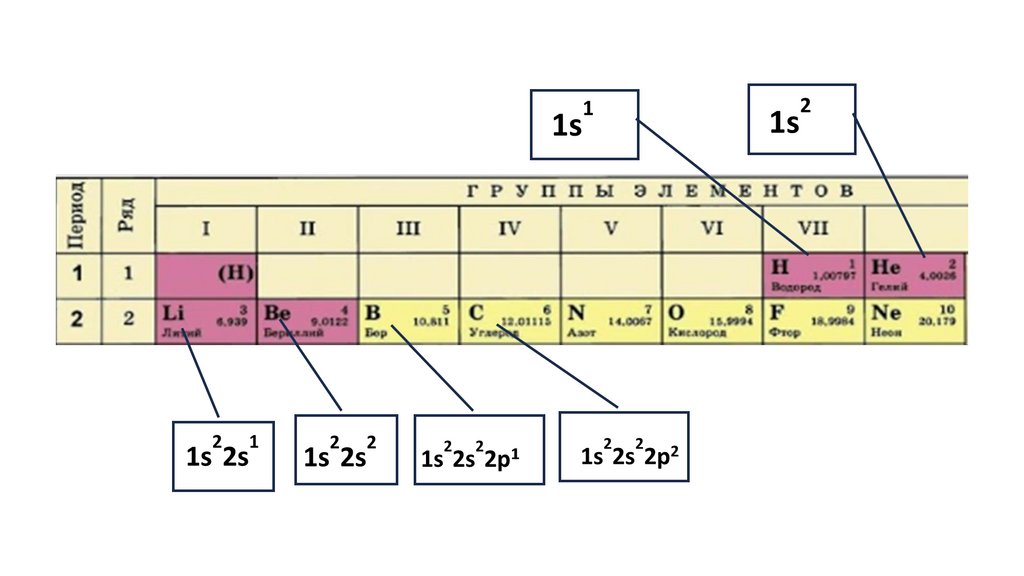
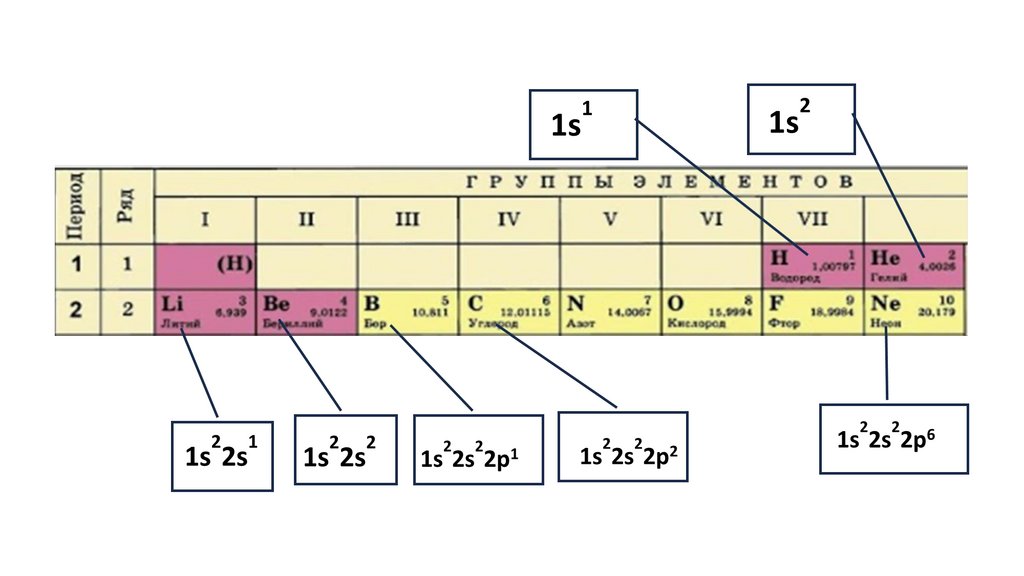
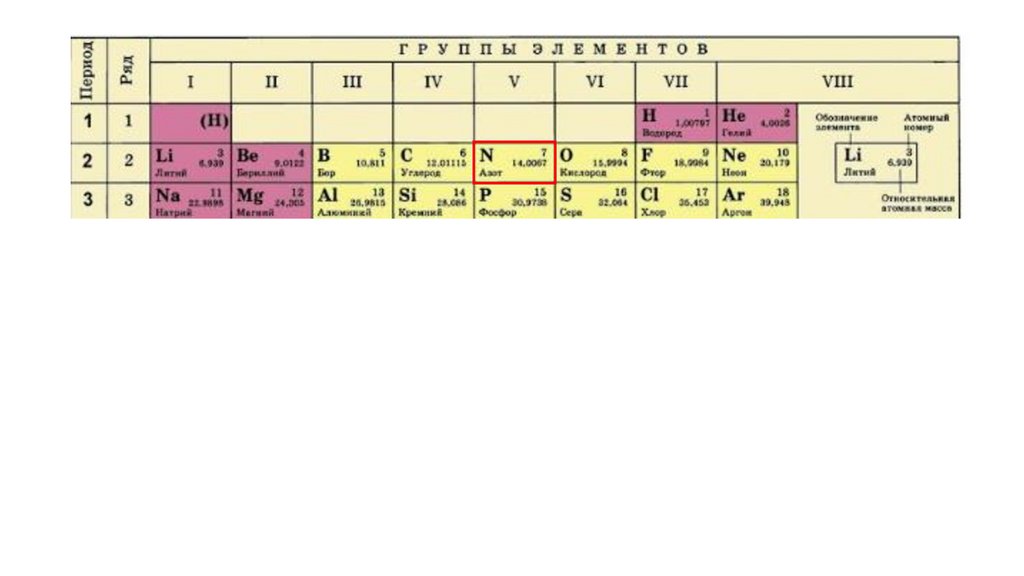
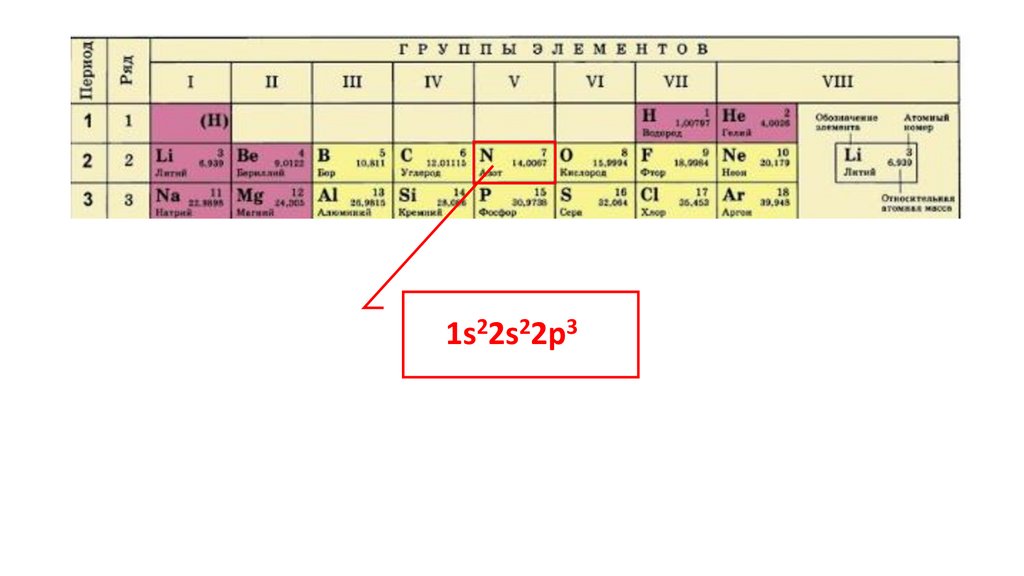
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.N
порядковый номер период группа
неметалл
7
2
VA
4.
2n25.
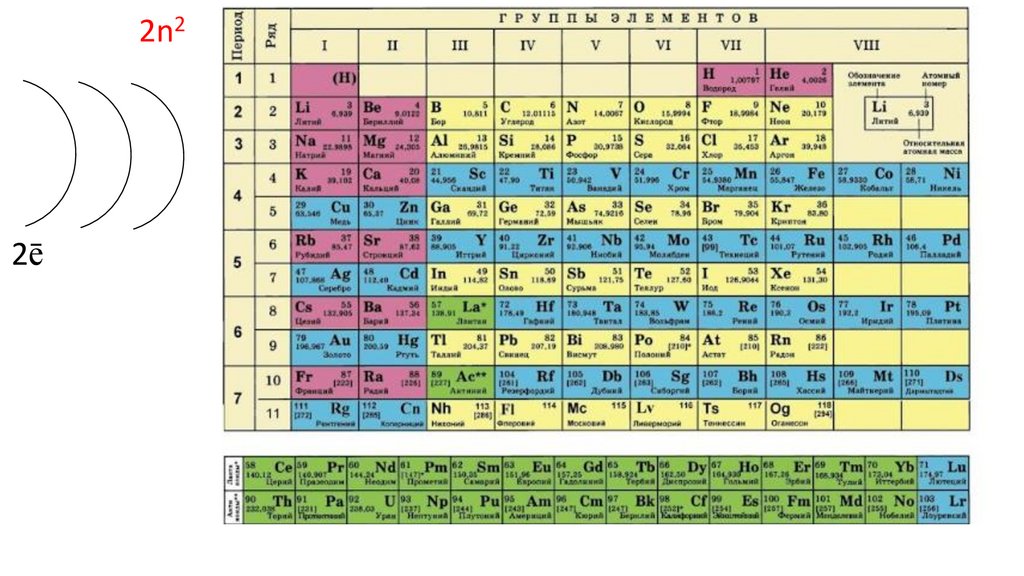
2n22ē
6.
2n22ē 8ē
7.
2n22ē 8ē 18ē
8.
9.
10.
11.
12.
13.
14.
Читаем формулы элементов15.
16.
17.
18.
19.
20.
21.
22.
23.
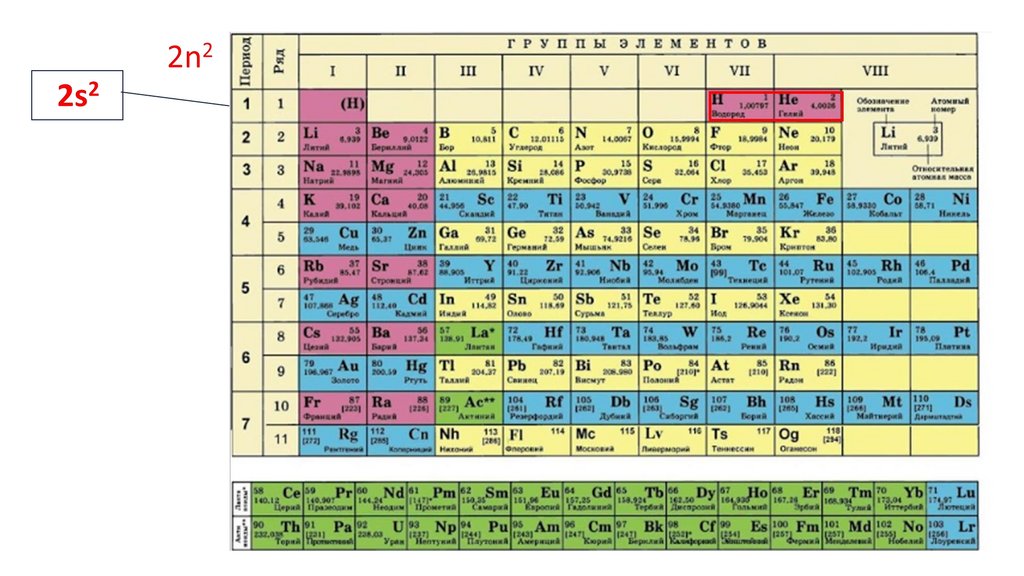
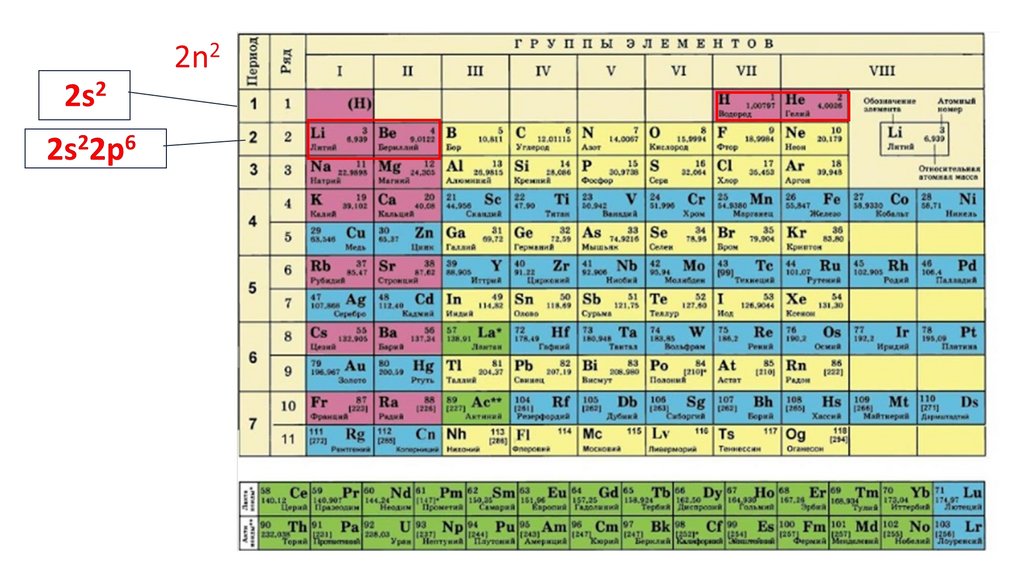
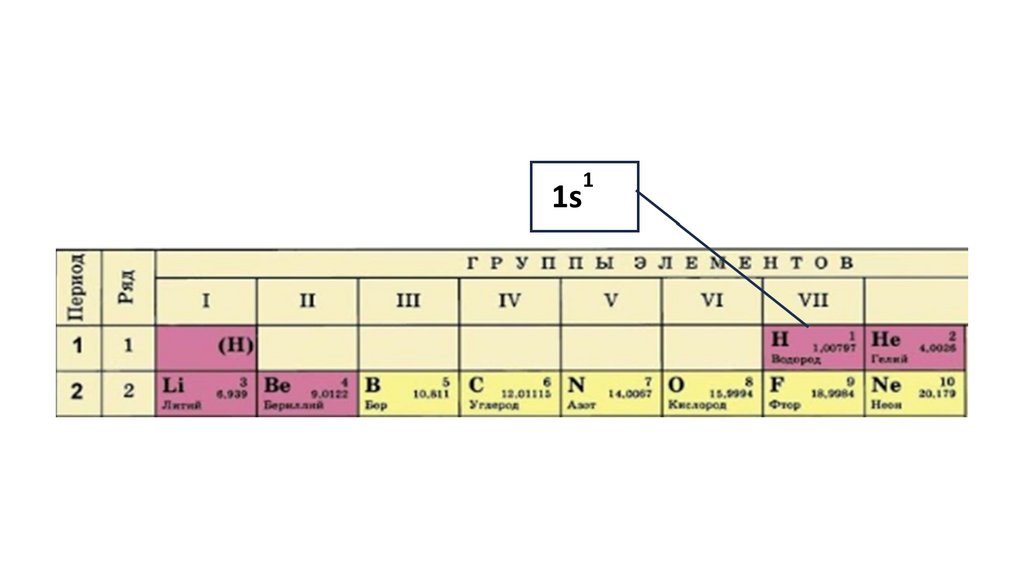
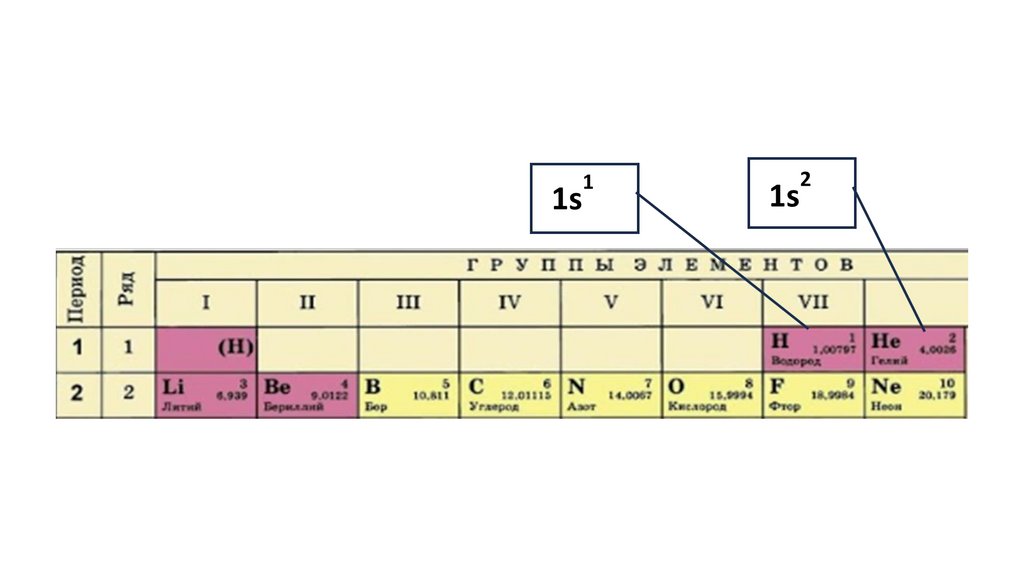
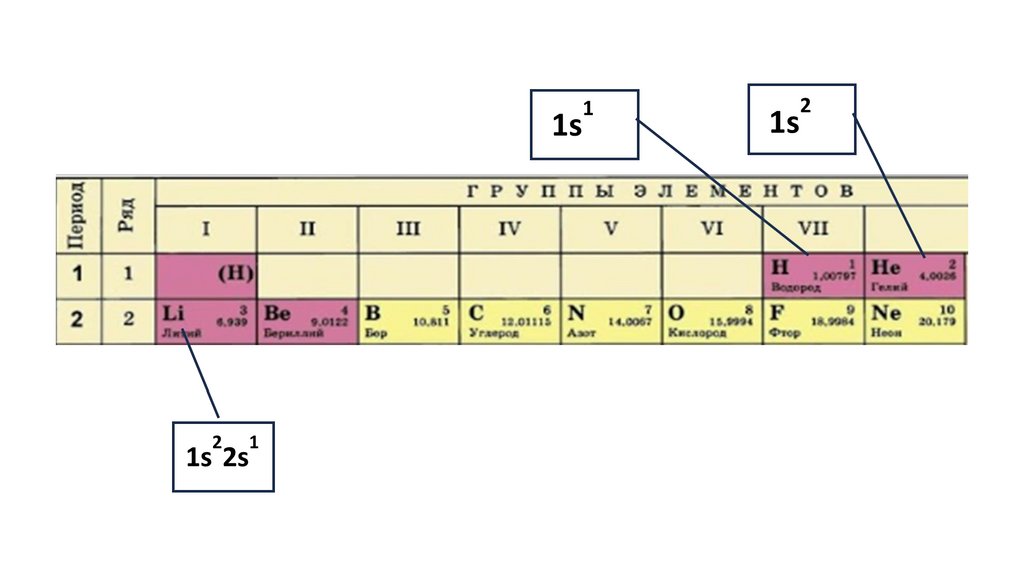
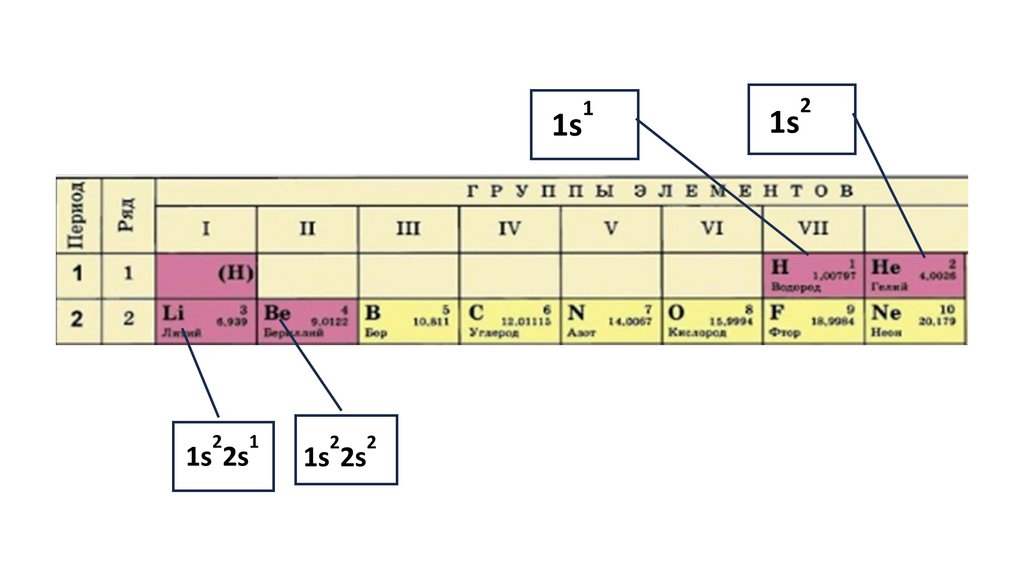
1s22s22p324.
Определяем степень окисления азота25.
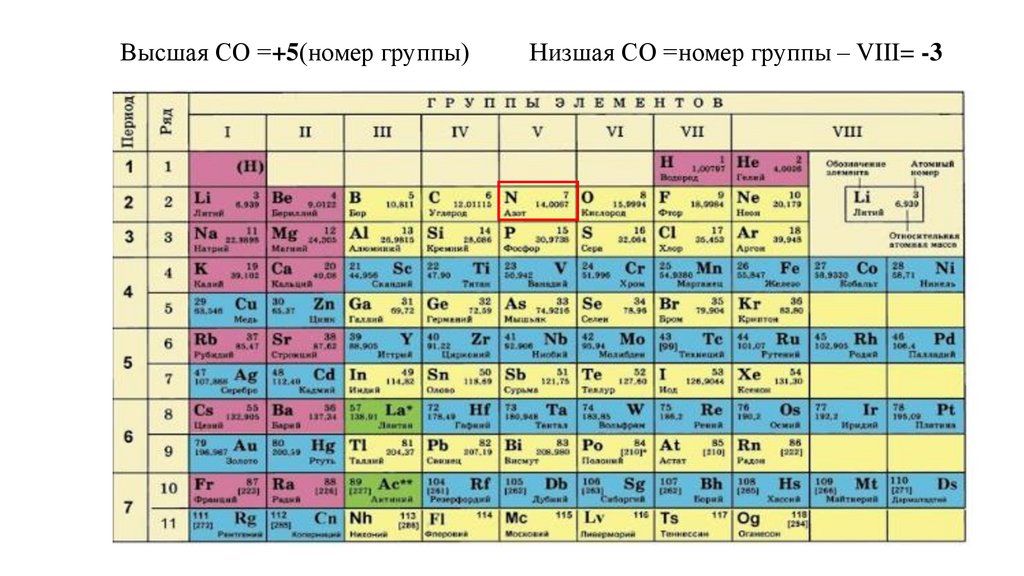
Высшая СО =+5(номер группы)Низшая СО =номер группы – VIII= -3
26.
Высшая СО =+5(номер группы)Низшая СО =номер группы – VIII= -3
1s22s22p3
1s2 2s2
2p3
Строение электронной оболочки атома можно изображать
графически с помощью квантовых ячеек.
валентные электроны
27.
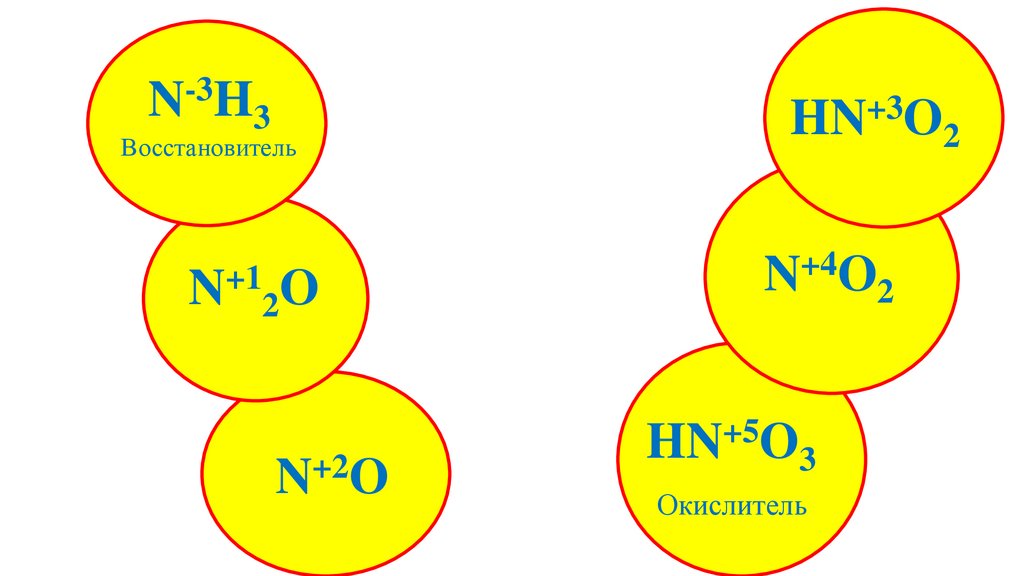
-3N H3
Восстановитель
+1
N 2O
+2
N O
+3
HN O2
N+4O2
+5
HN O3
Окислитель
28.
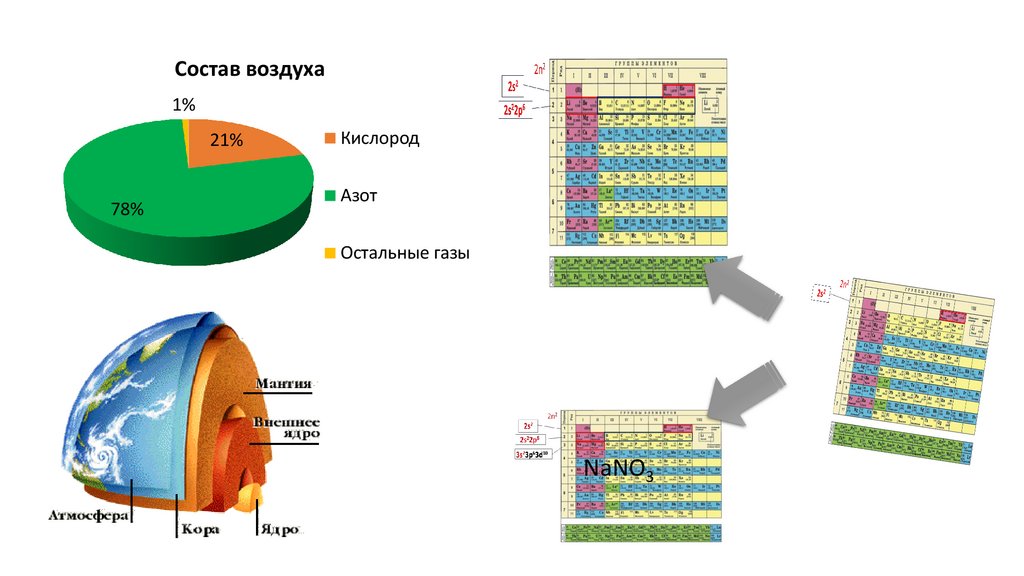
Состав воздуха1%
21%
78%
Кислород
Азот
Остальные газы
NaNO3
29.
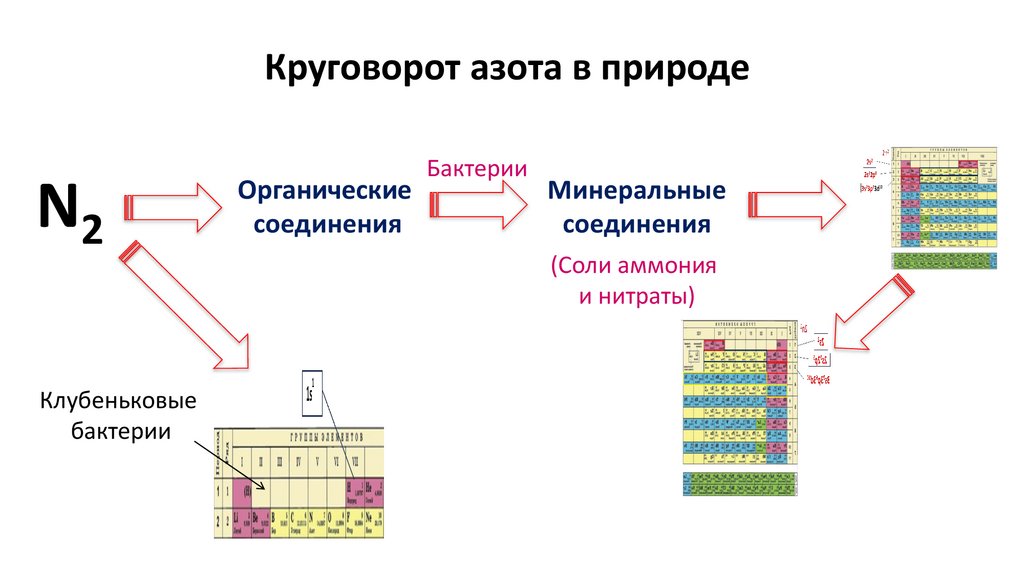
Круговорот азота в природе30.
Круговорот азота в природеN2
Клубеньковые
бактерии
Органические
соединения
Бактерии
Минеральные
соединения
(Соли аммония
и нитраты)
31.
Азот-простое вещество32.
N2●
●
●
●
●
―
―
―
NN N N
Азот – малоактивное вещество.
Азот является бесцветным газом, не имеет запаха и вкуса.
Не сжижается при обычной температуре.
Азот плохо растворим в воде.
Температура плавления азота -210 0С, а температура
кипения -196 0С.
33.
ОТРАБОТКА ОВР34.
N20 + O20 = 2N+2O-235.
N20 + O20 = 2N+2O-236.
N20 + O20 = 2N+2O-237.
N20 + O20 = 2N+2O-238.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
39.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
O20 + 4ē= 2O-2
40.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
O20 + 4ē= 2O-2
41.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
42.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
4
43.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
2
4
1
44.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
4
2 пр.окисления
1
45.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
4
2 пр.окисления
1 пр.восстановления
46.
N20 + O20 = 2N+2O-2N20 - 2ē= 2N+2
2
O20 + 4ē= 2O-2 4
4
2 пр.окисления
1 пр.восстановления
N20 восстановитель
O20 окислитель
47.
2N+2O + O20 =48.
2N+2O + O20 = 2N+4O2-249.
2N+2O + O20 = 2N+4O2-250.
2N+2O + O20 = 2N+4O2-251.
2N+2O + O20 = 2N+4O2-252.
2N+2O + O20 = 2N+4O2-253.
2N+2O + O20 = 2N+4O2-254.
2N+2O + O20 = 2N+4O2-255.
2N+2O + O20 = 2N+4O2-256.
2N+2O + O20 = 2N+4O2-257.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
58.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
59.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
O20 + 4ē = 2O -2
60.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
O20 + 4ē = 2O -2
61.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
O20 + 4ē = 2O -2
62.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
2
O20 + 4ē = 2O -2 4
63.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
2
O20 + 4ē = 2O -2 4
4
64.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
2 2
4
1
0
-2
4
O + 4ē = 2O
2
65.
2N+2O + O20 = 2N+4O2-22N+2 -2ē = 2N+4
2 2
4
1
0
-2
4
O + 4ē = 2O
2
66.
2N+2O + O20 = 2N+4O2-22 2 пр.окисления
4
1
0
-2
4
O + 4ē = 2O
2N+2 -2ē = 2N+4
2
67.
2N+2O + O20 = 2N+4O2-22 2 пр.окисления
4
пр.восстановления
1
0
-2
4
O + 4ē = 2O
2N+2 -2ē = 2N+4
2
68.
2N+2O + O20 = 2N+4O2-22 2 пр.окисления
4
пр.восстановления
1
0
-2
4
O + 4ē = 2O
2N+2 -2ē = 2N+4
2
2N+2 (N+2O)-восстановитель
69.
2N+2O + O20 = 2N+4O2-22 2 пр.окисления
4
пр.восстановления
1
0
-2
4
O + 4ē = 2O
2N+2 -2ē = 2N+4
2
2N+2 (N+2O)-восстановитель
O20 -окислитель
70.
4NO2 + O20 + 2H2O = 4HNO3-271.
4NO2 + O20 + 2H2O = 2HNO3-272.
2NO2 + O20 + 2H2O = 2HNO3-273.
2NO2 + O20 + 2H2O = 4HNO3-274.
4NO2 + O20 + 2H2O = 4HNO3-275.
4NO2 + O20 + 2H2O = 4HNO3-276.
+44NO2 + O20 + 2H2O = 4HNO3-2
77.
+40
4NO2 + O20 + 2H2O = 4HNO3-2
78.
+40
+5
4NO2 + 2O20 + 2H2O = 4HNO3-2
79.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
80.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
81.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
82.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
83.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
84.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N
85.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N
86.
+40
+5 -2
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N
0
O20 +
2
-2
= 2O-
87.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N
0
-2
O20 +4ē= 2O2
88.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1
0
-2
O20 +4ē= 2O2
4
89.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1
0
-2
O20 +4ē= 2O2
4
4
90.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1 4
0
-2
O20 +4ē= 2O2
4
4
1
91.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1 4
0
-2
O20 +4ē= 2O2
4
4
1
пр. окисления
92.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1 4
0
-2
O20 +4ē= 2O2
4
4
1
пр. окисления
пр. восстановления
93.
+4+5 -2
0
4NO2 + 2O20 + 2H2O = 4HNO3-2
+4
+5
N -1ē = N 1 4
0
4
-2
O20 +4ē= 2O-
4
1
пр. окисления
пр. восстановления
2
2N+4 (N+4O2)-восстановитель
O20 -окислитель
94.
Химические свойства азота95.
1. Реакции с металлами6Li0 + N20 = 2Li3+N-3
3Mg0 + N20 = Mg3+2N2-3
96.
1. Реакции с металлами6Li0 + N20 = 2Li3+N-3
3Mg0 + N20 = Mg3+2N2-3
2. Реакция с неметаллами
N20 + 3H20







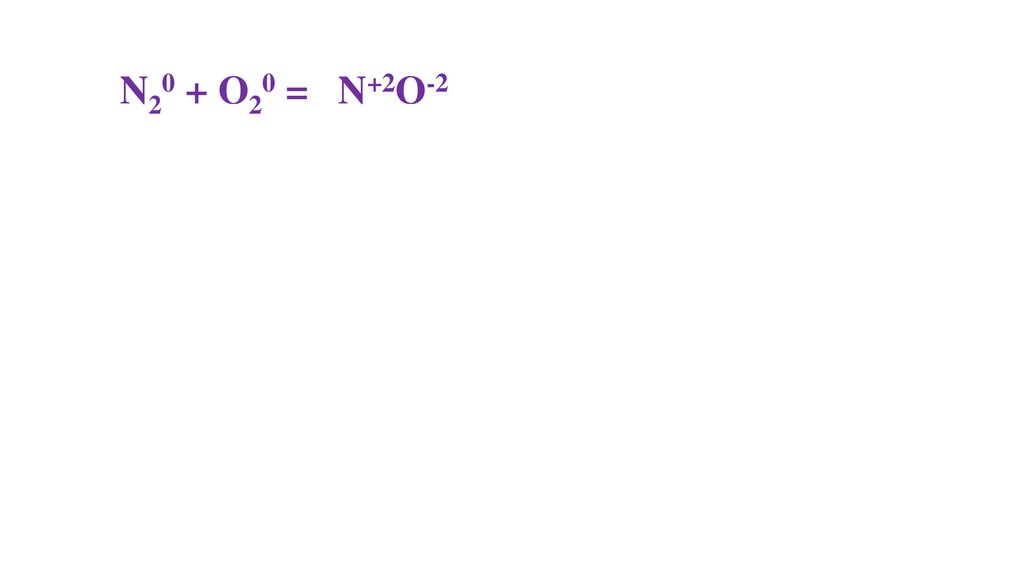
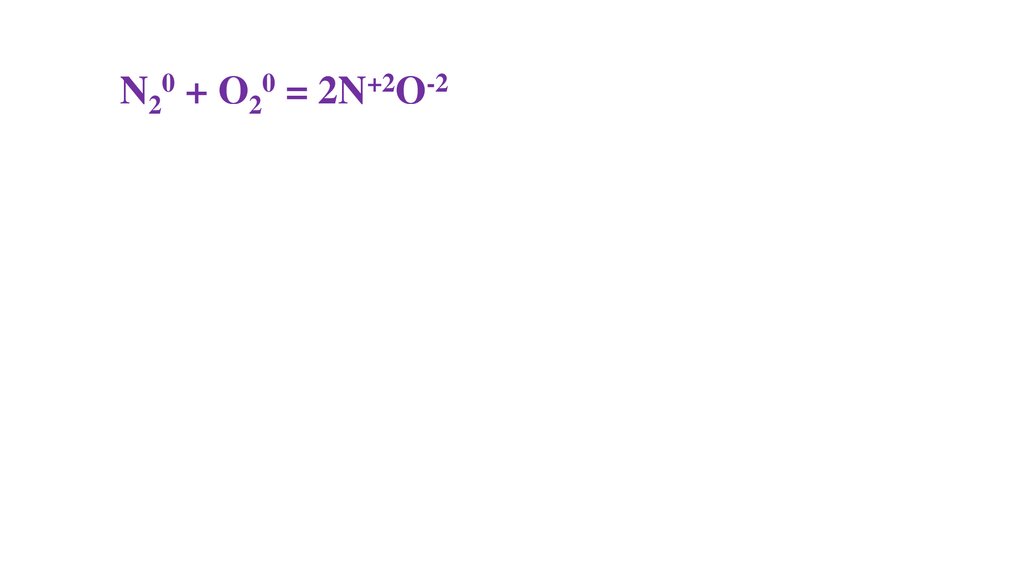
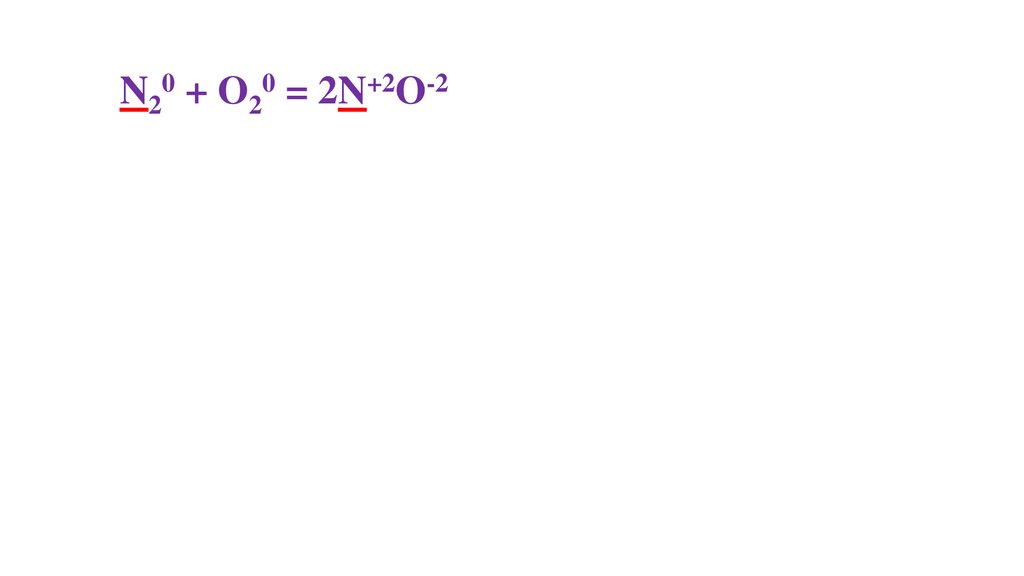
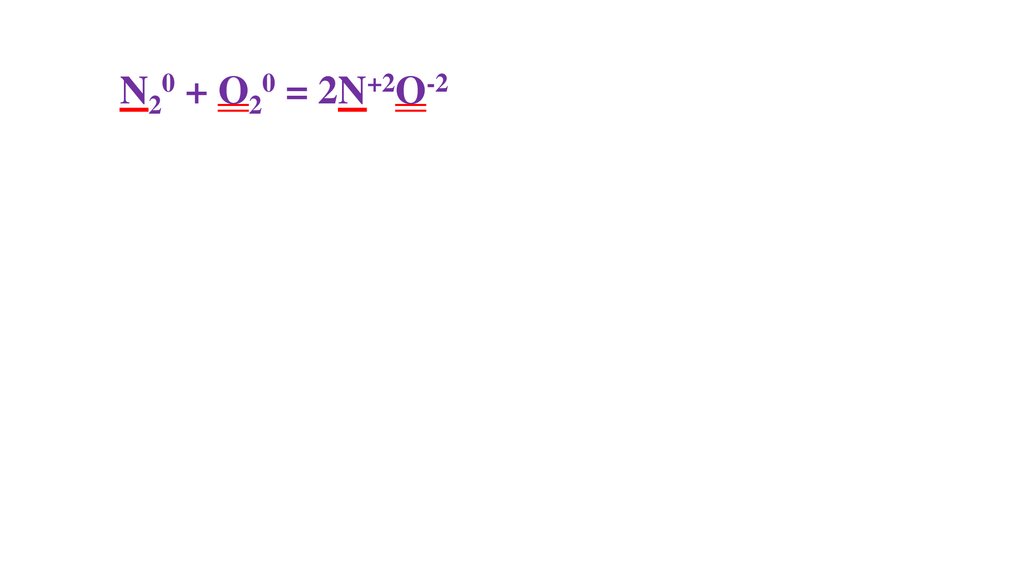
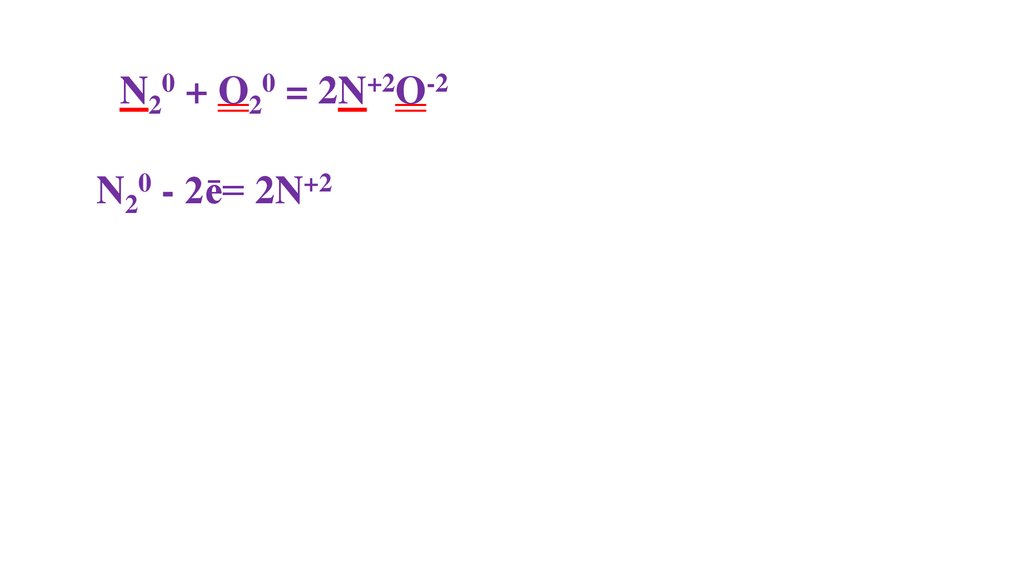
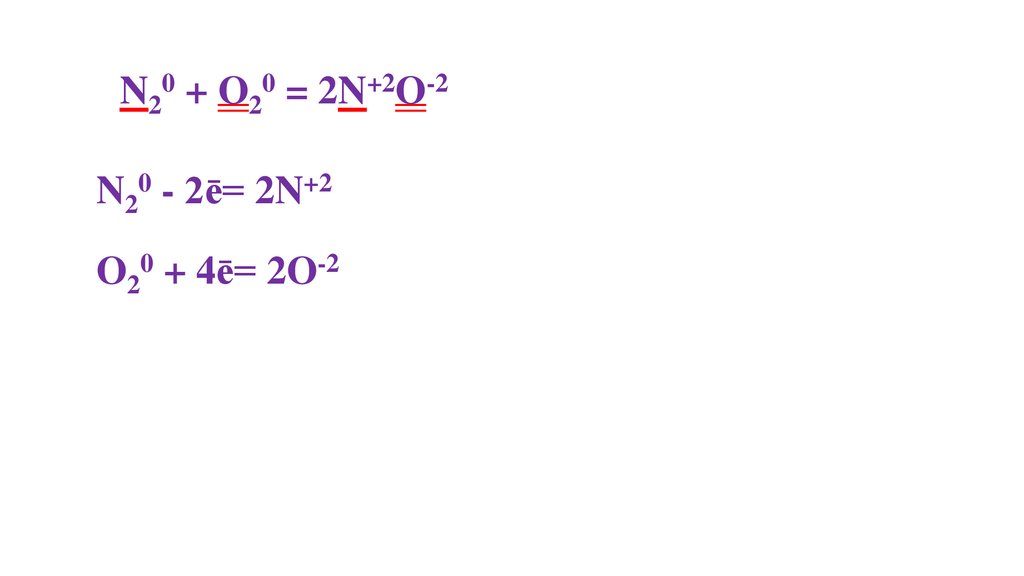
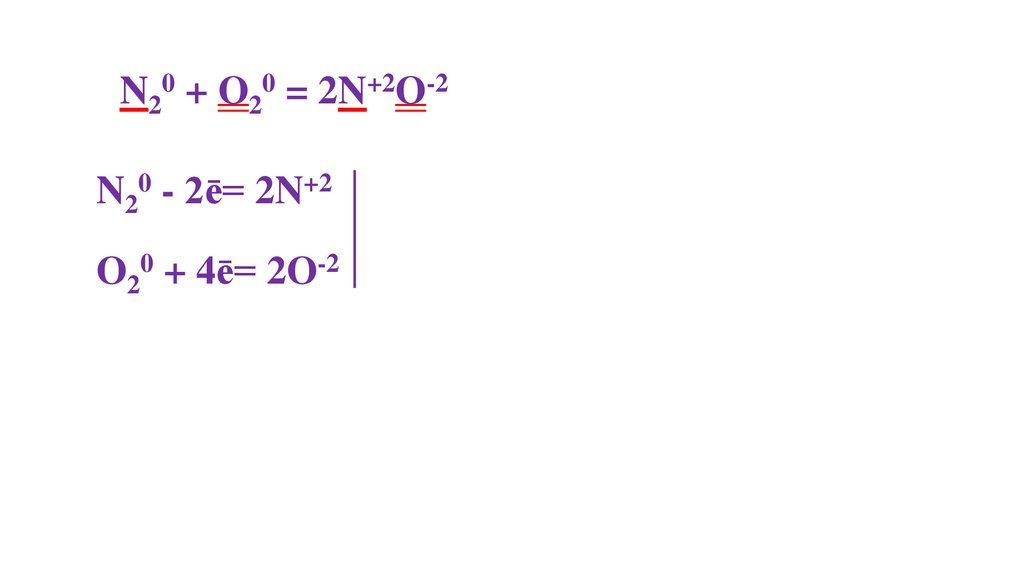
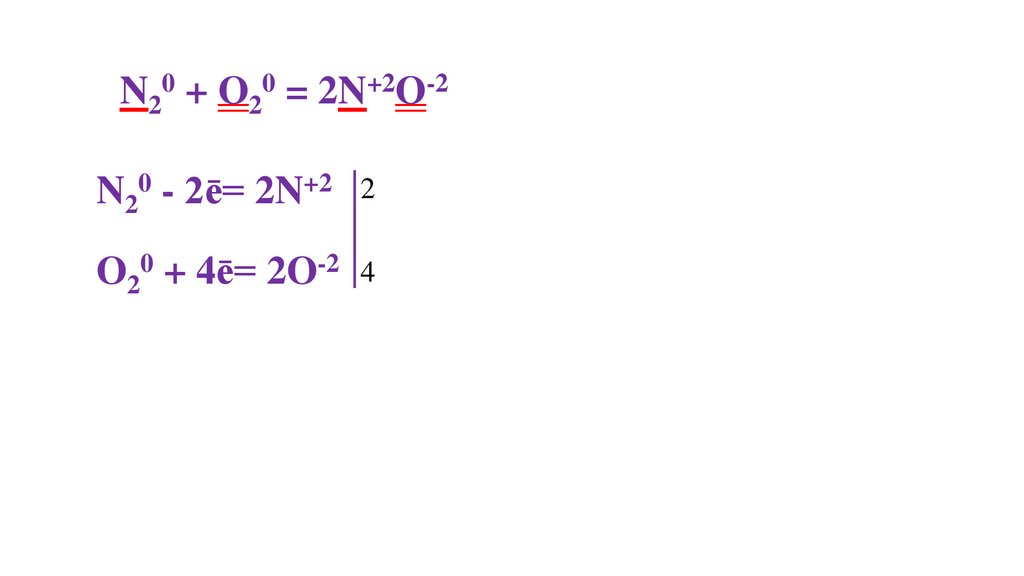
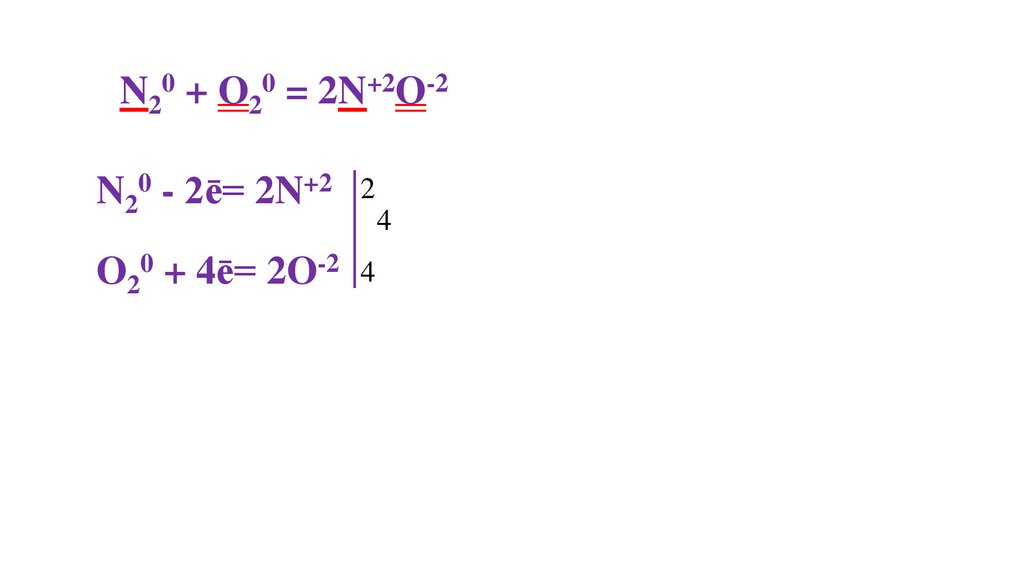
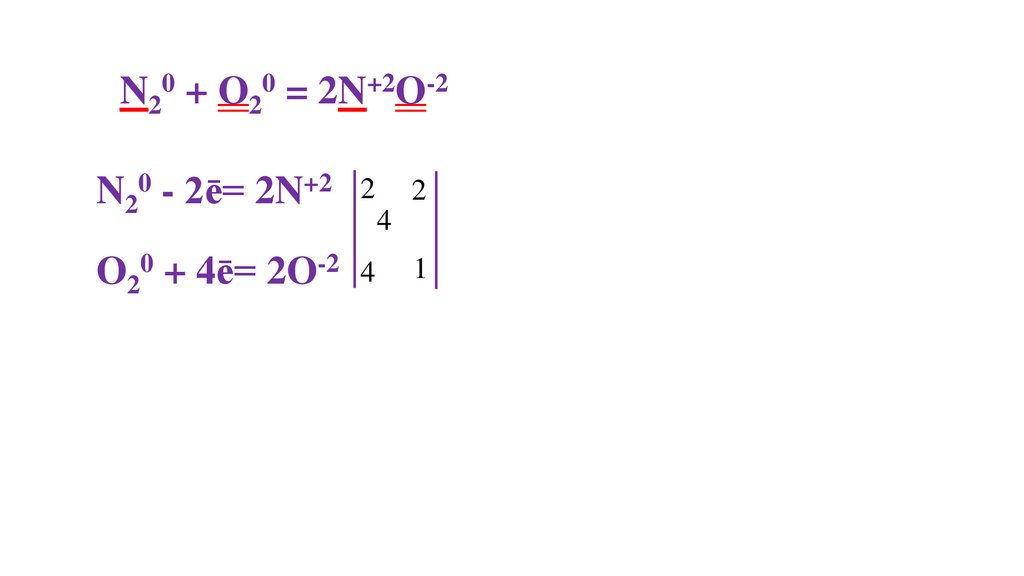
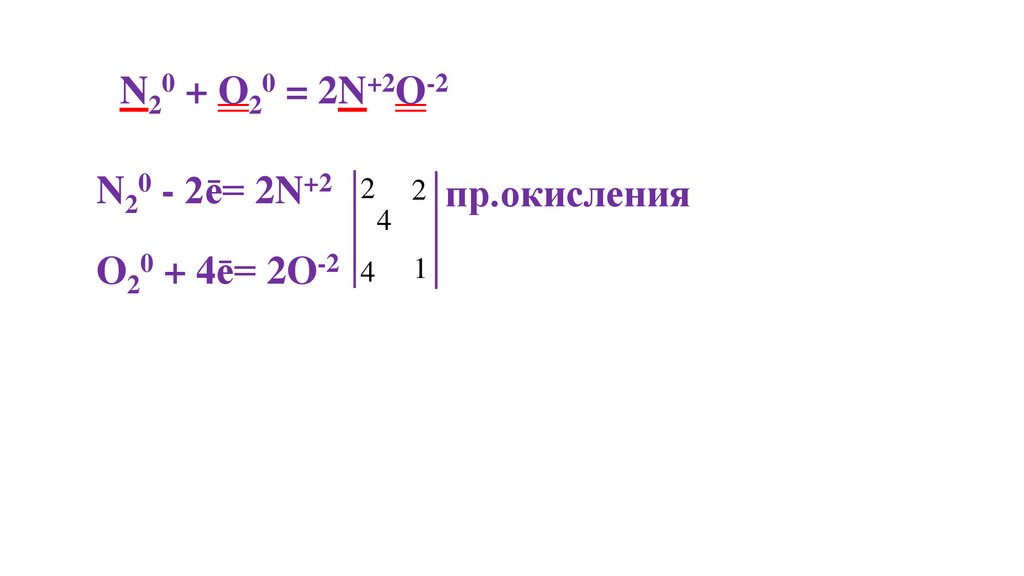


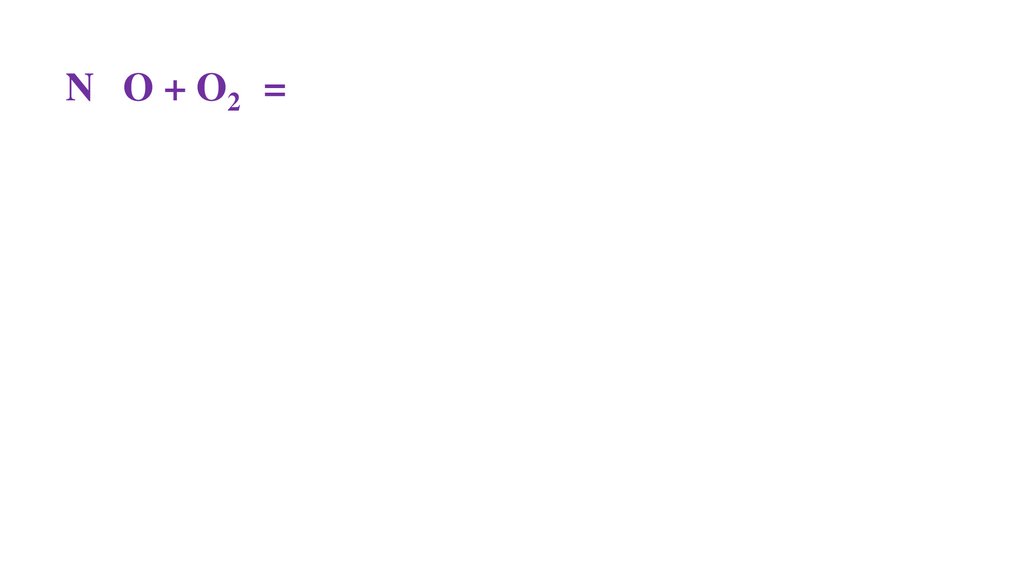
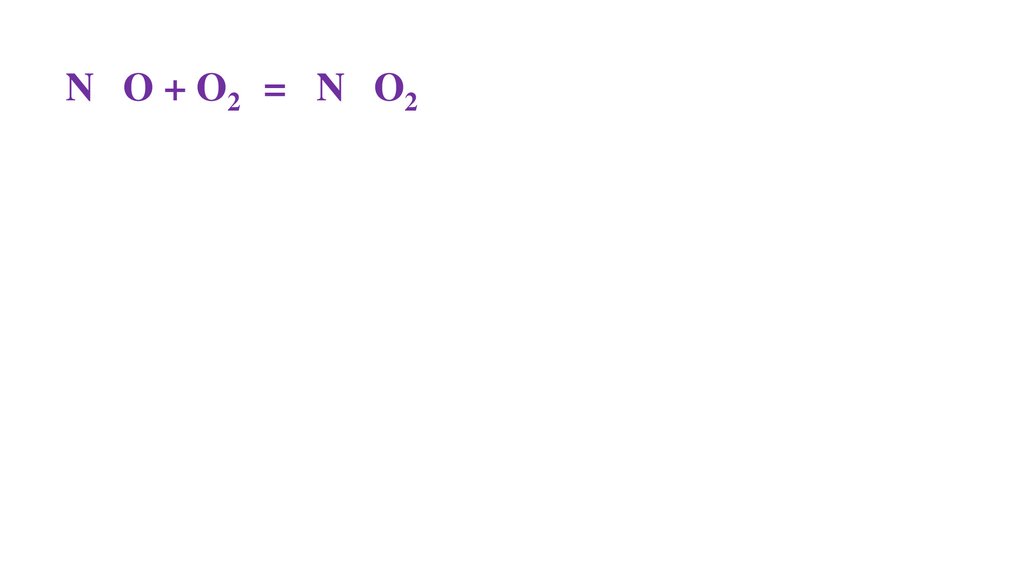
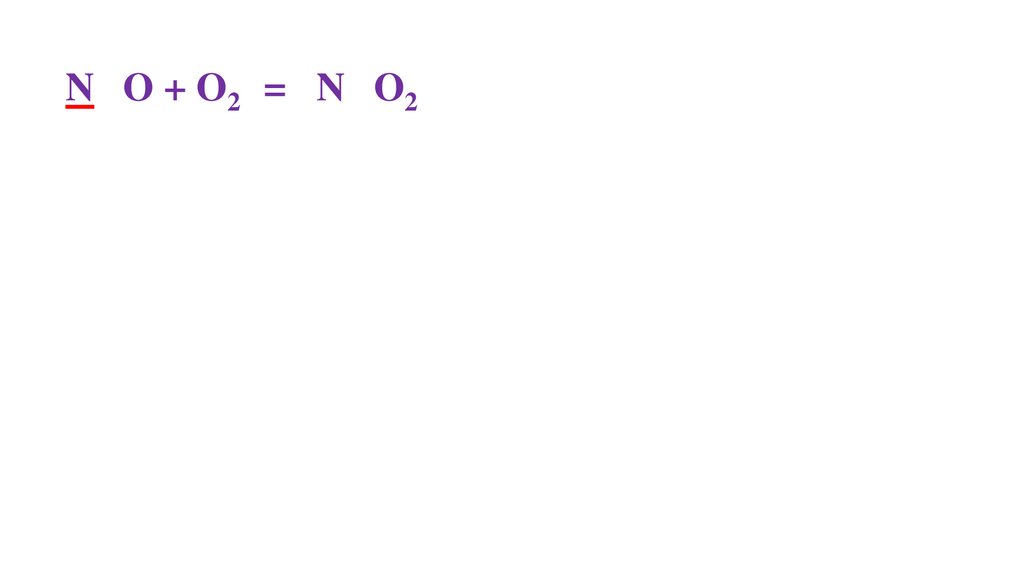
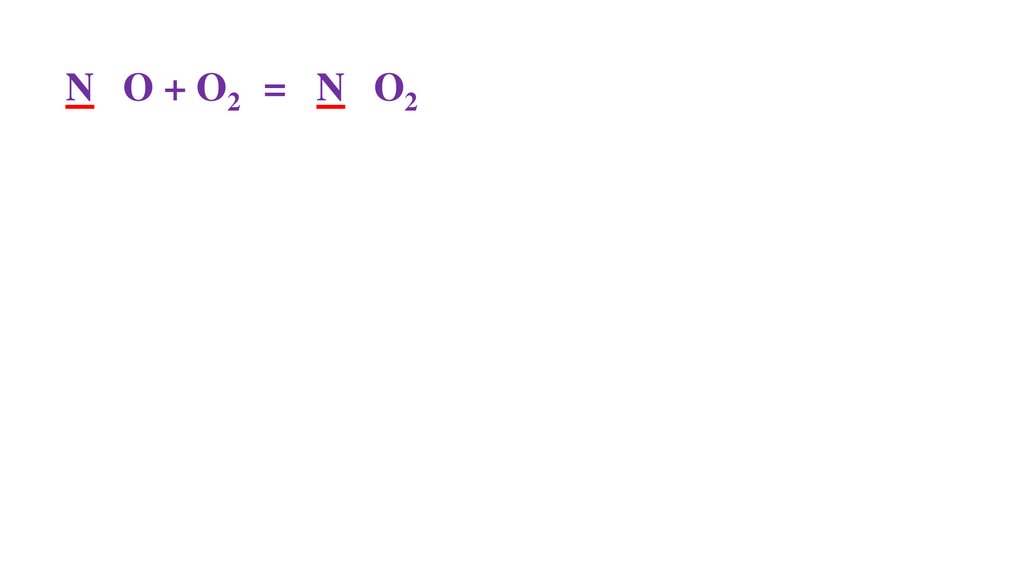
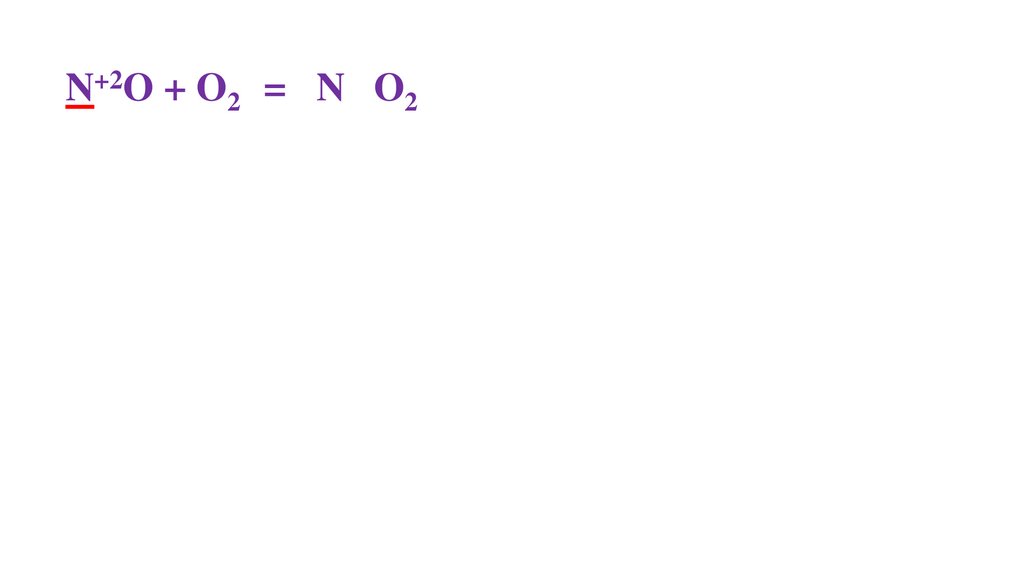
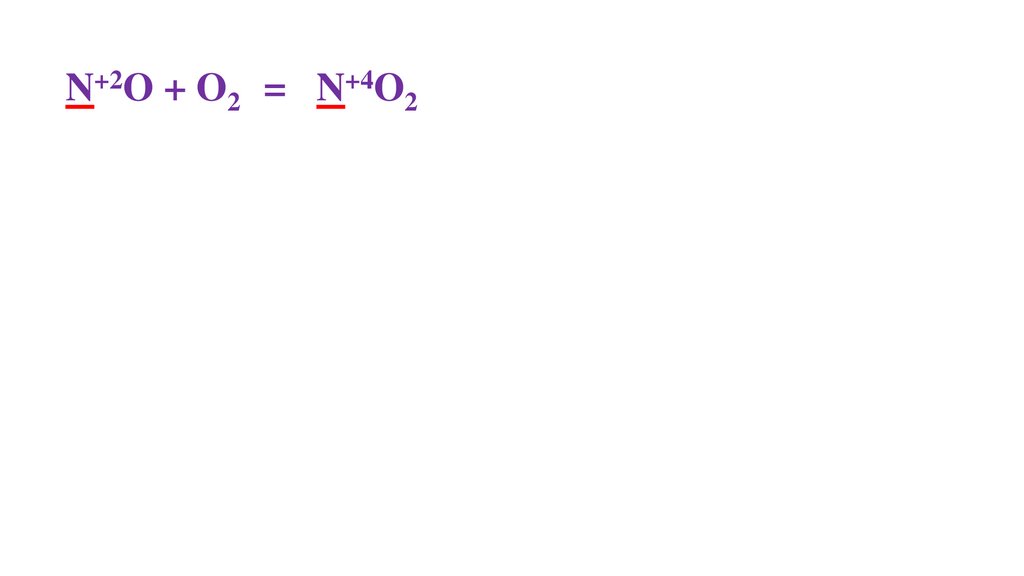
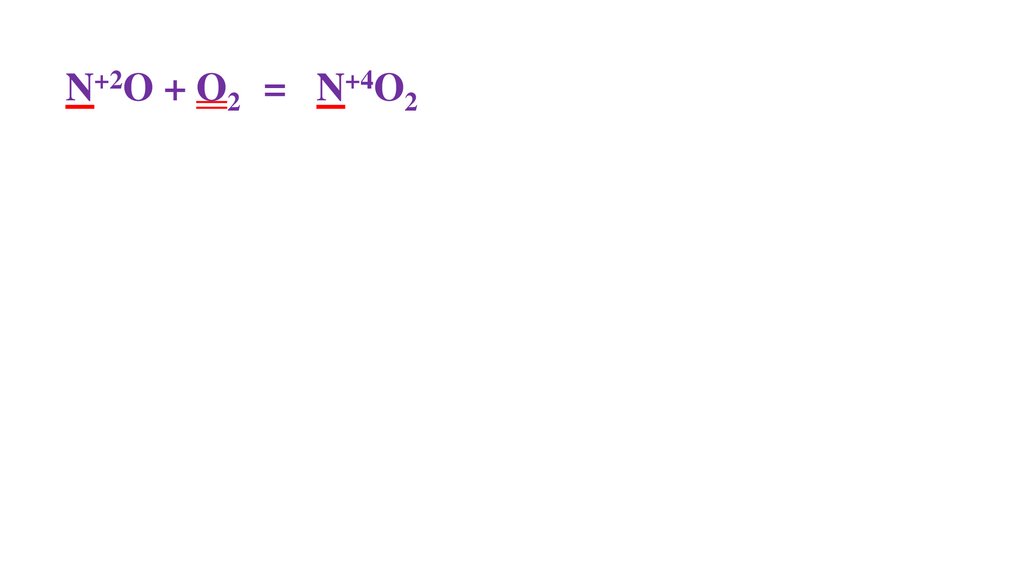
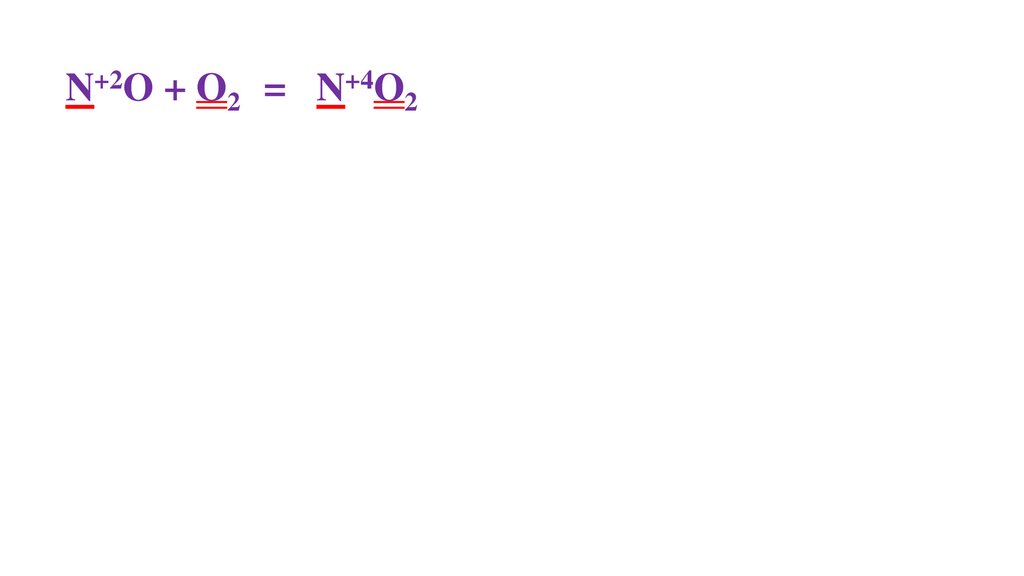
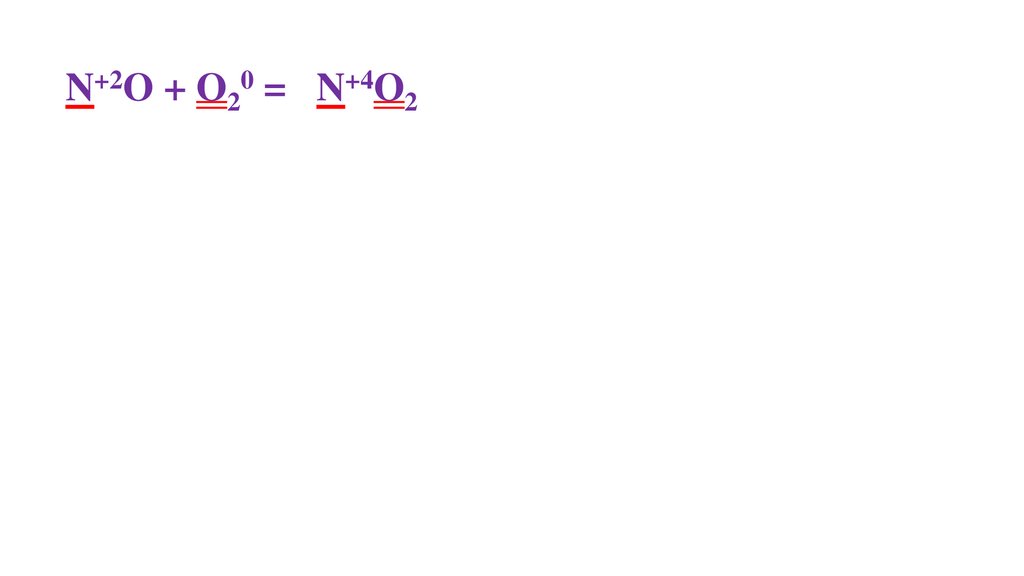
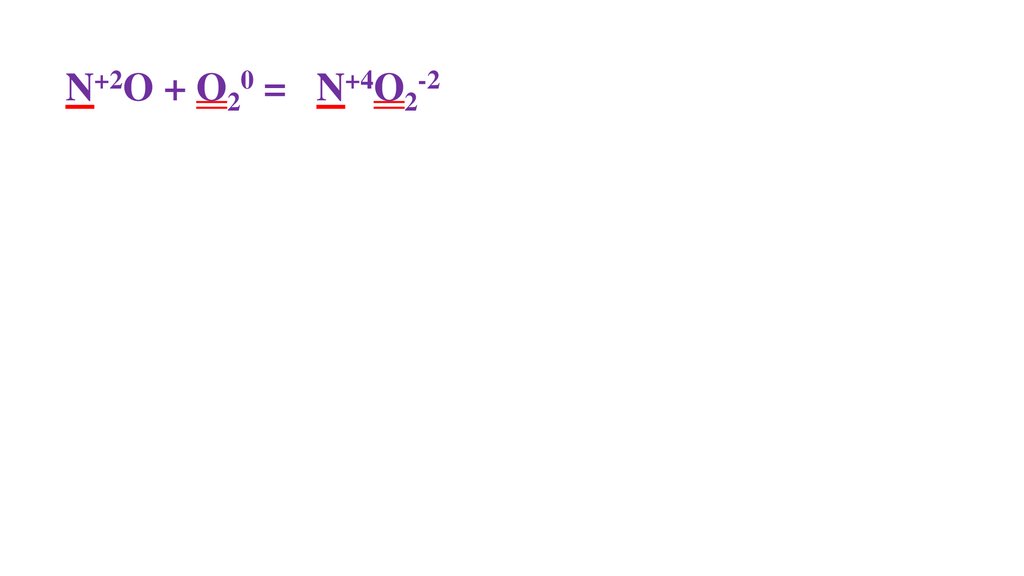
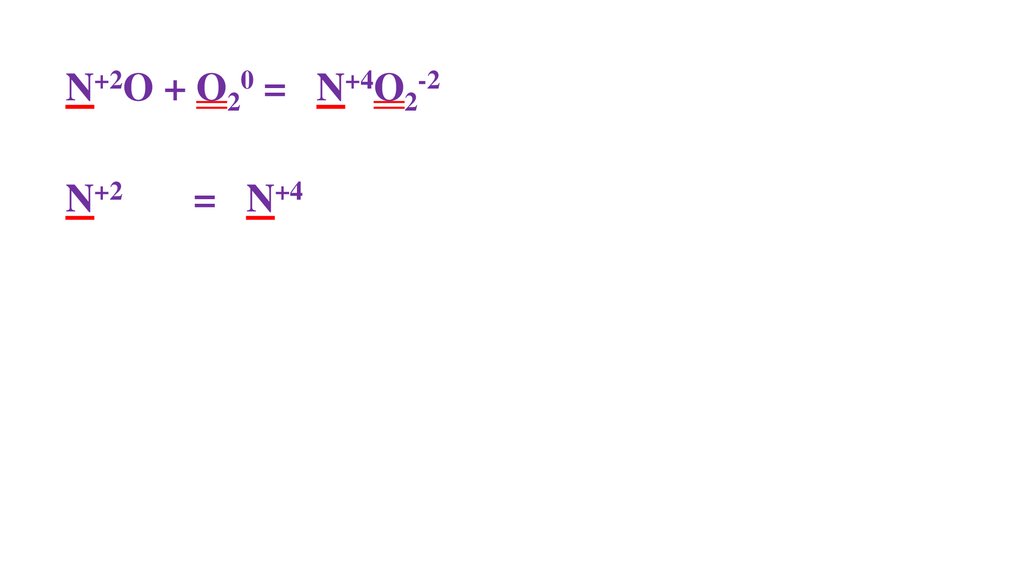
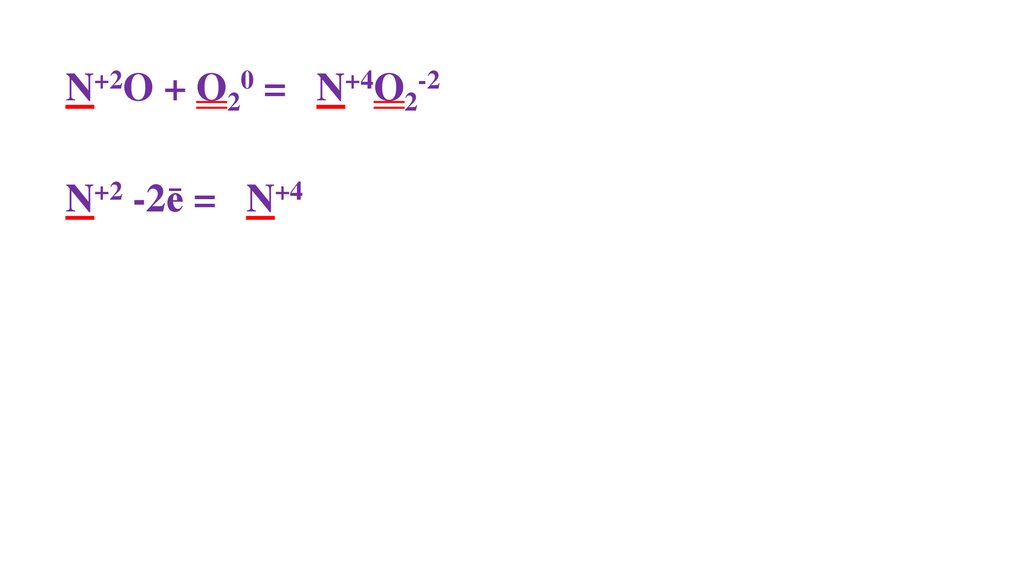
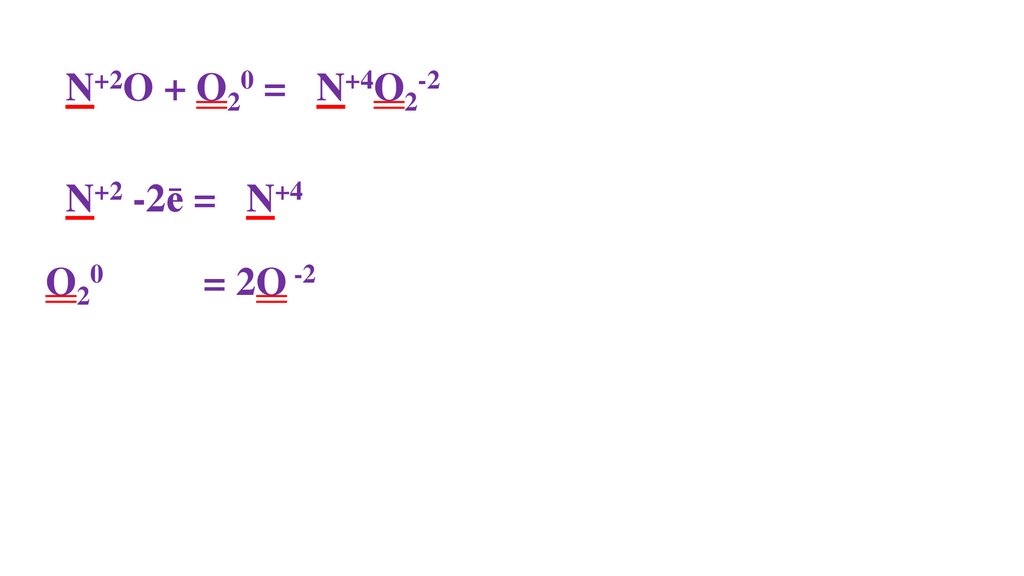
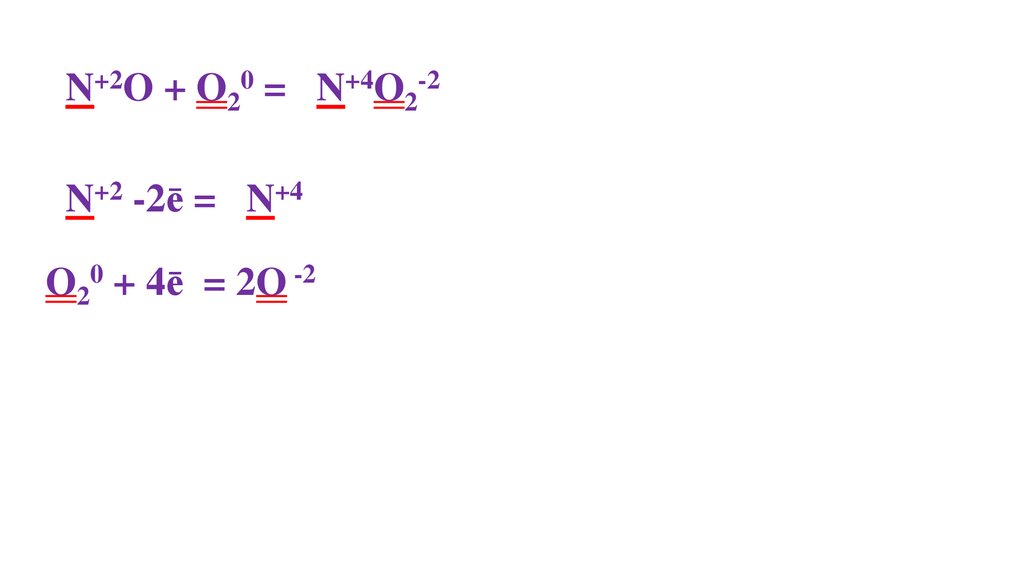
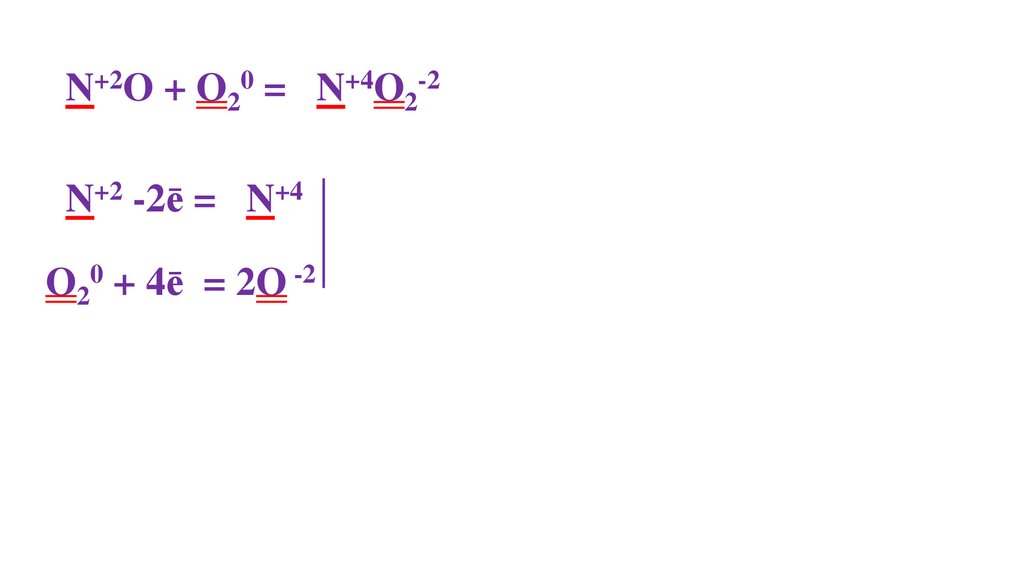
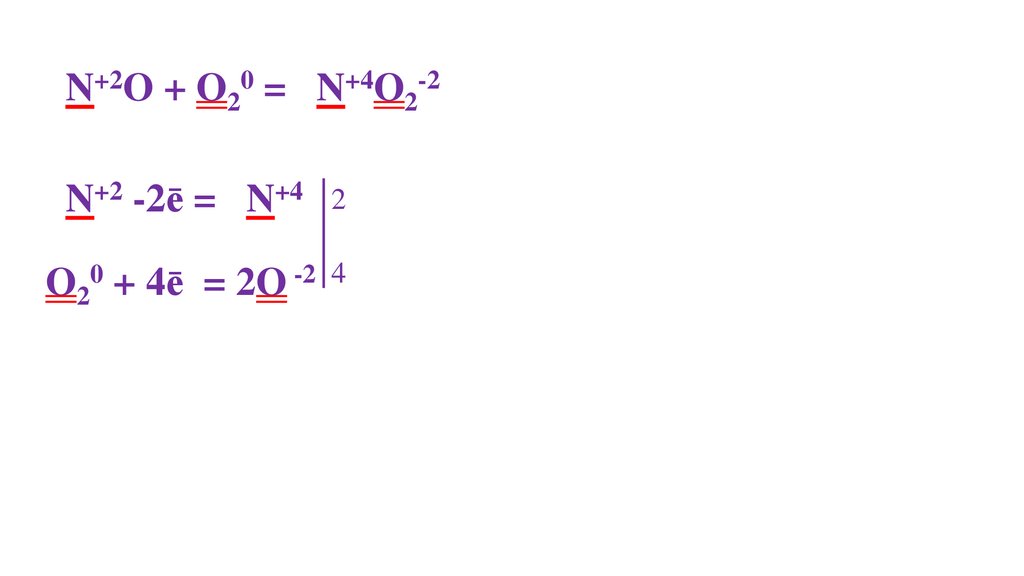
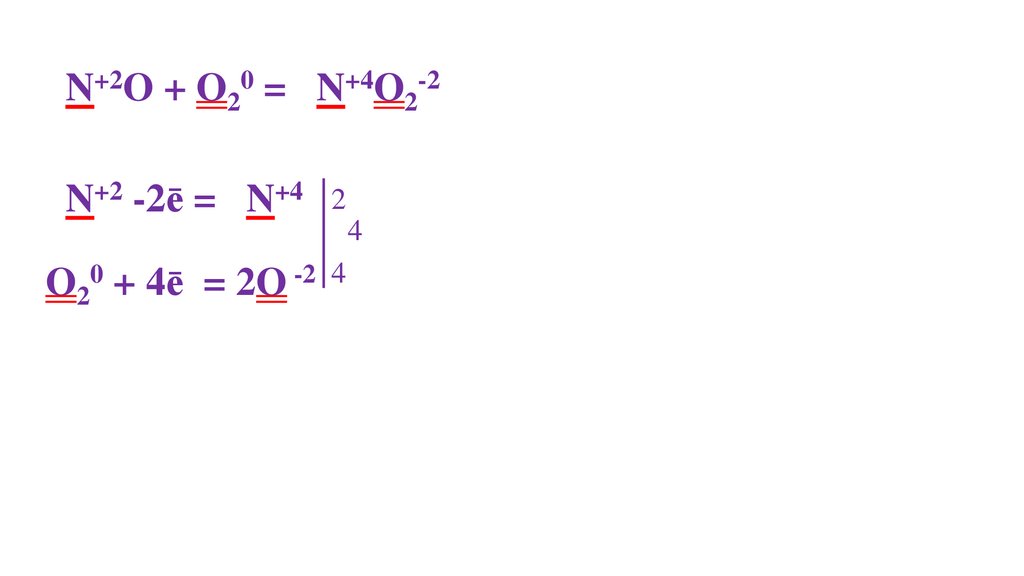
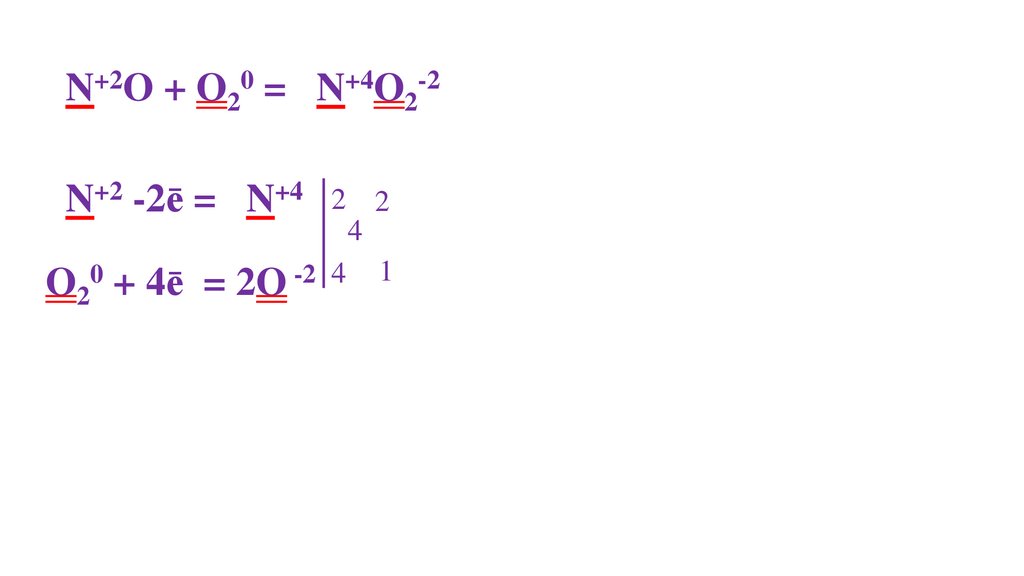
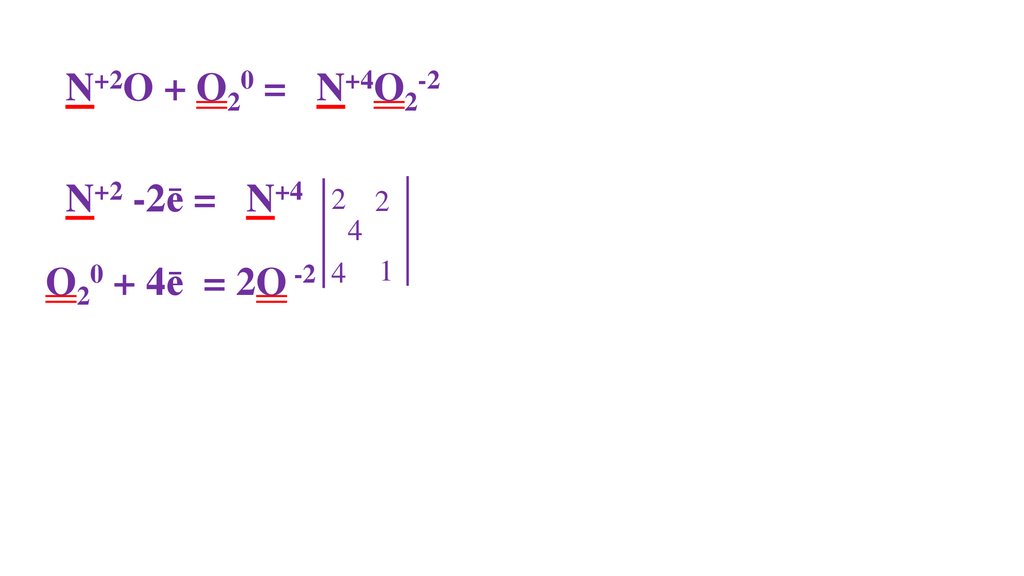
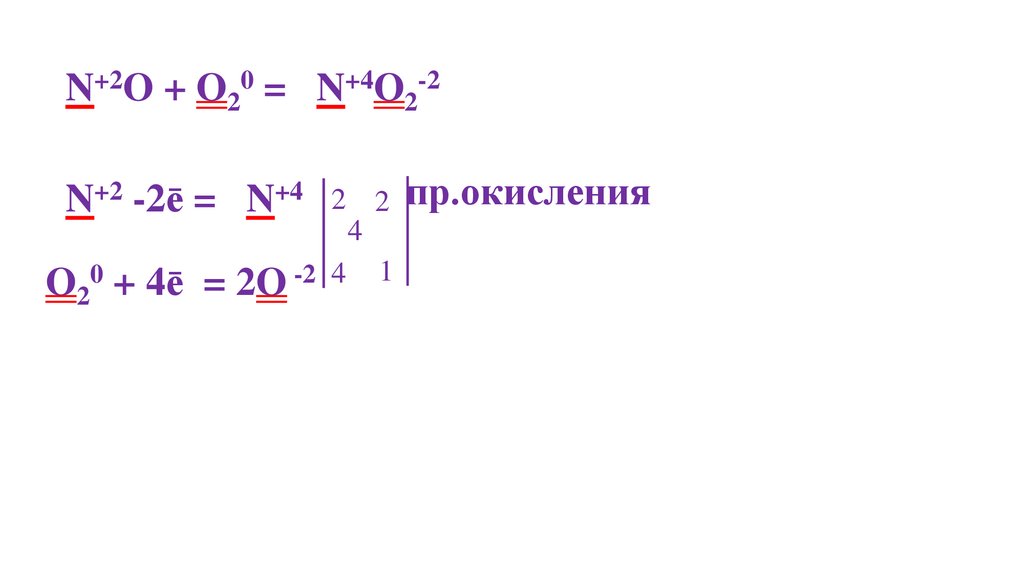



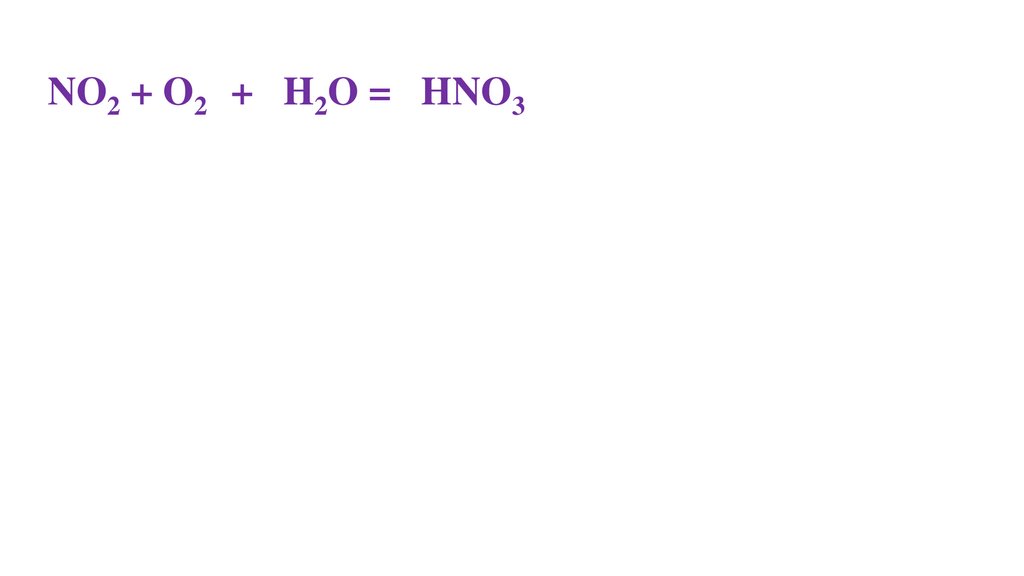








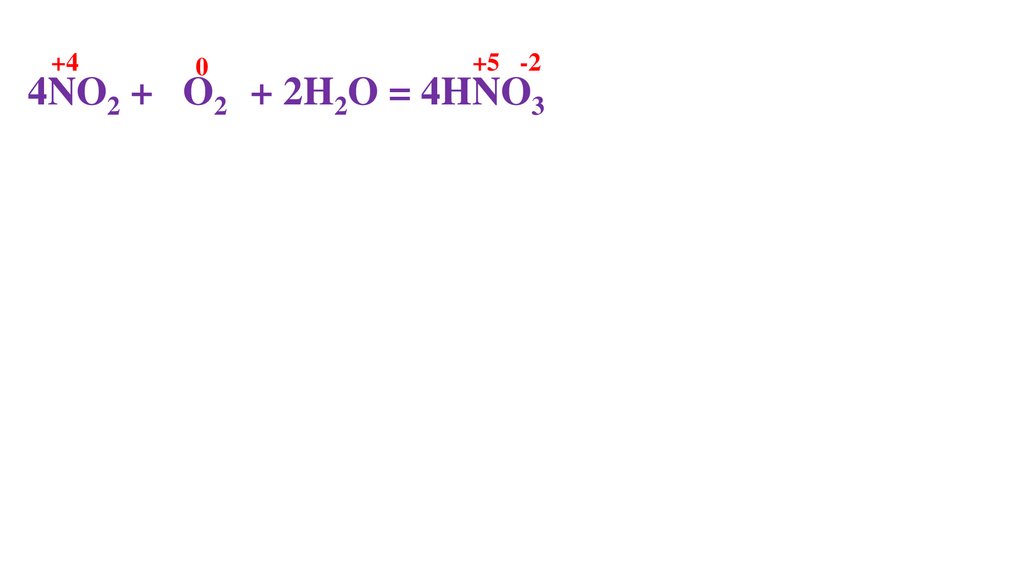
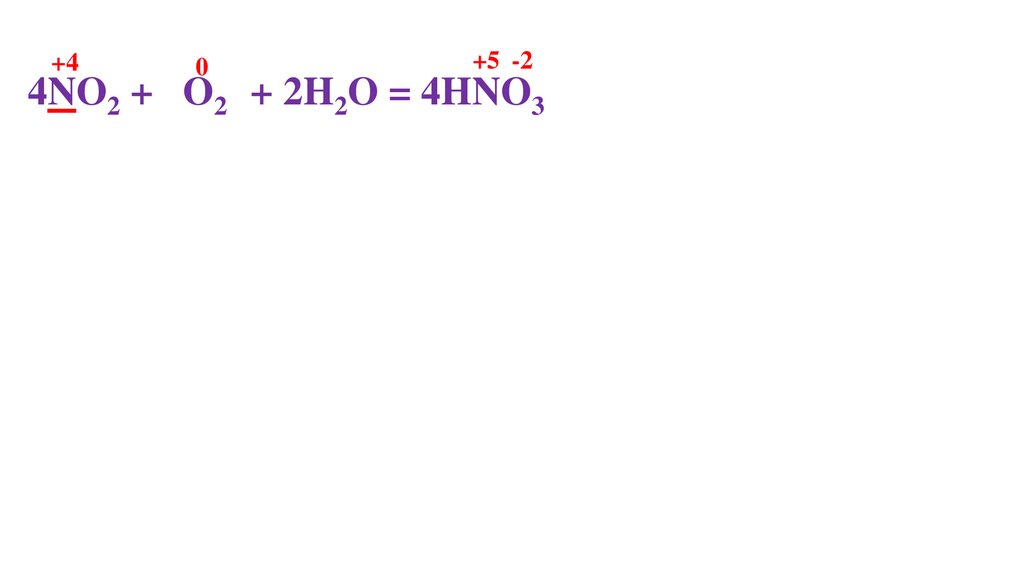
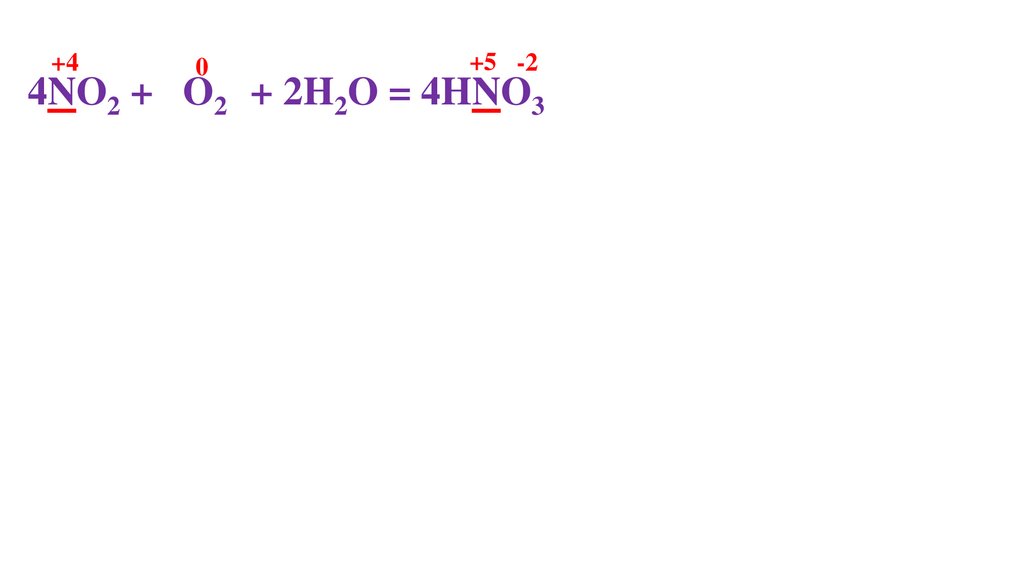
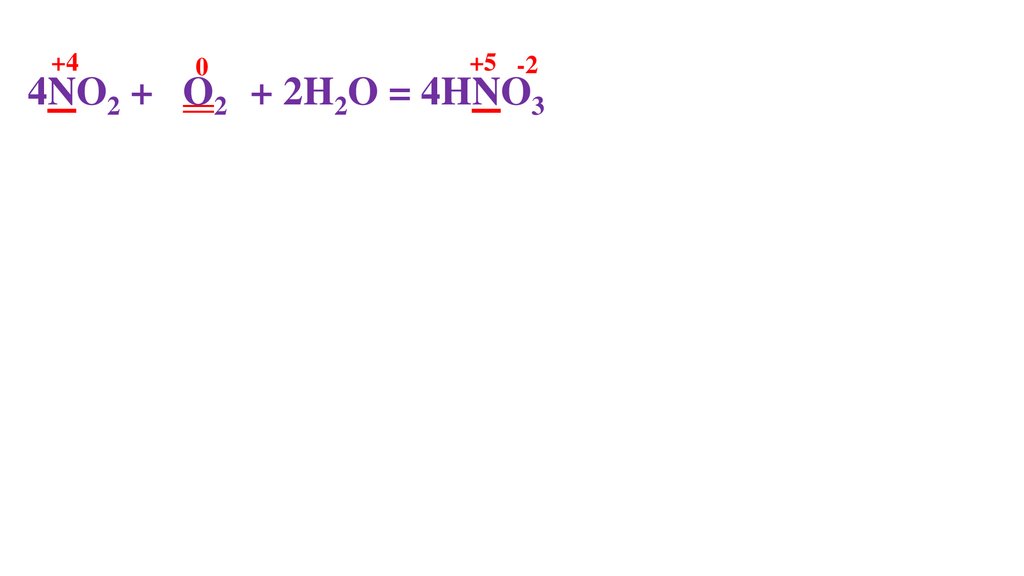
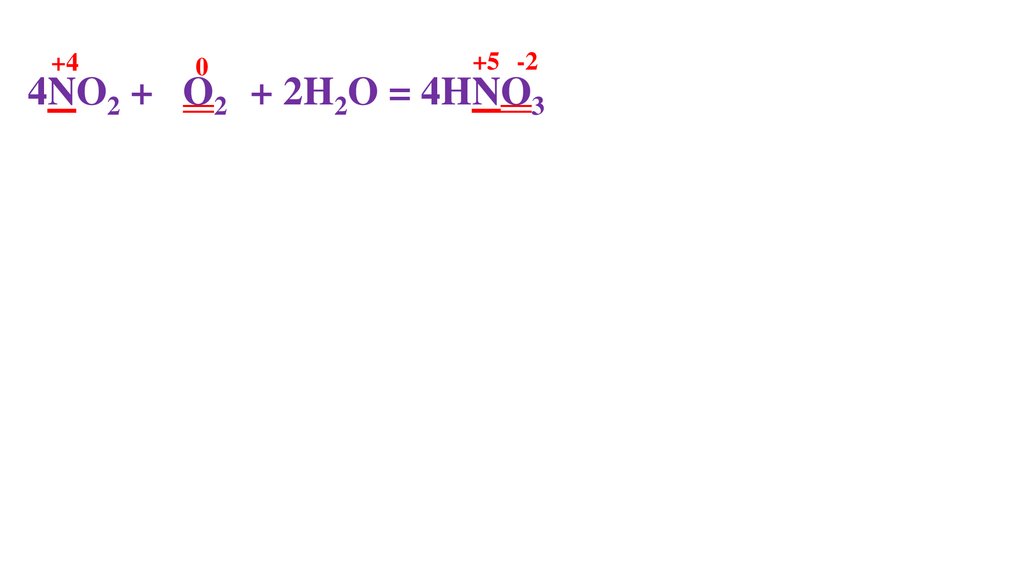
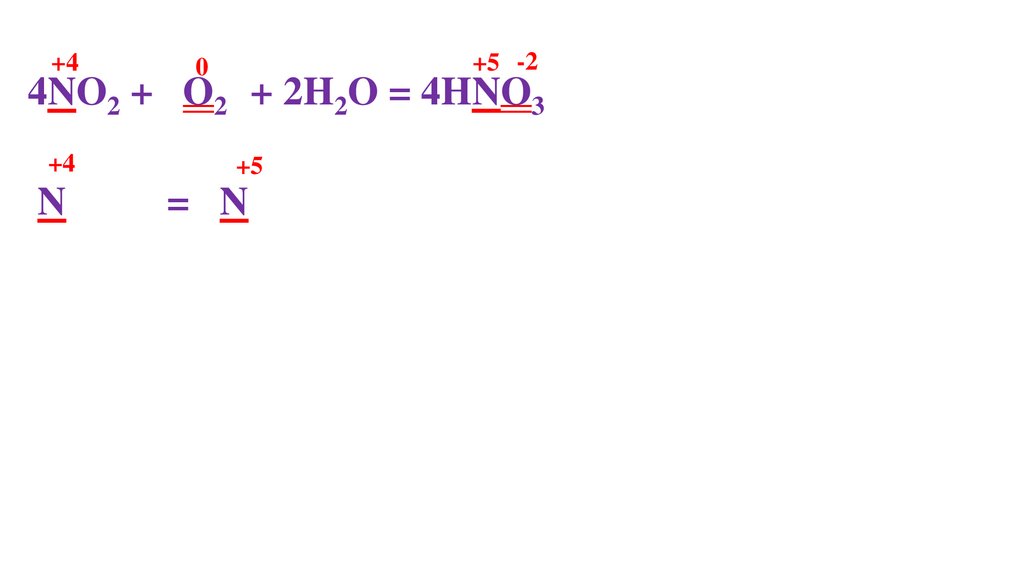
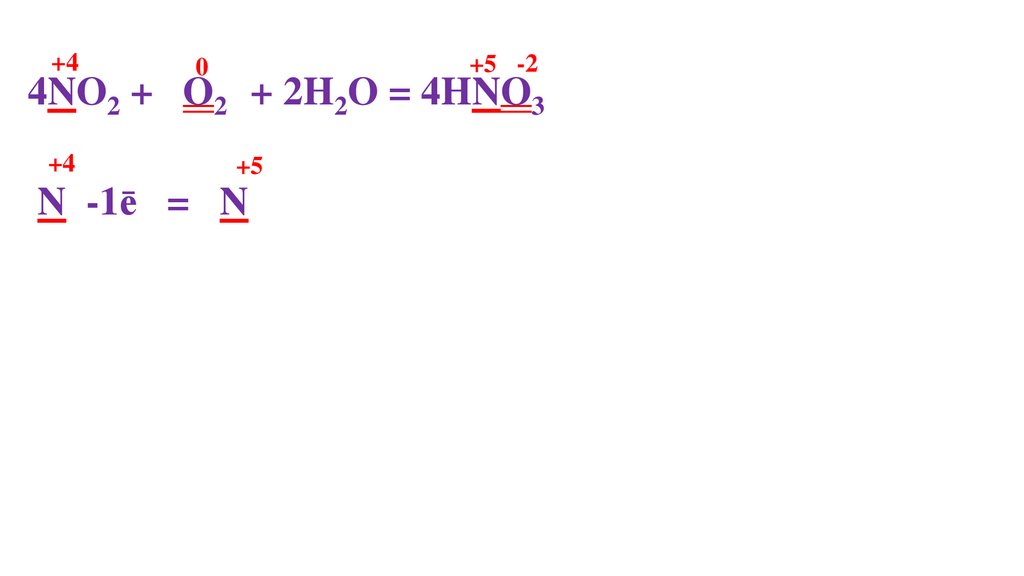
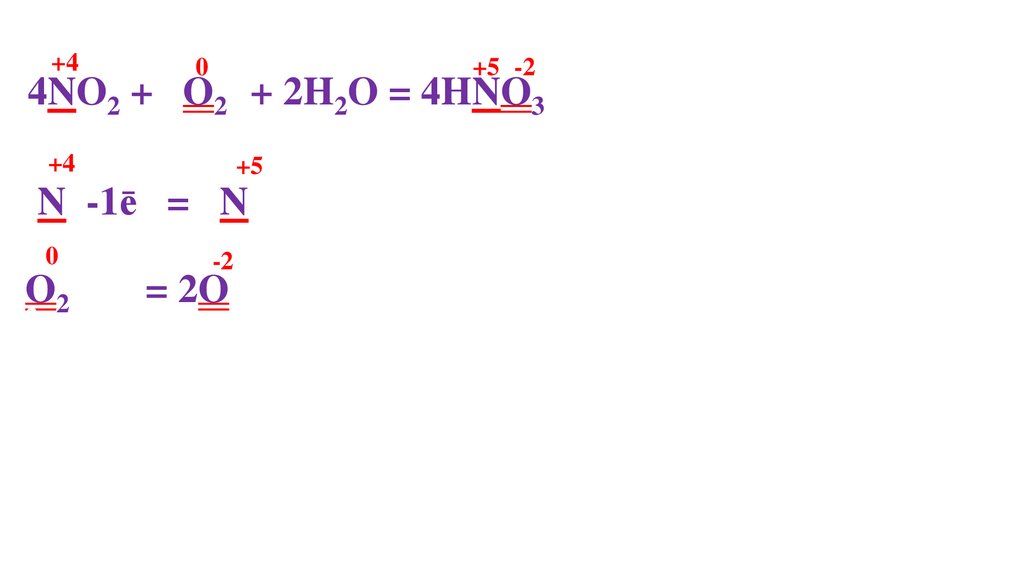

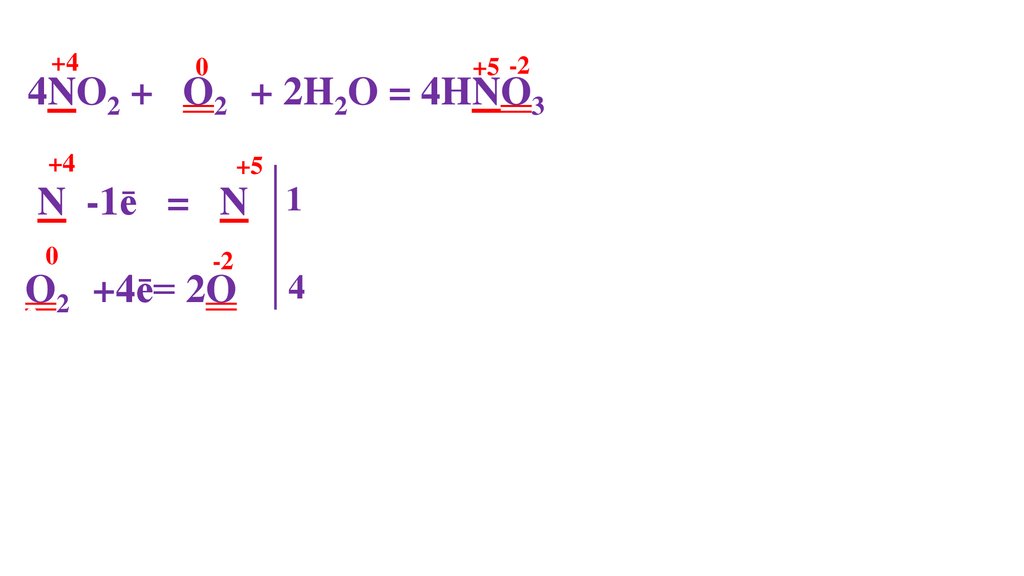
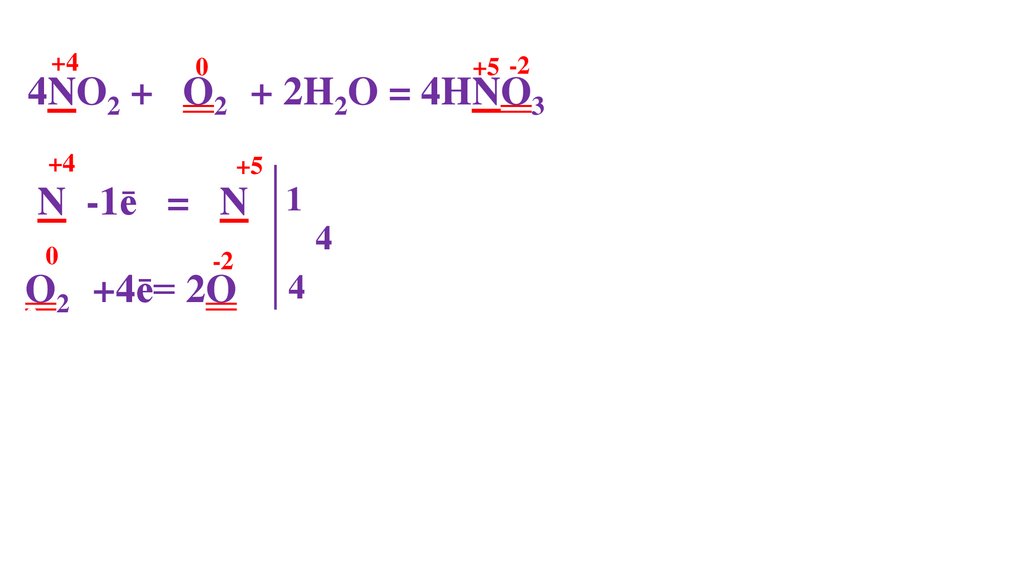
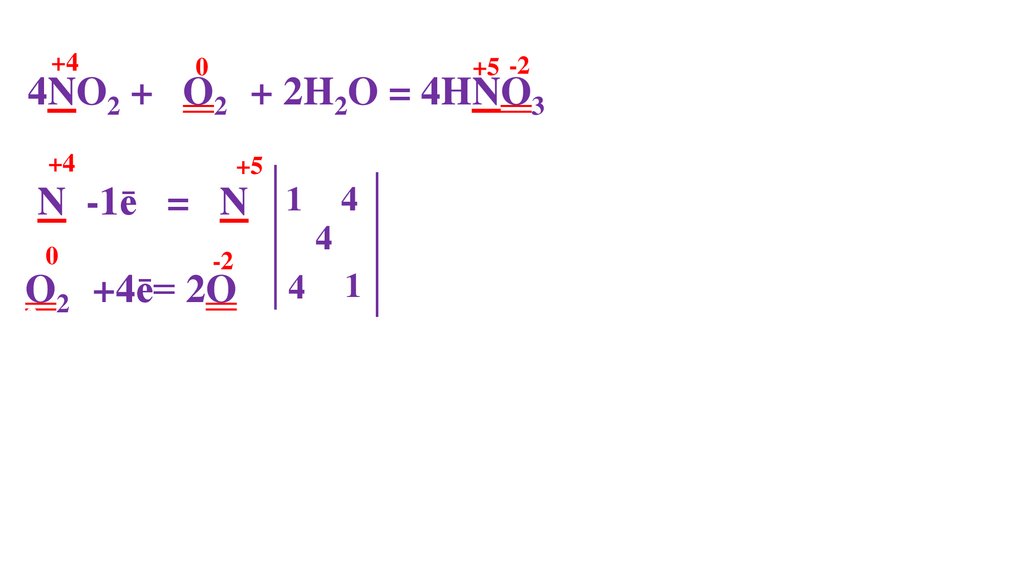












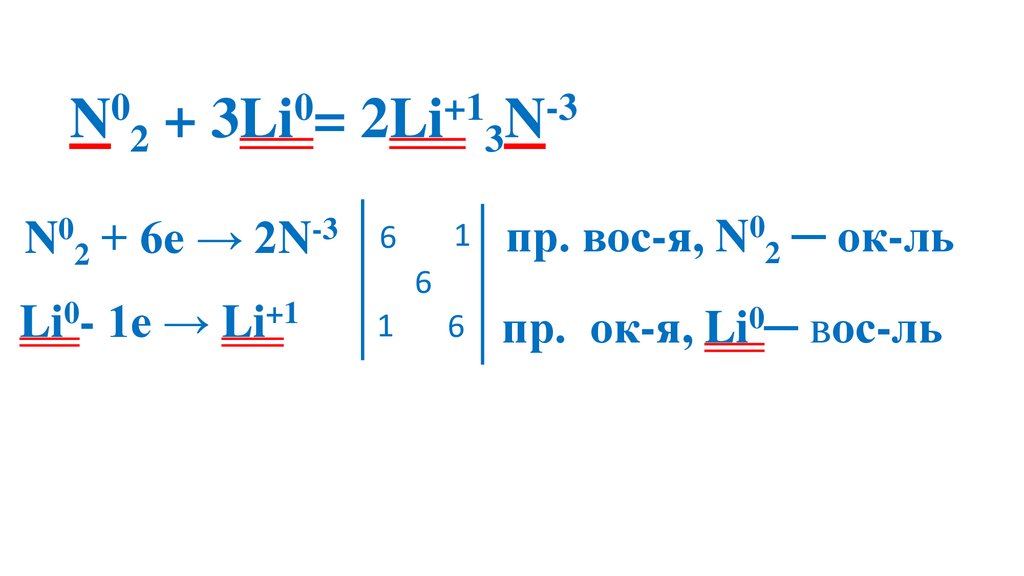
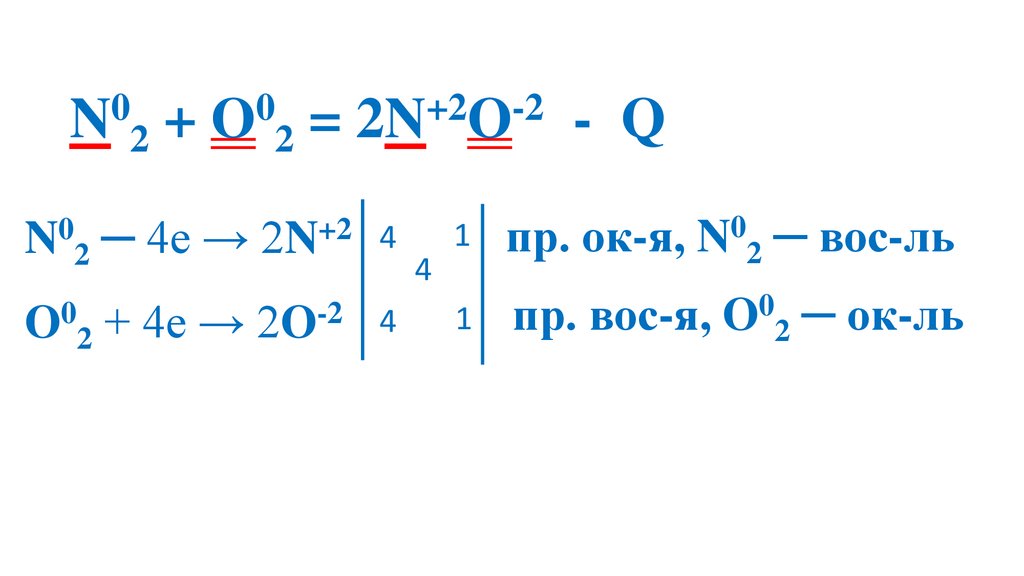

 Химия
Химия








