Похожие презентации:
2024_Аммиак_МОЙ
1.
§17.Аммиак.Соли аммония
2.
Цель урока.Формирование умений характеризовать строение молекул,
физические и химические свойства аммиака и солей
аммония, их распознавание; лабораторное и
промышленное получение аммиака; применение аммиака и
солей аммония.
Проблемный вопрос урока
Какими особенными физическими и химическими
свойствами обладают аммиак и соли аммония? Как можно
распознать аммиак и соли аммония? Как можно получить
аммиак в лаборатории?
3.
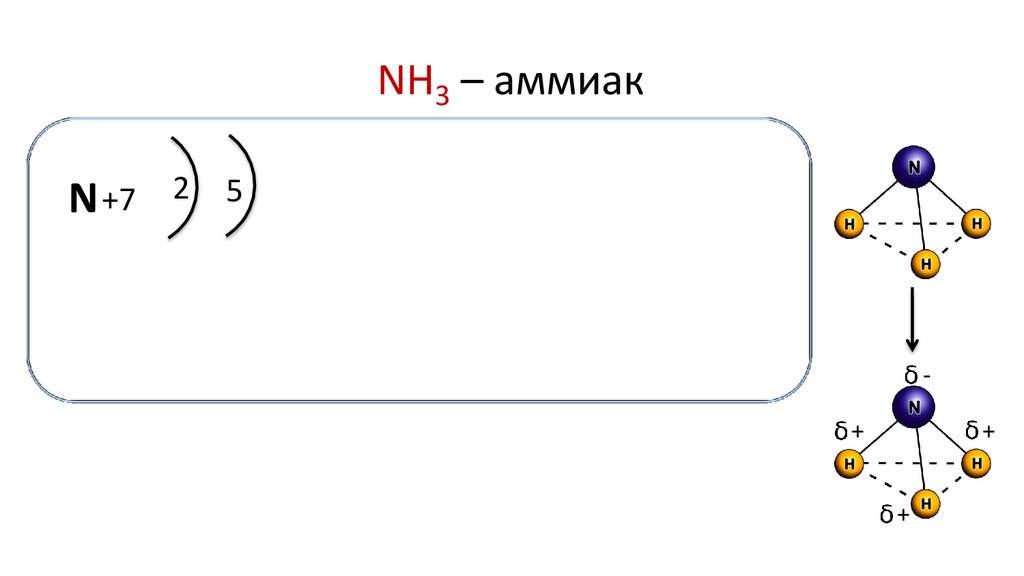
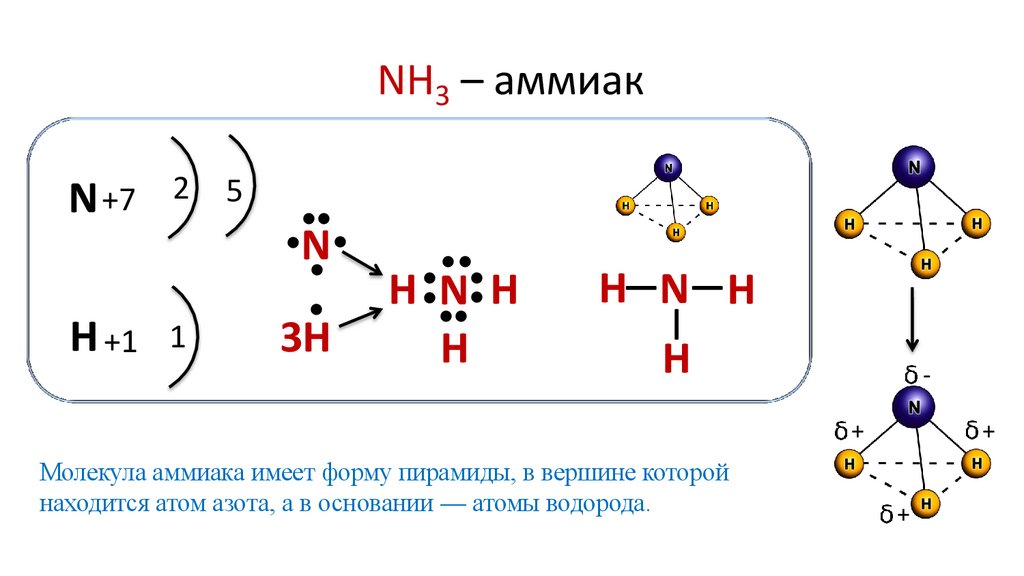
NH3 – аммиакN +7
2
5
+
+
+
4.
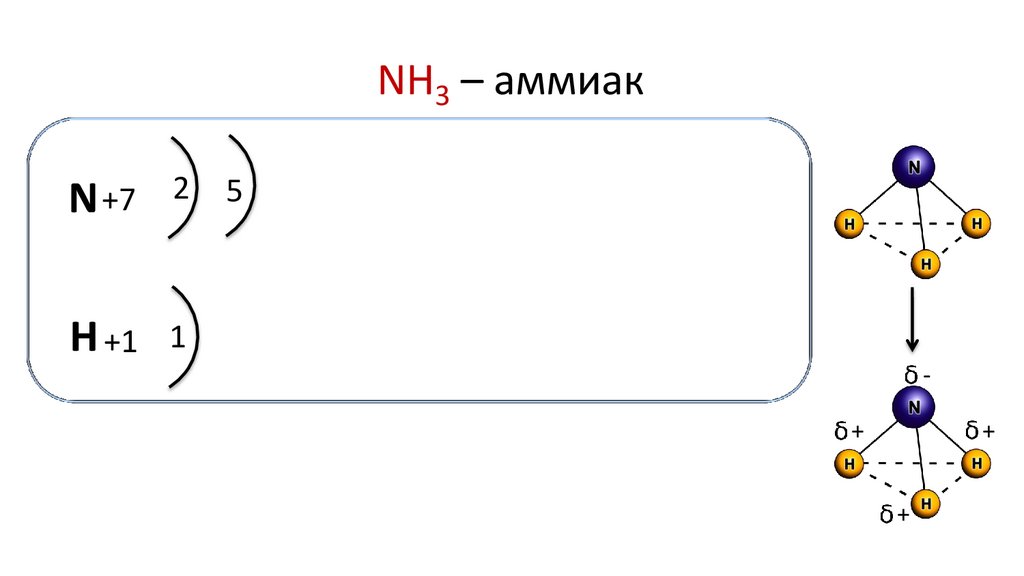
NH3 – аммиакN +7
2
5
H +1 1
+
+
+
5.
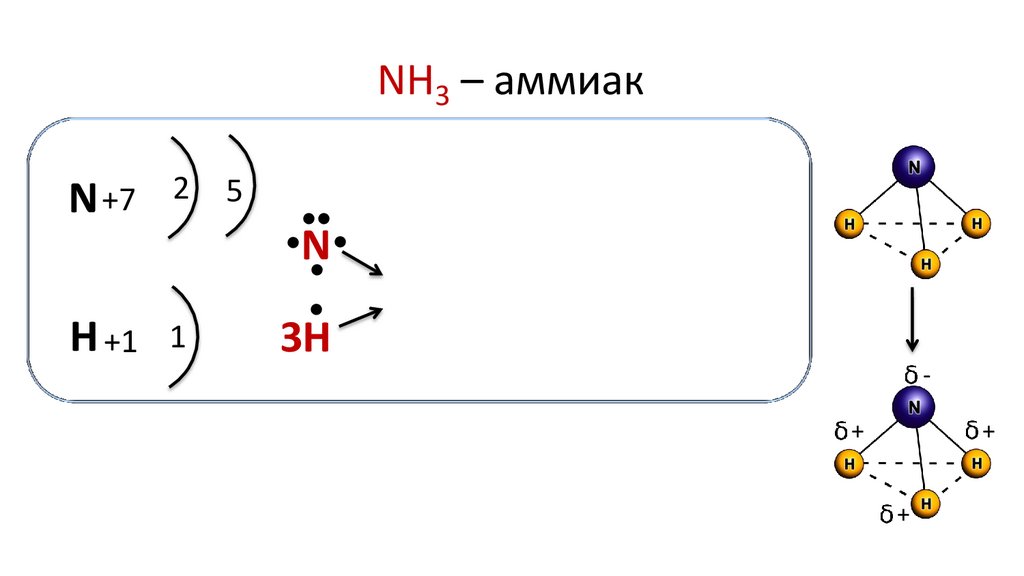
NH3 – аммиакN +7
2
5
●
●
N
H +1 1
3H
+
+
+
6.
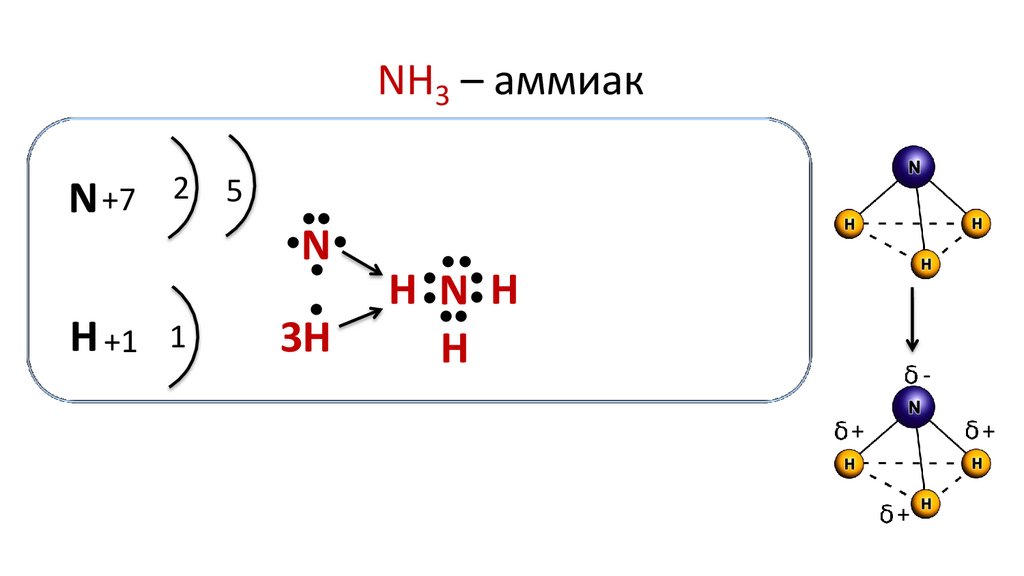
NH3 – аммиакN +7
2
5
●
●
N
H +1 1
3H
●
●
H N H
H
+
+
+
7.
NH3 – аммиакN +7
2
5
●
●
N
3H
●
●
H N H
H
H—N— H
—
H +1 1
H
+
Молекула аммиака имеет форму пирамиды, в вершине которой
находится атом азота, а в основании — атомы водорода.
+
+
8.
АммиакАммиак ― бесцветный газ с резким запахом.
Почти в два раза легче воздуха.
В 1 объёме воды растворяется 700 объёмов аммиака.
10%-ый раствор аммиака называется
нашатырным спиртом.
9.
АммиакАммиак нельзя вдыхать продолжительное время, так
как он ядовит.
Легко сжижается при обычном давлении и температуре
-33,4 0С.
Аммиак используют в холодильных установках.
10.
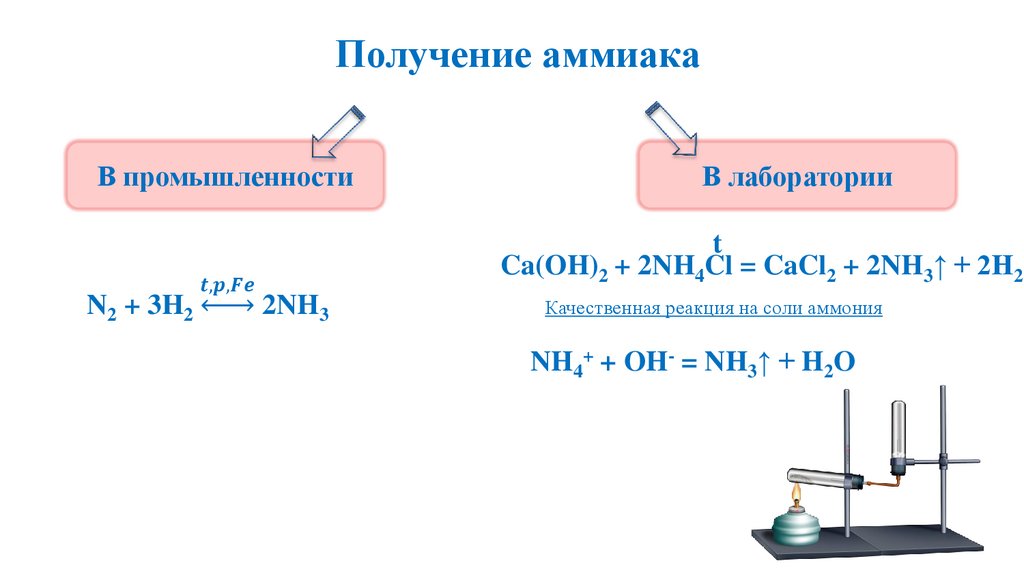
Получение аммиака11.
NH3 + H2O = NH3 · H2O Раствор аммиака в воде имеетNH3 · H2O ↔ NH4+ + OH- щелочную среду.
12.
Взаимодействие аммиакас кислотами
13.
Химические свойства аммиака1. Реакции с кислотами
NH3 + HCl = NH4Cl
NH3 + HNO3 = NH4NO3
NH3 + H2SO4 = (NH4)2SO4
Катион аммония выступает в роли катиона металла.
14.
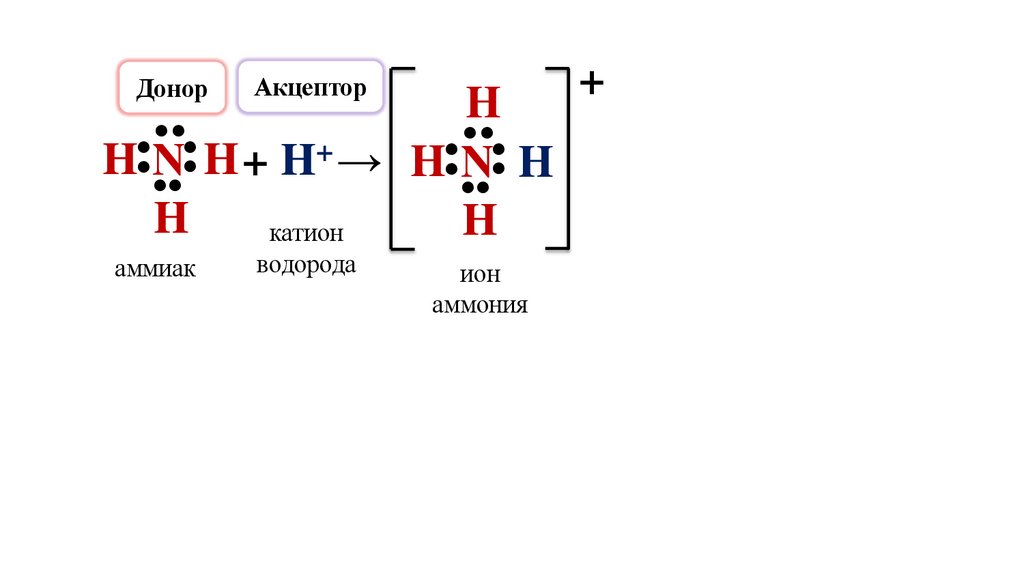
ДонорАкцептор
●
●
H N H + H+ →
H
катион
аммиак
водорода
15.
ДонорАкцептор
аммиак
водорода
H
●
●
●
H●●N●● H + H+ → H●●N●●● H
H
H
катион
ион
аммония
+
16.
ДонорАкцептор
H
●
●
●
H●●N●● H + H+ → H●●N●●● H
H
H
катион
аммиак
водорода
ион
аммония
+
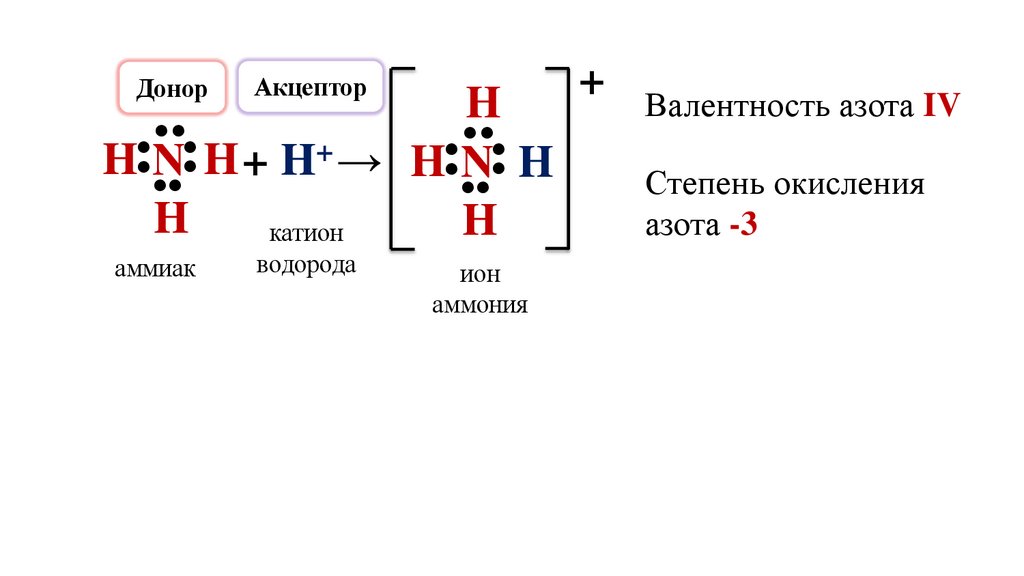
Валентность азота IV
Степень окисления
азота -3
17.
ДонорАкцептор
H
●
●
●
H●●N●● H + H+ → H●●N●●● H
H
H
катион
аммиак
водорода
+
Валентность азота IV
Степень окисления
азота -3
ион
аммония
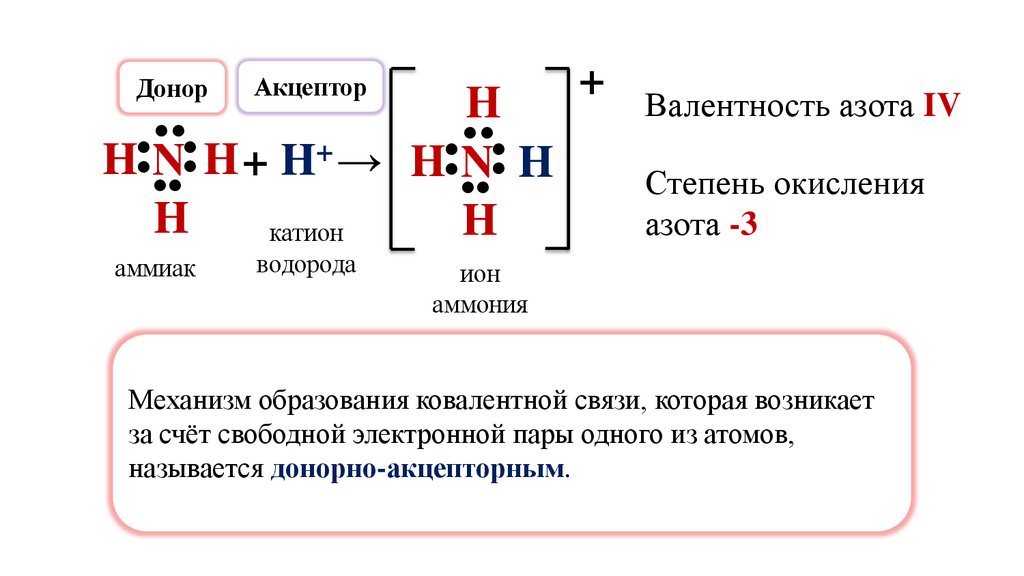
Механизм образования ковалентной связи, которая возникает
за счёт свободной электронной пары одного из атомов,
называется донорно-акцепторным.
18.
NH4NO3 – нитрат аммония(NH4)2SO4– сульфат аммония
(NH4)2CO3– карбонат аммония
Твёрдые кристаллические вещества.
Хорошо растворимые в воде.
Соли аммония схожи с солями калия.
19.
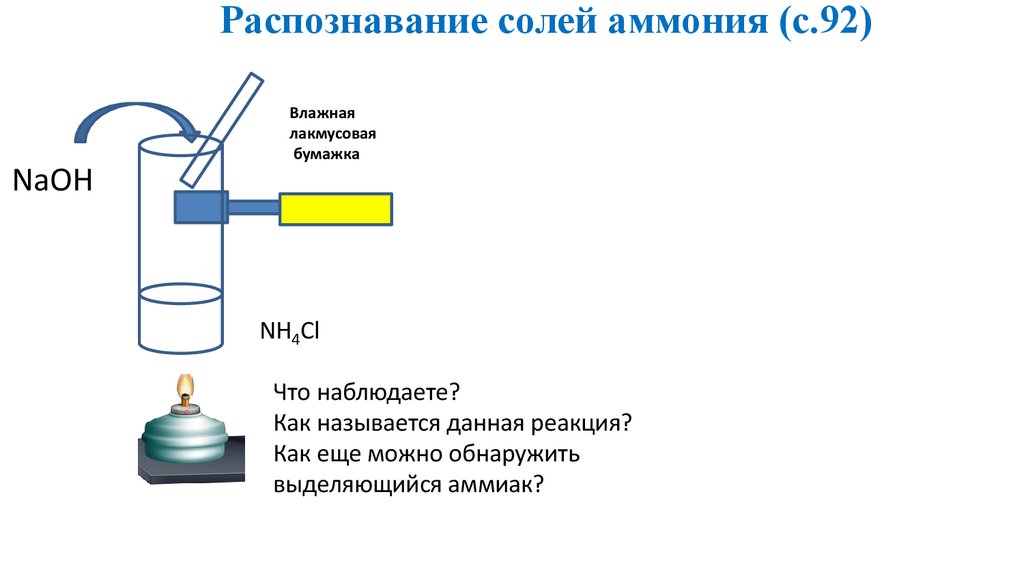
Лабораторный опыт«Распознавание солей аммония»
20.
Распознавание солей аммония (с.92)Влажная
лакмусовая
бумажка
NaOH
NH4Cl
Что наблюдаете?
Как называется данная реакция?
Как еще можно обнаружить
выделяющийся аммиак?
21.
Химические свойства солей аммонияРеакции с кислотами
(NH4)2CO3 + 2HCl =
22.
Химические свойства солей аммонияРеакции с кислотами
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O
23.
Химические свойства солей аммонияРеакции с кислотами
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O
24.
Химические свойства солей аммонияРеакции с кислотами
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O
Разложение
t
NH4Cl = NH3↑ + HCl↑
25.
Восстановительные свойства аммиакаРеакции окисления
-3
4N H3 + 3O20 = 2N20 + 6H2O-2
26.
Восстановительные свойства аммиакаРеакции окисления
-3
4N H3 + 3O20 = 2N20 + 6H2O-2
-3
4N H3+5O20 = 4N+2O-2 + 6H2O
27.
Восстановительные свойства аммиакаРеакции окисления
-3
4N H3 + 3O20 = 2N20 + 6H2O-2
-3
4N H3+5O20 = 4N+2O-2 + 6H2O
Реакции с оксидами металлов
3Cu+2O + 2N-3H3 = N20 + 3Cu0 + 3H2O
28.
Получение аммиака29.
Получение аммиакаВ промышленности
N2 + 3H2


























 Химия
Химия








