Похожие презентации:
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
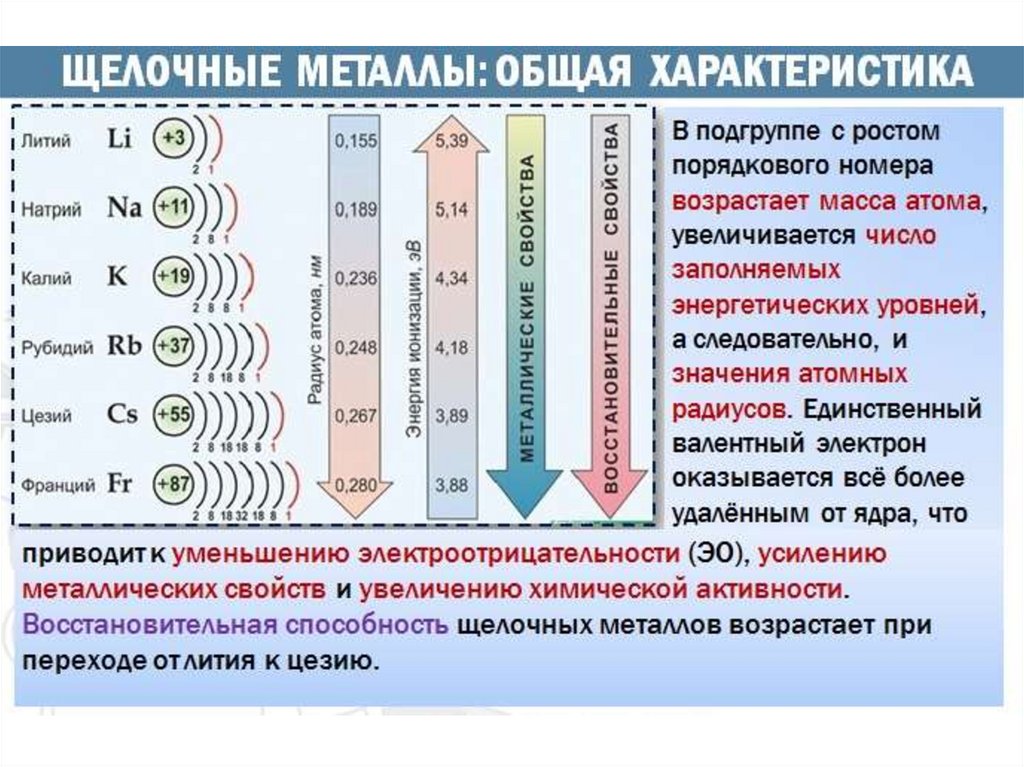
1.
2.
3.
4.
5.
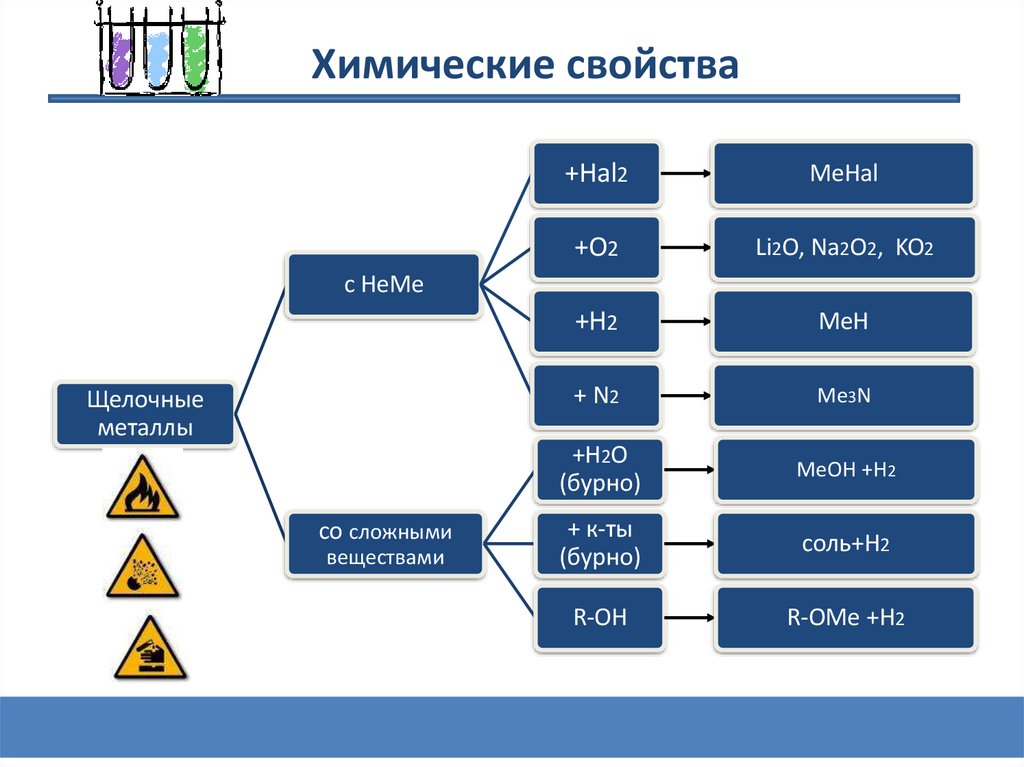
Химические свойства+Hal2
MeHal
+O2
Li2O, Na2O2, KO2
+H2
МеH
+ N2
Me3N
+H2O
(бурно)
МеOH +H2
+ к-ты
(бурно)
соль+H2
R-OH
R-OMe +H2
с НеМе
Щелочные
металлы
со сложными
веществами
6.
7.
8.
9.
10.
11.
12.
13.
14.
Получение щелочных металлов1) Электролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и гидроксидов
щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Схема электролизера для получения натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и
кольцевым железный катодом К, между которыми расположена сетчатая диафрагма.
Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что
позволяет проводить процесс при 610–650°С). Металлический натрий собирается в
верхней части кольцевого катодного пространства, откуда и переходит в сборник. По
мере хода электролиза в ванну добавляют NaCl.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
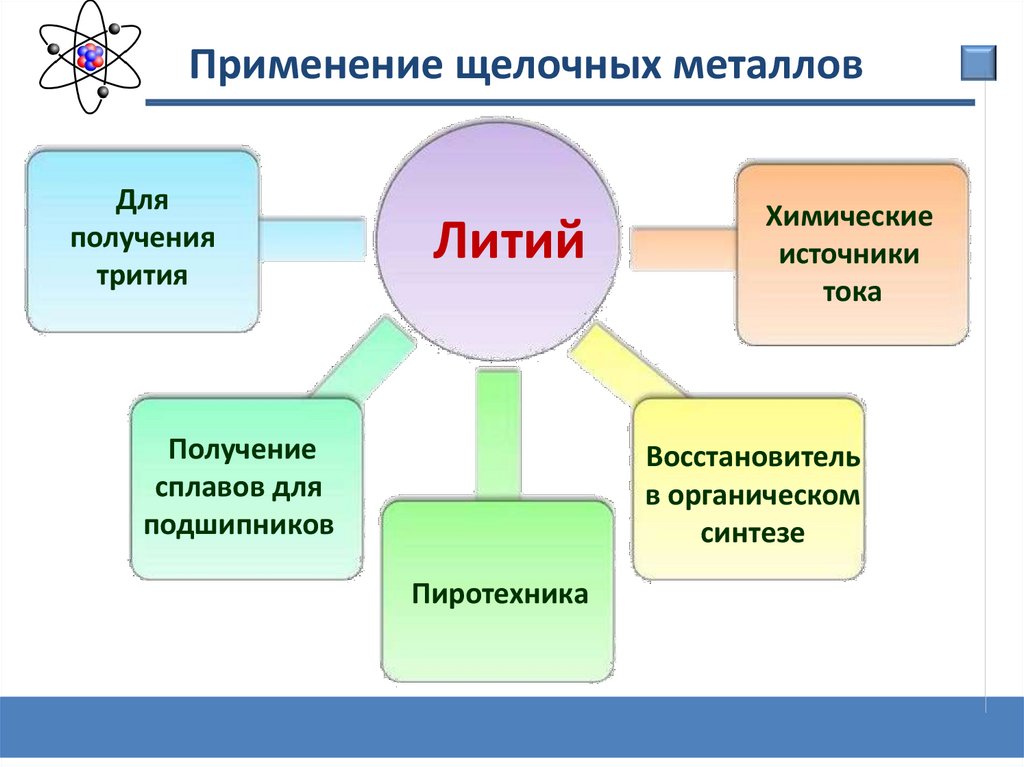
Применение щелочных металловДля
получения
трития
Литий
Получение
сплавов для
подшипников
Химические
источники
тока
Восстановитель
в органическом
синтезе
Пиротехника
36.
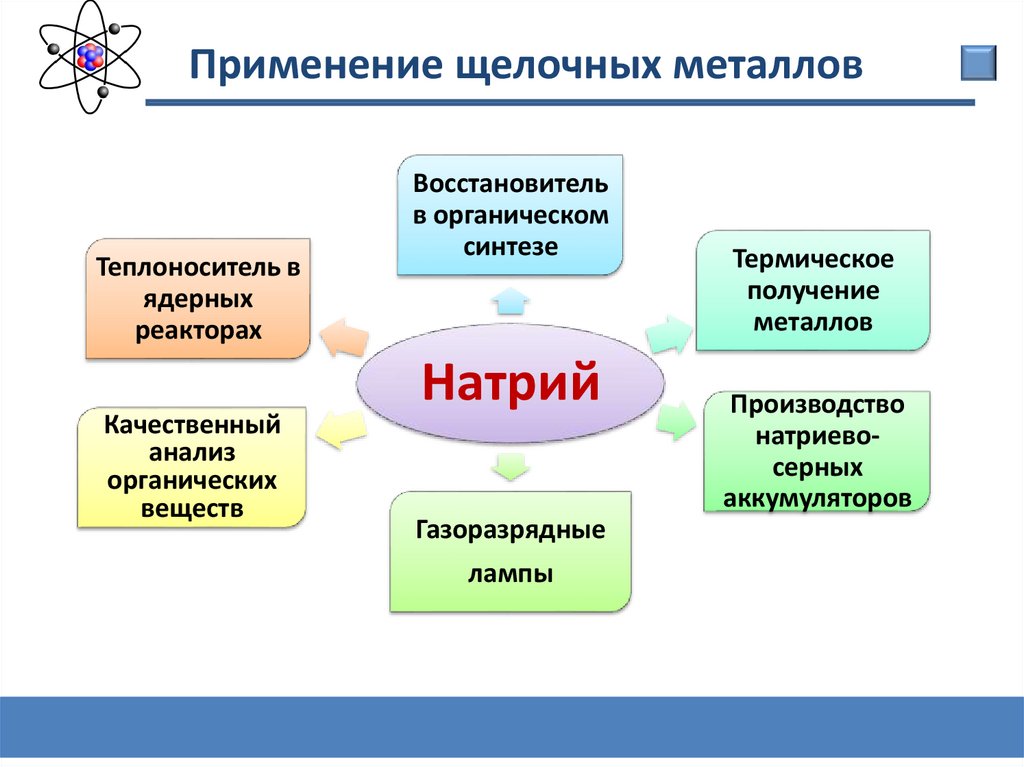
Применение щелочных металловТеплоноситель в
ядерных
реакторах
Качественный
анализ
органических
веществ
Восстановитель
в органическом
синтезе
Натрий
Газоразрядные
лампы
Термическое
получение
металлов
Производство
натриевосерных
аккумуляторов
37.
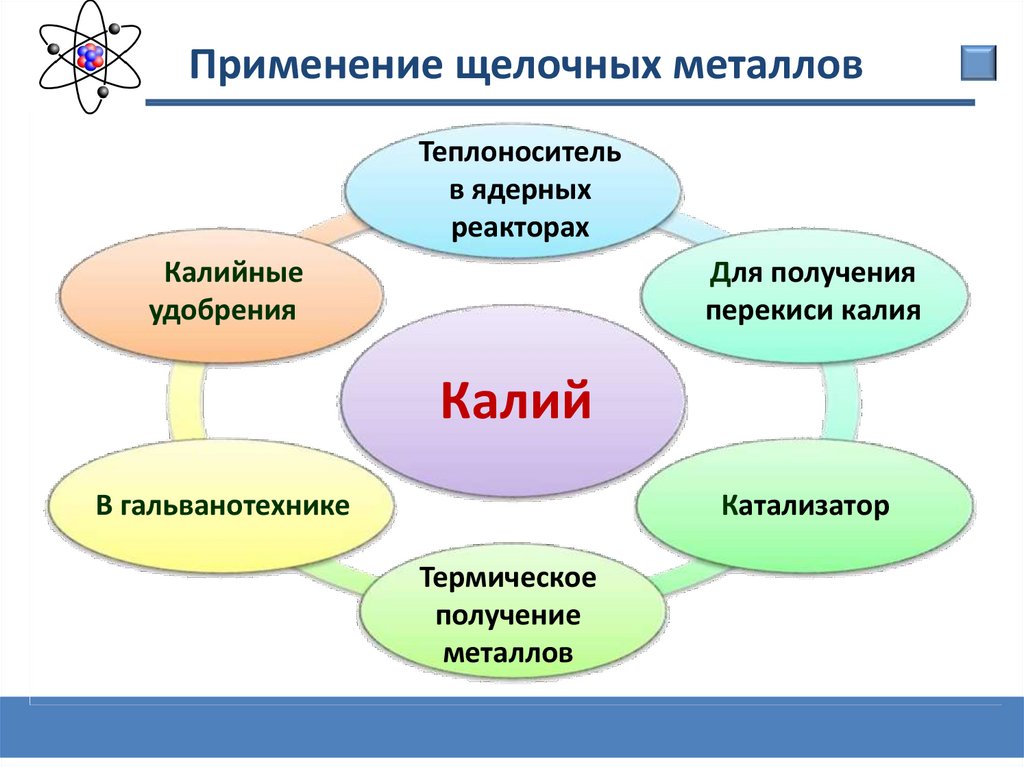
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Калийные
удобрения
Для получения
перекиси калия
Калий
В гальванотехнике
Катализатор
Термическое
получение
металлов






























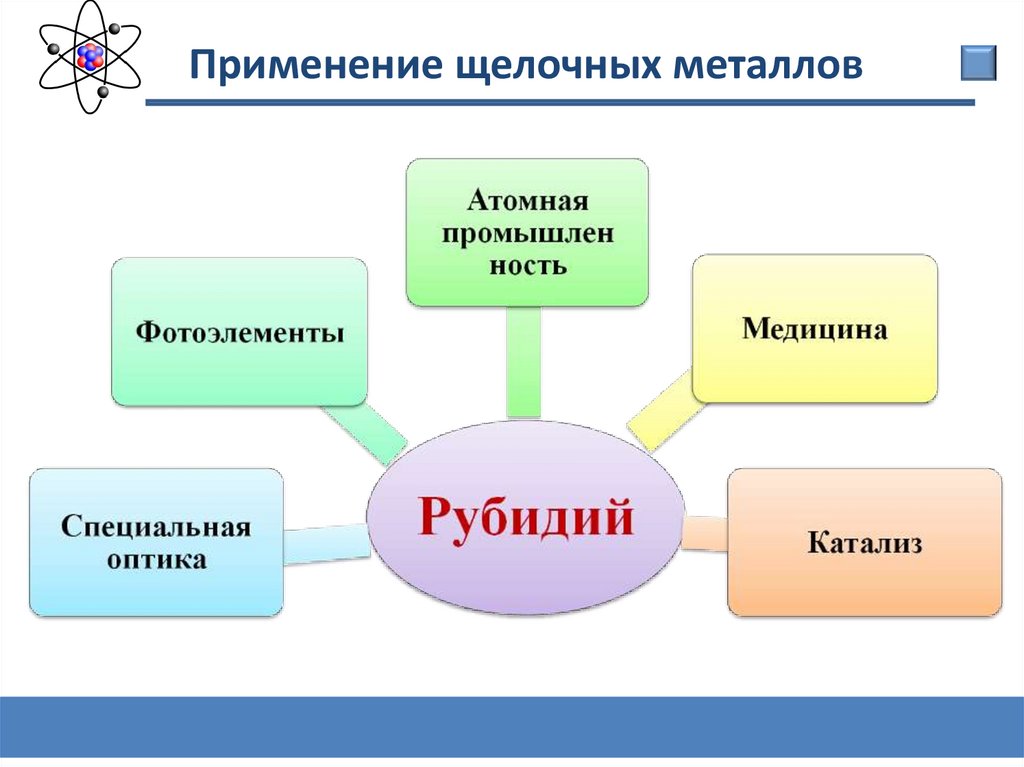
 Химия
Химия








