Похожие презентации:
Тема 13 Гидролиз
1.
Важнейшие классынеорганических
Гидролизсоединений.
солей
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
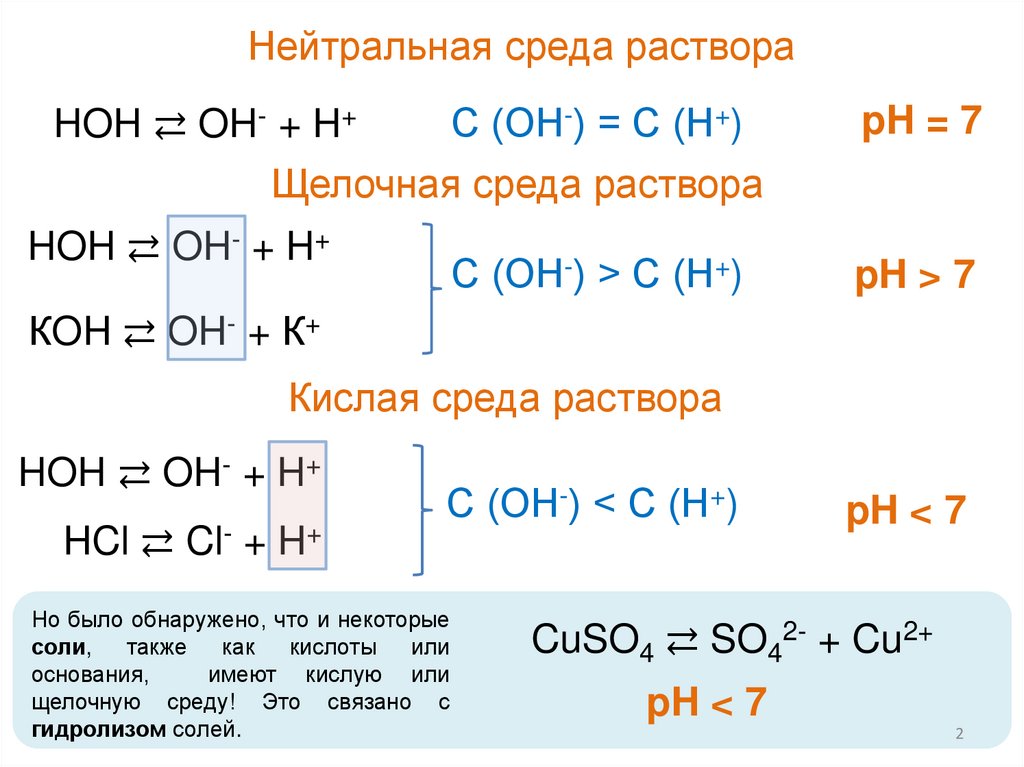
Нейтральная среда раствораС (ОН-) = С (Н+)
HOH ⇄ OH- + H+
pH = 7
Щелочная среда раствора
HOH ⇄ OH- + H+
С (ОН-) > С (Н+)
pH > 7
КOH ⇄ OH- + К+
Кислая среда раствора
HOH ⇄ OH- + H+
HCl ⇄ Cl- + H+
С (ОН-) < С (Н+)
Но было обнаружено, что и некоторые
соли,
также
как
кислоты
или
основания,
имеют кислую или
щелочную среду! Это связано с
гидролизом солей.
pH < 7
CuSO4 ⇄ SO42- + Cu2+
pH < 7
2
3.
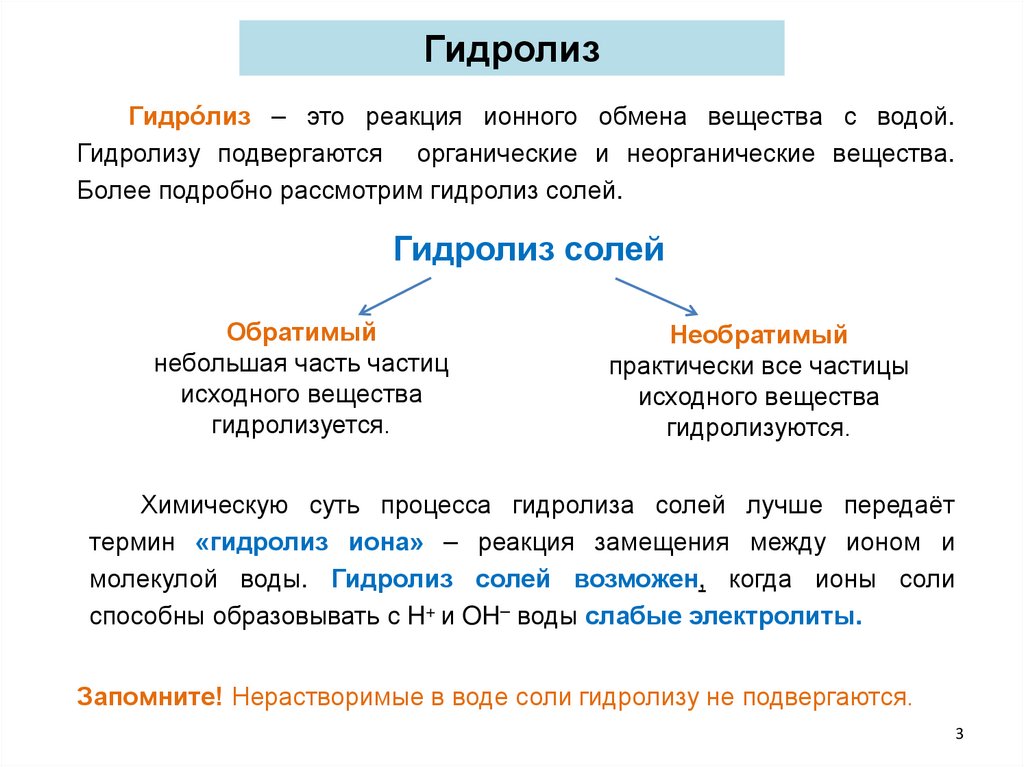
ГидролизГидро́лиз – это реакция ионного обмена вещества с водой.
Гидролизу подвергаются органические и неорганические вещества.
Более подробно рассмотрим гидролиз солей.
Гидролиз солей
Обратимый
небольшая часть частиц
исходного вещества
гидролизуется.
Необратимый
практически все частицы
исходного вещества
гидролизуются.
Химическую суть процесса гидролиза солей лучше передаёт
термин «гидролиз иона» – реакция замещения между ионом и
молекулой воды. Гидролиз солей возможен, когда ионы соли
способны образовывать с H+ и OH– воды слабые электролиты.
Запомните! Нерастворимые в воде соли гидролизу не подвергаются.
3
4.
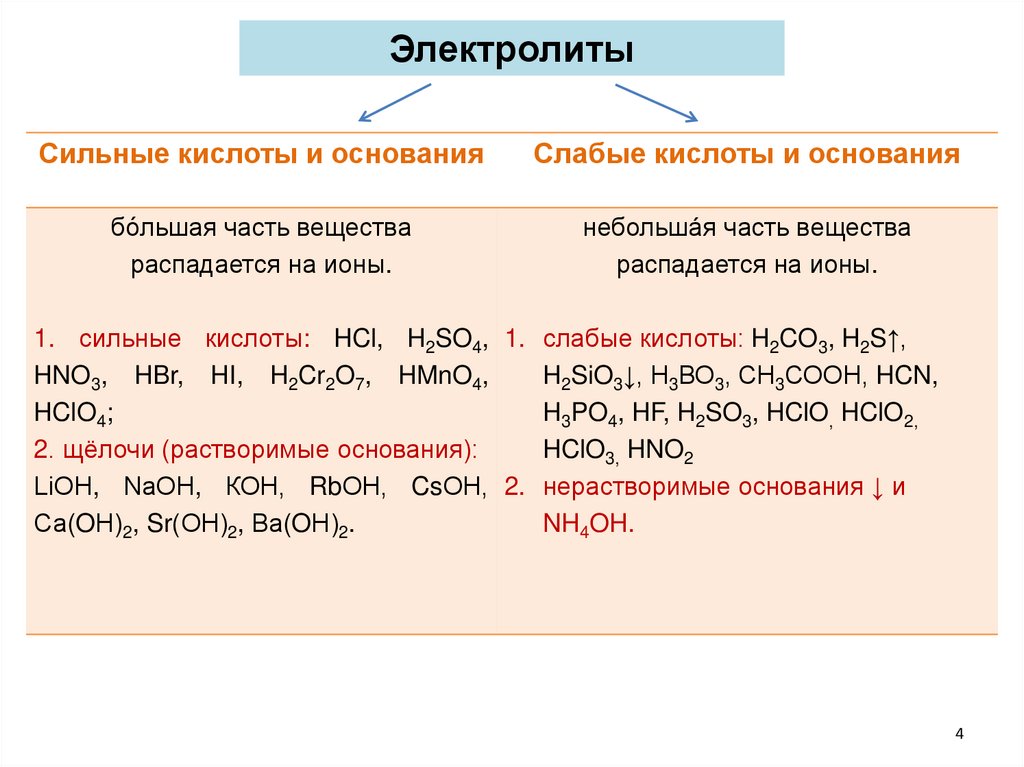
ЭлектролитыСильные кислоты и основания
Слабые кислоты и основания
бо́льшая часть вещества
распадается на ионы.
небольшáя часть вещества
распадается на ионы.
1. сильные кислоты: HCl, H2SO4, 1. слабые кислоты: H2CO3, H2S↑,
HNO3, HBr, HI, H2Cr2O7, HMnO4,
H2SiO3↓, Н3ВО3, СН3СООН, HCN,
HClO4;
H3PO4, HF, H2SO3, HClO, HClO2,
2. щёлочи (растворимые основания):
HClO3, HNO2
LіОН, NаОН, КОН, RbОН, CsОН, 2. нерастворимые основания ↓ и
Са(OН)2, Sr(ОН)2, Ва(OН)2.
NH4OH.
4
5.
Гидролиза нетРассмотри обратимый гидролиз.
В зависимости от состава соли различают четыре типа гидролиза:
1 тип
Соль, образованная сильным основанием и сильной кислотой
(СaCl2 (соль состоит из Сa(OH)2 и HCl), NaNO3 (соль состоит из NaOH и
HNO3), K2SO4, LiBr, KClO4), гидролизу не подвергаются, так как слабый
электролит не образуется.
Например,
NaCl + HOH ⇄ NaOH + HCl
Na+ + Cl- + HOH ⇄ Na+ + OH- + H+ + Cl-
HOH ⇄ OH- + H+
Ионы соли не участвуют в реакции с водой, поэтому гидролиза этого
типа солей НЕТ.
Среда растворов таких солей нейтральная (pH ≈ 7).
5
6.
Гидролиз по аниону2 тип
Соль, образованная сильным основанием и слабой кислотой
(Na3PO4, CaSO3, KCN, LiNO2, CH3COONa, Na2CO3) гидролизуется по
аниону.
Рассмотрим гидролиз цианида калия.
Диссоциация соли:
KCN ⇄ K+ + CN–
Полное ионно-молекулярное уравнение:
K+ + CN– + НОН ⇄ HCN + K+ + OH–
Сокращённое ионно-молекулярное уравнение:
CN– + Н2O ⇄ HCN + OH–
Реакция гидролиза:
KCN + Н2O ⇄ HCN + KOH
При гидролизе таких солей в растворе образуется избыток OH–
6
ионов, создавая щелочную среду (рН > 7).
7.
Гидролиз по анионуГидролиз солей многоосновных кислот проходит ступенчато, с
образованием кислых солей.
Рассмотрим гидролиз карбоната натрия.
1 ступень (преимущественно):
Na2СO3 ⇄ 2Na+ + СО32– (диссоциация соли)
2Na+ + СО32– + HOН ⇄ HСO3– + OH– + 2Na+ (полное ионно-молекулярное уравнение)
СO32– + HOН ⇄ HСO3– + OH– (сокращённое ионно-молекулярное ионное уравнение)
Na2СO3 + HOН ⇄ NaHСO3 + NaOH (молекулярное уравнение)
2 ступень:
NaHСO3 ⇄ Na+ + HСO3– (диссоциация соли)
Na+ + HСO3– + H2O ⇄ H2СO3 + OH– (полное ионно-молекулярное уравнение)
HСO3– + HOН ⇄ H2СO3 + OH– (сокращённое ионно-молекулярное уравнение)
NaHСO3 + H2O ⇄ H2СO3+ NaOH (молекулярное уравнение)
Вторая ступень гидролиза протекает незначительно, так как,
накапливаются ионы ОН− и создают сильнощелочную среду, что приводит к
реакции нейтрализации, сдвигу равновесия влево.
7
8.
Гидролиз по катиону3 тип
Соль, образованная слабым основанием и сильной кислотой
(Сu(NO3)2, NH4Cl, Pb(NO3)2, FeBr3, Zn(NO3)2) гидролизуется по катиону.
Рассмотрим гидролиз хлорида аммония.
Диссоциация соли:
NH4Cl ⇄ NH4+ + Cl–
Полное ионно-молекулярное уравнение:
NH4+ + Cl– + Н2O ⇄ NH4OH + H+ + Cl–
Сокращённое ионно-молекулярное уравнение:
NH4+ + Н2O ⇄ NH4OH + H+
Реакция гидролиза:
NH4Cl + Н2O ⇄ NH4OH + HCl
При гидролизе таких солей в растворе образуется избыток H+ ионов,
создавая кислую среду (рН < 7).
8
9.
Гидролиз по катионуГидролиз солей многокислотных оснований проходит ступенчато, с
образованием осно́вных солей.
Рассмотрим гидролиз нитрата меди (II).
1 ступень:
Сu(NO3)2 ⇄ Сu2+ + 2NO3– (диссоциация соли)
Сu2+ + 2NO3– + H2O ⇄ СuOH+ + H+ + 2NO3– (полное ионно-молекулярное уравнение)
Сu2+ + H2O ⇄ СuOH+ + H+ (сокращённое ионно-молекулярное уравнение)
Сu(NO3)2 + H2O ⇄ СuOHNO3 + HNO3 (молекулярное уравнение)
2 ступень:
СuOHNO3 ⇄ СuOH+ + NO3– (диссоциация соли)
СuOH+ + NO3– + H2O ⇄ Сu(OH)2 + H+ + NO3– (полное ионно-молекулярное уравнение)
СuOH+ + H2O ⇄ Сu(OH)2 + H+ (сокращённое ионно-молекулярное уравнение)
СuOHNO3 + H2O ⇄ Сu(OH)2↓ + HNO3 (молекулярное уравнение)
Вторая ступень гидролиза практически не протекает при комнатных
температурах, так как, накапливаясь, ионы H+ создают кислую среду, и
равновесие реакции гидролиза по 2-ой ступени смещено влево.
9
10.
Гидролиз по катиону и аниону4 тип
Соль, образованная слабым основанием и слабой кислотой
(Ni(NO2)2, NH4CN, CoSO3, AlF3, (CH3COO)2Zn) гидролизуется по катиону
и по аниону.
Рассмотрим гидролиз ацетата аммония.
Диссоциация соли:
CH3COONH4 ⇄ CH3COO– + NH4+
Ионно-молекулярное уравнение:
CH3COO– + NH4+ + Н2O ⇄ CH3COOH + NH4ОH
Реакция гидролиза:
CH3COONH4 + Н2O ⇄ CH3COOH + NH4ОH
Реакция среды при гидролизе таких солей зависит от силы
основания и кислоты, то есть от константы диссоциации. Часто реакция
среды будет почти нейтральной (рН ≈ 7).
10
11.
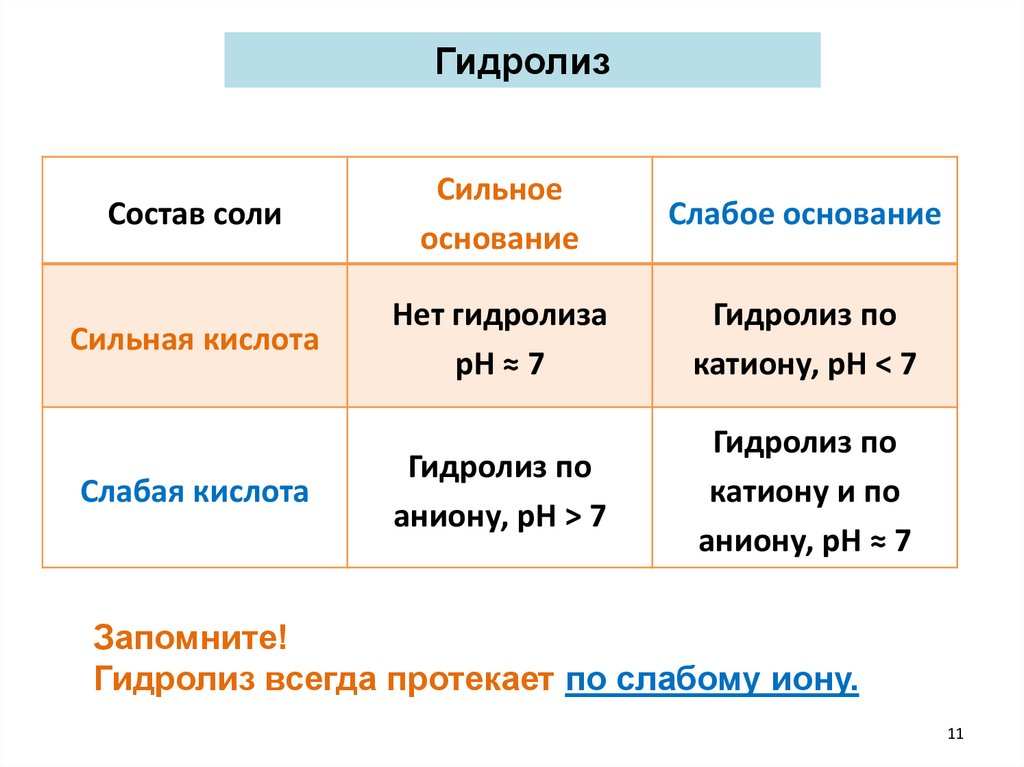
ГидролизСостав соли
Сильное
основание
Слабое основание
Сильная кислота
Нет гидролиза
рН ≈ 7
Гидролиз по
катиону, рН < 7
Гидролиз по
аниону, рН > 7
Гидролиз по
катиону и по
аниону, рН ≈ 7
Слабая кислота
Запомните!
Гидролиз всегда протекает по слабому иону.
11
12.
Необратимый гидролизНеобратимый гидролиз протекает, если в результате гидролиза
образуются газ / осадок или вода, то есть продукты, которые не
взаимодействуют друг с другом.
Совместный гидролиз обычно протекает при смешивании растворов
содержащих
катионы: Al3+, Cr3+, Fe3+, NH4+.
анионы: S2-, SO32-, CO32-, SiO32-.
Примеры:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
2AlCl3 + 2Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
2CrCl3 + 2Na2CO3 + 6H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
2CuSO4 + 2Na2CO3 + H2O → (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
При гидролизе таких солей растворы имеют нейтральную среду.
12
13.
Домашнее задание1. Какие из следующих солей подвергаются гидролизу? Напишите
молекулярное, ионное, краткое ионное уравнения реакции гидролиза. Укажите
реакцию среды раствора соли. Назовите все продукты реакции:
1) сульфит натрия; 2) нитрит кадмия; 3) хлорид аммония; 4) ацетат меди.
2. Установите соответствие между формулой соли и её отношением к
гидролизу:
Формула соли
А) FeCl3
Б) HCOOK
В) KClO
Г) (NH4)2CO3
Д) Ca3(PO4)2
Е) Al(NO3)3
Ж) K2SiO3
З) Na2S
И) MgCO3
Отношение к гидролизу
1) не гидролизуется
2) гидролизуется по катиону
3) гидролизуется по аниону
4) гидролизуется и по катиону, и по
аниону
13










 Химия
Химия








