Похожие презентации:
сем.Электролиз_и_коррозия_25
1. Электролиз и коррозия
2. Электролиз
Электролиз - процесс синтеза или разложения веществ с помощьюэлектрического тока с выделением на электродах веществ, входящих
в состав электролита
Система, в которой происходит электролиз, называется электролизер.
Электролиз позволяет осуществить несамопроизвольную
окислительно-восстановительную реакцию, за счет подвода
внешнего напряжения.
К отрицательному
прикладывается избыточный
отрицательный потенциал, к
положительному –
избыточный положительный
потенциал.
3.
η – перенапряжениеПри величине внешнего напряжения, равной E˚г-э, в системе
существует состояние равновесия и процесс электролиза не идет
Для того, чтобы система стала работать, потребляя энергию извне,
необходимо добавочное напряжение
η – перенапряжение
Электролиз возможен только при условии, что величина
напряжения электролиза
Uэл-за > E˚г-э , т.е.
Uэл-за = E˚г-э равн. + ηэл-за
ηэл-за = |ηкат| + |ηанод|
η – величина дополнительного напряжения по сравнению с
равновесным электродным потенциалом , необходимая для
протекания электродного процесса с определенной скоростью
4.
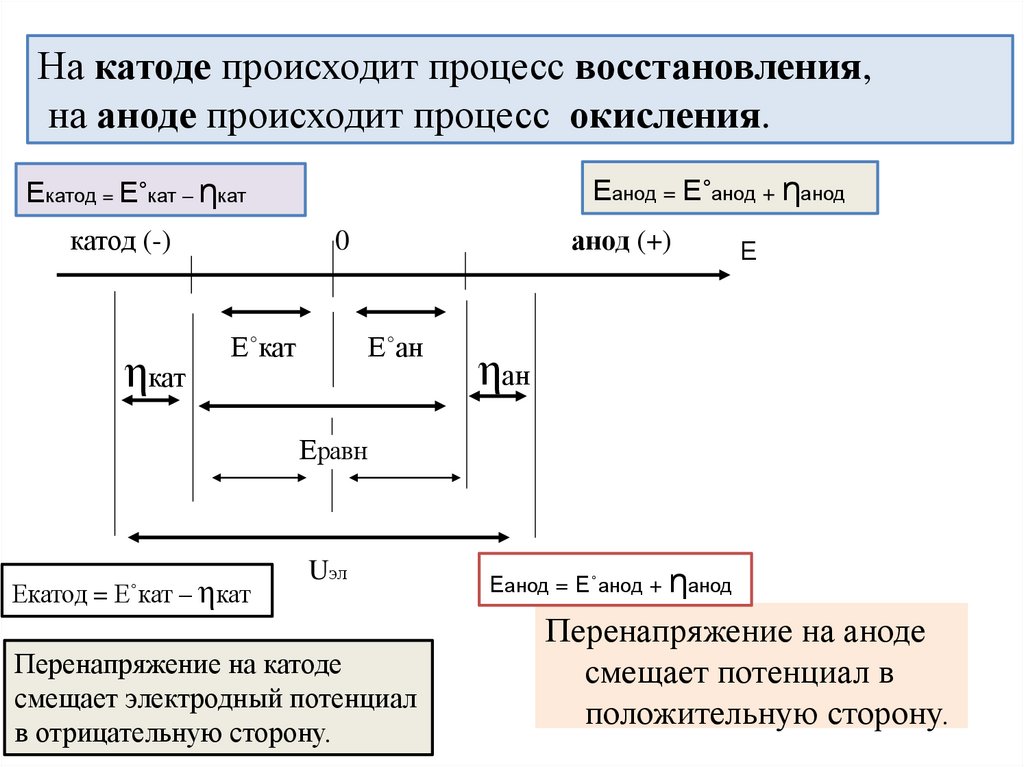
На катоде происходит процесс восстановления,на аноде происходит процесс окисления.
Еанод = Е˚анод + ηанод
Екатод = Е˚кат – ηкат
катод (-)
ηкат
анод (+)
0
Е˚кат
Е˚ан
Е
ηан
Еравн
Екатод = Е˚кат – ηкат
Uэл
Перенапряжение на катоде
смещает электродный потенциал
в отрицательную сторону.
Еанод = Е˚анод + ηанод
Перенапряжение на аноде
смещает потенциал в
положительную сторону.
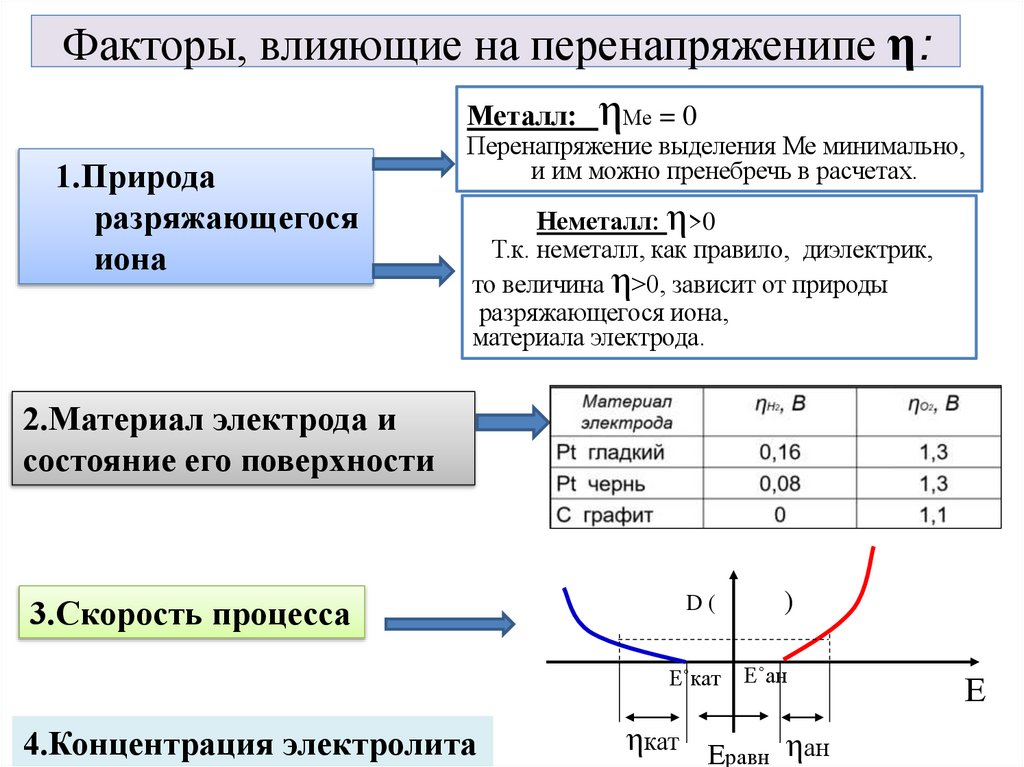
5. Факторы, влияющие на перенапряженипе η:
Металл: ηМе = 01.Природа
разряжающегося
иона
Перенапряжение выделения Ме минимально,
и им можно пренебречь в расчетах.
Неметалл: η>0
Т.к. неметалл, как правило, диэлектрик,
то величина η>0, зависит от природы
разряжающегося иона,
материала электрода.
2.Материал электрода и
состояние его поверхности
3.Скорость процесса
4.Концентрация электролита
D(
)
Е˚кат
Е˚ан
ηкат Еравн ηан
Е
6.
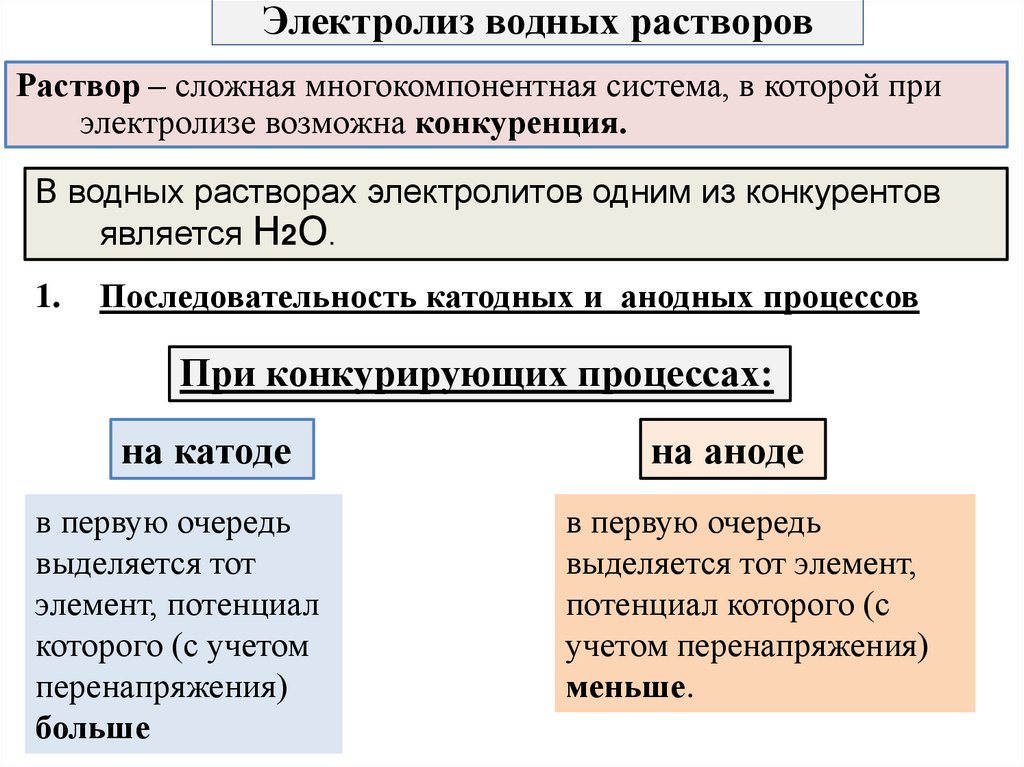
7. Электролиз водных растворов
Раствор – сложная многокомпонентная система, в которой приэлектролизе возможна конкуренция.
В водных растворах электролитов одним из конкурентов
является Н2О.
1.
Последовательность катодных и анодных процессов
При конкурирующих процессах:
на катоде
в первую очередь
выделяется тот
элемент, потенциал
которого (с учетом
перенапряжения)
больше
на аноде
в первую очередь
выделяется тот элемент,
потенциал которого (с
учетом перенапряжения)
меньше.
8.
2. Величина разряда анионов оксокислот: NО-3, SО2-4 -, PО3-4 ит.п. имеет (с учетом перенапряжения) величину, больше 2.5В,
поэтому в водных растворах они не разряжаются
3. При электролизе водных растворов галогенидов (хлоридов) на
аноде в свободном виде будет выделяться галоген (Cl˚2 ), а не O2
т.к. перенапряжение выделения любого галогена всегда
меньше перенапряжения O2 на аналогичных электродах
4. Большие величины перенапряжений выделения водорода на
активных металлах (Ме катод) позволяют получать металлы из
водных растворов.:
Ni, Zn, Sn, Fe, Cd могут быть получены из водных растворов
Металлы с ЕМе˂ -1.0В не могут быть получены из водных растворов
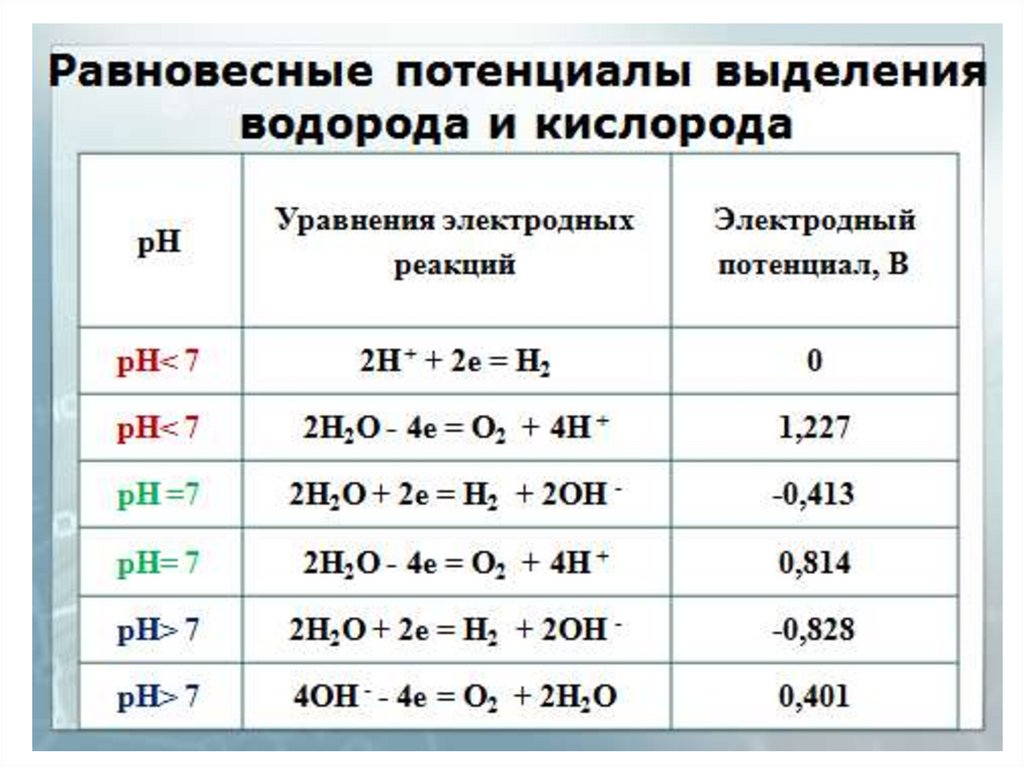
9. процессы при электролизе СrCl3 в кислой среде (рН < 7) НCl?
Электролиз раствора на инертных электродахпроцессы при электролизе СrCl3
в кислой среде (рН < 7) НCl?
Анод - Сграфит, катод - Сграфит
1. Характеристика электролита
СrCl3 → Cr+3 + 3ClH2O
H+ + OHHCl → H+ + Cl-
10.
2. Электродные процессыНа катоде (восст.)
Екат = Е˚э – ηэ/эл-д
(1) Cr+3 + 3e → Сr˚
Е1= (-0,74) – ηCr/Cгр = -0,74В
(2) 2H+ + 2e → H˚2
Е2 = Е˚Н2 – ηН2/Cгр = 0 – 0.6 = -0.6В
ЕН2 = - 0,059 рН
Е1 < Е2 => (2) на катоде
На аноде (окисл.)
Еанод = Е˚э + ηэ/эл-д
(3) 2Cl- – 2e → Cl˚2
(4) 2H2O – 4e → O2 + 4H+
Табл.: ηCl2 /Cгр = 0,1В
ЕO2 = 1,226 – 0,059рН
Е3 < Е4 => (3)
3.
Е3 = Е˚Cl2 + ηCl2 /Cгр = 1,36 + 0,1
Е4 = Е˚O2 + ηO2/Cгр = 1,226 + 1,18
ηO2/Cгр = 1,18 В
Электродный процесс.
2Н+ + 2е + 2Сl- – 2e → H2↑ + Cl2↑
2Н+ + 2Сl- → H2↑ + Cl2↑
При конкурирующих процессах на катоде в
первую очередь выделяется тот элемент,
потенциал которого с учетом
перенапряжения больше, а на аноде в
первую очередь выделяется тот элемент,
потенциал которого с учетом
перенапряжения меньше.
11. электролиз растворов солей с металлическим катодом и инертным анодом
ZnCl2 (р-р) рН < 7ZnCl2 → Zn+2 + 2ClН2О
Н+ + ОННСl → H+ + Cl-
Cграф – анод
Екат = Еэ – ηэ/эл-д
На катоде:
(1) Zn2+ + 2e → Zn˚
Zn – катод
ЕZn = Е˚Zn – ηZn/Zn = -0,76 В
(2) 2Н+ + 2е → Н˚2
ЕН2 = Е˚Н2 - ηН2/Zn = 0-0,8 В
Е1 > Е2 => (1) процесс идет на катоде. Для активных Ме процесс
выделения Н2 не происходит.
На аноде:
Еанод = Еэ + ηэ/эл-д
(3) 2Cl- – 2e → Cl˚2
Е3 = Е˚Cl2 + ηCl2/Cгр = 1,46 В
(4) 2H2O – 4e → O2 + 4H+
Е3 < Е4 => (3)
E4 = Е˚O2 + ηO2/Cгр = 2,3 В
Zn2+ + 2е + 2Сl- – 2e → Zn˚↓ + Cl2˚↑
12. Электролиз растворов солей с металлическим анодом и инертным катодом
СuCl2(р-р)рН < 7
Катод Сгр,
Анод Сu
Характеристика электролита:
СuСl2 → Cu+2 + 2ClН2О Н+ + ОНHCl → H+ + ClНа катоде:
(1) Сu+2 + 2e → Cu˚
(2) 2Н+ + 2е → Н˚2
Сu+2 + 2e → Cu
Е1 > Е2 => (1)
Екат = Еэ – ηэ/эл-д
Е1 = Е˚Cu/Cu - η˚Cu/Cграф = 0,34 В
Е2 = -0,1 В
На аноде:
(3) 2Cl- – 2e → Cl˚2
(4) 2H2O – 4e → O2 + 4H+
(5) Сu˚ - 2e → Cu+2
Растворение анода
Еанод = Еэ + ηэ/эл-д
Е3 = Е˚Cl2 + ηCl2/ /Cu = 1,46В
E4 = 2,33В
Е5 = Е˚Cu + η˚Cu/Cu = 0,34В
Сu2+ + 2е + Cu˚ – 2e → Cu+2 + Cu˚↓
13.
ВЫВОДЫ1. Eсли материал анода инертный (графит или платина),
то при рассмотрении электролиза учитывается
конкуренция только растворенного вещества и
растворителя.
2. Если анод металлический, то среди конкурирующих
процессов необходимо учесть растворение самого анода и
восстановление катионов металлического анода на катоде.
3. При электролизе водных растворов галогенидов на аноде
в свободном виде будет выделяться галоген, т.к.
перенапряжение выделения любого галогена всегда
меньше перенапряжения O2 на аналогичных электродах.
Потенциал разряда анионов оксокислот : NО-3, SО2-4 , PО3-4
и др. с учетом перенапряжения больше 2.5 В , поэтому не
происходит
4.
14.
15.
Законы Фарадея1.Масса прореагировавшего (выделившегося или растворённого) на
катоде или на аноде вещества пропорциональна количеству
электричества, прошедшего через электролит.
2.При постоянном количестве прошедшего электричества массы
прореагировавших веществ пропорциональны их химическим
эквивалентам.
m(г)=k·Q(кул) ;Q=IA·τc
k – электрохимический эквивалент, который характеризует массу вещества,
прореагировавшего при прохождении одного кулона электричества.
K=М/(z·F)
М – молярная масса вещества (г/моль); z – количество электронов принятых или
отданных в электродной полуреакции; F=96485 кул/моль – константа Фарадея
m=М·Q/(z·F)
16.
Коррозия17. Химическая коррозия
ХИМИЧЕСКАЯ КОРРОЗИЯХимическая коррозия – разрушение металлов из-за
взаимодействия с окислителями в средах, не обладающих
ионной проводимостью (газовая, атмосферная в сухом
газе, в сухом воздухе).
3Fe + 2O2⇾ Fe3O4
Рыхлая плёнка
2Al + 3O2 ⇾ 2Al2O3
Плотная плёнка
Скорость химической реакции определяется свойствами металла
окислителя и свойствами продукта, образовавшегося на поверхности.
Скорость химической реакции прямо пропорциональна скорости
диффузии окислителя через плёнку продукта к чистому металлу.
Ti, Zr, Ni, Cr, V, Mo, W – коррозионностойкие металлы
18.
Электрохимическая коррозия металловЭлектрохимическая коррозия металлов – это процесс разрушения
металлов в среде различных электролитов, который сопровождается
возникновением внутри системы электрического тока.
Анодный процесс – металл в виде ионов переходит в раствор
Катодный
процесс– образовавшиеся при анодном процессе
электроны, связываются деполяризатором (вещество — окислитель).
Водородная деполяризация
осуществляется на катоде при электрохимической коррозии в кислой среде
2H++2e— = H2
разряд водородных ионов
Кислородная деполяризация
осуществляется на катоде при электрохимической коррозии в
нейтральной среде:
O2 + 4H++4e— = H2O
восстановление растворенного кислорода
19.
1.Активные металлы (высокая термодинамическая нестабильность)– это все металлы, находящиеся в интервале щелочные металлы —
кадмий (Е0 < -0,4 В).
Их коррозия возможна даже в нейтральных водных средах, в которых
отсутствуют кислород или другие окислители.
2. Металлы средней активности (термодинамическая нестабильность)
– располагаются между кадмием и водородом (-0.414В < Е0 < 0,0 В).
В нейтральных средах, в отсутствии кислорода, не корродируют, но
подвергаются коррозии в кислых средах
3. Малоактивные металлы (промежуточная термодинамическая
стабильность) медь, серебро, висмут,
– находятся между водородом и родием (0 < Е0 < +0,814 В).
Они устойчивы к коррозии в нейтральных и кислых средах, в которых
отсутствует кислород или другие окислители
4.Благородные металлы (высокая термодинамическая стабильность)
+0,814 В< Е0 < 1.229В– золото, платина, иридий, палладий.
Могут подвергаться коррозии лишь в кислых средах при наличии в них
сильных окислителей.
5. Металлы полной термодинамической стабильности (золото и некоторые
сплавы) устойчивы в кислых средах в присутствии кислорода и других
окислителей, Е0 > +1.229 В
20.
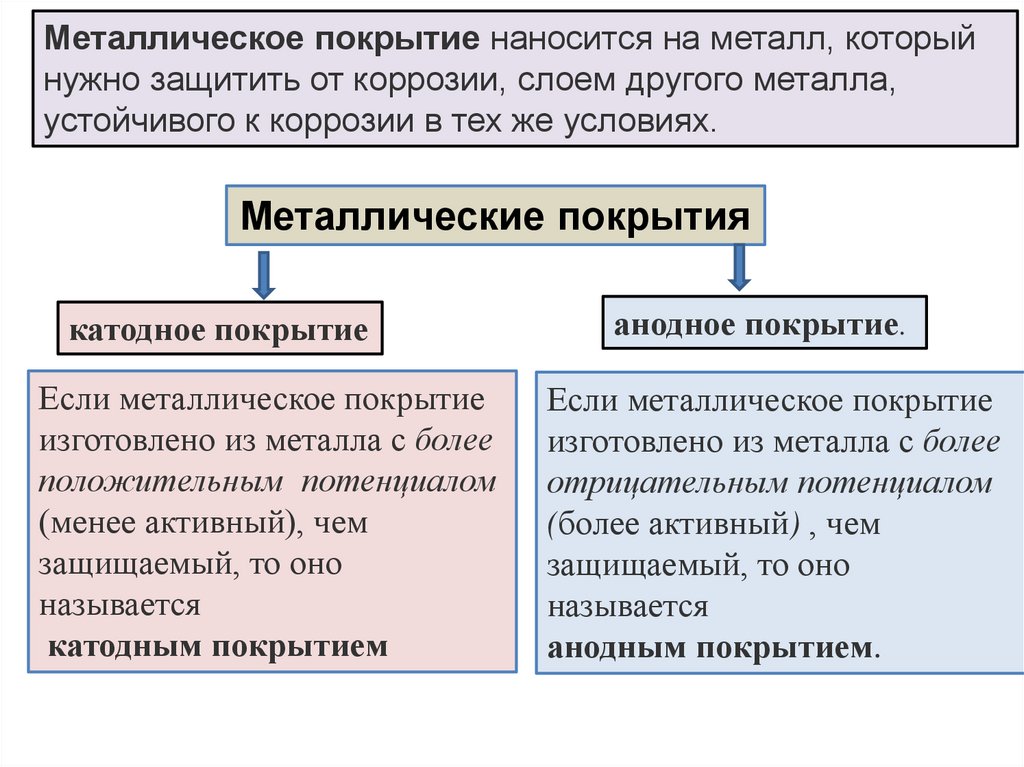
Металлическое покрытие наносится на металл, которыйнужно защитить от коррозии, слоем другого металла,
устойчивого к коррозии в тех же условиях.
Металлические покрытия
катодное покрытие
Если металлическое покрытие
изготовлено из металла с более
положительным потенциалом
(менее активный), чем
защищаемый, то оно
называется
катодным покрытием
анодное покрытие.
Если металлическое покрытие
изготовлено из металла с более
отрицательным потенциалом
(более активный) , чем
защищаемый, то оно
называется
анодным покрытием.
21. Электрохимическая коррозия
Электрохимическая коррозия –возникает в химических средах с ионной проводимостью вследствие
образования гальванических микроэлементов.
Обязательное условие – наличие 2-х
или более разнородных металлов.
Cu
Zn - коррозионная пара.
Среда – разбавленный раствор кислоты.
Е˚Zn = -0,76 В
Е˚Cu = +0,34 В
Zn играет роль анода.
анод Zn˚ - 2e → Zn2+
катод (Cu) 2Н+ + 2е → Н2↑, (Cu)
Σ Zn˚– 2е + 2Н+ + 2е → Zn+2 + H2↑ (Cu)
Коррозия :
анод Zn H2O, H2SO4 H2, Cu катод
22.
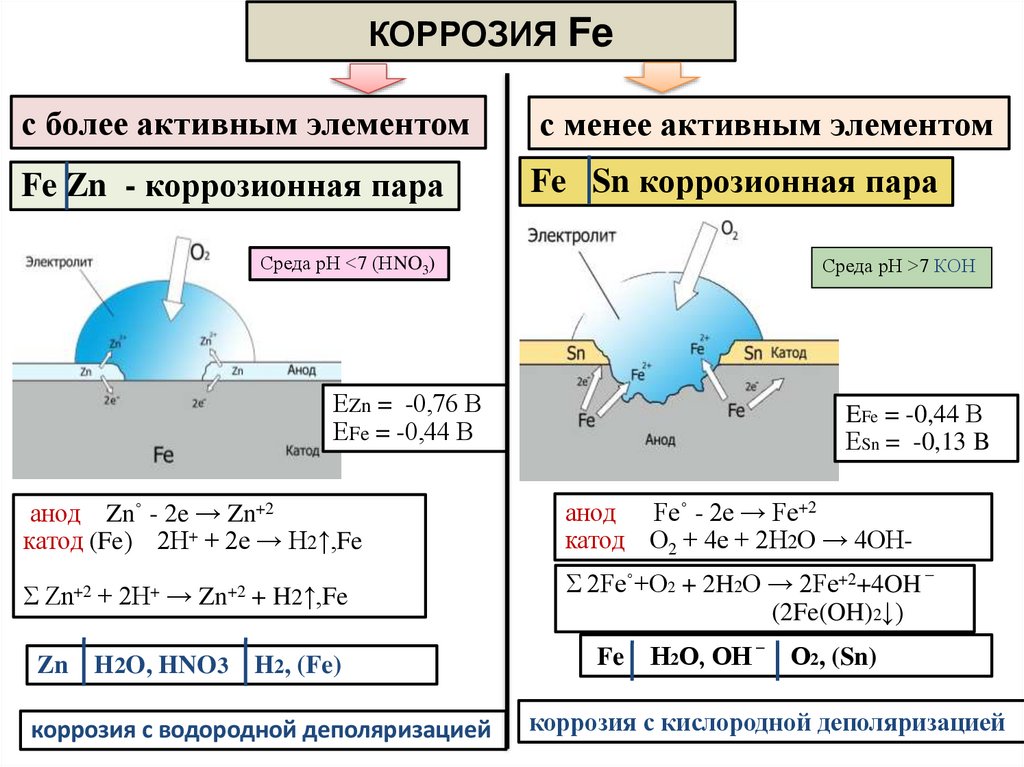
КОРРОЗИЯ Feс более активным элементом
с менее активным элементом
Fe Zn - коррозионная пара
Fe Sn коррозионная пара
Среда рН <7 (НNO3)
Среда рН >7 КОН
ЕZn = -0,76 В
ЕFe = -0,44 В
EFe = -0,44 В
ЕSn = -0,13 B
анод Zn˚ - 2e → Zn+2
катод (Fe) 2Н+ + 2е → Н2↑,Fe
анод Fe˚ - 2e → Fe+2
катод О2 + 4е + 2Н2О → 4ОН-
Σ Zn+2 + 2Н+ → Zn+2 + H2↑,Fe
Σ 2Fe˚+O2 + 2H2O → 2Fe+2+4OH
Zn
H2O, HNO3
H2, (Fe)
коррозия с водородной деполяризацией
_
(2Fe(OH)2↓)
Fe
Н2О, ОН
_
О2, (Sn)
коррозия с кислородной деполяризацией
23. Электрохимическая коррозия(выводы)
1) Электрохимическая коррозия возникает в токопроводящих средахпри наличии контакта разнородных металлов, за счет
образования гальванических микроэлементов.
2) При коррозии происходит анодное растворение металла, за счет
катодного восстановления окислителя среды, где в рН < 7 –
окислитель – Н+, в рН =7 и рН > 7 – окислитель – О2.
3) Скорость коррозии более активных металлов возрастает в случае
электрохимической коррозии.
4) Процесс коррозии идет самопроизвольно, если
Еок-ля > Еанодного р-ния Ме
Скорость разрушения активного металла возрастает, а менее
активного не изменяется в случае электрохимической
коррозии.
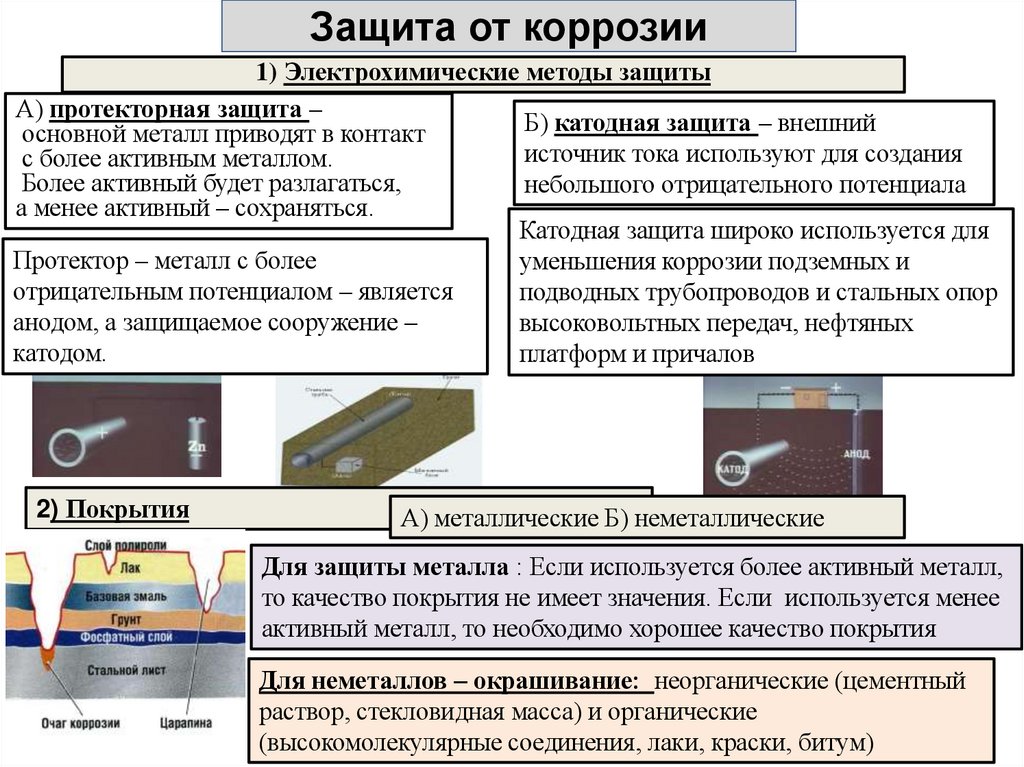
24. Защита от коррозии
1) Электрохимические методы защитыА) протекторная защита –
Б) катодная защита – внешний
основной металл приводят в контакт
источник тока используют для создания
с более активным металлом.
Более активный будет разлагаться,
небольшого отрицательного потенциала
а менее активный – сохраняться.
Катодная защита широко используется для
Протектор – металл с более
уменьшения коррозии подземных и
отрицательным потенциалом – является
подводных трубопроводов и стальных опор
анодом, а защищаемое сооружение –
высоковольтных передач, нефтяных
катодом.
платформ и причалов
2) Покрытия
А) металлические Б) неметаллические
Для защиты металла : Если используется более активный металл,
то качество покрытия не имеет значения. Если используется менее
активный металл, то необходимо хорошее качество покрытия
Для неметаллов – окрашивание: неорганические (цементный
раствор, стекловидная масса) и органические
(высокомолекулярные соединения, лаки, краски, битум)

















 Химия
Химия