Похожие презентации:
Окислительно-восстановительные равновесия в растворах ч.1
1. Окислительно-восстановительные равновесия в растворах
Окислительновосстановительные равновесияв растворах
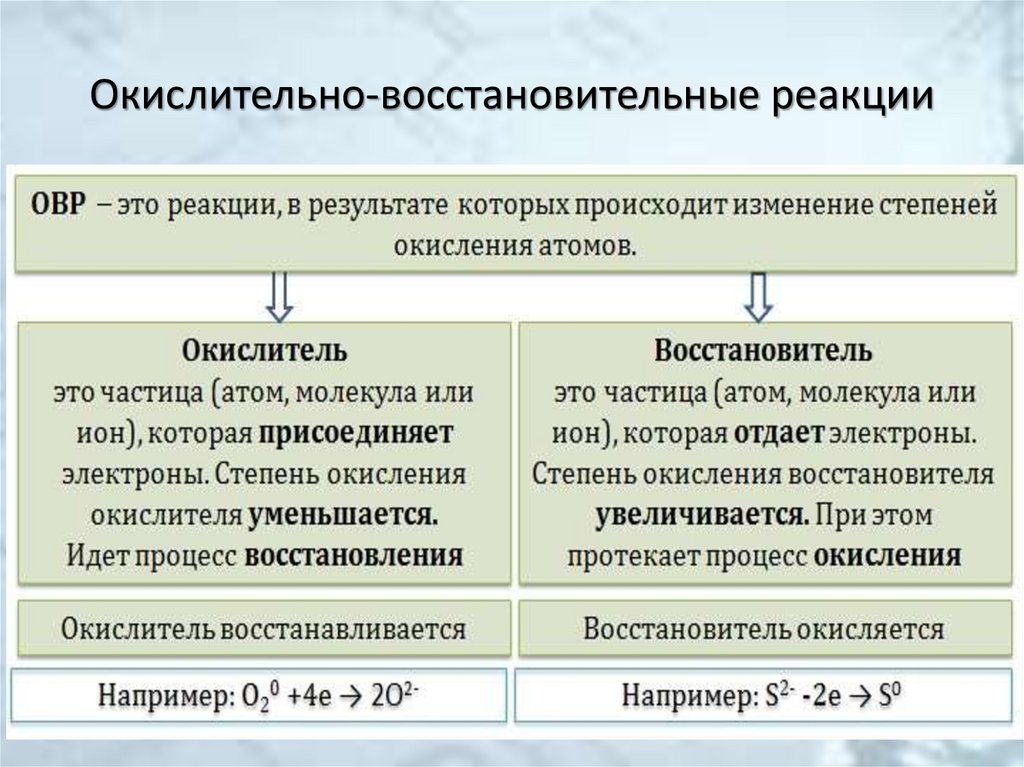
2. Окислительно-восстановительные реакции
3. Сопряжённые окислители и восстановители
Red1 + Ox2Ox1 + Red2
• Red1 и Ox1, Red2 и Ox2 – сопряжённые
восстановители и и окислители
(окислительно-восстановительные пары,
восстановленные и окисленные формы
веществ)
4. Пример
• 2KMn+7O4 + 16HCl-1 = 2Mn+2Cl2 + 5Cl20 + 2KCl + 8H2OMnO4- + 8H+ + 5ē = Mn2+ + 4H2O
окислитель
восстановитель
(окисленная форма) (восстановленная форма)
2Cl- - 2ē
=
Cl2
восстановитель
окислитель
(восстановленная форма) (окисленная форма)
MnO4-/Mn2+
Cl2/2Cl-
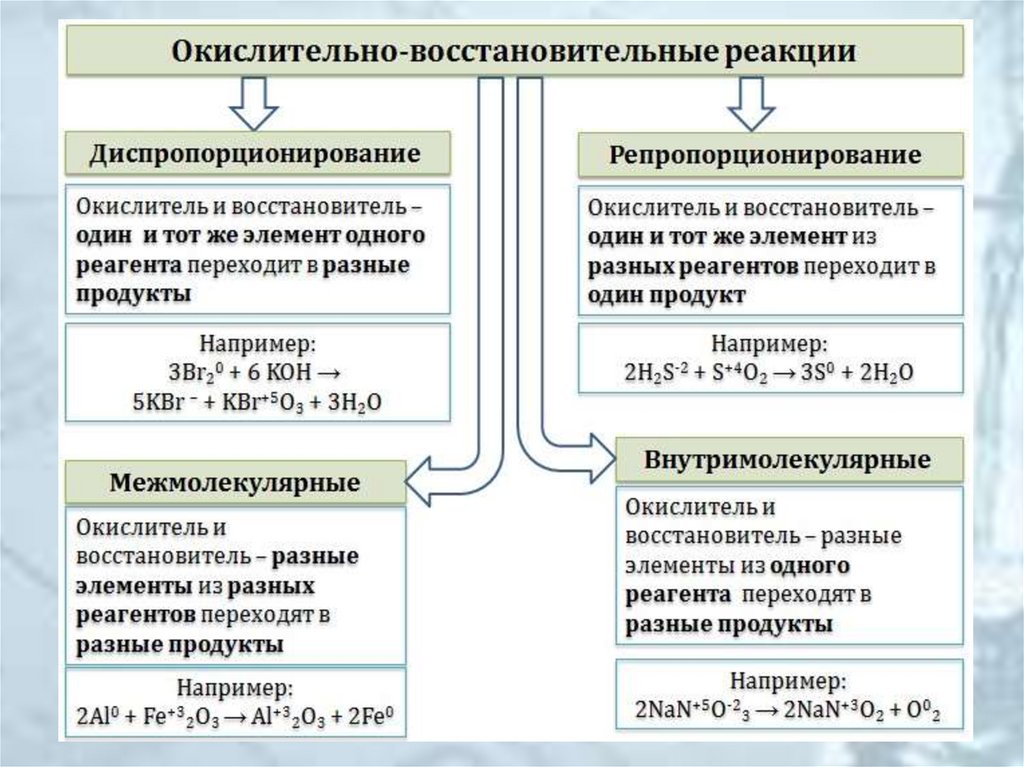
5. Типы ОВР
Межмолекулярные
I20 + 5Cl20 + 6H2O = 10HCl-I + 2HI+5O3
8KI-I + 5H2S+6O4(конц.) = 4I20 + H2S-2 + 4K2SO4 + 4H2O
Внутримолекулярные
(N-3H4)2Cr+62O7 = N20 + Cr+32O3 + 4H2O (при нагревании)
Диспропорционирование (дисмутация, самоокислениесамовосстановление)
6Cl20 + 6Ba(OH)2 = 5BaCl-I2 + Ba(Cl+5O3)2 + 6H2O
(при нагревании)
2Na2S0,+42O3 = Na2S-2 + 3Na2S+6O4 (при нагревании)
6.
7.
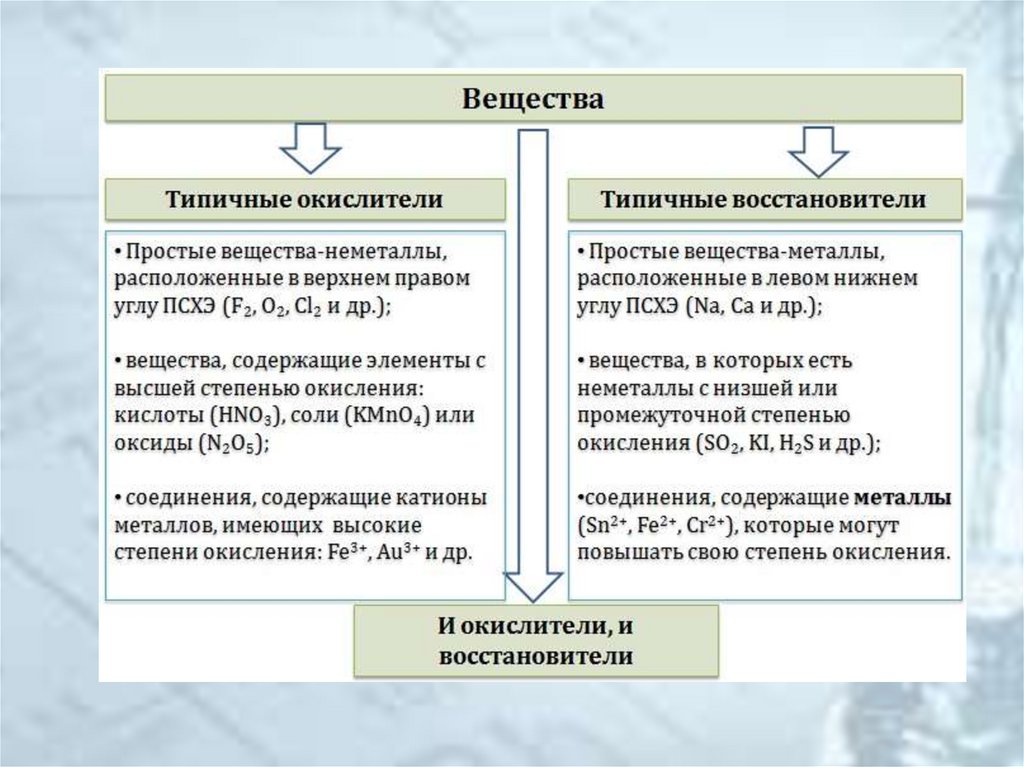
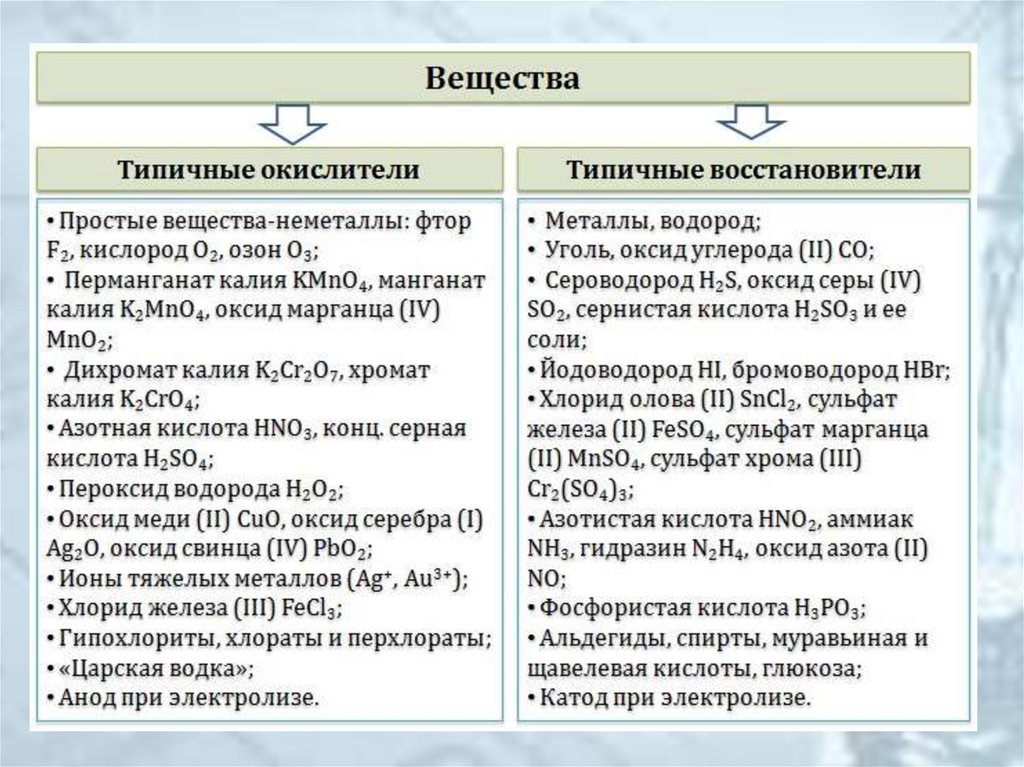
8. Классификация веществ по окислительно-восстановительным свойствам
Классификация веществ по окислительновосстановительным свойствам• Окислители
• Восстановители
• Вещества с окислительновосстановительной двойственностью (могут
быть окислителями или восстановителями в
зависимости от условий)
9.
10.
11. Вещества с окислительно-восстановительной двойственностью
• Содержат атомы с промежуточными степенямиокисления
• Простые вещества: H2, Cl2, Br2, I2, S, P
• Сложные вещества: Fe+2, Cu+, Bi+3, NO2-, ClO-,
H3P+3O3, N+2O, S+4O2, N-22H4 и др.
2KN+3O2 + 2KI-I + 2H2SO4 = I20 + 2N+2O + 2K2SO4 + 2H2O
5KN+3O2 + 2KMn+7O4 + 3H2SO4 =
= 2Mn+2SO4 + 5KN+5O3+ K2SO4 + 3H2O
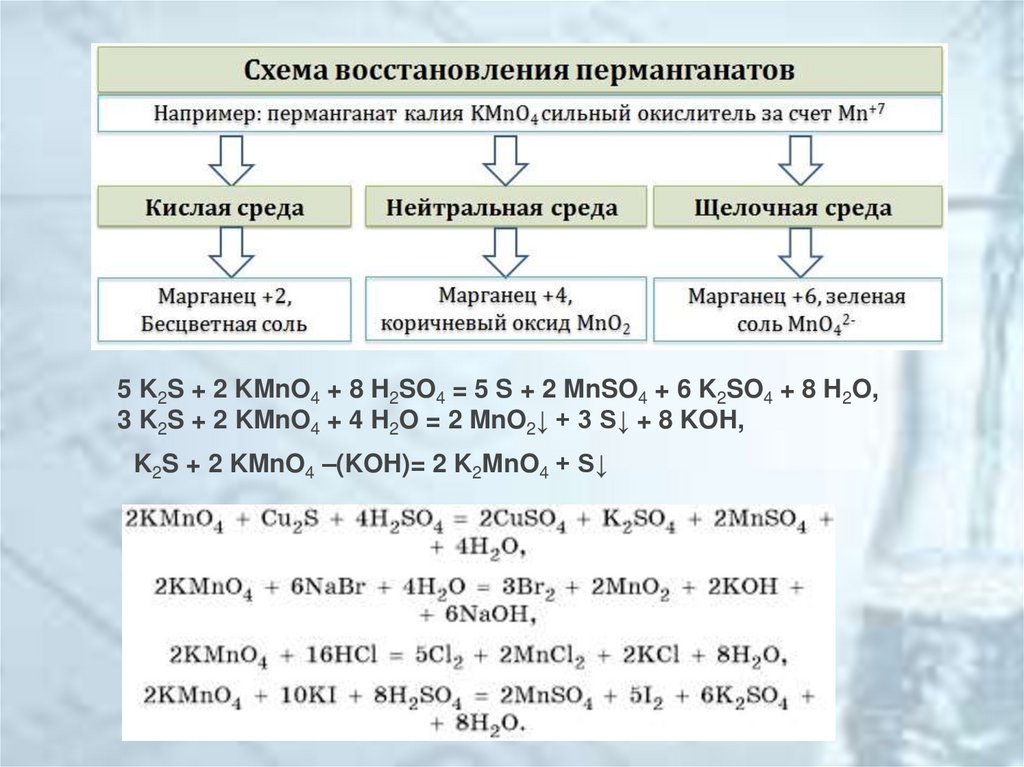
12.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
13.
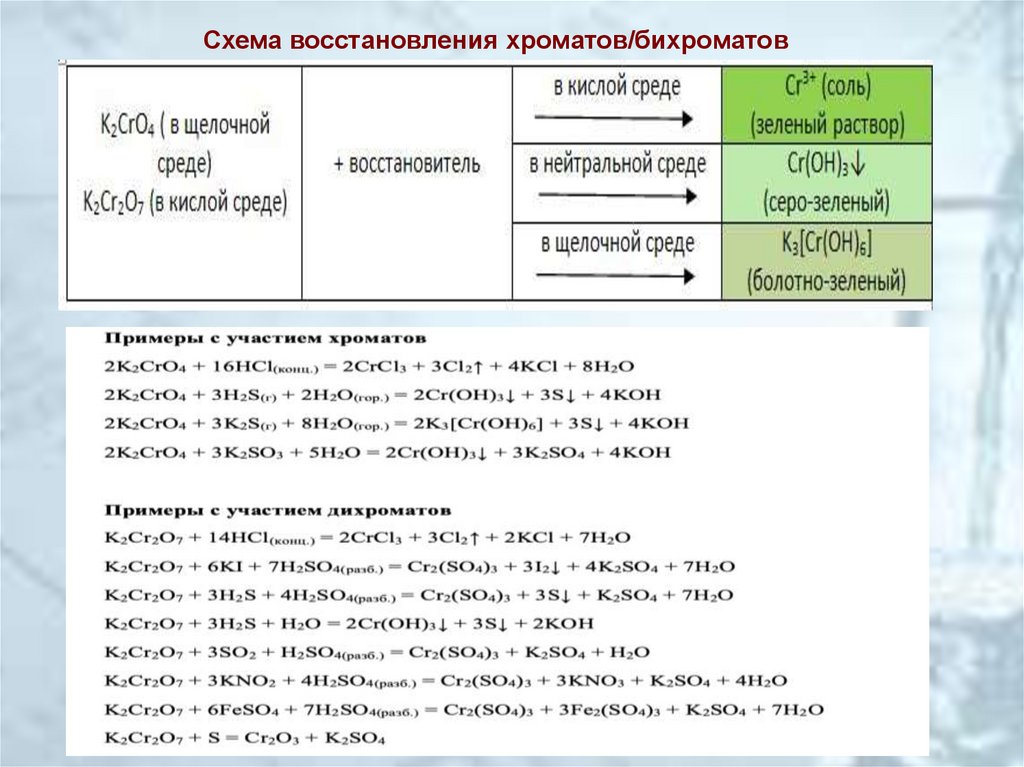
Схема восстановления хроматов/бихроматов14.
В зависимости от типа металла, образующего соль, при термическом(температурном) разложении нитратов образуются различные продукты:
если металл активный (в ряду электрохимической активности находятся до
магния), то азот восстанавливается до степени окисления +3, и
при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2
Если
металл
в
ряду
электрохимической
активности
находится правее магния и левее меди (включая магний и медь), то при
разложении
образуется
оксид
металла
в
устойчивой
степени
окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла
образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2
Ионы
металлов,
расположенных
в
ряду
электрохимической
активности
правее
меди
являются
сильными
окислителями.
При разложении нитратов они, как и N+5, участвуют в окислении
кислорода, и восстанавливаются до простых веществ, т.е. образуется
металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
15.
При нагревании нитрат аммония разлагается. При температуре до 270 оСобразуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое
степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые
вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит
контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему
арифметическому степеней окисления исходных атомов азота —
окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
16.
Термическое разложениенитрата марганца (II) сопровождается
окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида
железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
17.
Пероксид водородаПероксид водорода H2O2 содержит кислород в степени окисления -1. Такой
кислород может и повышать, и понижать степень окисления. Таким образом,
пероксид водорода проявляет и окислительные, и восстановительные
свойства.
18. Ионно-электронный метод поиска стехиометрических коэффициентов
KMn+7O4 + H2C+32O4 + H2SO4 →→ Mn+2SO4 + C+4O2 + K2SO4 + H2O
KMn+7O4 – окислитель
H2C+22O4 – восстановитель
H2SO4 – солеобразователь (фактор среды)
1. Разделим реакцию на две полуреакции
MnO4- → Mn2+ - восстановление
H2C2O4 → CO2 - окисление
19. Ионно-электронный метод поиска стехиометрических коэффициентов
2. Обеспечим материальный баланс междуправыми и левыми частями уравнений
полуреакций:
a) По числу атомов, изменяющих степень
окисления
MnO4- → Mn2+
H2C2O4 → 2CO2
20. Ионно-электронный метод поиска стехиометрических коэффициентов
b) По числу атомов кислорода, добавляя вправую или левую части уравнений ионы OH(при реакции в щелочной или нейтральной
средах) и молекулы H2O (при реакции в
любых средах)
MnO4- → Mn2+ + 4H2O
H2C2O4 → 2CO2
21. Ионно-электронный метод поиска стехиометрических коэффициентов
c) По числу атомов водорода, добавляя вправую или левую части уравнений ионы
H+ (при реакции в кислой или
нейтральной средах)
MnO4- + 8H+ = Mn2+ + 4H2O
H2C2O4 = 2CO2 + 2H+
22. Ионно-электронный метод поиска стехиометрических коэффициентов
3. Обеспечим электронный баланс,добавляя или отнимая электроны в левых
частях уравнений полуреакций (сумма
зарядов частиц в левой части равна сумме
зарядов частиц в правой части)
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O
H2C2O4 - 2ē = 2CO2 + 2H+
23. Ионно-электронный метод поиска стехиометрических коэффициентов
4. Обеспечим электронный баланс междуполуреакциями, умножив их уравнения на
подходящие коэффициенты (числа
электронов, участвующих в полуреакциях,
равны)
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O | 2
H2C2O4 - 2ē = 2CO2 + 2H+
|5
24. Ионно-электронный метод поиска стехиометрических коэффициентов
5. Запишем общее уравнение реакции вионной форме
2MnO4- + 5H2C2O4 + 16H+ =
= 2Mn2+ + 10CO2 + 10H+ + 8H2O
и сократим одинаковые частицы в обеих
частях уравнения
2MnO4- + 5H2C2O4 + 6H+ =
= 2Mn2+ + 10CO2 + 8H2O
25. Ионно-электронный метод поиска стехиометрических коэффициентов
6. Перенесём полученныестехиометрические коэффициенты в
уравнение реакции, записанное в
молекулярной форме
2KMnO4 + 5H2C2O4 + 3H2SO4 =
= 2MnSO4 + 10CO2 + K2SO4 + 8H2O
26. Ионно-электронный метод поиска стехиометрических коэффициентов
Запись должна выглядеть так:2KMnO4 + 5H2C2O4 + 3H2SO4 =
= 2MnSO4 + 10CO2 + K2SO4 + 8H2O
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O | 2
H2C2O4 - 2ē = 2CO2 + 2H+
|5
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O
27.
28.
29.
30.
31. Самопроизвольное протекание ОВР
• Для самопроизвольной химическойреакции
ΔE = Евосстановление – Еокисление > 0
• Для предварительной оценки возможности
самопроизвольного протекания реакции
можно вычислить стандартное напряжение
гальванического элемента
Δ E° = Е°восстановление – Е°окисление > 0
32. Стандартные потенциалы некоторых окислительно-восстановительных пар
ПараNO3 /NO 2
Cl2/2ClZn2+/Zn
I2/2I2H+/H2
Полуреакция
Е°(298), В
NO3 2H 2e NO 2 H 2 O
+0,836
Cl2 + 2ē 2ClZn2+ + 2ē Zn
I2 + 2ē 2I2H+ + 2ē H2
MnO 4 /Mn 2 MnO 4 8H 5e Mn 2 4H 2O
HNO2/NO HNO2 + H+ + 1ē NO + H2O
+1,359
-0,763
+0,540
0,000
+1,520
+1,084
33. Пример
Составить прогноз о самопроизвольном протеканииследующей реакции:
Cl2 + KNO2 + H2O = KNO3 + 2HCl
Cl2 + NO2- + H2O = NO3- + 2H+ + 2ClCl2 + 2ē 2Cl- - восстановление
NO3 2H 2e NO 2 H 2 O - окисление
Е oCl /2Cl 1,359 В;
Е oNO /NO 0,836 В
3
2
2
o
o
o
E
Е
Е
1,359 0,836 0,523 В 0
Cl /2Cl
NO /NO
2
3
2
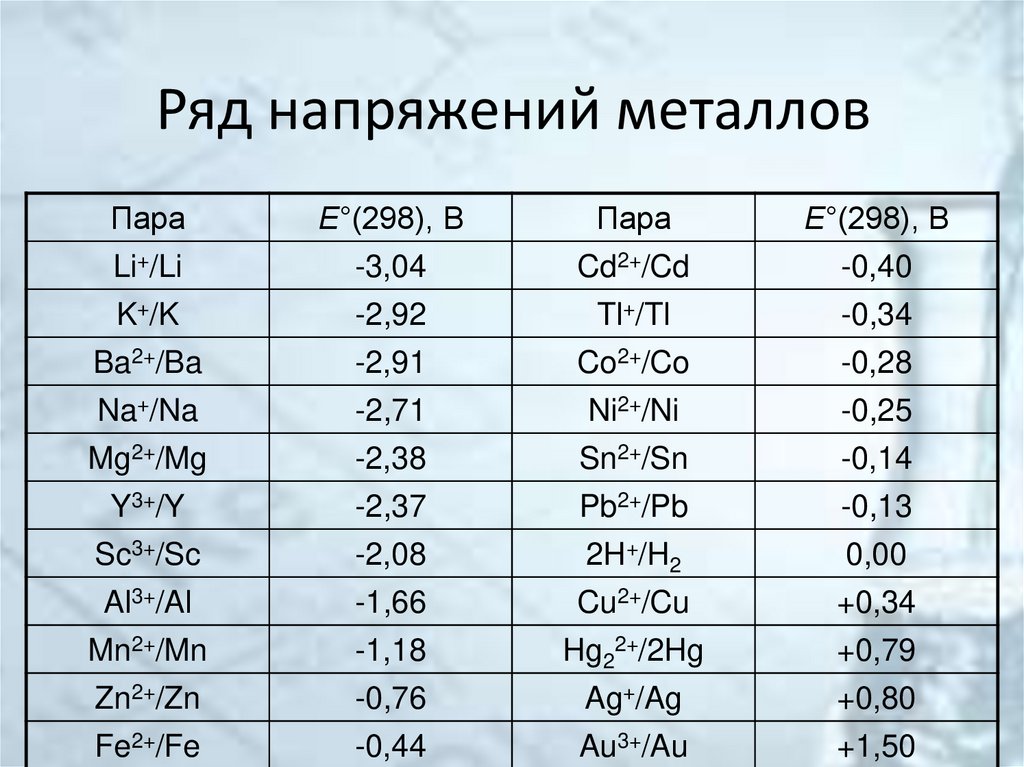
34. Ряд напряжений металлов
ПараЕ°(298), В
Пара
Е°(298), В
Li+/Li
-3,04
Cd2+/Cd
-0,40
K+/K
-2,92
Tl+/Tl
-0,34
Ba2+/Ba
-2,91
Co2+/Co
-0,28
Na+/Na
-2,71
Ni2+/Ni
-0,25
Mg2+/Mg
-2,38
Sn2+/Sn
-0,14
Y3+/Y
-2,37
Pb2+/Pb
-0,13
Sc3+/Sc
-2,08
2H+/H2
0,00
Al3+/Al
-1,66
Cu2+/Cu
+0,34
Mn2+/Mn
-1,18
Hg22+/2Hg
+0,79
Zn2+/Zn
-0,76
Ag+/Ag
+0,80
Fe2+/Fe
-0,44
Au3+/Au
+1,50



























 Химия
Химия








