Похожие презентации:
Окислительно-восстановительные реакции в аналитической химии
1.
Правила поведения на вебинареАНАЛИТИЧЕСКАЯ
ХИМИЯ
1. Перед вебинаром подготовь таблицу Менделеева, таблицу
растворимости, блокнот для записей. Отключи звук и видео в
zoom
Лекции
2. Вопросы и ответы на них фиксируй в блокноте
3.
4.
7-8.
ОкислительноОтветы в чат не пиши, участники работают в разном темпе и
восстановительные
ответы могут запутать того, кто еще ищет ответ
реакции в аналитической
Будь терпелив и выдержан, это общий курс для
ребят с разным
химии
уровнем подготовки, а не индивидуальные занятия.
Чем добрее и уважительнее поведешь себя на курсе – тем
больше повезет на ЕГЭ
5. Возникающие вопросы фиксируй в блокноте, в конце вебинара
будет возможность их задать в чате.
Не ответили на вопрос – не расстраивайся, напиши его в группе
VK
2.
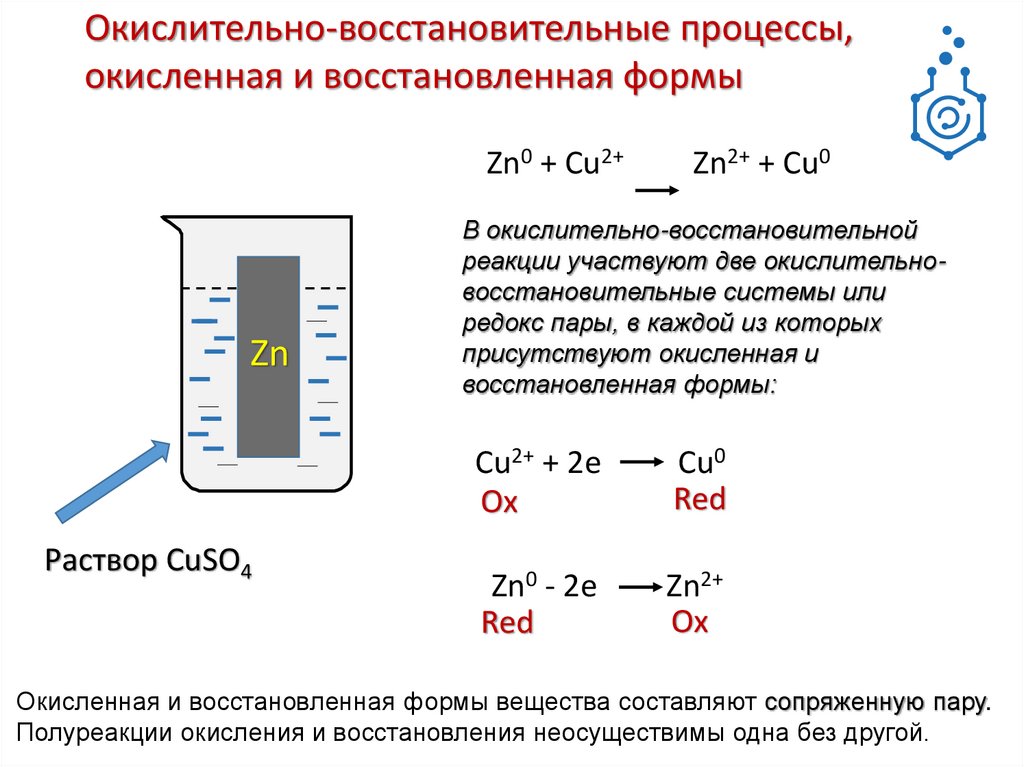
Окислительно-восстановительные процессы,окисленная и восстановленная формы
Zn0 + Cu2+
Zn
Раствор CuSO4
Zn2+ + Cu0
В окислительно-восстановительной
реакции участвуют две окислительновосстановительные системы или
редокс пары, в каждой из которых
присутствуют окисленная и
восстановленная формы:
Cu2+ + 2е
Ox
Cu0
Red
Zn0 - 2е
Red
Zn2+
Ox
Окисленная и восстановленная формы вещества составляют сопряженную пару.
Полуреакции окисления и восстановления неосуществимы одна без другой.
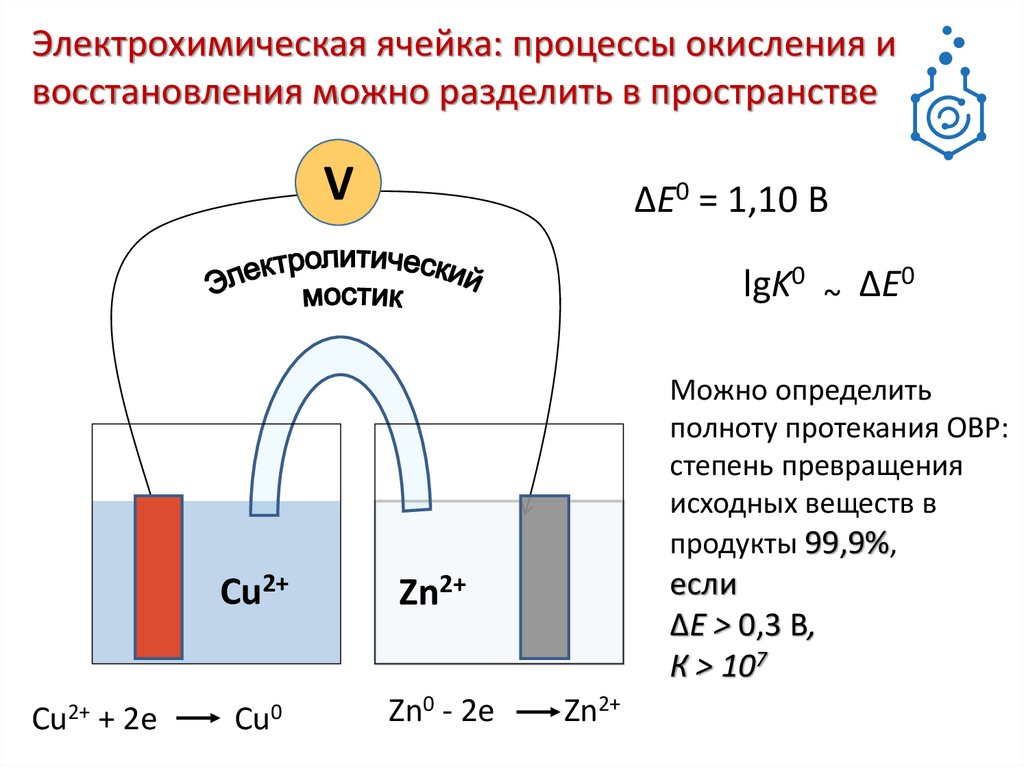
3.
Электрохимическая ячейка: процессы окисления ивосстановления можно разделить в пространстве
V
∆E0 = 1,10 В
lgK0 ~ ∆E0
Можно определить
полноту протекания ОВР:
степень превращения
исходных веществ в
продукты 99,9%,
Cu2+
+ 2е
Cu2+
Zn2+
Cu0
Zn0 - 2е
если
∆E > 0,3 В,
К > 107
Zn2+
4.
Электроды сравнения:стандартный водородный электрод (с.в.э.)
1 – платиновая пластинка,
покрытая платиновой чернью
2 – раствор H2SO4,
a(H+) = 1 моль/л
2H+ +2e
1
2
H20
E0(2H+,H2) = 0 В
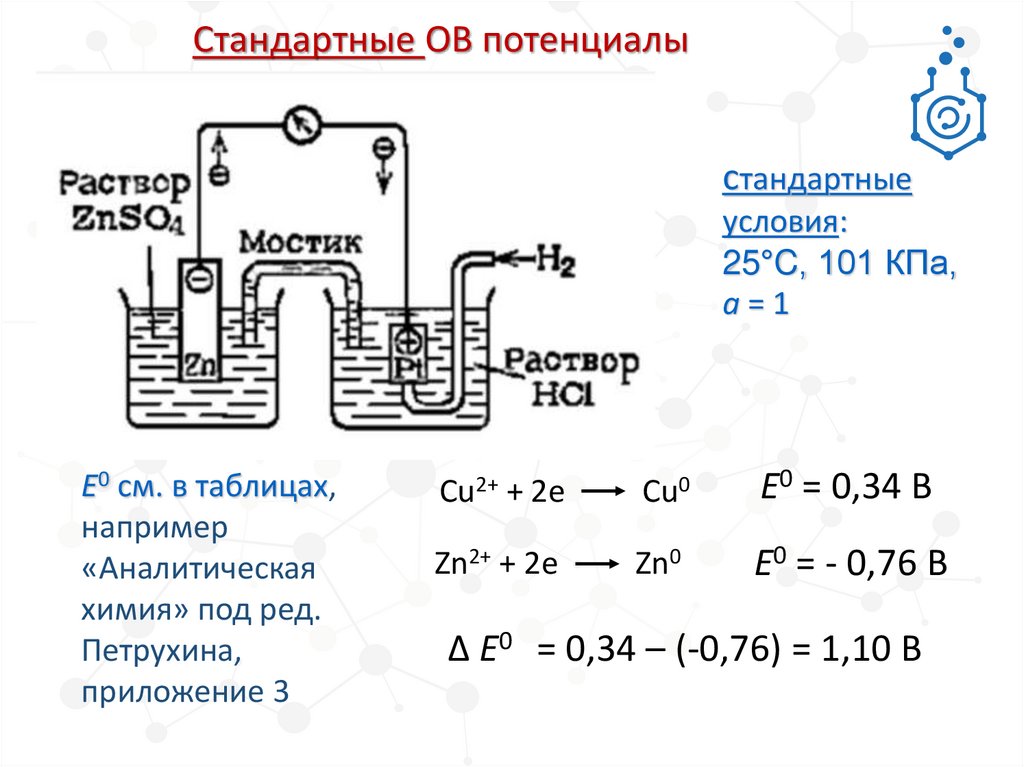
5.
Cтандартные ОВ потенциалыcтандартные
условия:
25°C, 101 КПа,
а=1
Е0 см. в таблицах,
например
«Аналитическая
химия» под ред.
Петрухина,
приложение 3
Cu2+ + 2е
Cu0
E0 = 0,34 В
Zn2+ + 2е
Zn0
E0 = - 0,76 В
∆ E0 = 0,34 – (-0,76) = 1,10 В
6.
E0 - количественная характеристикасилы окислителя и восстановителя
Ox + ze
Окисленная
форма
Cu2+
NO3–
NO3–
NO3–
Red
Восстановленная Е , В
форма
Cu
NO
NO2
NO
+0,34
+0,96
+0,81
-0,14
Среда
кислая
кислая
щелочн.
Чем выше значение Е0, тем более сильным окислителем
является оксиленная форма в стандартных условиях.
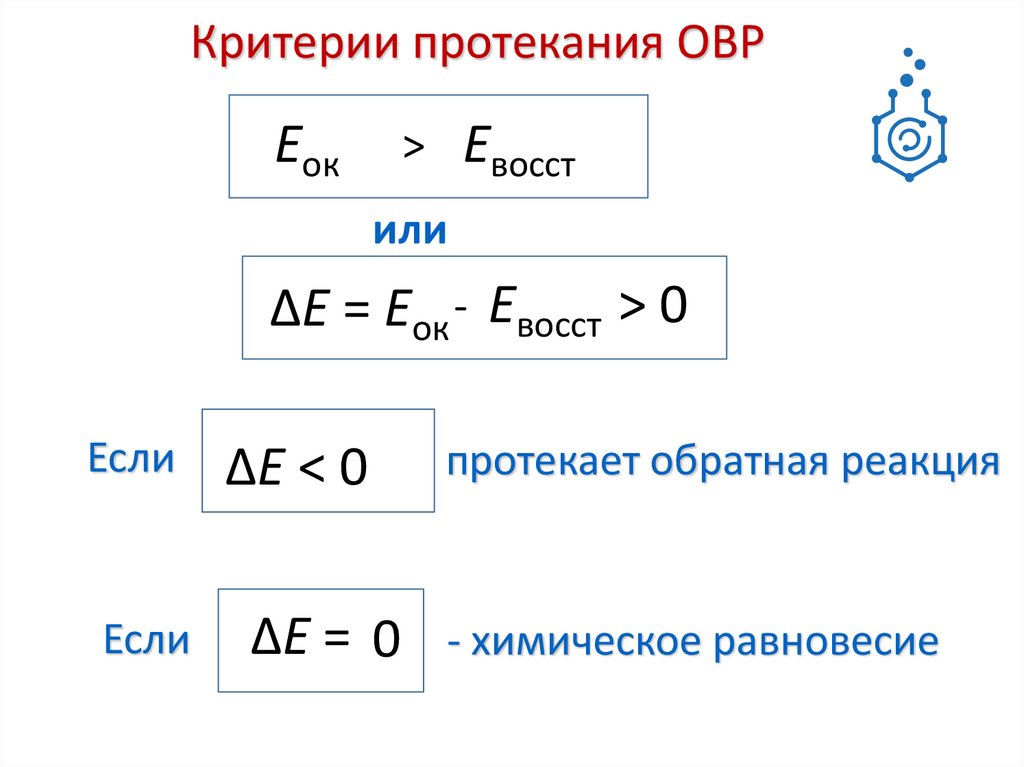
7.
Критерии протекания ОВРЕок
Евосст
>
или
∆Е = Еок - Евосст > 0
Если
Если
∆Е < 0
протекает обратная реакция
∆Е = 0 - химическое равновесие
8.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНОГО
ПОТЕНЦИАЛА
• 1.Соотношение концентраций - [ Ox ] / [ Red ]
• 2.Температура
• 3.Ионная сила раствора
• 4.Концентрация ионов водорода
• 5.Побочные реакции комплексообразования и
осаждения, приводящие к образованию различных
форм компонентов окислительно-восстановительной
пары.
9.
Если условия отличаются отстандартных: уравнение Нернста
Для ОВ системы (полуреакции), выражаемой
уравнением Ox + ne
Eox / red E
o
Red
ox / red
RT aox
ln
nF ared
или
Eox / red E
o
ox / red
0,059 aox
lg
n
ared
10.
Уравнение Нернста, примерыa) Cu2+ +2e
ECu
2
/ Cu
E
б) 2H+ +2e
E2 H
/H
2
Cu
o
2
Cu / Cu
0,059
2
lg[Cu ]
2
H2
0,059
2
0
lg[ H ] 0,059 pH
2
11.
Уравнение Нернста, примерыв) Fe3+ + e
EFe
3
/ Fe
2
E
Fe2+
o
3
3
Fe / Fe
г) NO3- + 4H+ + 3e
ENO
3
/ NO
E
o
NO
3
2
0,059 [ Fe ]
lg
2
1
[ Fe ]
NO + 2H2O
0,059
4
lg[ NO3 ][ H ]
/ NO
3
12.
Семинар: примеры задач наиспользование уравнения Нернста
1. Рассчитать равновесный потенциал никелевой
пластинки, опущенной в 0,01 М раствор сульфата
никеля, если стандартный потенциал ОВ системы
Ni2+ +2e
Ni
равен -0,25 В.
0,059
2
E Ni / Ni E Ni / Ni
lg[ Ni ]
2
0,059
0,059
0,25
lg[ 0,01] 0,25
( 2)
2
2
2
o
2
13.
Семинар: примеры задач наиспользование уравнения Нернста
2. Рассчитать значение равновесного потенциала
окислительно-восстановительной пары
Ti3+ + e
Ti2+
при соотношении концентраций окисленной и
восстановленной форм 10 к 1.
Стандартный ОВ потенциал системы равен -0,37 В.
ETi
3
/ Ti
2
o
E Ti / Ti
3
3
2
0,059 [Ti ]
lg 2
1
[Ti ]
0,059
0,37
lg10 0,37 0,059
1
14.
Семинар: примеры задач наиспользование уравнения Нернста
3. Рассчитать значение равновесного потенциала
окислительно-восстановительной пары
Cr2O72- + 14H+ + 6e
2Cr3+ + 7H2O
при рН = 2, [Cr2O72-] = 0,1 M, [Cr3+] = 0,01 M.
Стандартный ОВ потенциал системы равен 1,33 В.
E E
o
2
14
0,059 [Cr2O7 ][ H ]
lg
3
2
6
[Cr ]
2 14
0,059 [0,1][10 ]
1,33
lg
2
6
[0,01]
1,33 0,01( 25)
15.
Семинар: как определить направлениепротекания реакции?
Пример 1
3Cu + 8HNO3
восст
ок
3Cu(NO3)2 + 2NO + 4H2O
Cu2+ + 2ē → Cu
NO3– + 4H+ + 3ē → NO + 2H2O
E0 = 0,34 В
E0 = 0,96 В
∆Е0 = Е0(ок) – Е0(восст) = 0,96 – 0,34 = 0,62 В
Реакция протекает в заданном направлении
16.
Семинар: как определить направлениепротекания реакции?
Пример 2
I2 + Br2 + H2O
HIO3 + HBr
ок
Br2 + 2ē → 2Br2IO3– + 12H+ + 10ē → I2 + 6H2O
E0 = 1,07 В
E0 = 1,19 В
∆Е0 = Е0(ок) – Е0(восст) < 0
Реакция протекает в обратном направлении
17.
Семинар: как определить полнотупротекания реакции?
Полнота протекания ОВ реакции
определяется разностью Е1 и Е2:
n1n2 E
lg K
0,059
Реакция идет практически до конца, если
степень превращения исходныхвеществ в
продукты 99,9%.
При этом ΔЕ > 0,3 В,
K ≥ 107
18.
Реальный (формальный) потенциалОВ системы
Реальный (формальный) потенциал ОВ системы
равен равновесному потенциалу при общих
концентрациях окисленной и восстановленной
форм 1 М и заданных концентрациях всех других
веществ, присутствующих в системе.
19.
Реальный потенциал с учетом ионнойсилы раствора
Eox / red E
E
E
o'
ox / red
o
ox / red
E
o
o
ox / red
0,059 aox
lg
ared
n
0,059 ox cox
lg
red cred
n
ox / red
Например, для ОВ пары
Fe3+ + e →Fe2+
0,059 ox
lg
n
red
I=0
E0 = 0,77 B
I = 0,01
E0’ = 0,76 B
I = 0,1
E0’ = 0,74 B
20.
Реальный потенциал в системах, вкоторых участвуют Н+
Расчет реального потенциала на примере
окислительно-восстановительной пары:
Cr2O72- + 14H+ + 6e
E Eo
Eo
2Cr3+ + 7H2O
0,059 [Cr2O7 2 ][ H ]14
lg
3
2
6
[Cr ]
0,059 [Cr2O7 2 ] 0,059
14
lg
lg[
H
]
3
2
6
6
[Cr ]
Реальный потенциал Е0’ ([Cr2O72-] =[Cr3+] = 1 М):
E E
o'
o
0,059
0,059 14
14
o
lg[ H ] E
pH
6
6
21.
Реальный потенциал в системах, вкоторых участвуют Н+
В общем случае:
Ox + mH+ + ne → Red + …
3. E
o'
Eo x /red
0
0,059
m pH
n
Пример: найти Е0’ при рН=1 и рН=3 ОВ системы
MnO4- + 8H+ + 5e → Mn2+ + 4H2O.
E0(MnO4-, H+/ Mn2+) = 1,52 В.
22.
Реальный потенциал с учетом побочныхреакций комплексообразования
EFe
3
/ Fe
2
E o Fe
3
/ Fe
2
0,059 [ Fe3 ]
lg
2
1
[ Fe ]
Ион Fe3+ образует ряд комплексных соединений с ионом F-:
Fe3+ + F- ↔ [FeF]2+
[[ FeF ]2 ]
[ Fe3 ]
[ Fe3 ][ F ]
3
[ Fe ]
При [FeF]2+ = [F-] = 1 M
E
o'
3
Fe / Fe
2
E
o
3
Fe / Fe
2
[[ FeF ]2 ]
[F ]
1
0,059 1
lg
1
23.
С учетом побочных реакцийкомплексообразования в общем случае:
Если в комплекс связана окисленная форма:
E o'Ox / Re d
E
o
Ox / Re d
0,059
1
lg
n
OxL
Если в комплекс связана восстановленная форма:
E o'Ox / Re d
E
o
Ox / Re d
0,059
lg Re dL
n
Если в комплекс связаны обе формы:
o'
E Ox / Re d
E
o
Ox / Re d
0,059 Re dL
lg
n
OxL
24.
Реальный потенциал с учетом побочныхреакций осаждения
Как определить направление реакции между
Cu2+/Cu+ и I2/2I- ?
E0(Cu2+/Cu+) = 0,16 В ;
E0(I2/2I-) = 0,54 В ;
Ks(CuI) = 10-12
На основе значений стандартных окислительновосстановительных потенциалов можно заключить, что ионы Cu+
должны окисляться I2. Однако на практике реакция идет в
противоположном направлении:
2Cu2+ + 4I- → 2CuI ↓+ I2
Это связано с образованием малорастворимого
соединения CuI, т.е. с протеканием побочной реакции осаждения.
Поэтому для оценки окислительно-восстановительных свойств
пары Cu2+/Cu+ необходимо рассчитать реальный потенциал.
25.
Реальный потенциал с учетом побочныхреакций осаждения
Равновесная концентрация ионов Cu+:
Ks(CuI) = [Cu+][I-], отсюда [Сu+]= Ks/[I-].
ECu
2
/ Cu
E oCu
2
E
/ Cu
o'
E Cu / Cu
2
o
2
2
Cu / Cu
0,059 [Cu ]
lg
1
[Cu ]
0,059 [Cu 2 ][ I ]
lg
1
K s (CuI )
0,16 0,059 12 0,87B
26.
Кривые ОВ титрованияРассмотрим титрование FeSO4
раствором KMnO4 в кислой среде:
Fe3+ + e →Fe2+
MnO4- + 8H+ + 5e → Mn2+ + 4H2O
1. Нетитрованный раствор – потенциал не рассчитывают
2. Недотитрованный раствор – потенциал определяется
парой титруемого вещества
EFe
3
/ Fe
2
E
o
3
Fe / Fe
2
0,059 [ Fe3 ]
lg
1
[ Fe2 ]
27.
Кривые ОВ титрования3. Отитрованный раствор – потенциал в точке
эквивалентности рассчитывают по формуле:
E
o
n1E1
o
n2 E2
n1 n2
4. Перетитрованный раствор – потенциал определяется
парой титранта
MnO4- + 8H+ + 5e →Mn2+ + 4H2O
28.
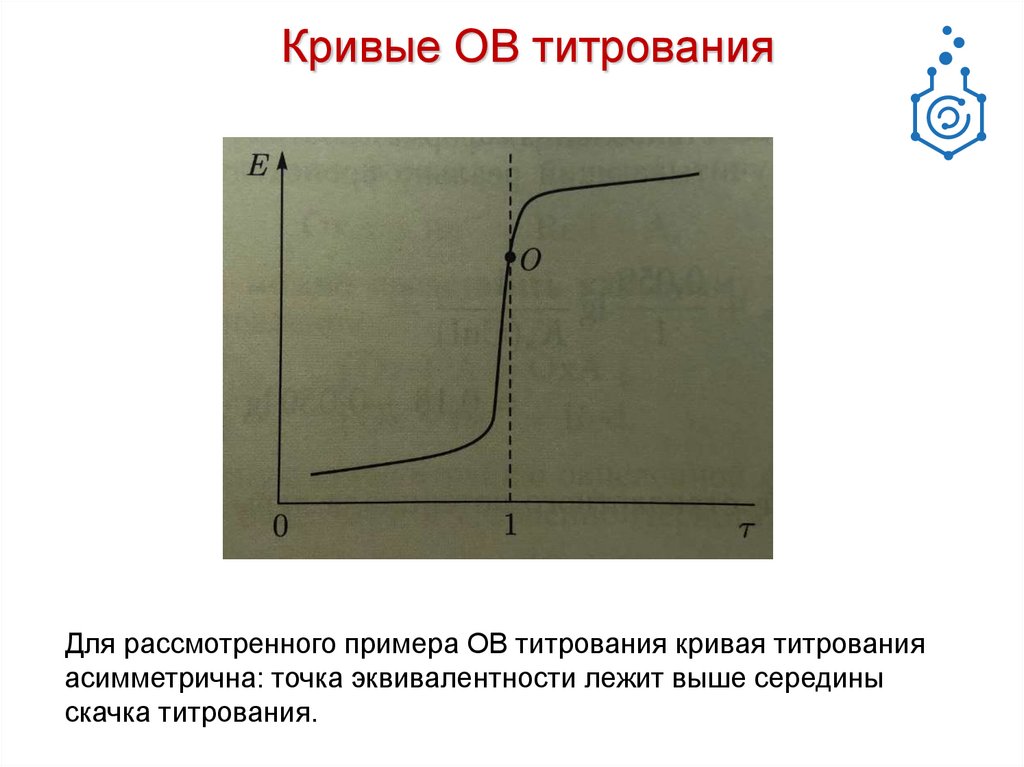
Кривые ОВ титрованияДля рассмотренного примера ОВ титрования кривая титрования
асимметрична: точка эквивалентности лежит выше середины
скачка титрования.
29.
Подготовка к КР 41. Напишите формулу для расчета окислительно-восстановительного
потенциала в точке эквивалентности. Чему равно значение
окислительно-восстановительного потенциала в точке эквивалентности
при титровании 0,05 н. раствора I2 0,05 н. раствором Na2S2O3, если
0
EI 2
0,54 B, à ES4O2
0
2I-
6
2S2O32
0,09 B
Ответ подтвердите расчётом и запишите уравнения соответствующией
химической реакции и полуреакций.
Решение:
n1E1o n2 E2o
E
n1 n2
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
I2 + 2e → 2IS4O62- +2e → 2S2O32-
E = 0,315 В
30.
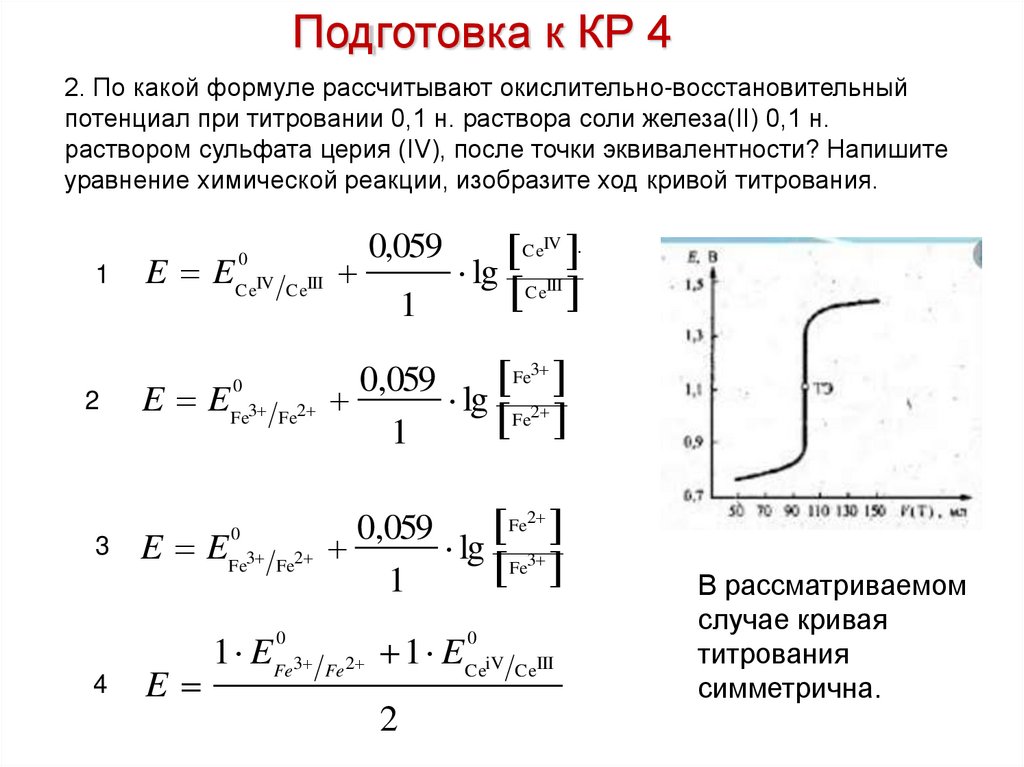
Подготовка к КР 42. По какой формуле рассчитывают окислительно-восстановительный
потенциал при титровании 0,1 н. раствора соли железа(II) 0,1 н.
раствором сульфата церия (IV), после точки эквивалентности? Напишите
уравнение химической реакции, изобразите ход кривой титрования.
1
2
3
E ECeIV
0
E EFe3
CeIII
0
E EFe3
Fe2
0
Fe2
1 E Fe3
Fe3
0,059
lg Fe2
1
Fe2
0,059
lg Fe3
1
0
4
E
CeIV
lg CeIII
1
0,059
1 ECeiV CeIII
0
Fe 2
2
В рассматриваемом
случае кривая
титрования
симметрична.
31.
Подготовка к КР 43. Сколько граммов перманганата калия нужно взять, чтобы приготовить
1 л раствора KMnO4 с концентрацией приблизительно 0,1 моль-экв/л для
титрования в кислой среде.
MnO4– + 8H+ + 5e = Mn2+ + 4H2O
f = 1/5
MnO4– + 2H2O + 3e = MnO2↓ + 4OH–
f = 1/3
MnO4– + e = MnO42–
f=1
10Cl– + 2MnO4– + 16H+ = 5Cl2↑ + Mn2+ + 8H2O (отсутствие Cl-)
m( A) 1000
c( f экв
ýêâ ( A))
M ( f ýêâ
экв ( A)) V
1
1
c( KMnO4 ) V M ( KMnO4 )
0,1 1000 158 / 5
5
5
m( KMnO4 )
3,16
1000
1000
32.
ПЕРМАНГАНАТОМЕТРИЯСтандартизация перманганата проводится по оксалат-ионам
(Na2C2O4, (NH4)2C2O4, H2C2O4):
5H2C2O4 + 2KMnO4 + 3H2O = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
MnO4- + 5e + 8H+ =Mn2+ + 4H2O
ƒэкв =1/5
C2O42- - 2e = 2CO2
ƒэкв = 1/2
Скорость реакции низка, поэтому раствор оксалат-ионов перед
началом титрования нагревают до 70-80 оС.
По мере протекания реакции в системе накапливаются ионы Mn2+,
катализирующие реакцию, т.о. данная реакция - автокаталитическая.
В свежеприготовленном растворе перманганата возможны реакции,
приводящие к уменьшению концентрации MnO4-:
4MnO4- +2H2O →↓ 4MnO2 + 3O2 +4OHПоэтому раствор перманганата кипятят, а затем фильтруют для удаления
MnO2.
33.
Перманганатометрия – прямое титрование34.
Перманганатометрия – определениеокислителей
35.
Окислительно-восстановительные индикаторыЭто вещества, обладающие ОВ свойствами, у которых окисленная и
восстановленная формы имеют разную окраску:
IndOx + ne = IndRed
Уравнение Нернста для о-в индикаторов:
E(IndOx/IndRed) = E0(IndOx/IndRed) + 0,059lg [IndOx]/[IndRed]
Считается, что переход окраски наблюдается в интервале
соотношения окисленной и восстановленной форм индикатора
от 0,1 до 10.
Интервал потенциалов перехода окраски о-в индикаторов
рассчитывается по формуле:
ΔE(IndOx/IndRed) = E0(IndOx/IndRed) ± 0,059/n
36.
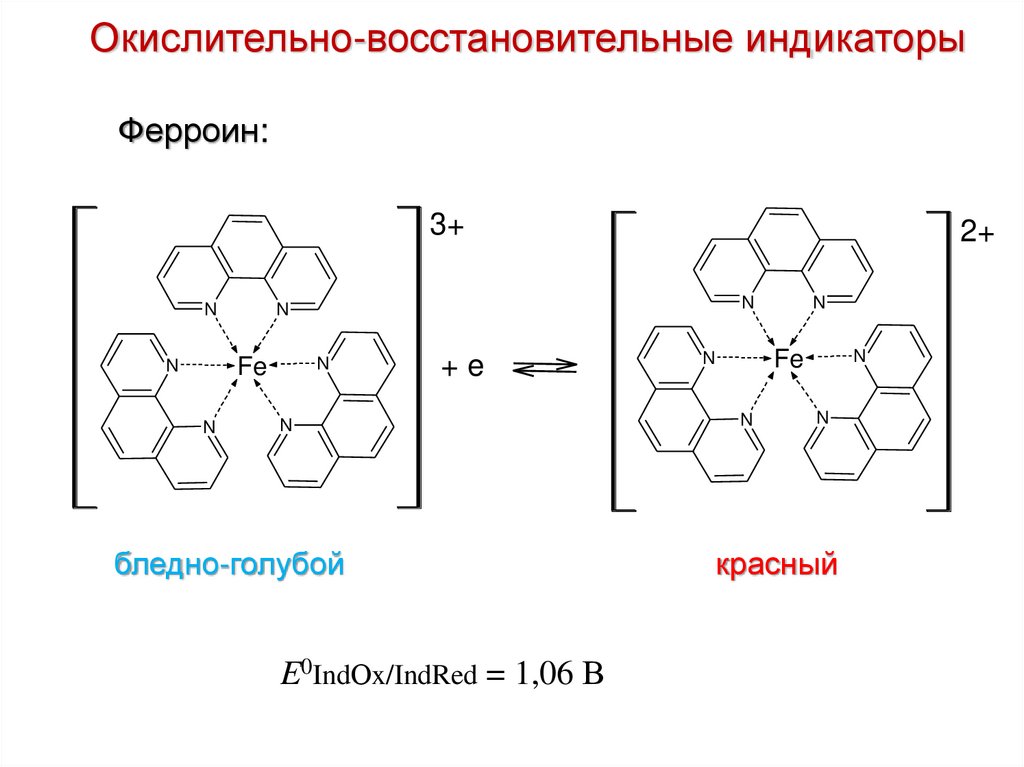
Окислительно-восстановительные индикаторыФерроин:
3+
N
N
N
N
Fe
N
2+
N
+e
N
бледно-голубой
E0IndОx/IndRed = 1,06 В
N
Fe
N
N
N
N
красный





























 Химия
Химия








