Похожие презентации:
1бСТР ЛЕКЦИЯ № 1 Основы хим
1.
Лекция №1«ОСНОВЫ ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКИ»
Новоселова Елена Викторовна
2.
Учебные вопросы:1. Основные понятия термодинамики
2. Первый закон термодинамики
3. Энтропия. Второй и третий законы
термодинамики
4. Энергия Гиббса
3.
Литература:1. Коровин, Н.В. Общая химия /Н.В. Коровин. − М.:
Академия, 2013. – 488 с.
2. Глинка, Н.Л. Общая химия: учеб. пособие / Н.Л.
Глинка.− М.: КНОРУС, 2016. – 750 с.
3. Основы химической термодинамики: учеб.
пособие / В.В. Грушина и др. − М.: МАДИ, 2014. −
72 с. (№ 792, (14Е190))
4. Основы химической термодинамики: учеб.
пособие / Е.А. Елисеева и др. − М.: МАДИ, 2023. −
88 с. (№ 937, (23Е653))
4.
1. Основные понятия термодинамикиХимическая
термодинамика
–
наука
о
превращениях одних форм энергии в другие (при
протекании химической реакции за счёт теплового,
хаотического движения молекул, атомов, ионов).
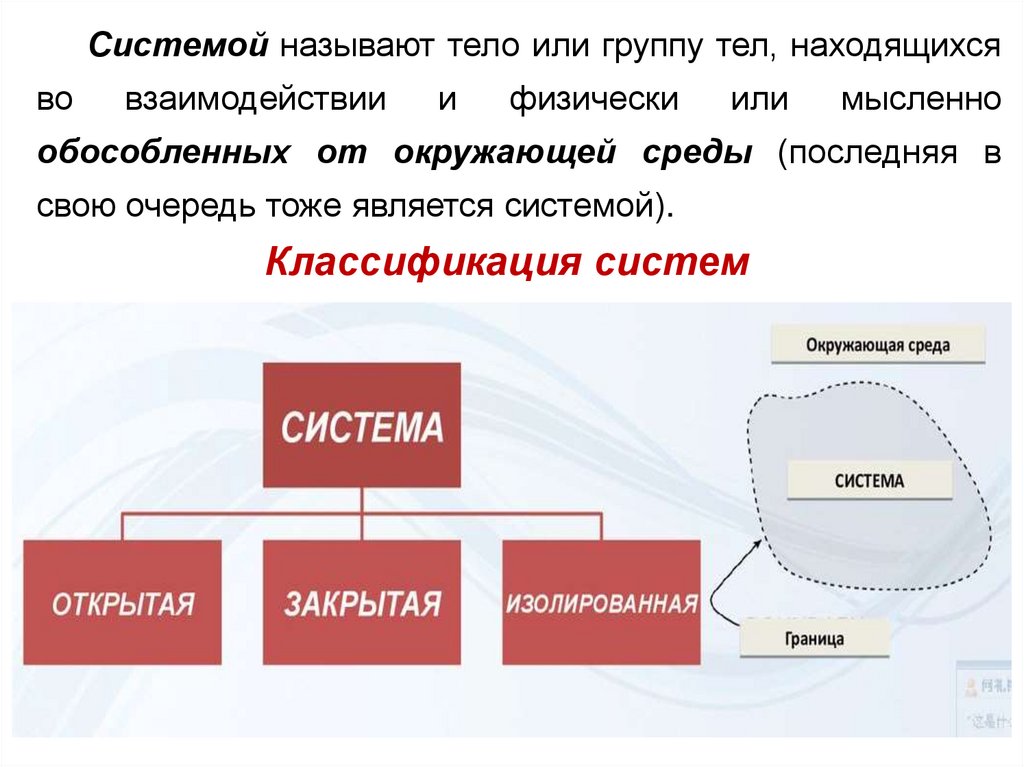
Системой называют тело или группу тел,
находящихся во взаимодействии и физически
или
мысленно
обособленных
от
окружающей среды (последняя в свою
очередь тоже является системой).
5.
Системой называют тело или группу тел, находящихсяво
взаимодействии
и
физически
или
мысленно
обособленных от окружающей среды (последняя в
свою очередь тоже является системой).
Классификация систем
6.
Системаназывается
изолированной,
если она не обменивается с окружающей
средой энергией и веществом.
Система называется закрытой, если
она обменивается с окружающей средой
энергией, но не обменивается веществом.
Система называется открытой, если
она обменивается с окружающей средой
энергией и веществом.
7.
Гомогенная система – сплошная однороднаясистема, любое свойство которой имеет во всех частях
одинаковое значение или непрерывно изменяется
от точки к точке.
Гетерогенная система - система, отдельные части
которой различаются по свойствам и отделены друг
от друга поверхностями раздела.
Фаза - это однородная часть неоднородной
(гетерогенной) системы, имеющая определенный
химический состав и свойства, отделенная от других
фаз поверхностью раздела, и которая в принципе
может быть выделена из системы каким-либо
механическим способом.
8.
Химическая система - совокупность исходныхвеществ и продуктов химической реакции:
СН4(г) + 2O2(г) = CO2(г) + 2Н2О(г)
исходные вещества
состояние 1
продукты
состояние 2
Термодинамические параметры - величины,
характеризующие макроскопические свойства
системы, например: давление, объем, температура.
Уравнения состояния - количественные
зависимости между параметрами системы.
Например, уравнение Менделеева –
Клапейрона):
рV = nRT.
9.
10.
11.
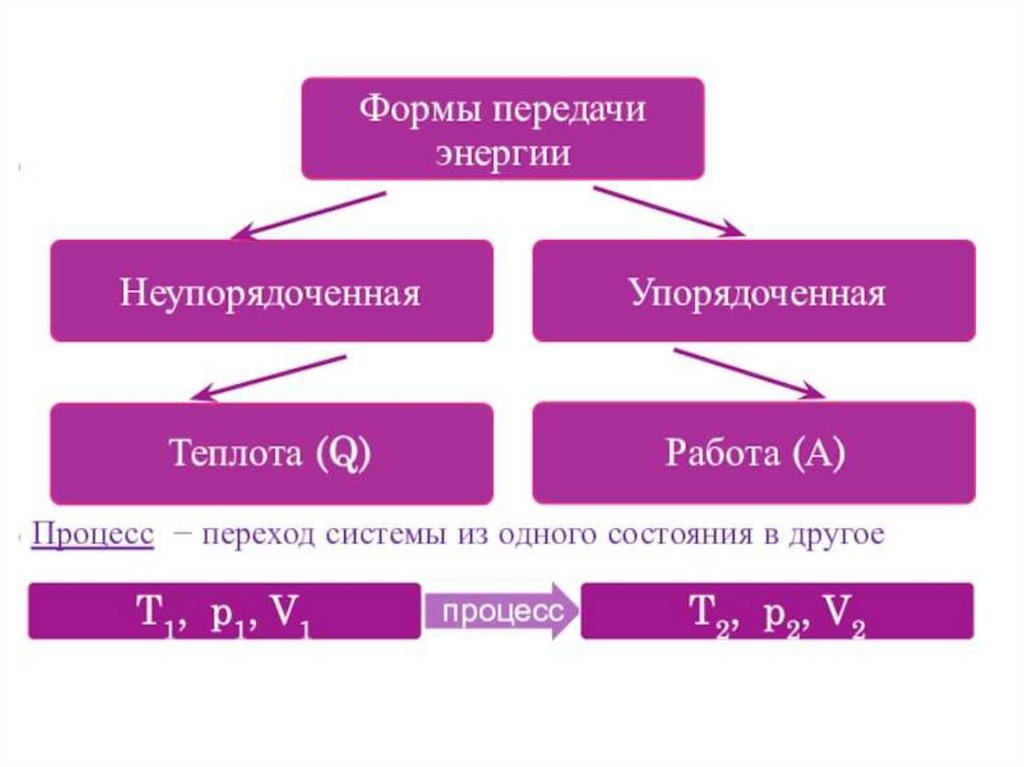
Теплота (Q) – неупорядоченная формапередачи
энергии
при
столкновении
хаотически движущихся молекул и атомов
соприкасающихся
путем
тел
(осуществляется
теплопроводности
или
теплоизлучения ).
Работа (A) – упорядоченная форма
передачи энергии, общей чертой которой
является перемещение масс, состоящих из
большого числа молекул, под действием
каких-либо сил.
12.
Функция состояния – величина,определяемая параметрами состояния, однозначно
характеризующая систему и не зависящая от пути
достижения данного состояния данной системой.
Свойства функции состояния:
1. Функция состояния системы не зависит от пути
достижения данного состояния данной системой.
2.
Функция
состояния
есть
величина
аддитивная:
функция состояния целого (системы) равна сумме функций
состояния её частей.
3. Абсолютное значение функции состояния определить,
как правило, нельзя, но её изменение при переходе системы
из одного состояния в другое - величина определённая и
измеряемая.
13.
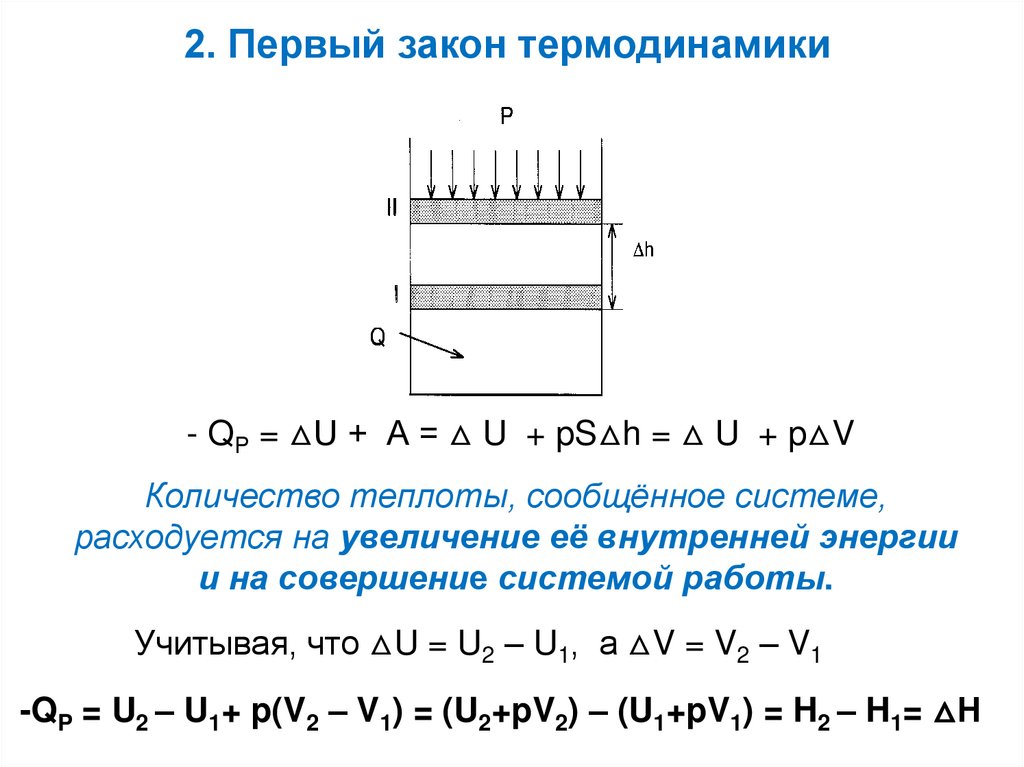
2. Первый закон термодинамики- QР = △U + А = △ U + pS△h = △ U + p△V
Количество теплоты, сообщённое системе,
расходуется на увеличение её внутренней энергии
и на совершение системой работы.
Учитывая, что △U = U2 – U1, а △V = V2 – V1
-QP = U2 – U1+ p(V2 – V1) = (U2+pV2) – (U1+pV1) = H2 – H1= △Н
14.
(H = U + pV) - энтальпия или энергосодержаниеЭнтальпия является функцией состояния.
Использование относительных значений
энтальпий
Н:
за точку отсчёта принимают значение энтальпии
образования простых веществ при 298 К (25оС),
давлении 101,3 кПа (1атм.), если они при этих условиях,
называемых стандартными, находятся в устойчивом
состоянии.
Стандартные энтальпии образования всех
простых веществ, устойчивых в стандартном
состоянии, равны нулю.
=0
15.
Энтальпия сложного вещества–
стандартная
энтальпия образования – равна количеству теплоты с
обратным знаком, выделяющейся или поглощающейся
при
образовании
веществ,
1
моля
находящихся
вещества
в
из
устойчивых
простых
агрегатных
состояниях в стандартных условиях:
H2(г) + 0,5 O2(г) → H2O(г) △H0298 = -241,8 кДж/моль
Стандартные энтальпии образования определены для
большого
числа
веществ
и
сведены
в
таблицы
термодинамических величин, измеряются в кДж/моль.
16.
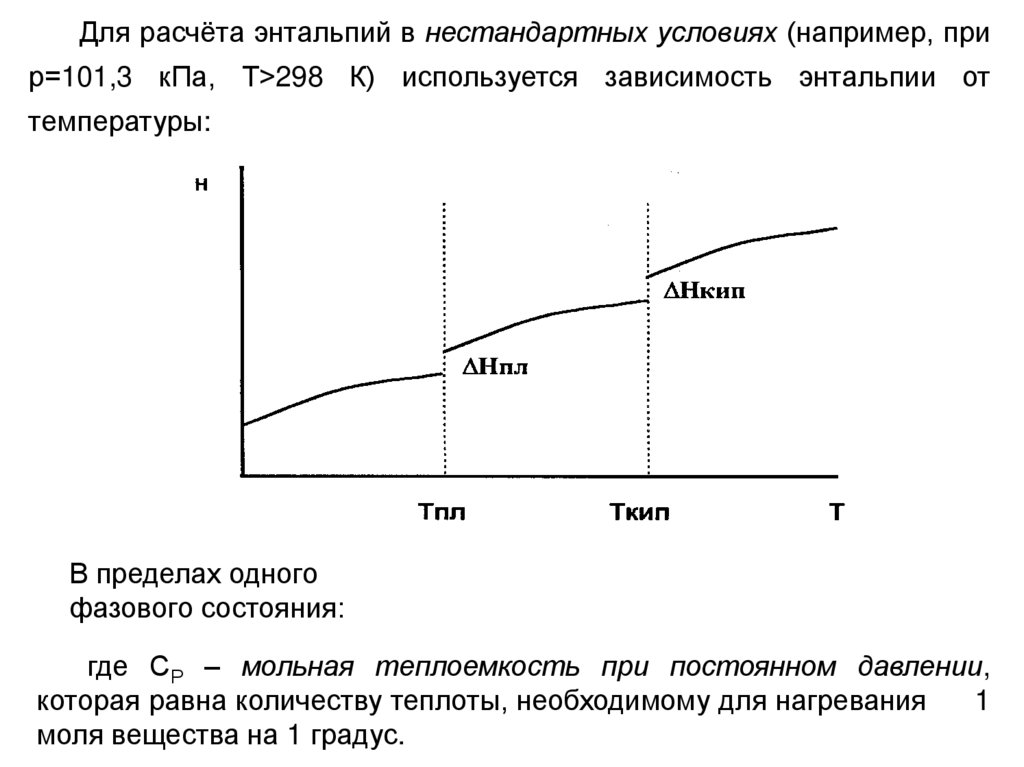
Для расчёта энтальпий в нестандартных условиях (например, прир=101,3 кПа, Т>298 К) используется зависимость энтальпии от
температуры:
В пределах одного
фазового состояния:
где СР – мольная теплоемкость при постоянном давлении,
которая равна количеству теплоты, необходимому для нагревания
1
моля вещества на 1 градус.
17.
Тепловойэффект
химической
реакции
–
изменение энергии системы в результате протекания
химической
реакции
при
условии,
совершает
никакой
другой
работы,
что
система
кроме
не
работы
расширения.
Если △Н<0, реакция называется экзотермической.
Если △ Н>0, реакция называется эндотермической.
Тепловой эффект, приведенный к стандартным
термодинамическим
условиям,
называется
стандартным изменением энтальпии реакции:
△ Но298, реакции .
18.
Основные законытермохимии
Закон Гесса. Тепловой эффект химической реакции
зависит от природы и состояния исходных веществ и
конечных продуктов, но не зависит от пути реакции,
т.е. от числа и характера промежуточных стадий.
Закон Гесса позволяет рассчитать энтальпию
химических реакций.
С2Н6(г) + З,5O2(г) = 2CO2(г) + 3Н2О(г).
Исходные вещества и продукты реакции можно
получить из простых веществ: C, H2, O2
△ Но298, реакции + △ Но298 исх. веществ= △ Но298 продуктов
19.
Энтальпия химической реакции△ Но298, реакции равна разнице
суммы стандартных энтальпий образования
продуктов реакции и суммы стандартных
энтальпий образования исходных веществ с
учётом стехиометрических
коэффициентов.
△ Но298, реакции =
20.
Зная теплоты образования веществ, можноопределить и их теплоты разложения по закону
Лавуазье–Лапласа:
При разложении сложного вещества на
простые поглощается (или выделяется)
столько же теплоты, сколько выделяется
(или поглощается) при его образовании из
простых веществ в тех же условиях.
Н2(г) + 0,5O2(г) = Н2O(г)
△Н<0
Н2O(г) = Н2(г) + 0,5O2(г)
△ Н>0
21.
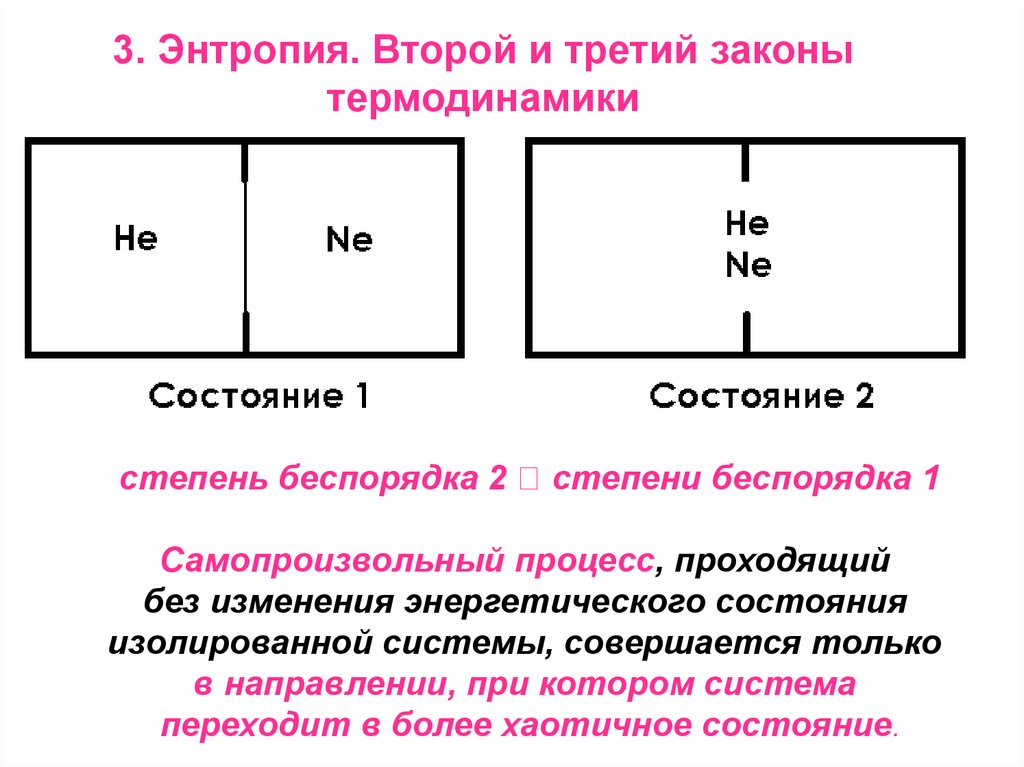
3. Энтропия. Второй и третий законытермодинамики
степень беспорядка 2
степени беспорядка 1
Самопроизвольный процесс, проходящий
без изменения энергетического состояния
изолированной системы, совершается только
в направлении, при котором система
переходит в более хаотичное состояние.
22.
Число микросостояний (или способов),которыми может быть реализовано данное
макросостояние системы, называется
термодинамической вероятностью (W).
W = CxN
где x – число молекул
N – число состояний (число объёмов молекул)
CxN – число размещений x молекул по N объёмам
Для больших значений x и N:
W
Nx .
23.
Понятие энтропии S ввел в науку Р. Клаузиус.Приведённая теплота
связана с изменением
функции состояния этой системы –
энтропией S:
где Ср – мольная теплоемкость (р = const);
– бесконечно малое приращение
теплоты.
24.
Связь энтропиис термодинамической вероятностью
(уравнение Л. Больцмана) :
S = k•lnW
где S – энтропия,
W – термодинамическая вероятность;
k – константа Больцмана,
k=
где R - универсальная газовая постоянная (8,31),
NА – число Авогадро (6,02·1023 частиц в 1 моле).
25.
Самопроизвольные изменения в изолированнойсистеме всегда сопровождаются увеличением
энтропии системы.
Второй закон термодинамики
∆S > 0
S(к) < S(ж) < S(г)
Стандартная энтропия вещества представляет
собой энтропию вещества (с указанием фазового
состояния) при температуре 298 К и давлении 101,3 кПа.
Sо298 >0
26.
Изменение энтропии химической реакции равноразности суммы энтропий продуктов реакции и
исходных веществ с учетом стехиометрических
коэффициентов.
aA + bB = сС + dD
∆S оp =(cSоC+ dSоD) − (aSоА+ bSоВ),
где ∆Sоp − изменение энтропии для данной реакции,
Дж/К;
SоА, SоВ, SоC, SоD − стандартные значения энтропий
веществ, участвующих в реакции, Дж/(моль·К).
27.
Свойства энтропииЗависимость энтропии от объема
(Для 1 моля газа)
Процессы,
протекающие
в
системе
и
сопровождающиеся увеличением объема системы при
сохранении числа участвующих молекул, протекают с
увеличением энтропии системы.
28.
Зависимость энтропии от давленияИз уравнения состояния
следует, что для 1 моля газа:
идеального
При увеличении давления
энтропия системы уменьшается.
газа
29.
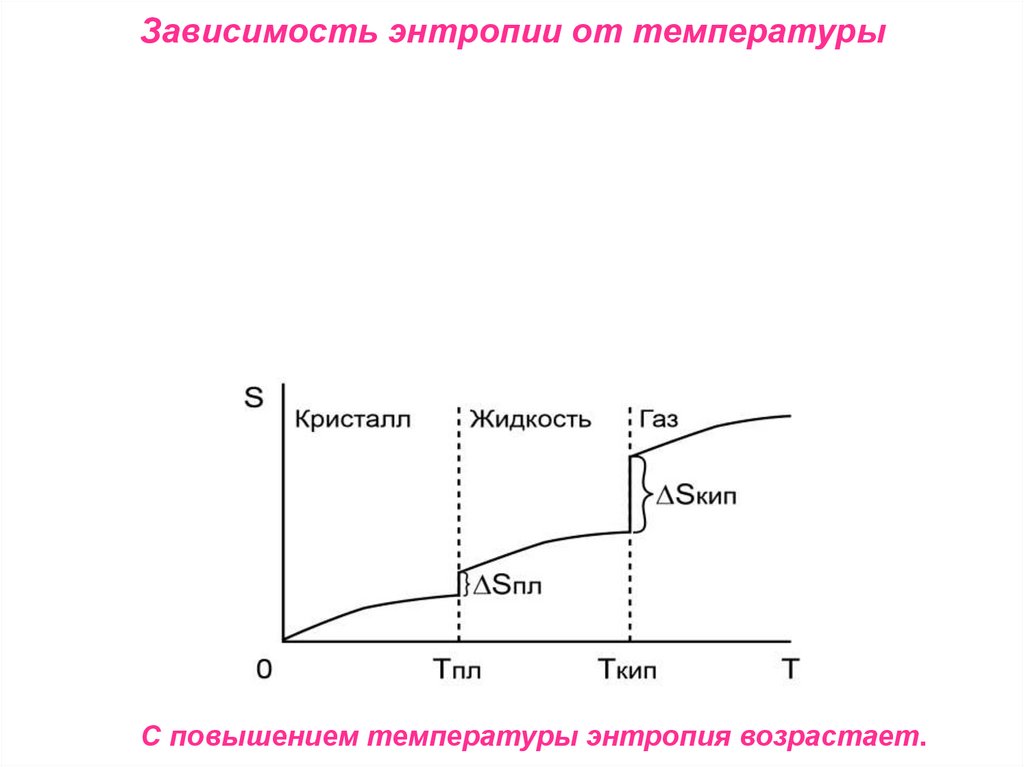
Зависимость энтропии от температурыС повышением температуры энтропия возрастает.
30.
При температуре,равной абсолютному нулю,
тепловое движение отсутствует,
все атомы в идеальном кристалле занимают
строго определенные места в
пространстве.
Такое состояние системы может быть
реализовано единственным способом,
при этом W = 1, а S = 0.
Это третий закон термодинамики,
называемый также постулатом Планка.
31.
4. Энергия ГиббсаG = H − TS,
∆G = ∆H − T∆S.
∆Gр= −Аmax
Возможен только самопроизвольный переход
системы из состояния с большей энергией Гиббса в
состояние с меньшей энергией Гиббса.
Это более общая формулировка второго закона
термодинамики.
При ∆G 0 реакция протекает в прямом направлении.
При ∆G 0 возможен лишь обратный процесс.
При ∆G=0 все вещества находятся в химическом
равновесии.
32.
Из уравнения ∆G = ∆H − T∆S следует:1) если ∆H 0 и ∆S 0, то всегда ∆G 0, т.е. реакция с
выделением теплоты и увеличением степени беспорядка
возможна при любых температурах;
2) если ∆H 0 и ∆S 0, то всегда ∆G 0, т.е. реакция с
поглощением
теплоты
и
уменьшением
степени
беспорядка невозможна ни при каких условиях;
3) во всех остальных случаях (∆H 0, ∆S 0 и ∆H 0,
∆S 0) знак ∆G зависит от соотношения членов ∆H и
T∆S.
33.
Энергия Гиббса является функцией состояния.Стандартные энергии Гиббса образования простых
веществ, находящихся в стандартном состоянии в
устойчивой модификации, равны нулю.
∆Gо298, Н2(газ) = 0 кДж/моль
Стандартная энергия Гиббса образования
вещества Gо298 – изменение энергии Гиббса в реакции
образования 1моль вещества из простых веществ,
находящихся в устойчивых состояниях при стандартных
условиях (р=101,3 кПа и Т=298 К).
∆Gо298, реакции = ∑ ∆Gо298, продукты реакции – ∑ ∆Gо298, исходные вещества
34.
Энергия Гиббса химических реакцийИзменение энергии Гиббса химической реакции при
стандартных условиях (р =101,3 кПа и Т=298 К) можно
вычислить по уравнению
∆Gо298, реакции =∆Hо 298, реакции –T∆Sо298, реакции,
где ∆Hо298,реакции, ∆Sо298,реакции – стандартные изменения
энтальпии и энтропии химической реакции,
соответственно в кДж и Дж/К;
Т– стандартная температура, равная 298 К.




























 Химия
Химия








