Похожие презентации:
сера
1. Сера: нахождение в природе, способы получения, физические и химические свойства.
2.
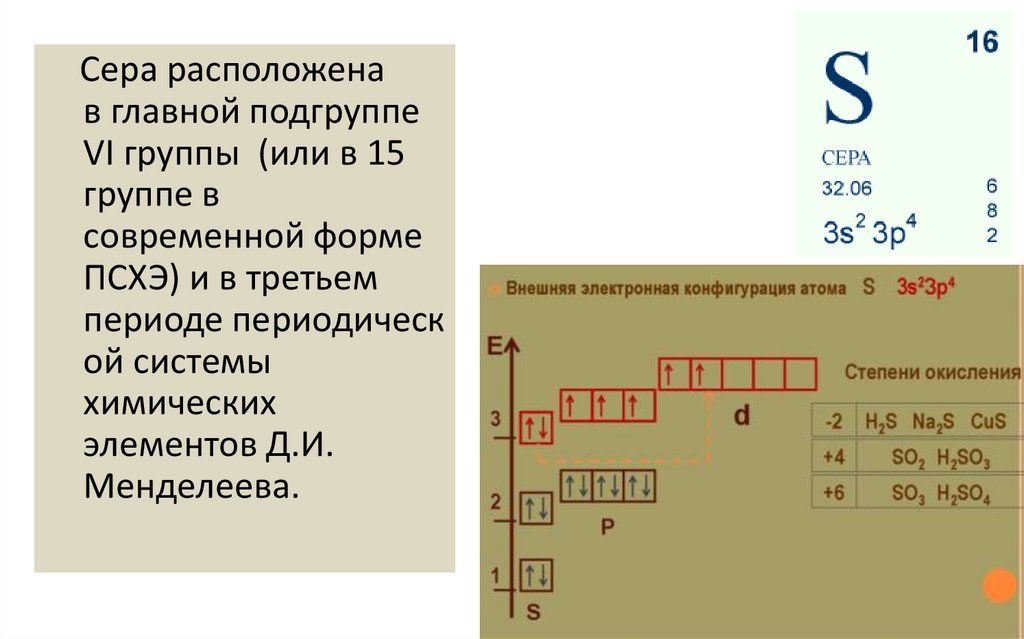
Сера расположенав главной подгруппе
VI группы (или в 15
группе в
современной форме
ПСХЭ) и в третьем
периоде периодическ
ой системы
химических
элементов Д.И.
Менделеева.
3. Физические свойства и нахождение в природе.
Сера образуетразличные простые
вещества
(аллотропные
модификации).
Наиболее устойчивая
модификация серы –
ромбическая сера
S8. Это хрупкое
вещество желтого
цвета.
4.
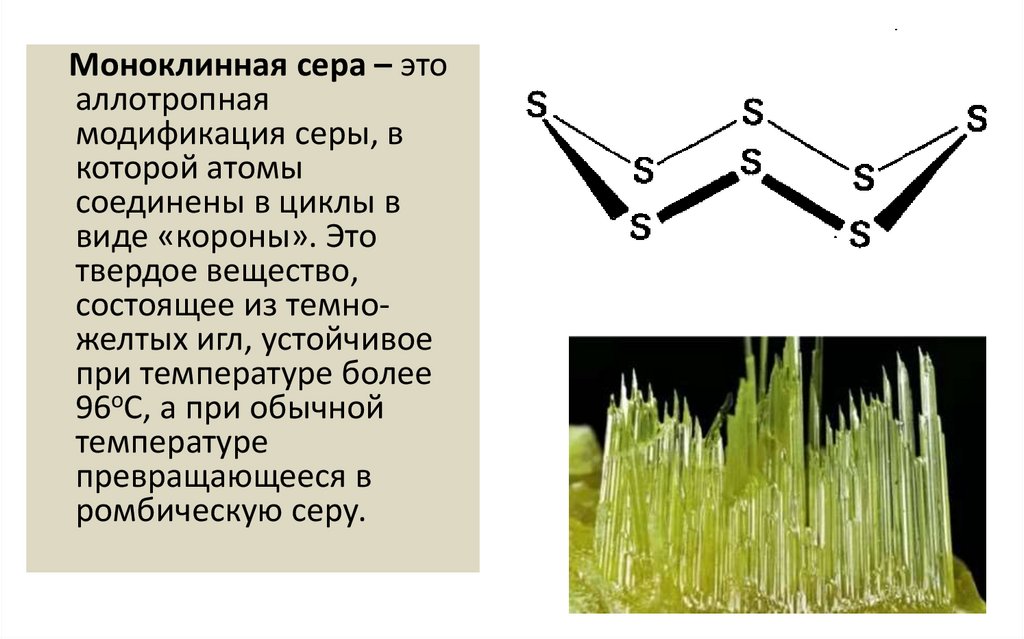
Моноклинная сера – этоаллотропная
модификация серы, в
которой атомы
соединены в циклы в
виде «короны». Это
твердое вещество,
состоящее из темножелтых игл, устойчивое
при температуре более
96оС, а при обычной
температуре
превращающееся в
ромбическую серу.
5.
Пластическая сера –это вещество,
состоящее из
длинных
полимерных цепей.
Коричневая
резиноподобная
аморфная масса,
нерастворимая в
воде.
6. В природе сера встречается:
в самородном виде;в составе сульфидов (сульфид цинка ZnS,
пирит FeS2, сульфид ртути HgS — киноварь
и др.)
в составе сульфатов (CaSO4·2H2O гипс,
Na2SO4·10H2O — глауберова соль)
7. Получение.
1. Неполное окисление сероводорода.2H2S + O2 → 2S + 2H2O
2. Взаимодействие сероводорода с оксидом серы(IV):
2H2S + SO2 → 3S + 2H2O
8. Химические свойства.
Сера проявляет свойства окислителя (при взаимодействии с элементами,которые расположены ниже и левее в Периодической системе) и
свойства восстановителя (с элементами, расположенными выше и правее).
Поэтому сера реагирует с металлами и неметаллами.
1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
2. С галогенами (со всеми, кроме йода)
образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
9.
3. С углеродом и серой образуются сульфиды фосфора исероуглерод.
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
4. С металлами.
S + Fe → FeS
3S + 2Al → Al2S3
5. С водородом.
S + H2 → H2S
10.
6. С кислотами.S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
S + 2H2SO4 → 3SO2 + 2H2O
7. Взаимодействие серы с сульфитами (при кипячении)
приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
8. При растворении в щелочах сера диспропорционирует
до сульфита и сульфида.
S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
9. При взаимодействии с перегретым паром сера
диспропорционирует:
3S + 2H2O (пар) → 2H2S + SO2








 Химия
Химия








