Похожие презентации:
fc1cdac2b32245b29eff40e2b7fbded2
1. ЖЕЛЕЗО
2.
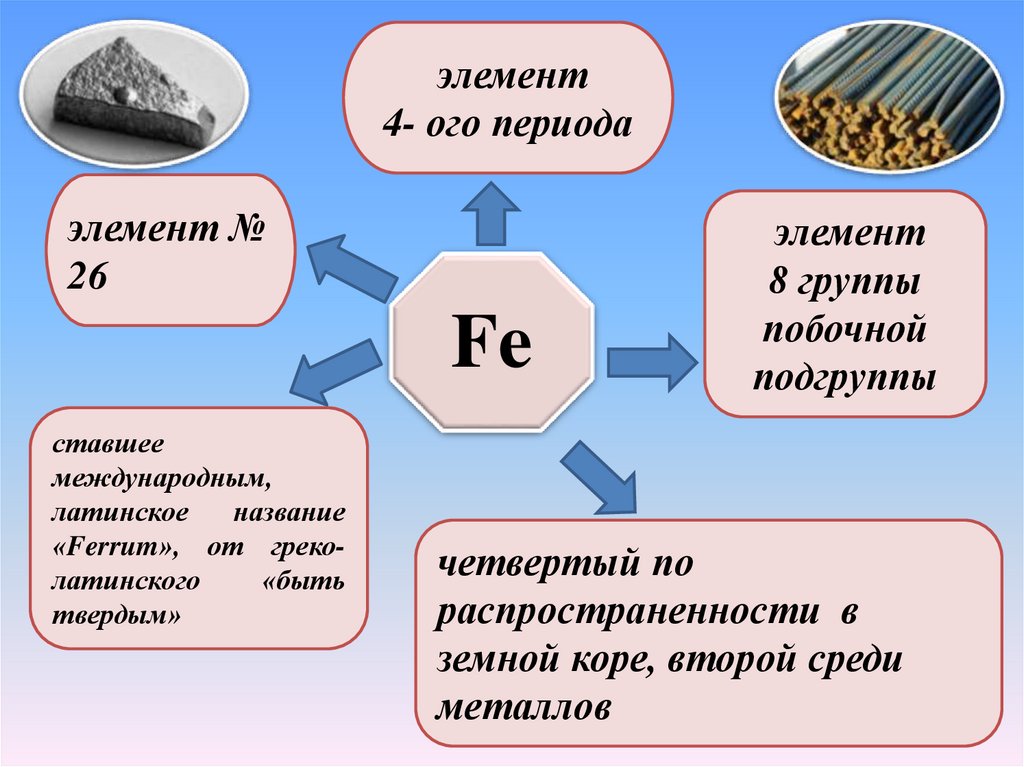
элемент4- ого периода
элемент №
26
Fe
ставшее
международным,
латинское
название
«Ferrum», от греколатинского
«быть
твердым»
элемент
8 группы
побочной
подгруппы
четвертый по
распространенности в
земной коре, второй среди
металлов
3.
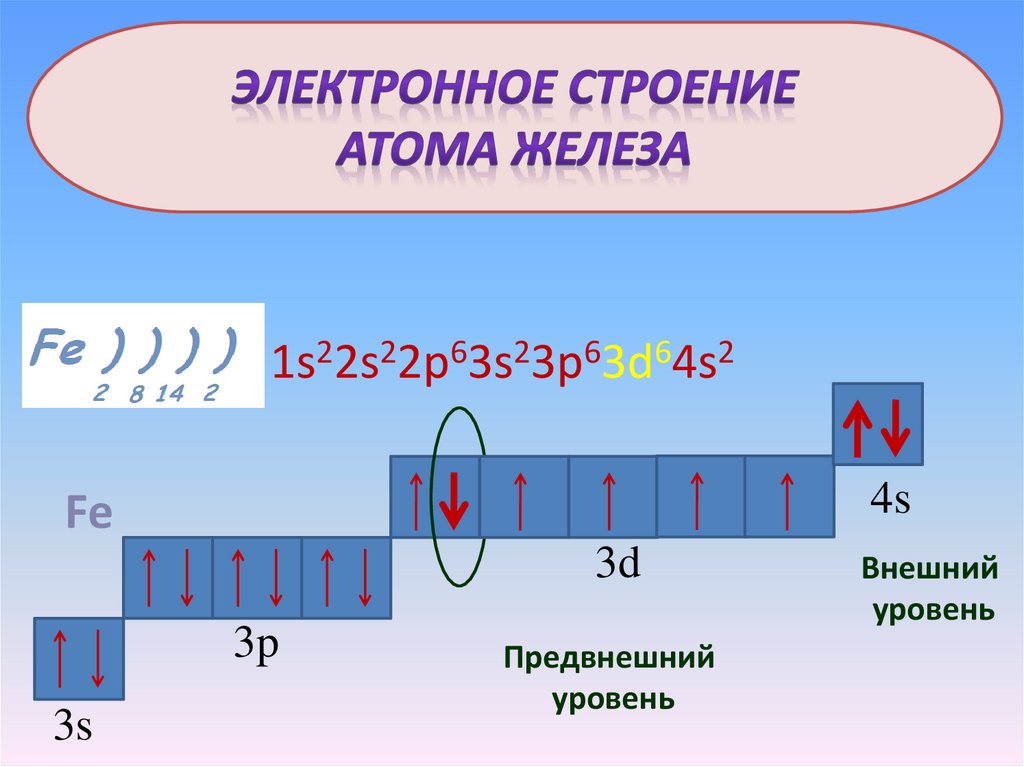
Fe1s22s22p63s23p63d64s2
4s
Fe
3d
3p
3s
Предвнешний
уровень
Внешний
уровень
4. Для железа характерны две основные степени окисления: +2, +3.
0+2
Fe - 2e = Fe
0
+3
Fe - 3e = Fe
5.
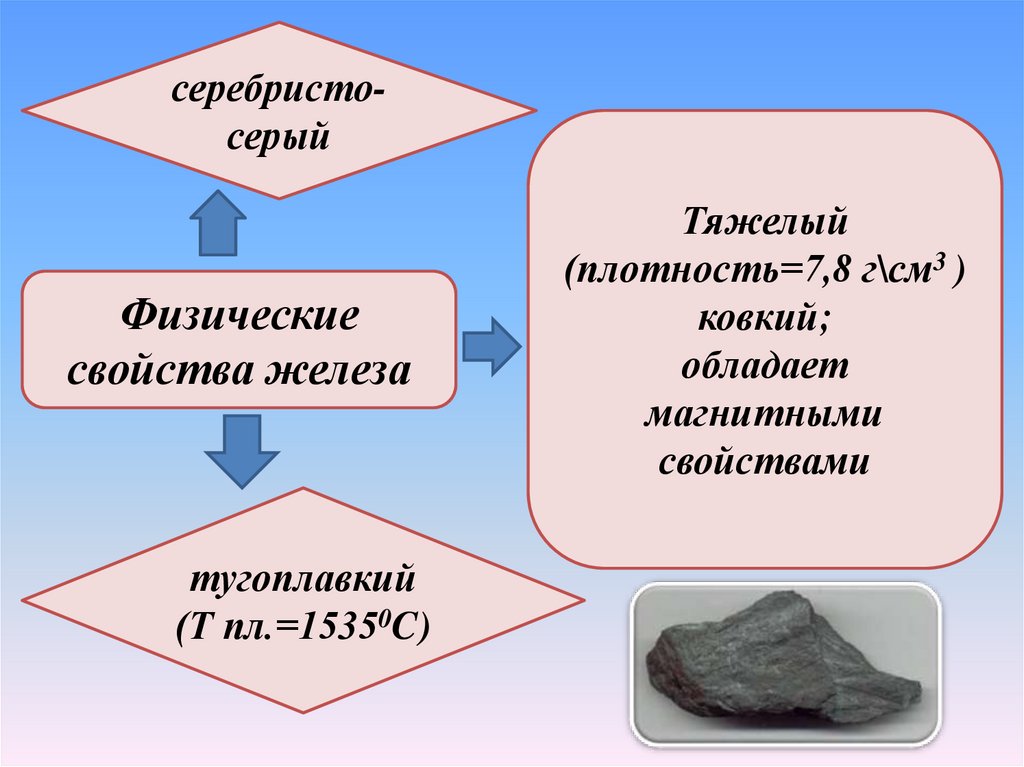
серебристосерыйФизические
свойства железа
тугоплавкий
(Т пл.=15350C)
Тяжелый
(плотность=7,8 г\см3 )
ковкий;
обладает
магнитными
свойствами
6.
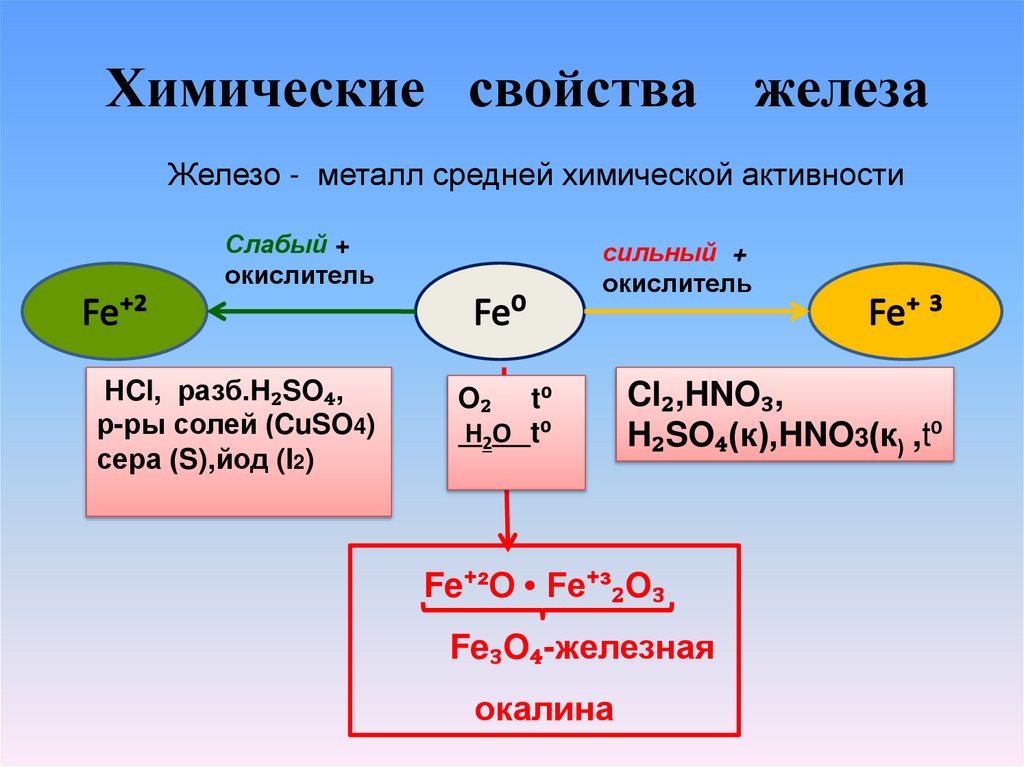
Химические свойства железаЖелезо - металл средней химической активности
Слабый +
окислитель
НCl, разб.H₂SO₄,
р-ры солей (CuSO4)
сера (S),йод (I2)
сильный +
окислитель
O₂ t⁰
H2O t⁰
Cl₂,HNO₃,
H₂SO₄(к),HNO3(к) ,t⁰
Fe⁺²O • Fe⁺³₂O₃
Fe₃O₄-железная
окалина
7.
8.
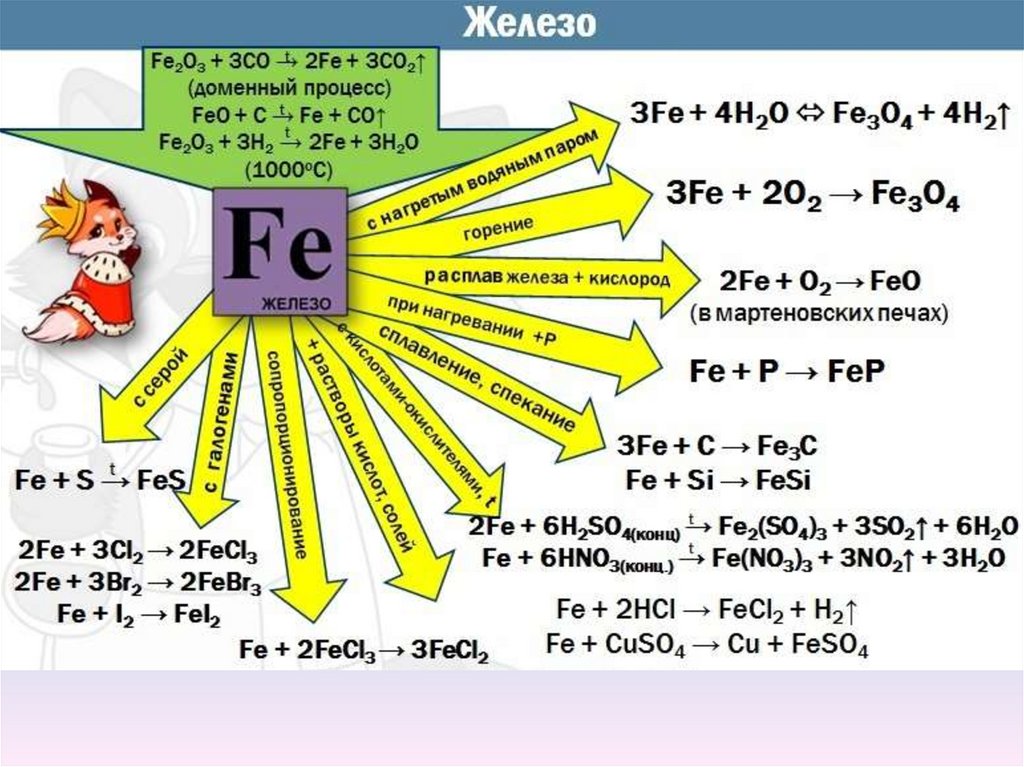
Химические свойства железаI.При взаимодействии железа с галогенами образуются галоге-ниды
состава FeF3, FeCl3, FeBr3, но в реакции с йодом - FeI2:
2Fe +3Cl2 → 2FeCl3
II. С неметаллами
III. С водой
Fe + I2 = FeI2
Fe + S → FeS
Fe+2S → FeS2 (t>700oC)
3Fe + 2О2 → Fe2O3(в присутствии H2O)
3Fe + 4H2O → Fe3O4 + 4H2↑
8
9.
Химические свойства железаIV. С кислотами
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4(разб.) = FeSO4 + H2↑
Железо пассивируется концентрированными серной и азотной кислотами,
но при нагревании реагирует с ними:
2Fe + 6H2SO4(конц.) = Fe2(SO4)3 + 3SO2+ 6H2O
Fe + 6HNO3(конц.) = Fe(NO3)3 + 3NO2+ 3H2O
4Fe + 10HNO3(оч.разб.) = 4Fe(NO3)3 + NH4NO3+ 3H2O
V. Железо взаимодействует со щелочными расплавами окислителей:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2+ H2O
9
10.
Химические свойства железаVI.С солями (вытесняет металлы, стоящие левее в ряду стандартных
электродных потенциалов)
Fe + CuSO4 → FeSO4 + Cu
VII. Образование карбонилов
Fe+5CO→[Fe(CO)5]
Получение
I. Чугун − сплав железа, содержащий углерод (2-6%), Si,Mn,P,S.
Химизм доменного процесса (450-1500ОС)
Исходные вещества: руда(например Fe2O3), кокс( С-восс-ль),флюс
(CaCO3− для связывания оксидов: SiO2,Al2O3 и др.)
1. Сгорание кокса
C+O2=СO2+Q(для поддержания температуры0
CO2+C=2CO(CO- восстановитель железа)
10
11.
Получение2. Восстановление железа
3Fe2O3+СО=2Fe3O4+CO2
Fe3O4+ СО=3FeO+ CO2
FeO+ CO=Fe+CO2
3. Восстановление других оксидов, входящих в состав руды
SiO2+C=Si+CO2
Mn2O3+3C=2Mn+3CO
Si и Mn -входят в состав чугуна
4. Взаимодействие оксидов и с флюсом
CaCO3=CaO+CO2 (t)
CaO+SiO2=CaSiO3
CaO+Al2O3=Ca (AlO2)2
Шлаки, отделяются от чугуна
II. Сталь- ковкий сплав железа и углерода (<2%)
Исходное вещество- чугун, металлический лом
11
12.
ПолучениеПроисходит уменьшение содержания углерода, Si,P,Mn,S.
2Fe + О2 → 2FeO
FeO+ C=Fe+CO
2FeO+Si=Fe+SiO2
5FeO+2P=5Fe+P2O5
12
13.
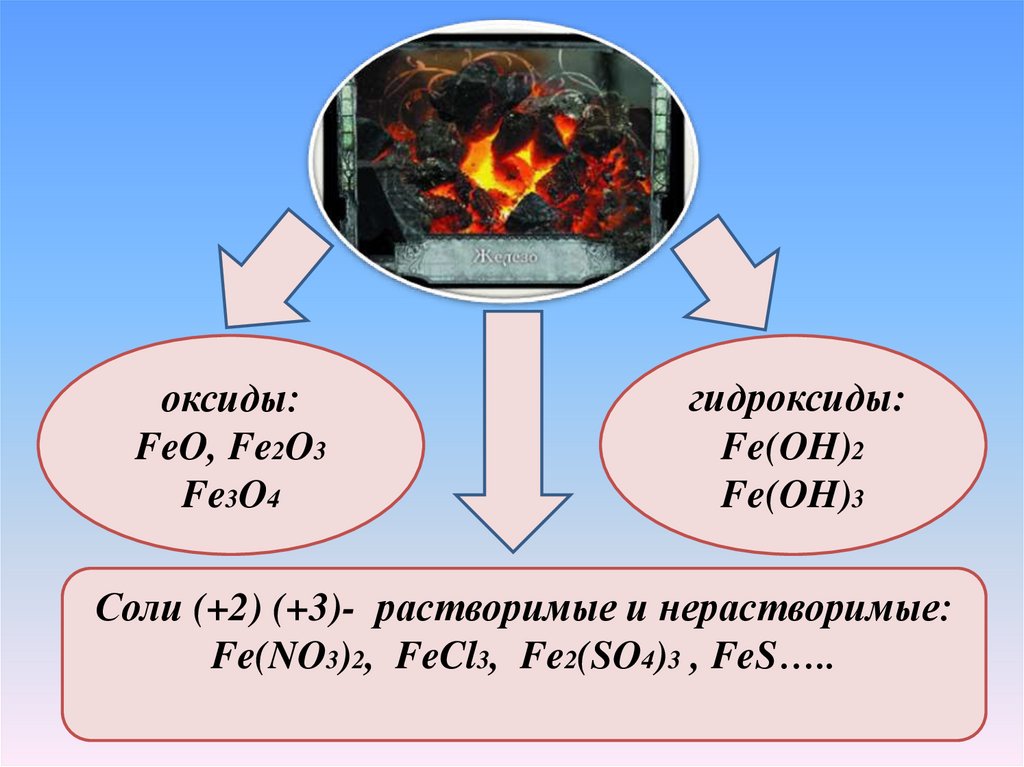
оксиды:FeO, Fe2O3
Fe3O4
гидроксиды:
Fe(OH)2
Fe(OH)3
Соли (+2) (+3)- растворимые и нерастворимые:
Fe(NO3)2, FeCl3, Fe2(SO4)3 , FeS…..
14.
Оксид железа (II) FeO обладает основными и восстанови-тельнымисвойствами:
FeO + 2HI = FeI2 + H2O
FeO + 4HNO3(конц.) = Fe(NO3)3 + NO2 + 2H2O
FeO+CO2=FeCO3 (t)
FeO+C=Fe+CO (t)
FeO+CO=Fe+CO2 (t)
FeO+H2=Fe+H2O(t)
3FeO+2Al=Al2O3+3Fe
Получение
Fe2O3+H2=2 FeO+H2O
14
15.
Оксид железа (III) обладает слабоамфотерными свойствами:Fe2O3 + 6HNO3 = 2Fe(NO3)3+ 3H2O
С растворами щелочей не взаимодействует; при сплавлении с ними
и карбонатами щелочных металлов получают ферриты:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2
Для него характерны также окислительные свойства:
Fe2O3 + 6HI = 2FeI2+ I2 + 3H2O
3Fe2O3+СО=2Fe3O4+CO2
Fe2O3+2Al=Al2O3+2Fe
15
16.
Оксид железа (II,III), железная окалина Fe3O4 – смешанныйоксид, проявляет свойства основного оксида. При
растворении в кислотах образует смесь солей Fe2+ и Fe3+:
Fe3O4 + 4H2SO4(разб.) = FeSO4 + Fe2(SO4)3 + 4H2O
2Fe3O4 + 10H2SO4(конц.) = 3Fe2(SO4)3 + SO2 + 5H2O
16
17.
Гидроксид железа (II) Fe(OH)2 проявляет основные ивосстановительные свойства:
FeO + 2HCl = FeCl2 +H2O
2Fe(OH)2 + H2O2 = 2Fe(OH)3
4Fe(OH)2 + O2 = 4FeO(OH)+ 2H2O
Fe(OH)2 + 2Br2 + 6NaOH = Na2FeO4+ 4NaBr+ 4H2O
В материалах ЕГЭ встречается такая запись состава гидроксида
железа(III): FeO(OH) – метагидроксид железа (III). Он проявляет
слабоамфотерные и окислительные свойства:
2FeO(OH) + 3H2SO4= Fe2(SO4)3 + 4H2O
FeO(OH) + 3NaOH(конц.) + H2O = Na3[Fe(OH)6] + 4H2O
2FeO(OH) + 6HI = 2FeI2 + 4H2O + I2
17
18.
В материалах ЕГЭ встречается такая запись состава гидроксидажелеза(III): FeO(OH) – метагидроксид железа (III). Он проявляет
слабоамфотерные и окислительные свойства:
2FeO(OH) + 3H2SO4= Fe2(SO4)3 + 4H2O
FeO(OH) + 3NaOH(конц.) + H2O = Na3[Fe(OH)6] + 4H2O
2FeO(OH) + 6HI = 2FeI2 + 4H2O + I2
Получение
FeCl3+3NaOH=Fe(OH)3+3NaCl
18
19.
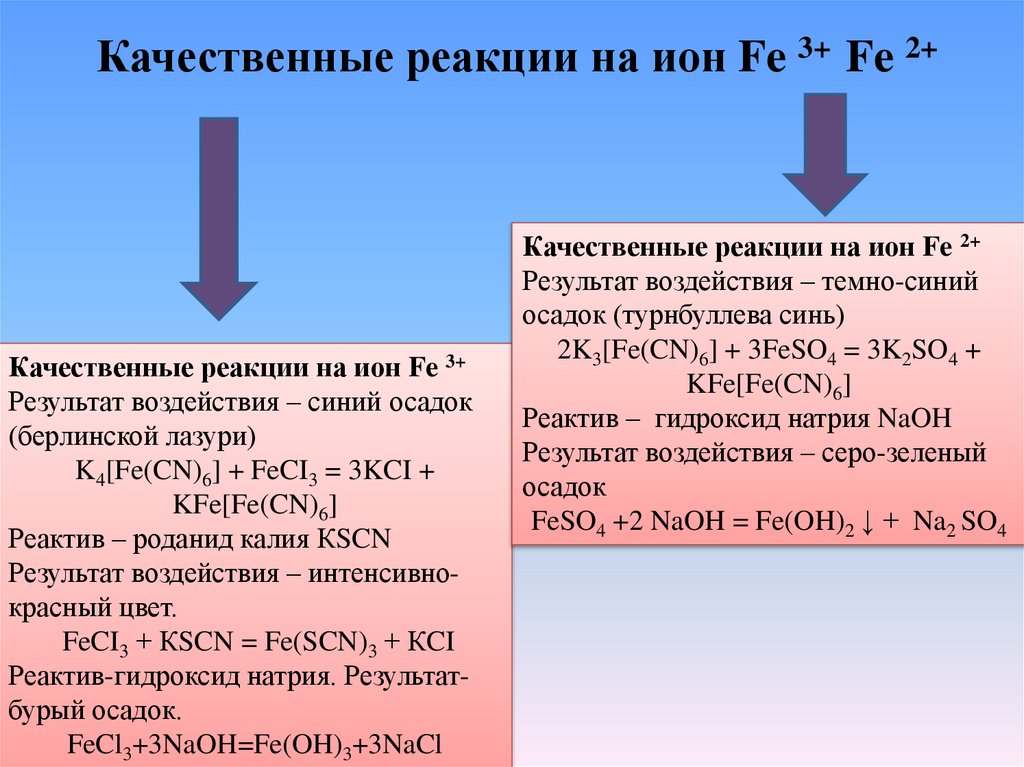
Качественные реакции на ион Fe 3+ Fe 2+Качественные реакции на ион Fe 3+
Результат воздействия – синий осадок
(берлинской лазури)
K4[Fe(CN)6] + FeCI3 = 3KCI +
KFe[Fe(CN)6]
Реактив – роданид калия КSCN
Результат воздействия – интенсивнокрасный цвет.
FeCI3 + КSCN = Fe(SCN)3 + КCI
Реактив-гидроксид натрия. Результатбурый осадок.
FeCl3+3NaOH=Fe(OH)3+3NaCl
Качественные реакции на ион Fe 2+
Результат воздействия – темно-синий
осадок (турнбуллева синь)
2K3[Fe(CN)6] + 3FeSO4 = 3K2SO4 +
KFe[Fe(CN)6]
Реактив – гидроксид натрия NaOH
Результат воздействия – серо-зеленый
осадок
FeSO4 +2 NaOH = Fe(OH)2 ↓ + Na2 SO4
20.
СолиСоли Fe3+ сильно гидролизуются, поэтому активные металлы
растворяются в них с выделением водорода:
FeCl3 + 2H2O + Zn = Fe(OH)2Cl + ZnCl2 + H2↑
Соли Fe3+ - окислители:
2FeCl3 + Fe = 3FeCl2
3FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl3 + 3H2S = 2FeS + S + 6HCl
2FeCl3 + 3KI = 2FeCl2 + I2↓ + 2KCl
Соли Fe2+ - восстановители:
2FeCl2 + Cl2 = 2FeCl3
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
FeS2 + 8HNO3 = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O
20
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
Нахождение в природеВ земной коре на долю железа приходится
около 4,1% массы земной коры (4-е место
среди всех элементов, 2-е среди металлов).
Известно большое число руд и минералов,
содержащих железо.
Оно бывает в виде различных соединений:
оксидов, гидроксидов и солей.
В свободном виде железо находят в
метеоритах, изредка встречается самородное
железо (феррит) в земной коре как продукт
застывания магмы.
35.
Первое металлическое железо,попавшее в руки человека, имело, явно,
метеоритное происхождение.
Руды железа широко распространены
и часто встречаются даже на
поверхности Земли
Железные изделия из метеоритного
железа найдены в захоронениях,
относящихся к очень давним
временам (IV - V тысячелетиях до
н.э.), в Египте и Месопотамии
36.
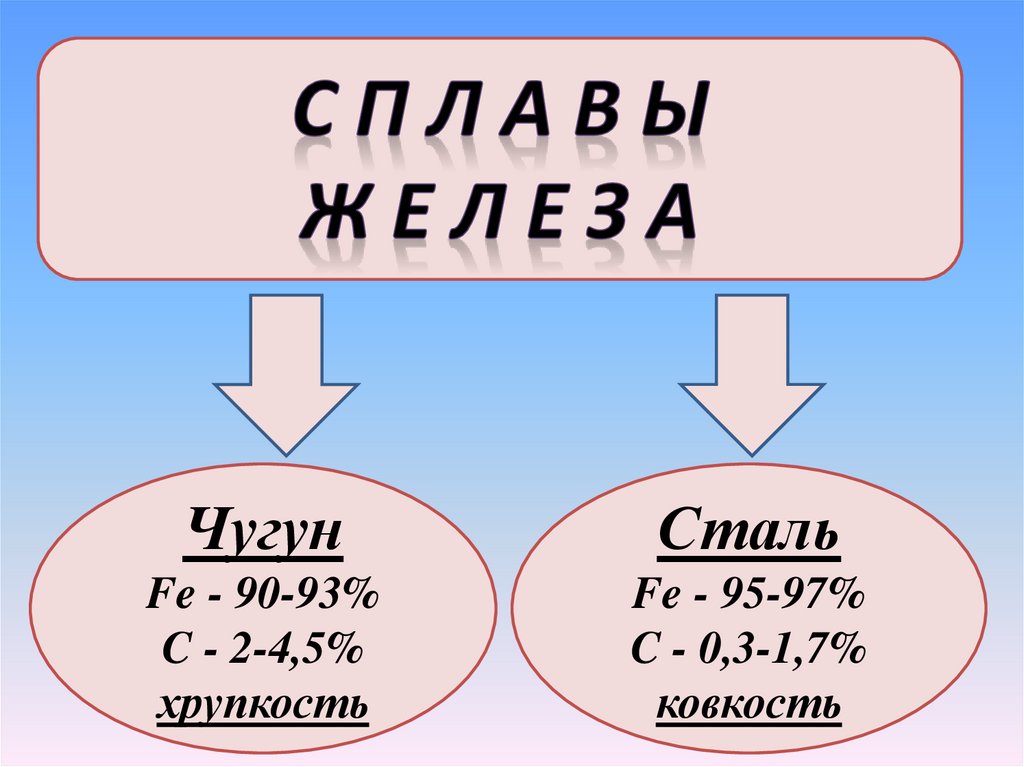
ЧугунСталь
Fe - 90-93%
C - 2-4,5%
хрупкость
Fe - 95-97%
C - 0,3-1,7%
ковкость
37.
Гидроэлектростанции и опорылиний электропередач
Железо
сегодня
Автомобили ,
Тракторы,
Подводные лодки,
Бытовые приборы,
Другие предметы
Трубопроводы
для воды,
нефти и газа




























 Химия
Химия