Похожие презентации:
Железо и его соединения
1.
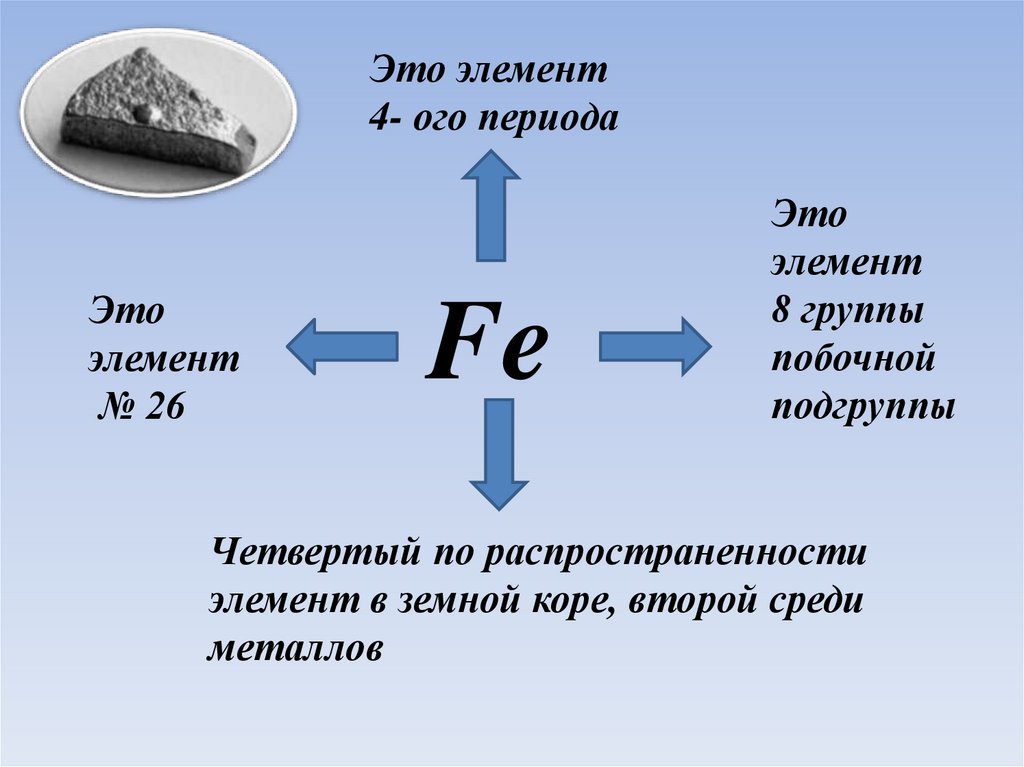
Железо2.
Это элемент4- ого периода
Это
элемент
№ 26
Fe
Это
элемент
8 группы
побочной
подгруппы
Четвертый по распространенности
элемент в земной коре, второй среди
металлов
3.
Электронное строение железа4.
Нахождение в природеВ земной коре железо
распространено достаточно широко
— на его долю приходится около
4,1% массы земной коры (4-е место
среди всех элементов, 2-е среди
металлов). Известно большое число
руд и минералов, содержащих
железо.
Встречается железо в виде
различных соединений: оксидов,
сульфидов, силикатов. В
свободном виде железо находят в
метеоритах, изредка
встречается самородное железо
(феррит) в земной коре как
продукт застывания магмы.
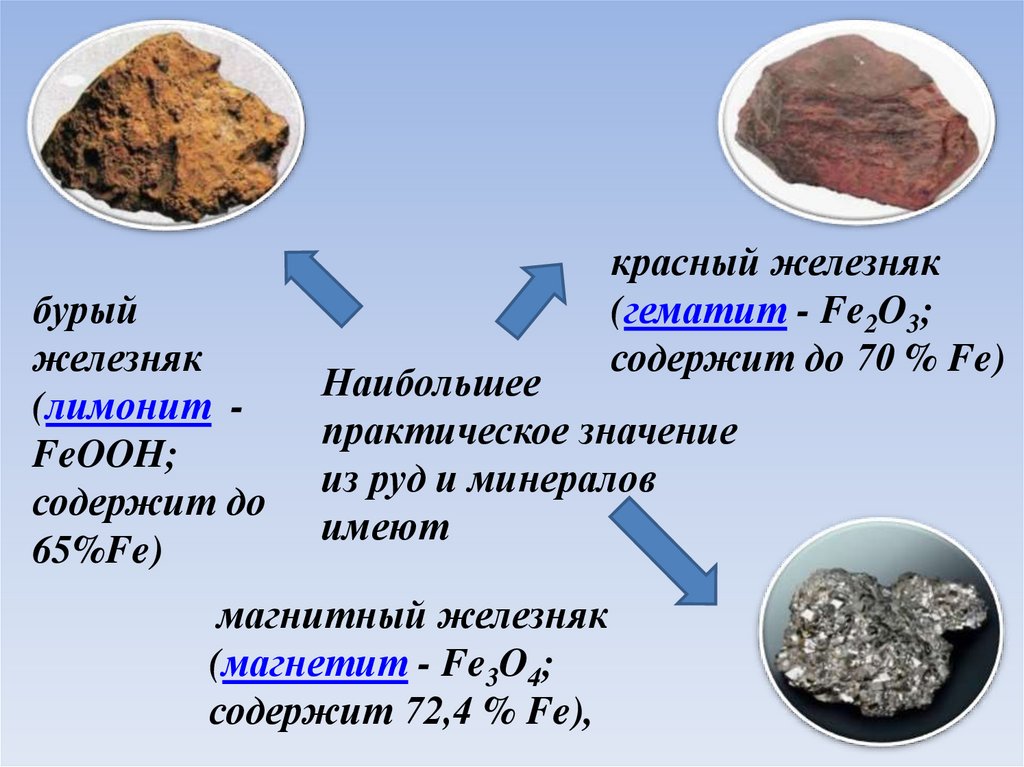
5.
бурыйжелезняк
(лимонит FeOOH;
содержит до
65%)
красный железняк
(гематит - Fe2O3;
содержит до 70 % Fe)
Наибольшее
практическое значение
из руд и минералов
имеют
магнитный железняк
(магнетит - Fe3O4;
содержит 72,4 % Fe),
6.
бурыйжелезняк
(лимонит FeOOH;
содержит до
65%Fe)
красный железняк
(гематит - Fe2O3;
содержит до 70 % Fe)
Наибольшее
практическое значение
из руд и минералов
имеют
магнитный железняк
(магнетит - Fe3O4;
содержит 72,4 % Fe),
7.
Физические свойства железаЖелезо- сравнительно мягкий , ковкий
серебристо-серый металл
Температура плавления 15350C
Температура кипения 28000C
При температуре ниже 7700C железо
обладает ферромагнитными свойствами
(оно легко намагничивается)
8.
Возможные пути получения железаВ промышленности:
2 Fe2O3 + 3 C = 2 Fe2 + 3 CO2 (t=400-650)
В лаборатории:
12 FeSO4(р) + 3 O2 + 6 H2O= 4 Fe2(SO4)3 + 4 F
e(OH)3
FeSO4(р) +Ме=Fe+MeSO4 (Me более
активные , чем Fe)
9.
Химические свойства1. Реакции с простыми веществами
Железо сгорает в чистом кислороде
при нагревании:4Fe +3O2=2Fe2O3
Реагирует с порошком серы при
нагревании:Fe +S = FeS
Реагирует с галогенами при
нагревании:2Fe + 3CL2=2FeCL3
10.
Химические свойства2. Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2HCL + Fe = FeCL2 + H2
Б) с серной кислотой
H2SO4 + Fe = FeSO4 + H2
В реакциях с разбавленными кислотами железо
не окисляется до железа +3
С солями:
Fe + CuSO4= Cu + FeSO4
Электрохимическая коррозия:
4Fe+3O2 +3SO2 =Fe2(SO4)3
11.
Оксид железа (II) (закись железа)Черное кристалличсекое
вещество. Не растворяется в
воде. Порошок оксида легко
окисляется. Плавится при t=1369
Проявляет преимущественно
основные свойства
Получается разложением оксалата железа (II) в
атмосфере азота или без доступа воздуха:
FeC2O4·3H2O = FeO + 3H2O + CO2 + CO
или в процессе восстановления оксида железа (III)
водородом или оксидом углерода (II):
Fe2O3 + H2 = 2FeO + H2O,
Fe O + CO = 2FeO + CO .
12.
Оксид железа (II) (закись железа)Проявляет преимущественно основные свойства. В
воде не растворяется, легко растворяется в
неокисляющих кислотах:
FeO + 2HCl = FeCl2 + H2O.
Проявляет восстановительные свойства:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O.
13.
Гидроксид железа (II)Cвежеосажденном виде имеет
серовато-зеленую окраску, в воде не
растворяется, при температуре выше
150 °С разлагается, быстро темнеет
вследствие окисления.
Порошок белого цвета.
Получается при взаимодействии солей железа (II) с
раствором щелочи в отсутствии кислорода воздуха:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4.
14.
Гидроксид железа (II)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Проявляет слабовыраженные амфотерные свойства с
преобладанием основных, легко реагирует с
неокисляющими кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O.
Взаимодействует с концентрированными растворами
щелочей при нагревании с образованием
тетрагидроксоферрата (II):
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4].
Проявляет восстановительные свойства, при
взаимодействии с азотной или концентрированной серной
кислотой образуются соли железа (III):
2Fe(OH)2 + 4H2SO4 = Fe2(SO4)3 + SO2 + 6H2O.
15.
Оксид железа (III)Вещество бурого цвета,
существует в трех
полиморфных модификациях.
Получается при термическом разложении
гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
или окислением пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
16.
Оксид железа (III)Проявляет слабовыраженные амфотерные свойства с
преобладанием основных. Легко реагирует с кислотами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O.
С растворами щелочей не реагирует, но при сплавлении
образует ферриты:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O.
Проявляет окислительные и восстановительные свойства.
При нагревании восстанавливается водородом или оксидом
углерода (II), проявляя окислительные свойства:
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
17.
В присутствии сильных окислителей в щелочнойсреде проявляет восстановительные свойства и
окисляется до производных железа (VI):
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O.
При температуре выше 1400°С разлагается:
6Fe2O3 = 4Fe3O4 + O2.
18.
Гидроксид железа (III)Кристаллическое или аморфное
вещество бурого цвета. Как и оксид,
проявляет слабовыраженные
амфотерные свойства с
преобладанием основных.
Получается при взаимодействии солей
железа (III) с растворами щелочей:
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4.
19.
Гидроксид железа (III)Легко реагирует с кислотами:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Реагирует с концентрированными растворами щелочей с
образованием гексагидроксоферратов (III):
Fe(OH)3 + 3NaOH = Na3[Fe(OH)6],
при сплавлении со щелочами или щелочными реагентами
образует ферриты:
Fe(OH)3 + NaOH = NaFeO2 + 2H2O,
2Fe(OH)3 + Na2CO3 = 2NaFeO2 + CO2 + 3H2O.
В присутствии сильных окислителей в щелочной среде
проявляет восстановительные свойства и окисляется до
производных железа (VI):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6NaBr + 8H2O.
При нагревании разлагается:
Fe(OH)3 = FeO(OH) + H2O, 2FeO(OH) = Fe2O3 + H2O.
20.
Соли железа (III)Кроме того, ионы Fe3+ определяют по
характерному кроваво-красному
окрашиванию роданида железа (III),
который образуется в результате
взаимодействия соли железа (III) с
роданидом калия или аммония:
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl,
Fe3+ + 3CNS- = Fe(CNS)3.
21.
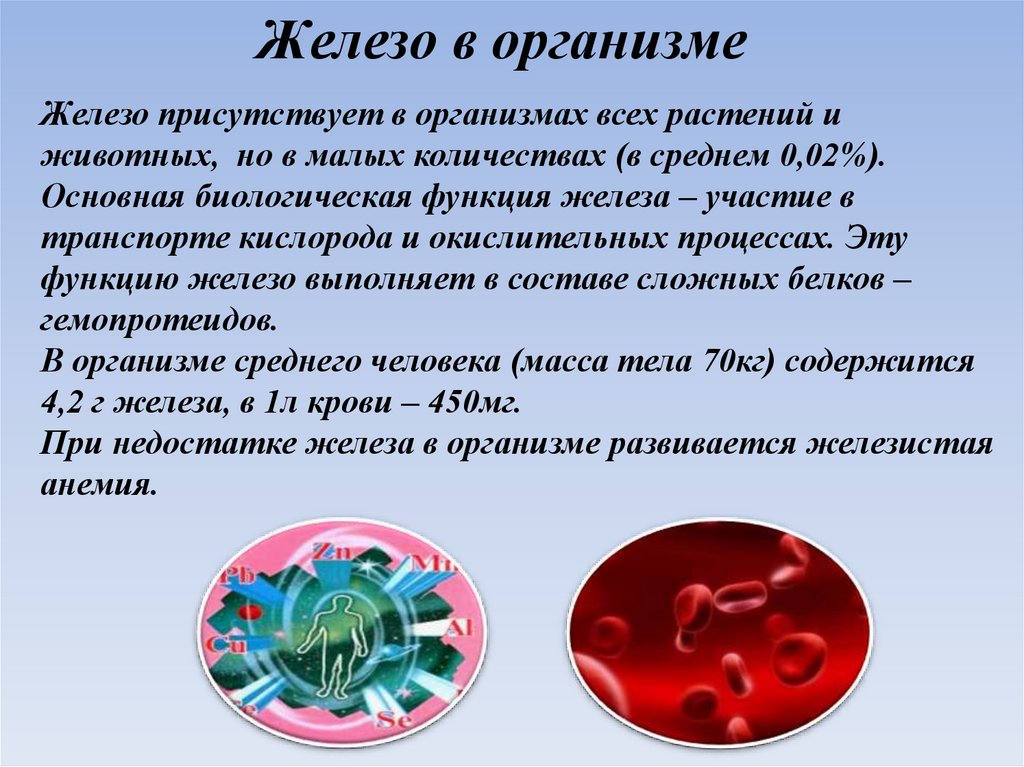
Железо в организмеЖелезо присутствует в организмах всех растений и
животных, но в малых количествах (в среднем 0,02%).
Основная биологическая функция железа – участие в
транспорте кислорода и окислительных процессах. Эту
функцию железо выполняет в составе сложных белков –
гемопротеидов.
В организме среднего человека (масса тела 70кг) содержится
4,2 г железа, в 1л крови – 450мг.
При недостатке железа в организме развивается железистая
анемия.
22.
Биологическая роль железаЖелезо играет важную роль в жизнедеятельности
живых организмов. Оно входит в состав гемоглобина
крови человека; соединения железа применяют для лечения
анемии
23.
Первое железо на земле…….Первое металлическое
железо, попавшее в руки
человека, имело, вероятно,
метеоритное
происхождение.
Руды железа широко
распространены и часто
встречаются даже на
поверхности Земли
24.
История получения железаЛюди впервые овладели
железом в четвертомтретьем тысячелетиях
до н. э., подбирая упавшие
с неба камни — железные
метеориты , и превращая
их в украшения, орудия
труда и охоты. Их и
сейчас находят у
жителей Северной и
Южной Америки,
Гренландии и Ближнего
Востока, а также при
археологических раскопках
на всех континентах.
25.
Применение железа, его сплавов и соединенийЧистое железо имеет довольно
ограниченное применение. Его
используют при изготовлении
сердечников электромагнитов, как
катализатор химических
процессов, для некоторых других
целей.
Но сплавы железа — чугун и
сталь — составляют основу
современной техники. Находят
широкое применение и многие
соединения железа. Так, сульфат
железа (III) используют при
водоподготовке, оксиды и цианид
железа служат пигментами при
изготовлении красителей .
26.
«Чистое железо способно быстро намагничиваться иразмагничиваться, поэтому его применяют для
изготовления сердечников, трансфо-, мембраноматоров,
электромагнитов и мембран микрофонов. Больше всего
на практике используют сплавы железа - чугуна и
стали»























 Химия
Химия








