Похожие презентации:
Углерод_урок1
1.
УглеродОбщая характеристика элементов подгруппы углерода
Углерод ─ химический элемент
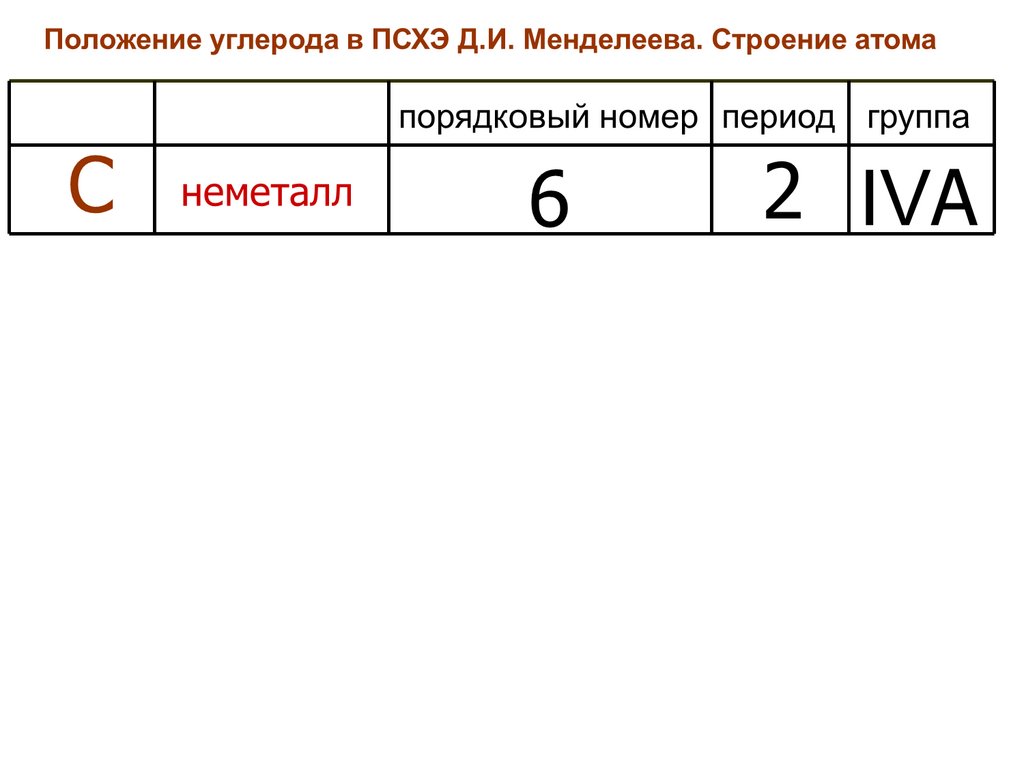
1. Положение углерода в ПСХЭ Д.И. Менделеева
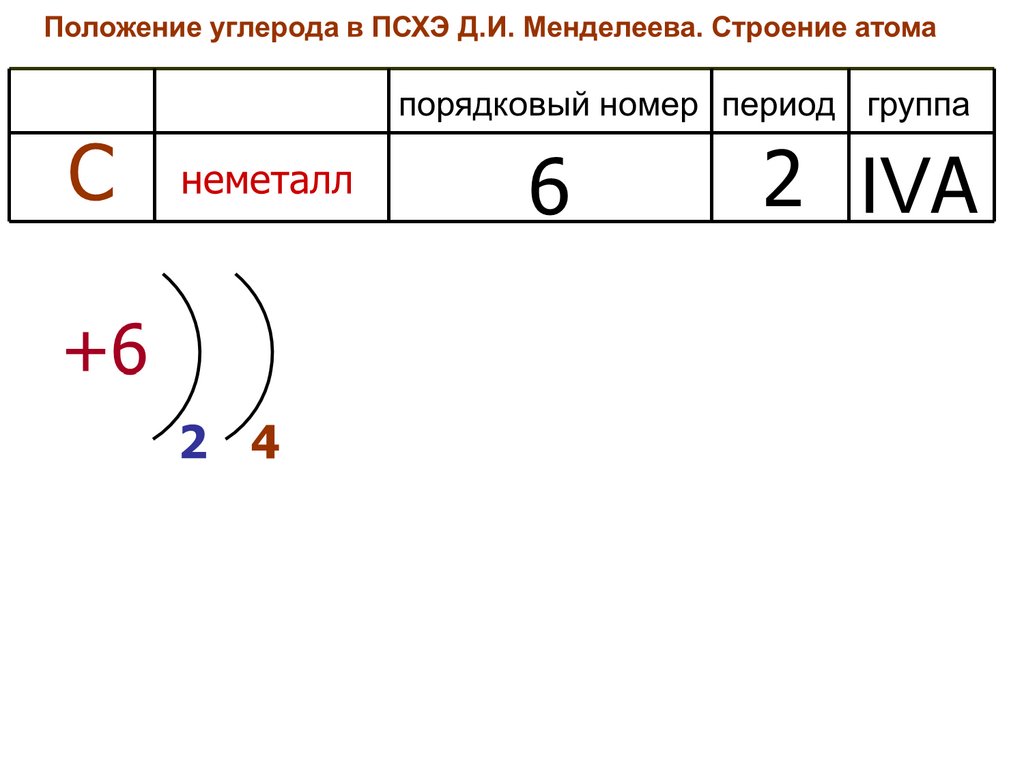
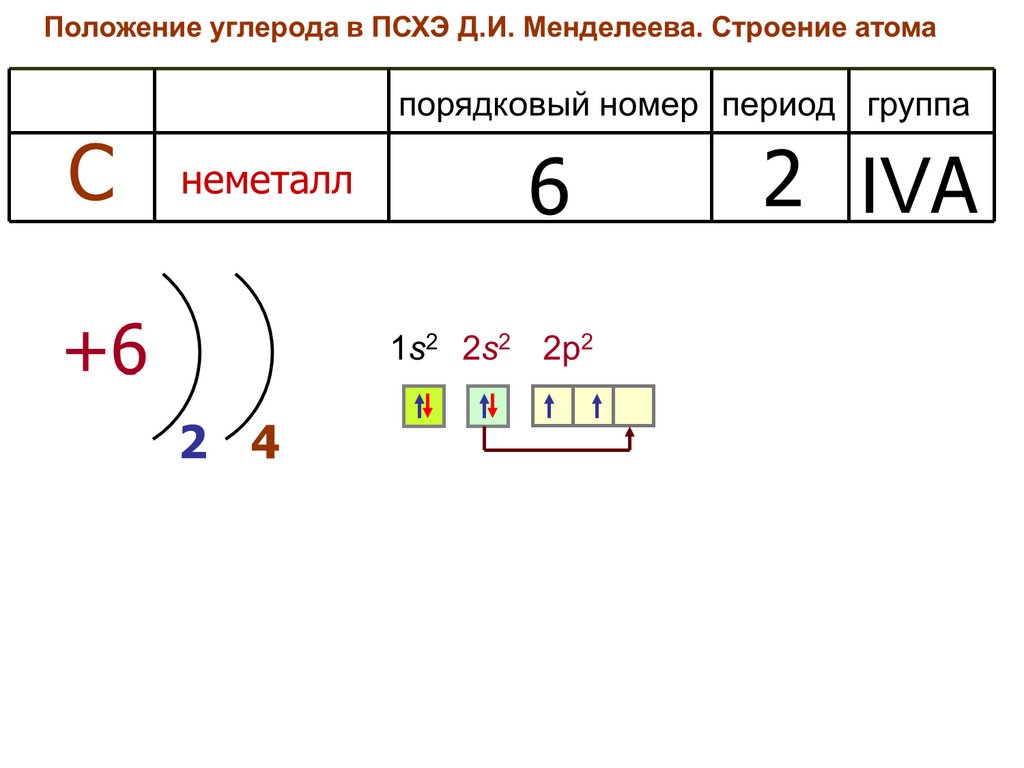
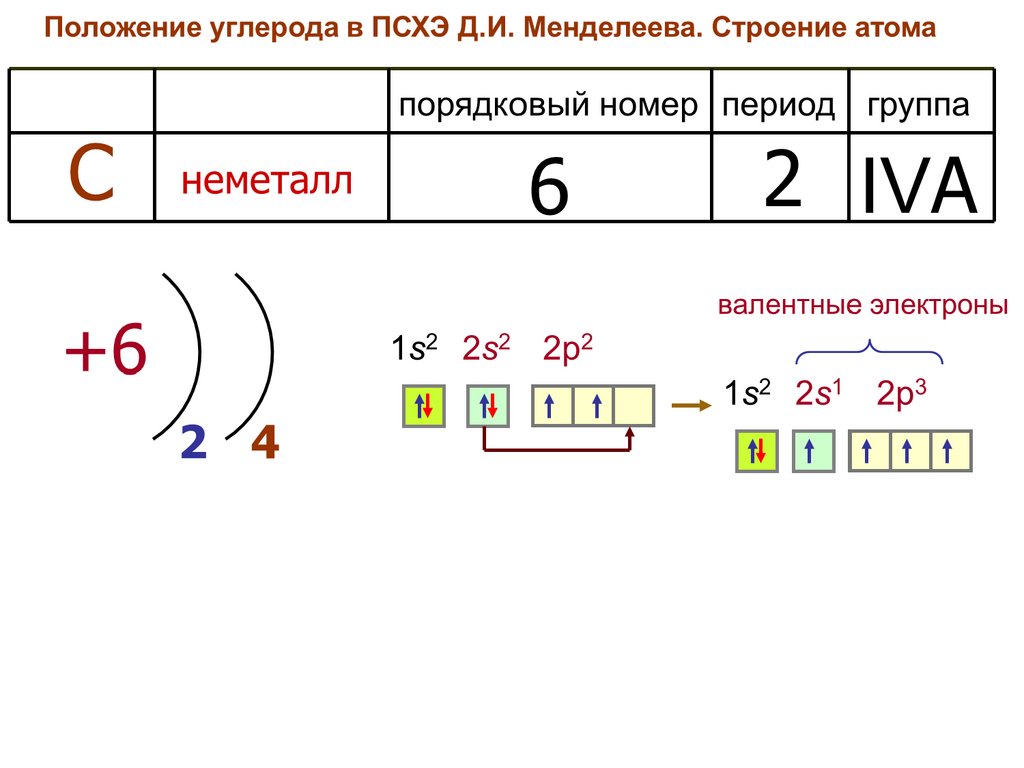
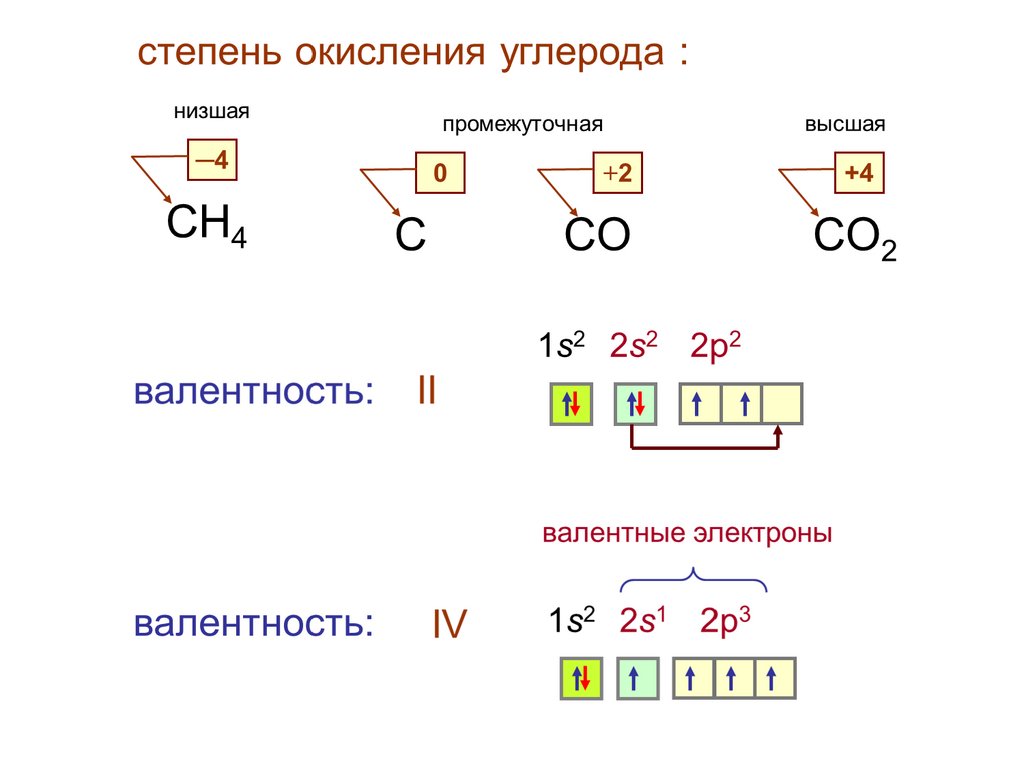
2. Строение атома углерода
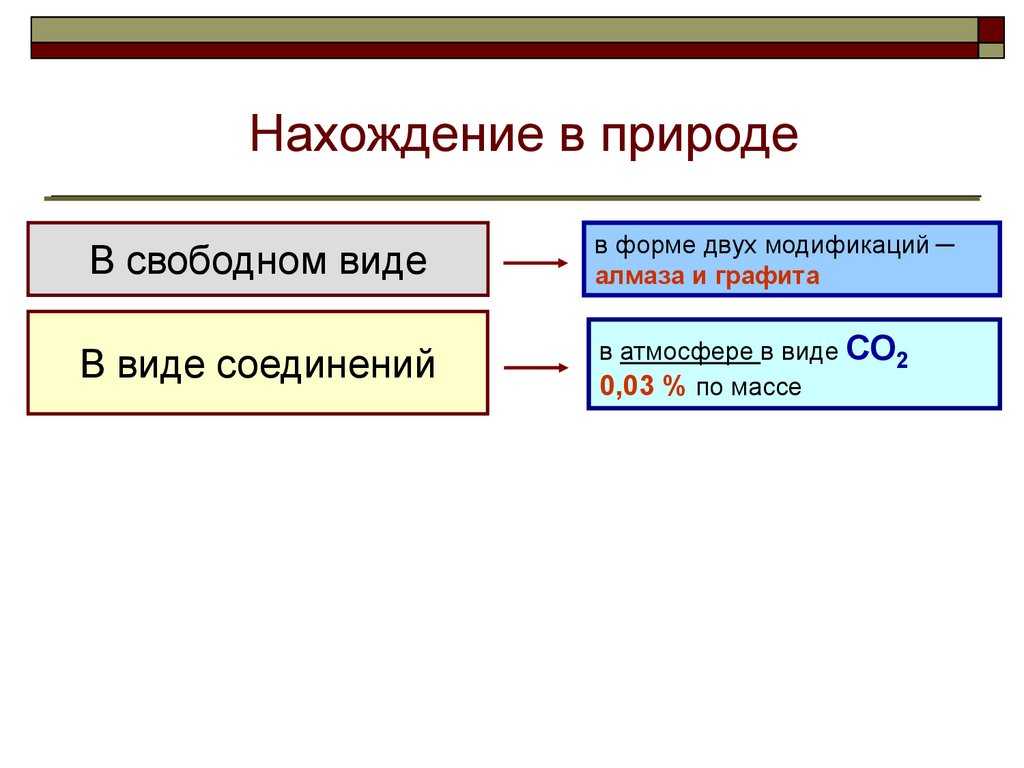
3. Нахождение в природе
4. Круговорот углерода в природе
Углерод ─ простое вещество
1. Аллотропные модификации углерода
2. Химические свойства
Соединения углерода
1. Оксиды
2. Угольная кислота и ее соли
2.
Общая характеристика подгруппы углерода3.
Углерод – химический элемент1. Положение углерода в ПСХЭ.
2. Строение атома углерода
3. Сравнение строения атома углерода и кремния
4. Нахождение в природе
4.
5.
6.
7.
8.
9.
Нахождение в природеВ свободном виде
в форме двух модификаций ─
алмаза и графита
В виде соединений
в атмосфере в виде СО2
0,03 % по массе
10.
Нахождение в природеВ виде соединений
в литосфере углерод занимает 13 место по распространенности среди всех
элементов и на его долю приходится 0,087%
Минералы: кальцит СаСО3 и его разновидности (мел, мрамор, известняк);
магнезит MgCO3; доломит CaCO3·MgCO3; малахит (CuOH)2CO3
11.
Аллотропные модификации углеродаграфит
алмаз
карбин
графит
фуллерен
карбин
фуллерен
Аллотропные модификации углерода имеют атомные
кристаллические решетки.
12.
АлмазС*
В возбужденном состоянии атом
углерода может образовывать четыре
ковалентные связи. В алмазе все
валентные электроны атомов углерода
участвуют в образовании связей, все
связи очень прочные. Недаром алмаз –
самое твердое вещество в природе. И с
незапамятных времен считается царем
всех самоцветов и драгоценных камней.
Да и само его название означает погречески «несокрушимый»
13.
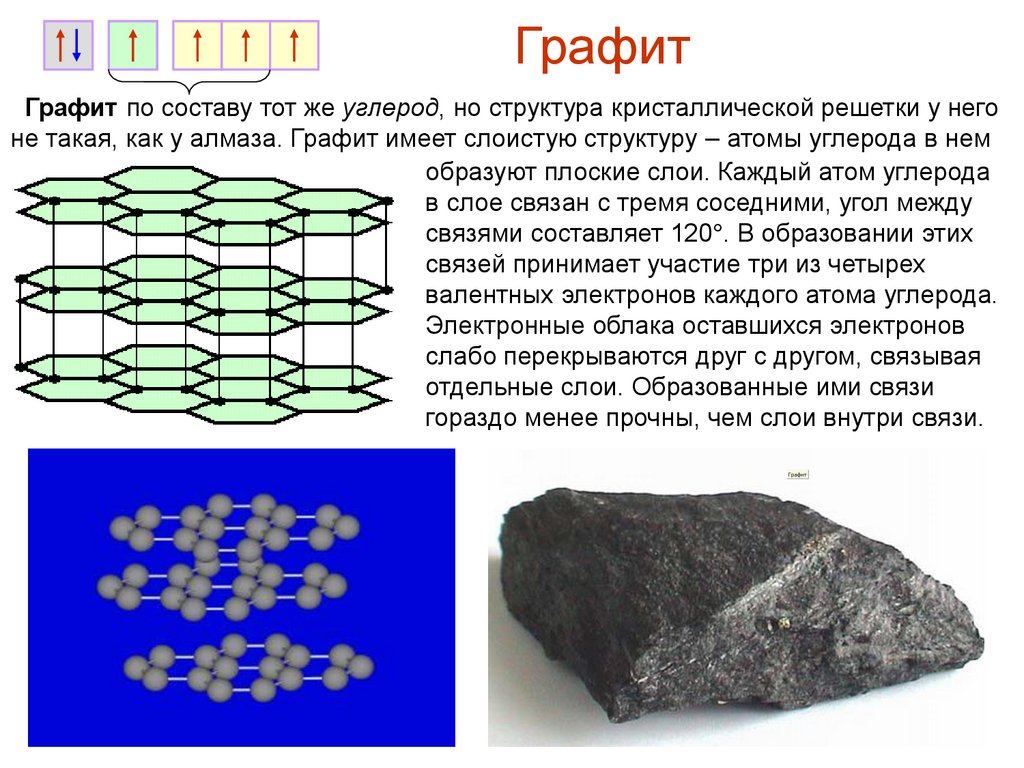
ГрафитГрафит по составу тот же углерод, но структура кристаллической решетки у него
не такая, как у алмаза. Графит имеет слоистую структуру – атомы углерода в нем
образуют плоские слои. Каждый атом углерода
в слое связан с тремя соседними, угол между
связями составляет 120°. В образовании этих
связей принимает участие три из четырех
валентных электронов каждого атома углерода.
Электронные облака оставшихся электронов
слабо перекрываются друг с другом, связывая
отдельные слои. Образованные ими связи
гораздо менее прочны, чем слои внутри связи.
14.
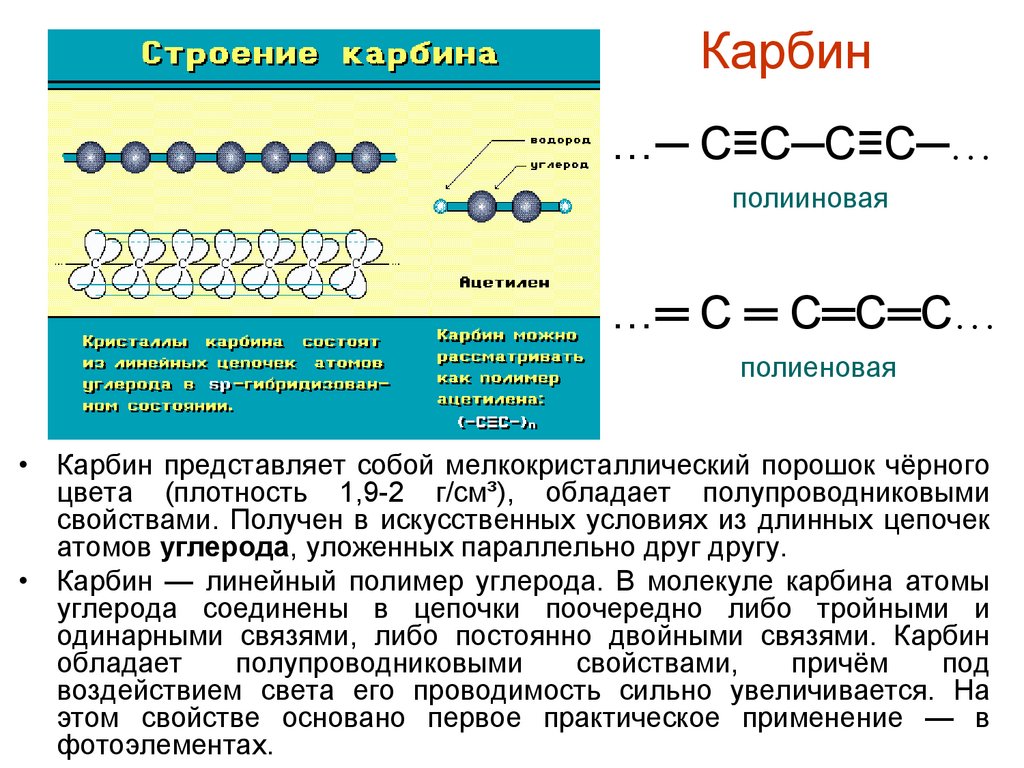
Карбин…─ С≡С─С≡С─…
полииновая
…═ С ═ С═С═С…
полиеновая
• Карбин представляет собой мелкокристаллический порошок чёрного
цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми
свойствами. Получен в искусственных условиях из длинных цепочек
атомов углерода, уложенных параллельно друг другу.
• Карбин — линейный полимер углерода. В молекуле карбина атомы
углерода соединены в цепочки поочередно либо тройными и
одинарными связями, либо постоянно двойными связями. Карбин
обладает
полупроводниковыми
свойствами,
причём
под
воздействием света его проводимость сильно увеличивается. На
этом свойстве основано первое практическое применение — в
фотоэлементах.
15.
Фуллерены.is?OxCviXpHeKIY3o-uzwkVGZrH_6HLYEh74pRx1m8X35Y
Это твердые кристаллические вещества, растворимые в органических
растворителях, с образованием ярко окрашенных
растворов.
Молекулы
фуллеренов
представляют собой сферы, состоящие из пятии
шестиугольников,
которые
образованы
атомами углерода.
16.
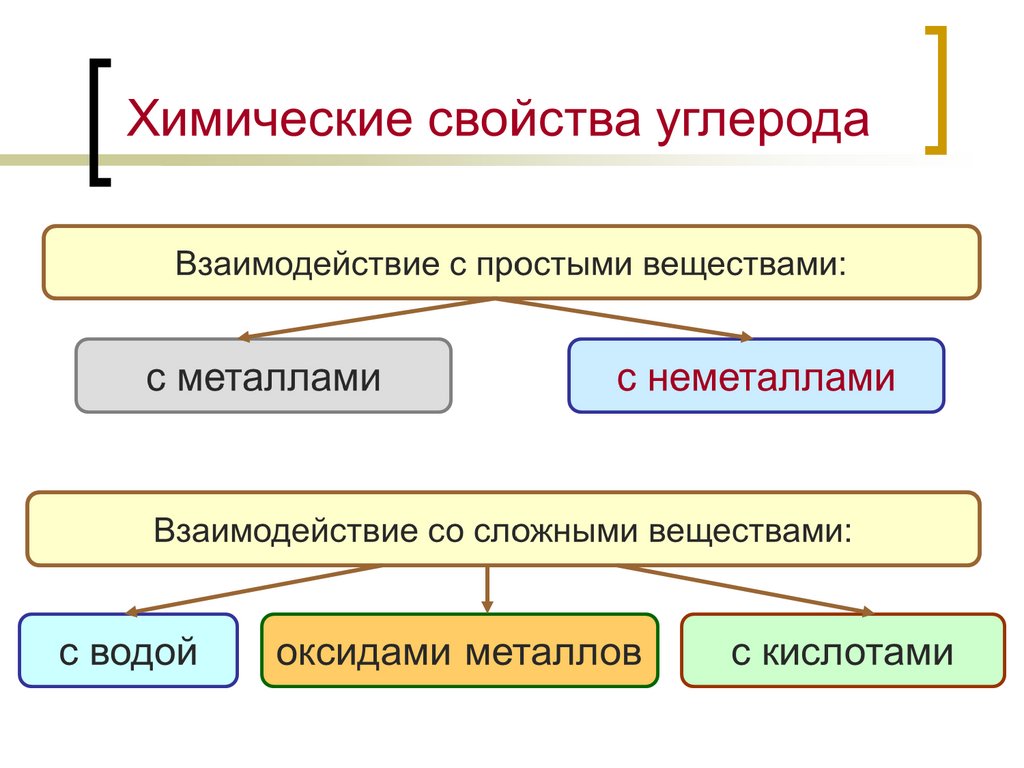
Химические свойства углерода17.
18.
19.
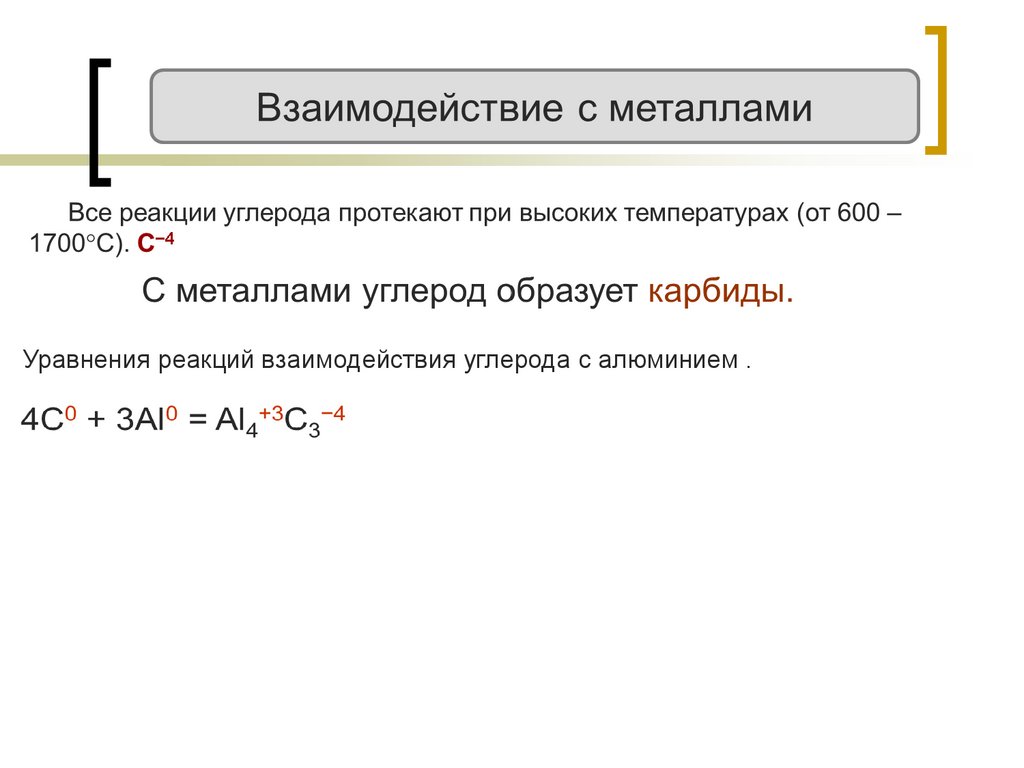
Уравнения реакций взаимодействия углерода с алюминием .20.
Уравнения реакций взаимодействия углерода с алюминием21.
Уравнения реакций взаимодействия углерода с алюминием22.
Уравнения реакций взаимодействия углерода с алюминием .23.
Уравнения реакций взаимодействия углерода с алюминием24.
Уравнения реакций взаимодействия углерода с алюминием25.
Уравнения реакций взаимодействия углерода с алюминием26.
Уравнения реакций взаимодействия углерода с алюминием27.
Уравнения реакций взаимодействия углерода с алюминием28.
Уравнения реакций взаимодействия углерода с алюминием29.
Уравнения реакций взаимодействия углерода с алюминием .30.
Уравнения реакций взаимодействия углерода с кальцием.С0 – окислитель, процесс восстановления
Связь между Са и С – ионная,
а между атомами углерода –
ковалентная неполярная.
31.
Уравнения реакций взаимодействия углерода с кальцием.С0 – окислитель, процесс восстановления
Ca0 – восстановитель, процесс окисления.
Связь между Са и С – ионная,
а между атомами углерода –
ковалентная неполярная.
32.
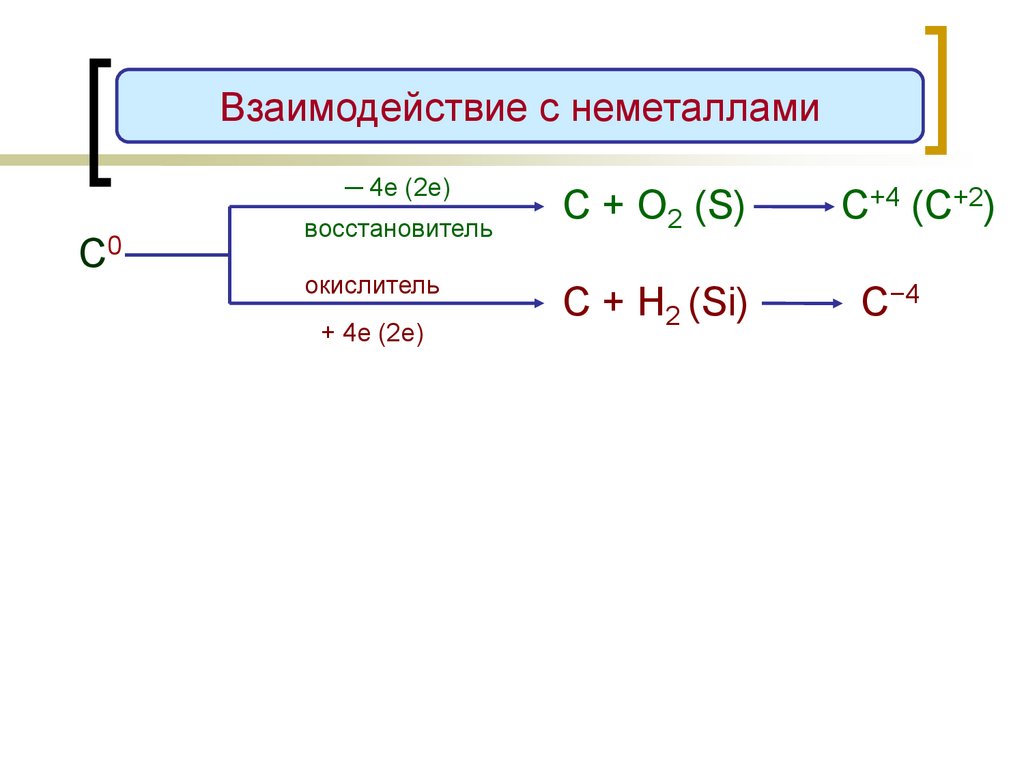
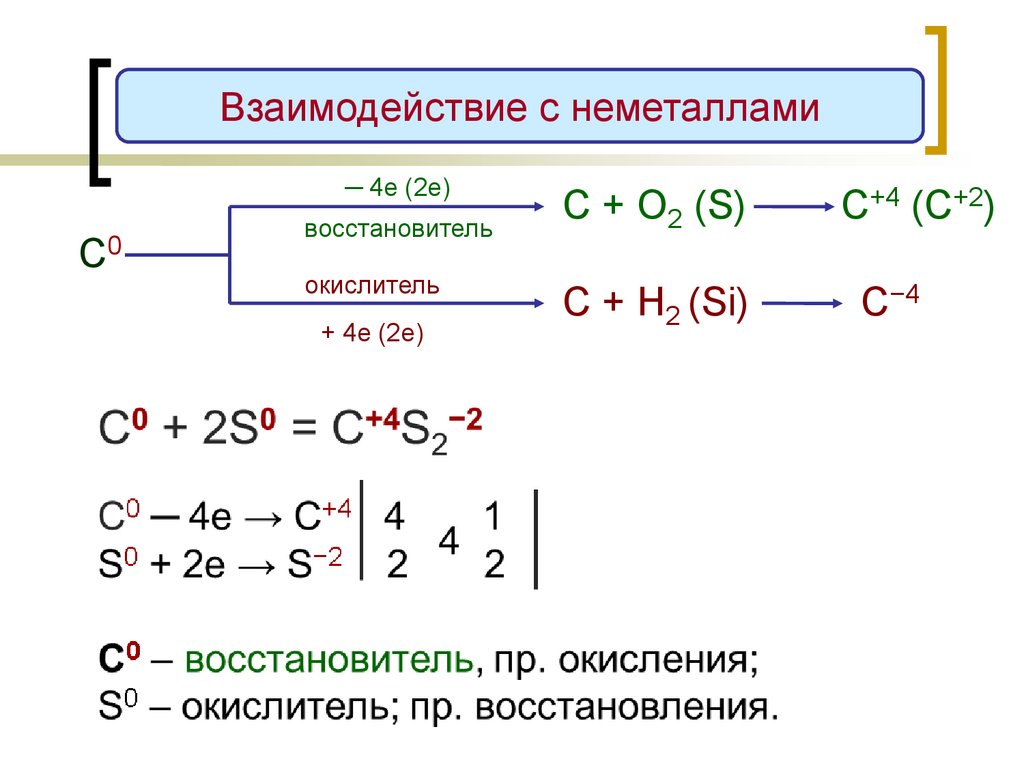
Взаимодействие с неметаллами─ 4е (2е)
С0
восстановитель
окислитель
+ 4е (2е)
С + О2 (S)
С+4 (C+2)
С + H2 (Si)
С−4
33.
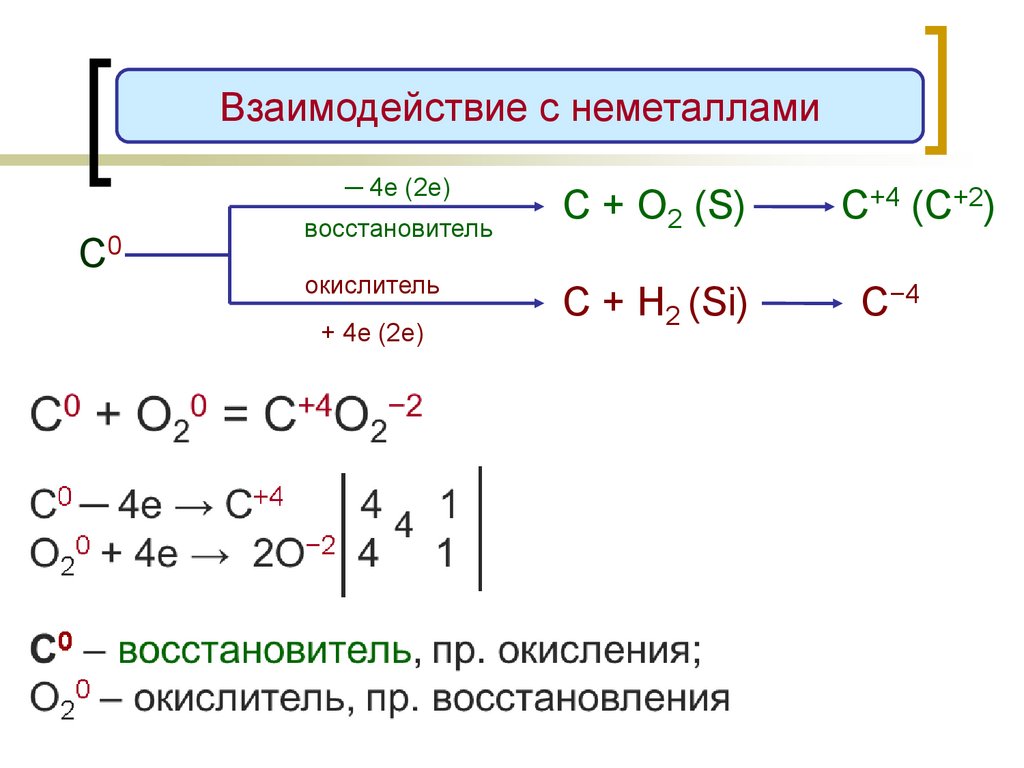
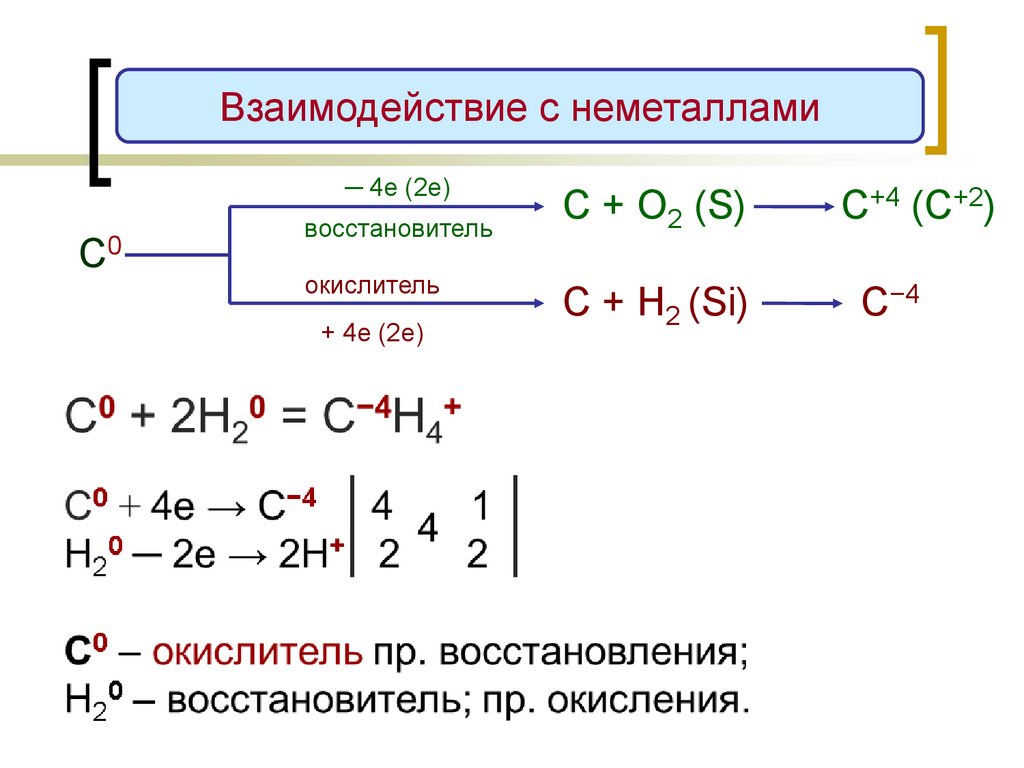
Взаимодействие с неметаллами─ 4е (2е)
С0
восстановитель
окислитель
+ 4е (2е)
С + О2 (S)
С+4 (C+2)
С + H2 (Si)
С−4
34.
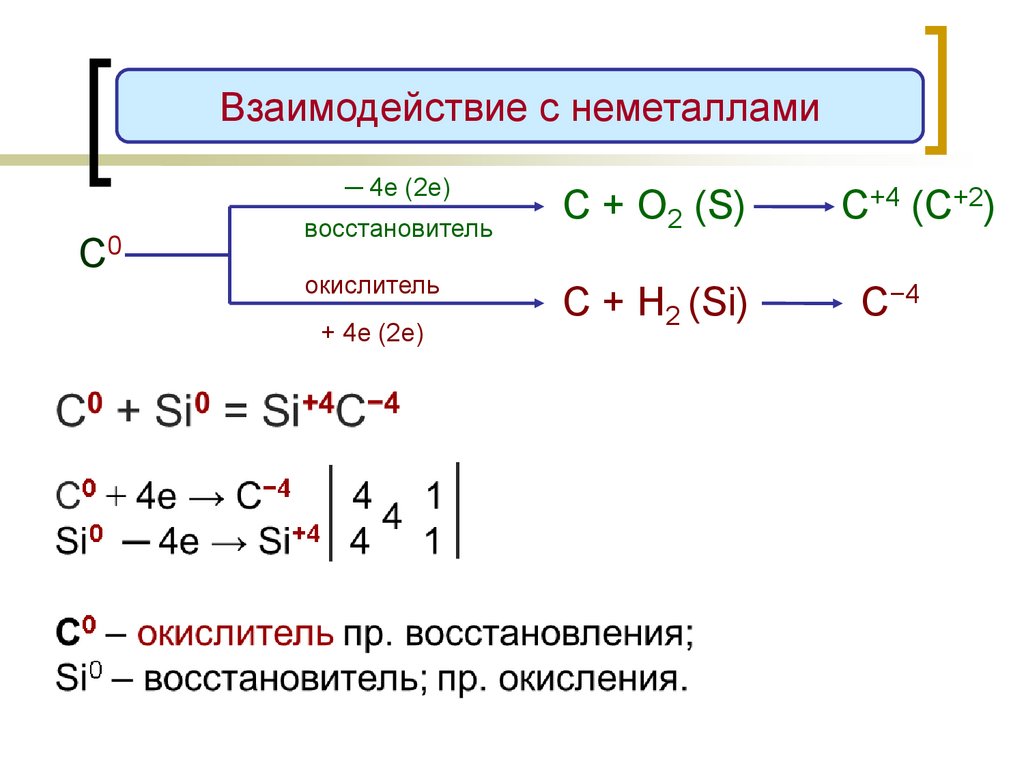
Взаимодействие с неметаллами─ 4е (2е)
С0
восстановитель
окислитель
+ 4е (2е)
С + О2 (S)
С+4 (C+2)
С + H2 (Si)
С−4
35.
Взаимодействие с неметаллами─ 4е (2е)
С0
восстановитель
окислитель
+ 4е (2е)
С + О2 (S)
С+4 (C+2)
С + H2 (Si)
С−4
36.
Взаимодействие с неметаллами─ 4е (2е)
С0
восстановитель
окислитель
+ 4е (2е)
С + О2 (S)
С+4 (C+2)
С + H2 (Si)
С−4
37.
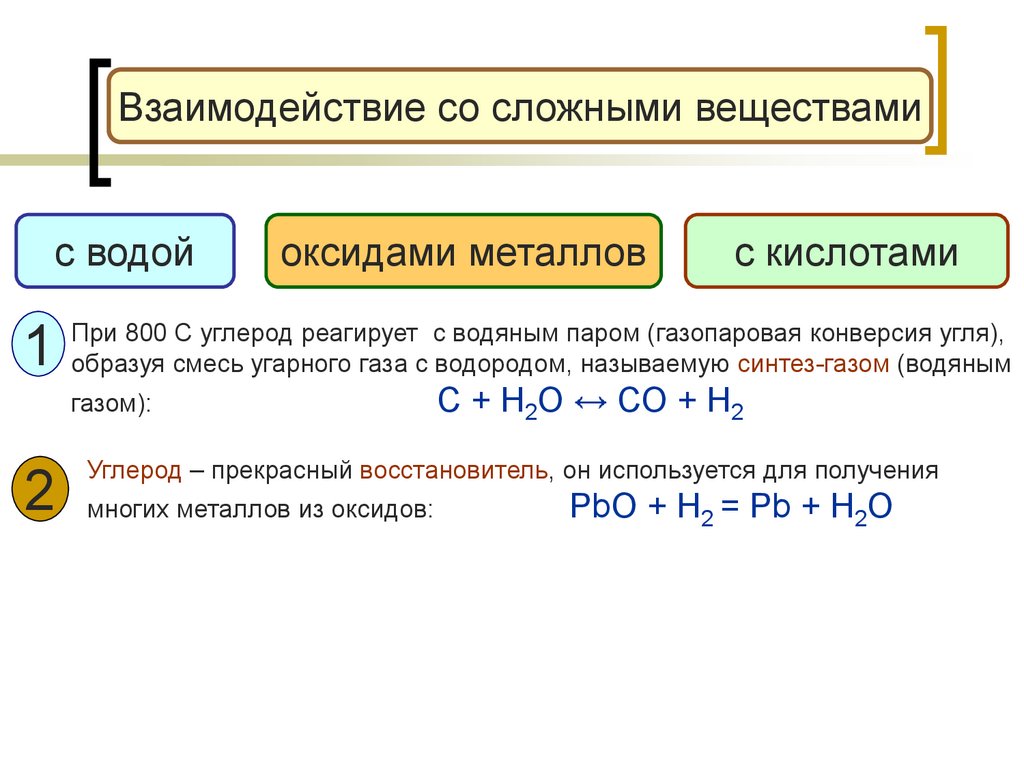
Взаимодействие со сложными веществамис водой
1
оксидами металлов
с кислотами
При 800 С углерод реагирует с водяным паром (газопаровая конверсия угля),
образуя смесь угарного газа с водородом, называемую синтез-газом (водяным
газом):
С + Н2О
СО + Н2
38.
Взаимодействие со сложными веществамис водой
1
оксидами металлов
с кислотами
При 800 С углерод реагирует с водяным паром (газопаровая конверсия угля),
образуя смесь угарного газа с водородом, называемую синтез-газом (водяным
газом):
С + Н2О
СО + Н2
Углерод – прекрасный восстановитель, он используется для получения
2 многих металлов из оксидов:
PbO + H2 = Pb + H2O
39.
Взаимодействие со сложными веществамис водой
1
оксидами металлов
с кислотами
При 800 С углерод реагирует с водяным паром (газопаровая конверсия угля),
образуя смесь угарного газа с водородом, называемую синтез-газом (водяным
С + Н2О
газом):
СО + Н2
Углерод – прекрасный восстановитель, он используется для получения
2 многих металлов из оксидов:
3
PbO + H2 = Pb + H2O
Углерод устойчив к действию щелочей, но окисляется горячими концентрированными растворами серной и азотной кислот до углекислого газа:
C + 4HNO3 = CO2 + 4NO2 + 2H2O
С + 2H2SO4 = CO2 + 2SO2 + 2H2O























 Химия
Химия








