Похожие презентации:
алканы
1.
Занятиепо органической
химии
2.
Тема: «Предельныеуглеводороды - алканы».
«Границ
научному
познанию и
предсказанию
предвидеть
невозможно».
Д.И.Менделеев
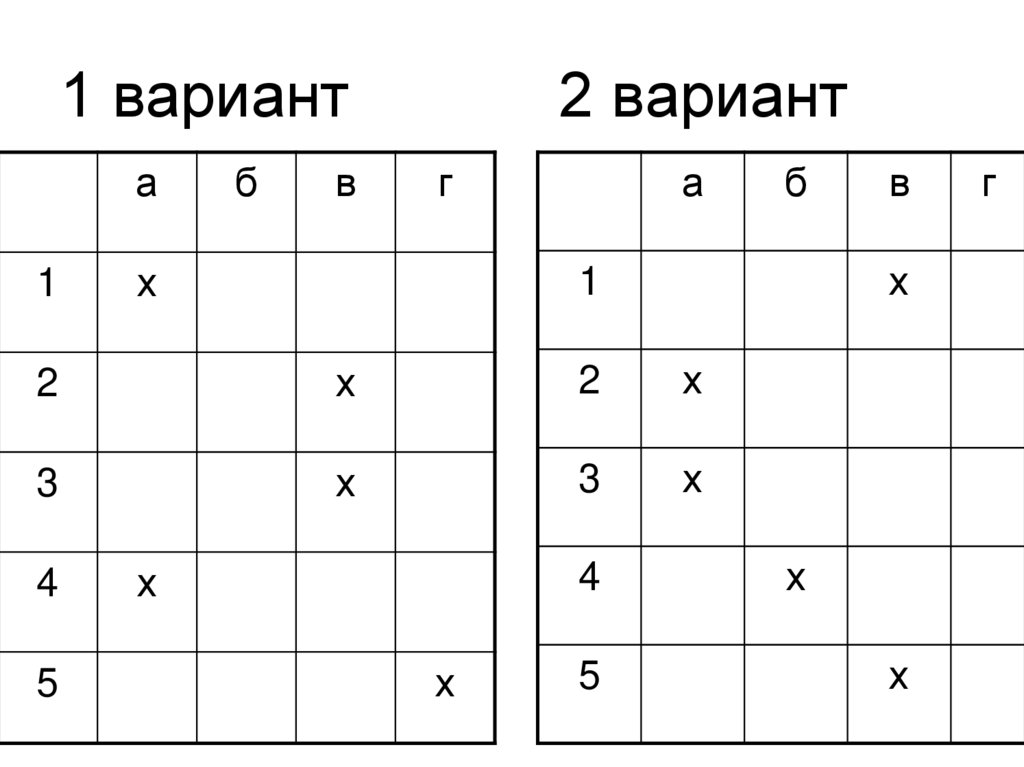
3. 1 вариант 2 вариант
1 варианта
1
б
в
2 вариант
г
х
а
х
2
х
3
х
3
х
5
х
4
х
5
в
х
1
2
4
б
х
х
г
4. План занятия
1. Определение, общая формула,гомологический ряд класса
предельных углеводородов.
2. Строение алканов.
3. Составление названий алканов
разветвленного строения.
4. Физические свойства.
5. Способы получения.
6. Химические свойства.
7. Применение.
5.
6.
Алканы - углеводороды вмолекулах которых все
атомы углерода
связаны одинарными
связями (σ-) и имеют
общую формулу:
CnH2n+2,
где n –число атомов
углерода в молекуле
7. Гомологический ряд
Гомологи – это вещества, сходные по строению и свойствами отличающиеся на одну или более групп СH2.
• СН4
• С2H6
• C3H8
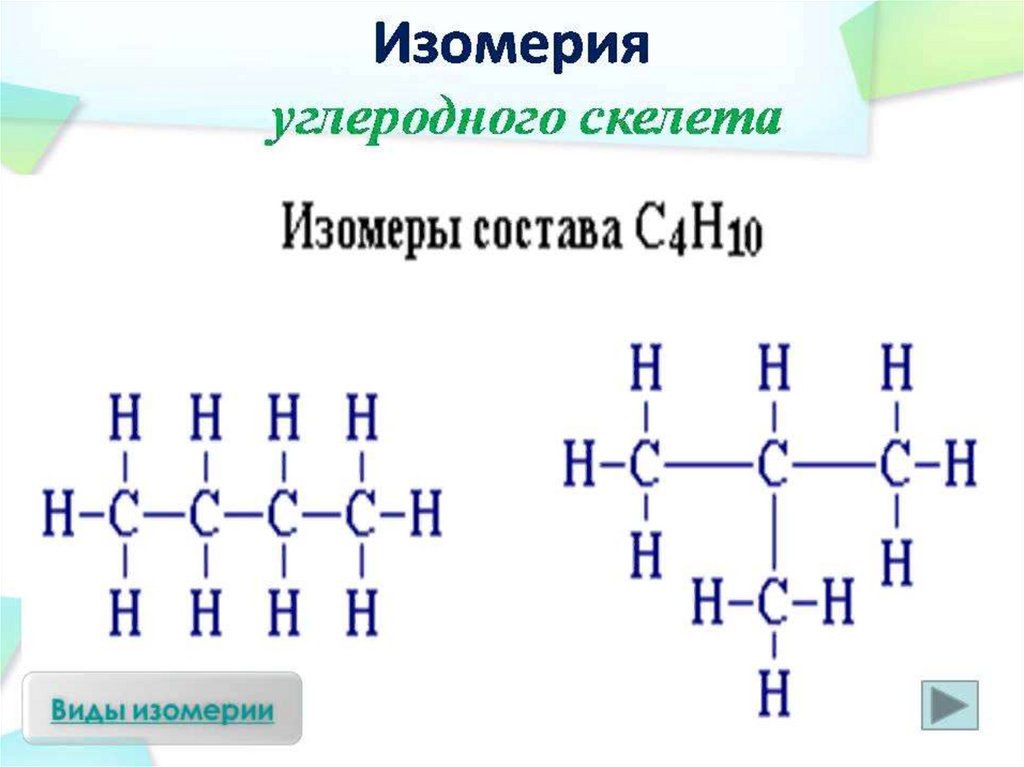
• C4H10
• C5H12
метан
этан
пропан
бутан
пентан
• C6H14
• C7H16
• C8H18
• C9H20
• C10H22
гексан
гептан
октан
нонан
декан
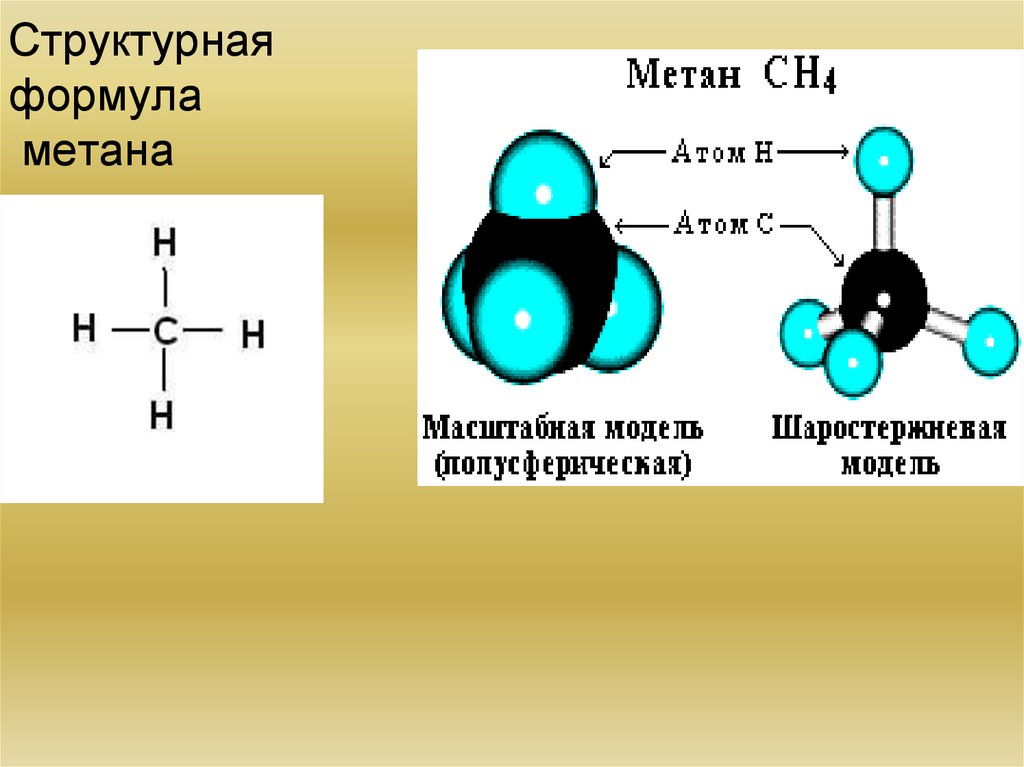
8. Структурная формула метана
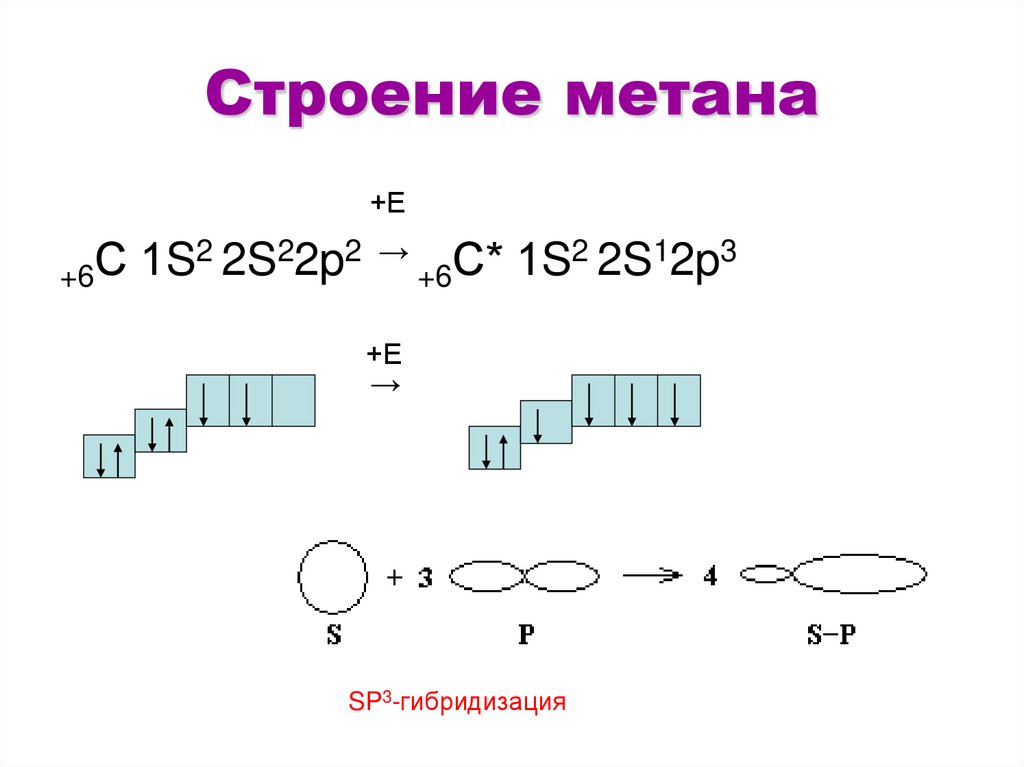
9. Строение метана
+Е2 2S22p2 → С* 1S2 2S12p3
С
1S
+6
+6
+Е
→
SP3-гибридизация
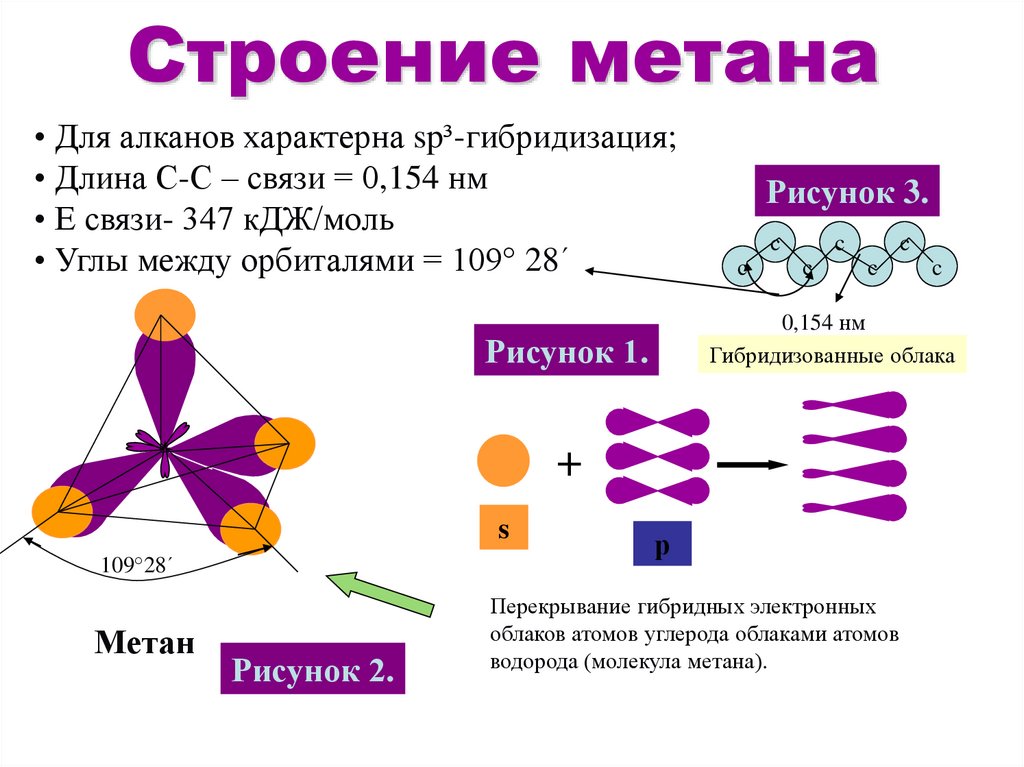
10. Строение метана
• Для алканов характерна sp³-гибридизация;• Длина С-С – связи = 0,154 нм
• Е связи- 347 кДЖ/моль
• Углы между орбиталями = 109° 28´
Рисунок 3.
c
c
c
c
c
c
0,154 нм
Гибридизованные облака
Рисунок 1.
+
s
109°28´
Метан
Рисунок 2.
c
р
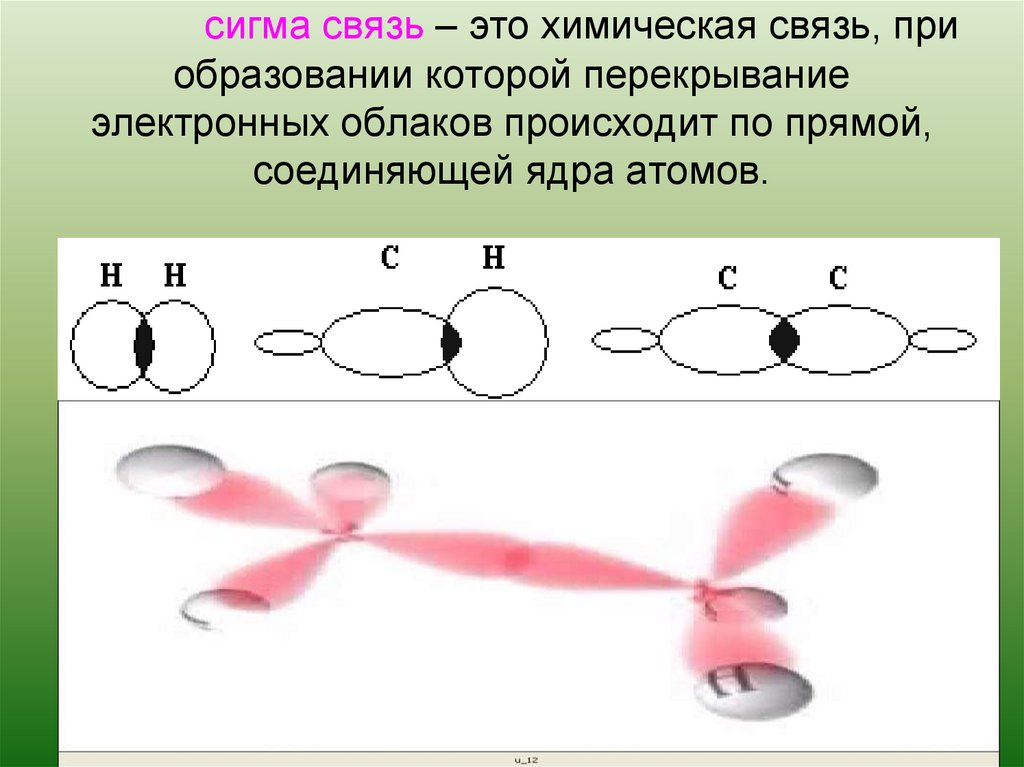
Перекрывание гибридных электронных
облаков атомов углерода облаками атомов
водорода (молекула метана).
11.
Американский химик и физик12. сигма связь – это химическая связь, при образовании которой перекрывание электронных облаков происходит по прямой, соединяющей
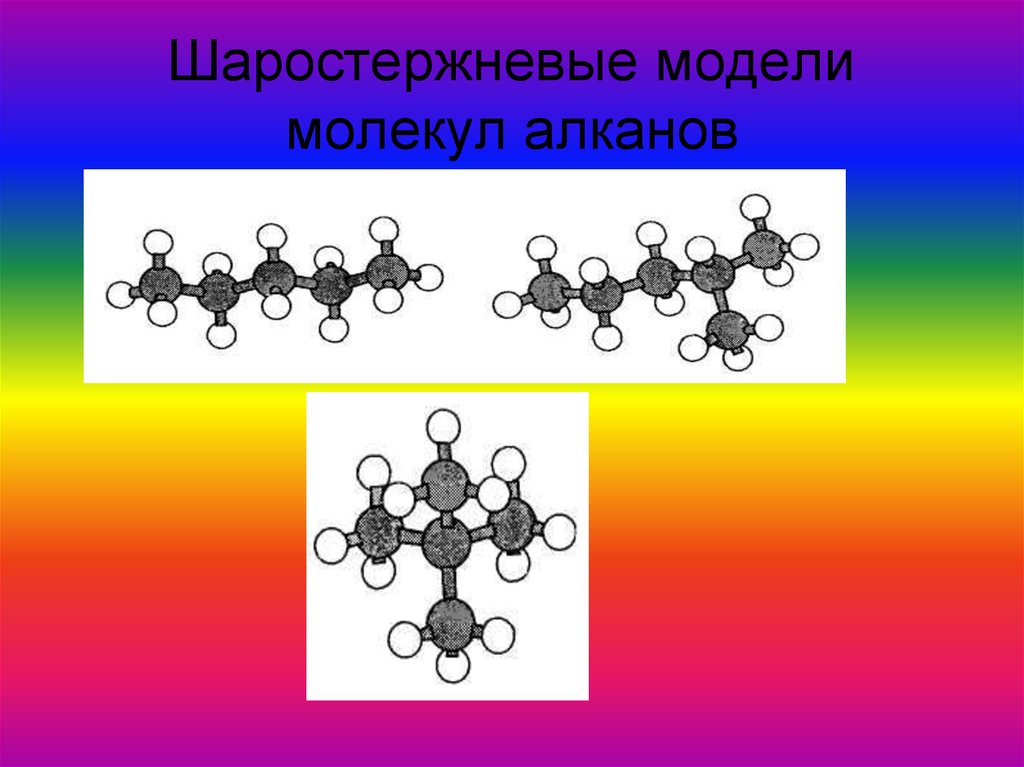
ядра атомов.13. Шаростержневые модели молекул алканов
14. 109º 28/
Характеристикауглеводорода
• Общая формула
• Тип гибридизации
• Валентный угол
• Длина связи
• Геометрия
молекул
Предельные
углеводороды
CnH2n+2
sp3
109º 28/
0,154нм
тетраэдр
15.
16.
17.
18. Номенклатура -
Номенклатура • это система названий, употребляющихсяв какой-либо науке.
• Химическая номенклатура – это
система формул и названий химических
веществ.
Она
включает
правила
составления формул и названий.
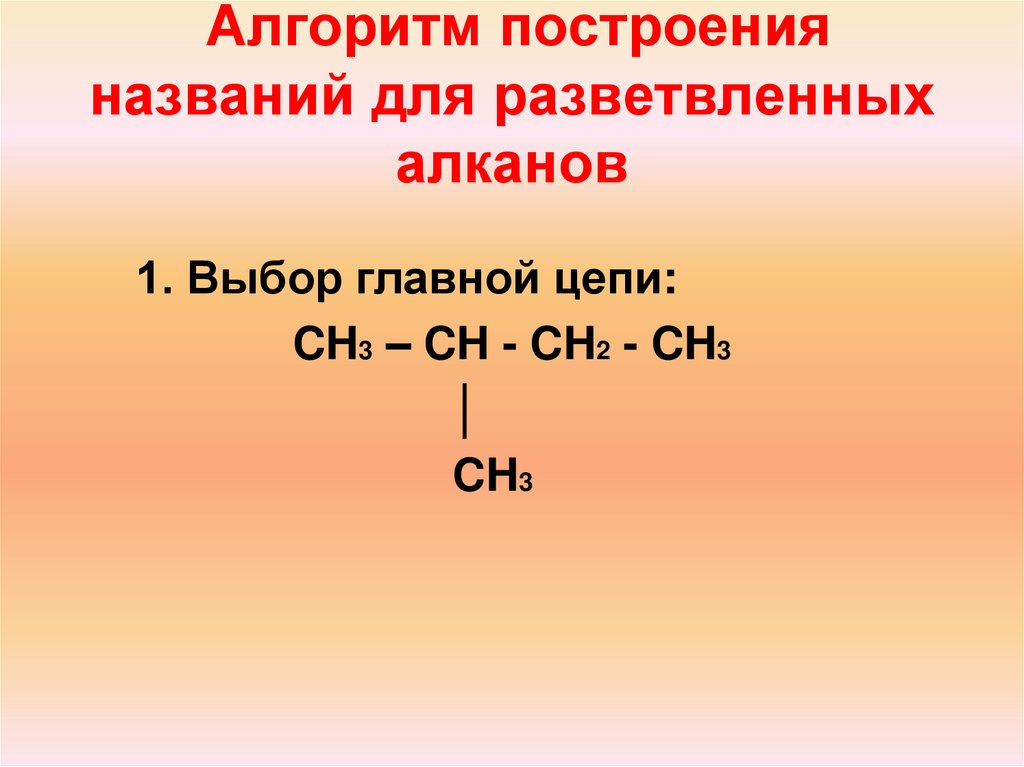
19. Алгоритм построения названий для разветвленных алканов
1. Выбор главной цепи:CH3 – CH - CH2 - CH3
│
CH3
20.
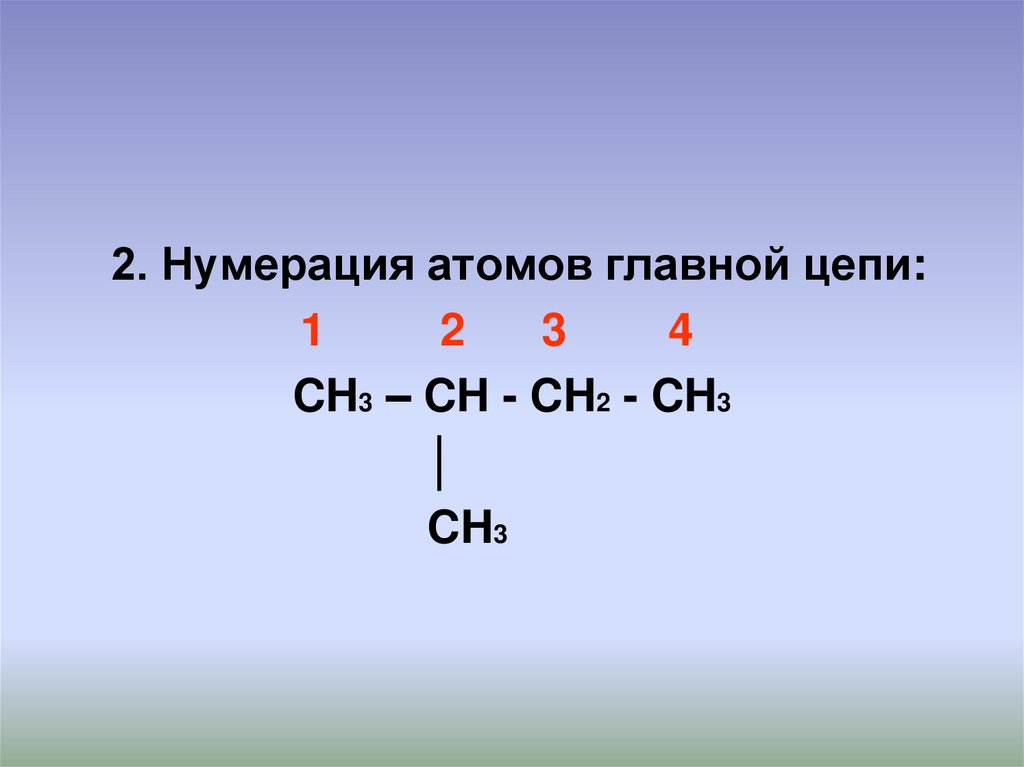
2. Нумерация атомов главной цепи:1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
21. Радикал – это частица, имеющая не спаренные электроны.
Число1
Название Формула
числа
радикала
моно-СН3
Название
радикала
метил
2
ди-
-С2Н5
этил
3
три-
-С3Н7
пропил
4
тетра-
-С4Н9
бутил
5
пента-
-С5Н11
пентил
22.
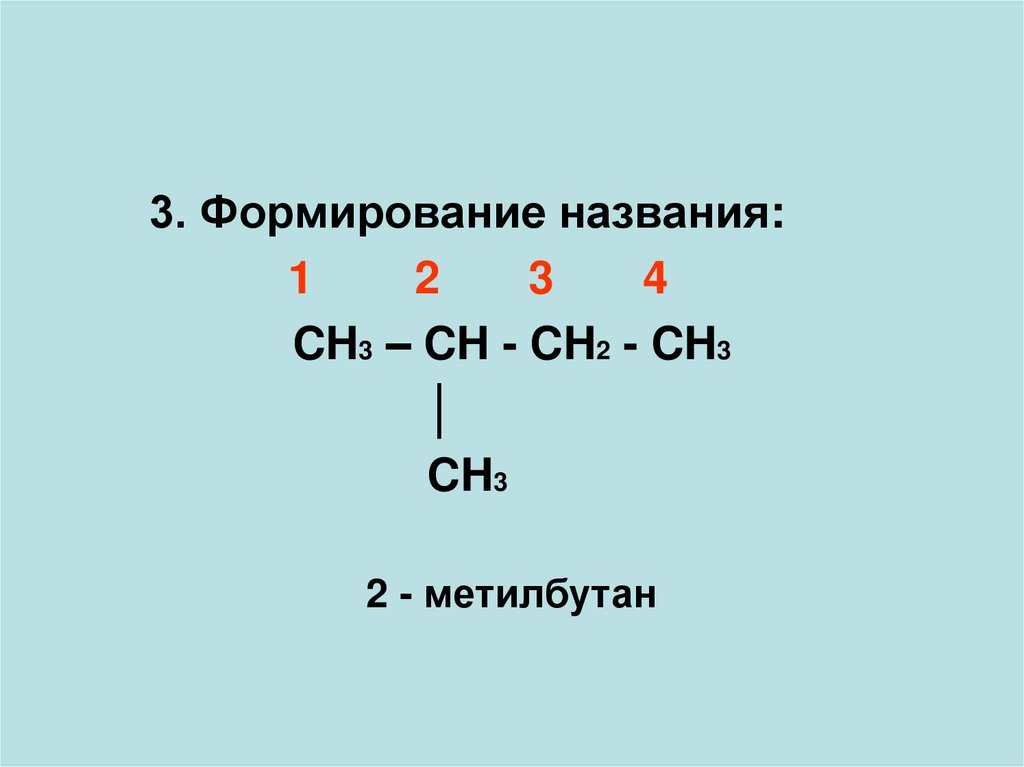
3. Формирование названия:1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан
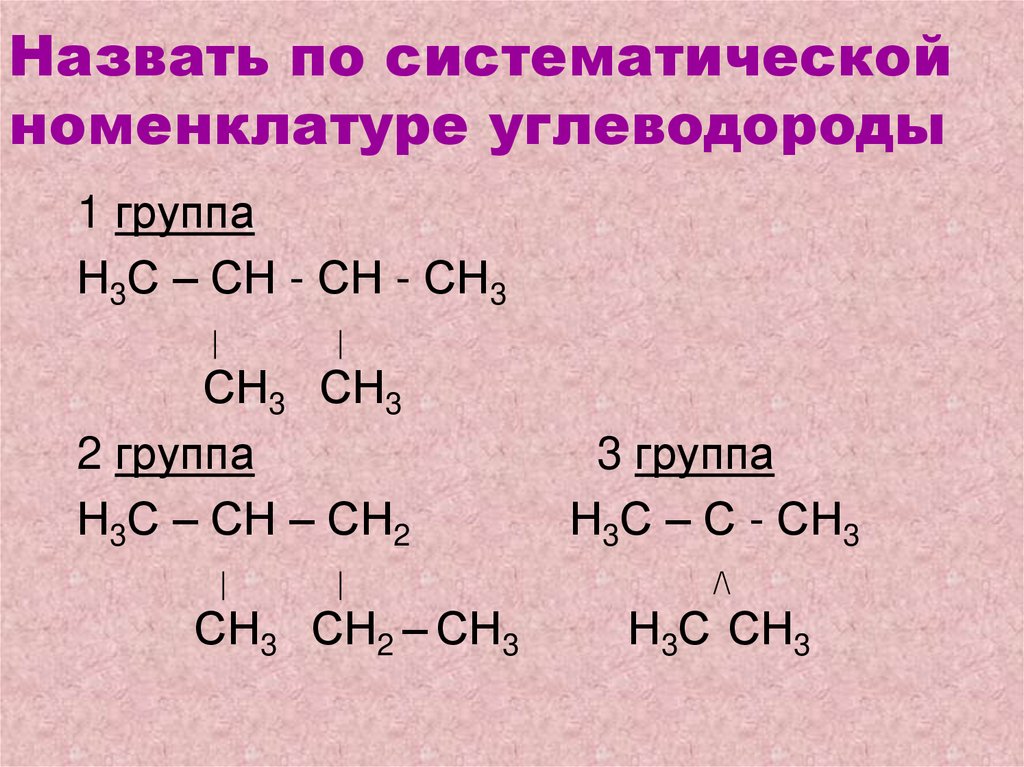
23. Назвать по систематической номенклатуре углеводороды
1 группаН3С – СН - СН - СН3
|
|
СН3 СН3
2 группа
Н3С – СН – СН2
3 группа
Н3С – С - СН3
|
|
/\
СН3 СН2 – СН3
Н3С СН3
24. Построить структурную формулу по названию алкана
• 1 группа2,2 –диметилгексан
• 2 группа
2– метил - 3-этилгептан
• 3 группа
2,3 - диметилпентан
25. Физические свойства
Алканы представляют собой бесцветныегазы (С-С14) или жидкости (С15-С16).
А начиная с С17, алканы являются
кристаллическими веществами.
26.
27.
С5Н12 до С16Н34 бесцветныежидкости со слабым приятным
запахом или без запаха. В воде
нерастворимы, легче воды, на
воздухе горят, пары с кислородом
образуют взрывчатые смеси.
Пентан, гексан, гептан, октан – в
виде паров наркоз.
28.
От С17Н36 и выше – твердыевещества
белового
цвета,
нерастворимы в воде, легче воды,
на воздухе горят. При высоких
температурах пары с кислородом
воздуха образуют взрывчатые
смеси. Неядовитые.
29.
Объясните почему возрастаюттемпературы плавления и
кипения алканов с увелечением
числа атомов углерода в
молекуле?
Чем длиннее цепь, тем сильнее взаимодействие
между молекулами, т.е. с увеличением числа
атомов углерода в молекуле возрастают
температуры плавления и кипения
углеводородов.
30. Химические свойства
31.
32. 1. Реакции замещения
Протекают по механизмурадикального замещения,
а) с галогенами (с Cl2 – на свету,
с Br2 – при нагревании).
33. 1.1.Хлорирование метана
h ,tCH4 + CI2 → CH3CI + HCI + Q
СН3Cl + Cl2 → CH2Cl2 + HCl
СН2Cl2 + Cl2 → CHCl3 + HCl
СНCl3 + Cl2 → CCl4 + HCl
34. 1.2. Нитрование алканов
б) замещение может происходить сазотной кислотой при t=140º (реакция
Коновалова), при этом получаются
нитросоединения:
t,Н2SO4
CH4 + НО-NO2 → CH3 NO2 + HOH+ Q
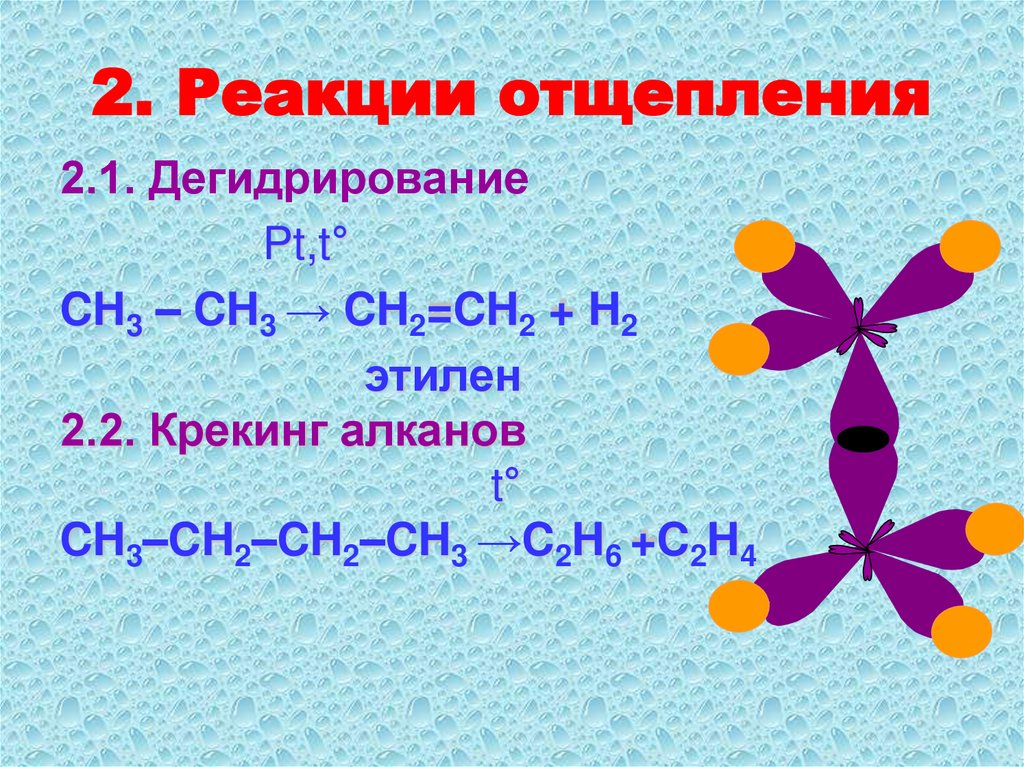
35. 2. Реакции отщепления
2.1. ДегидрированиеPt,t°
CH3 – CH3 → CH2=CH2 + H2
этилен
2.2. Крекинг алканов
t°
CH3–CH2–CH2–CH3 →C2H6 +C2H4
36.
2.3. Полное термическое разложение:1000° C
CH4 →C + 2H2
2.4. Пиролиз (для метана характерен)
1500° C
2CH4 → C2H2+ 3H2
ацетилен
37. 3. Реакции окисления
3.1. Предельные углеводороды горят (пламя некоптящее)
t
CH4+2O2 → CO2+2H2O + 880 кДж
3.2. В присутствии катализаторов окисляются с
разрывом С – С связи примерно в середине
молекулы:
t, р, кат
2CH4 + O2 → 2CH3OН + Q (t =480ºC)
t, р, кат
C4H10 + O2 → 2CH3COOН + Q (t =200ºC)
38.
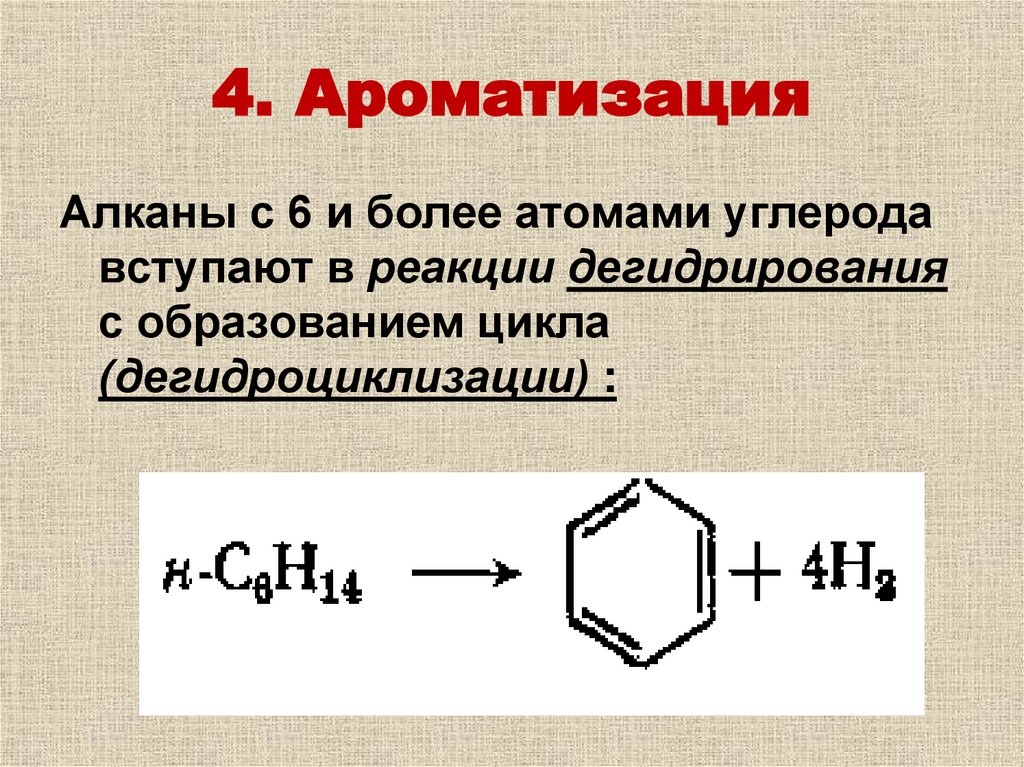
39. 4. Ароматизация
Алканы с 6 и более атомами углеродавступают в реакции дегидрирования
с образованием цикла
(дегидроциклизации) :
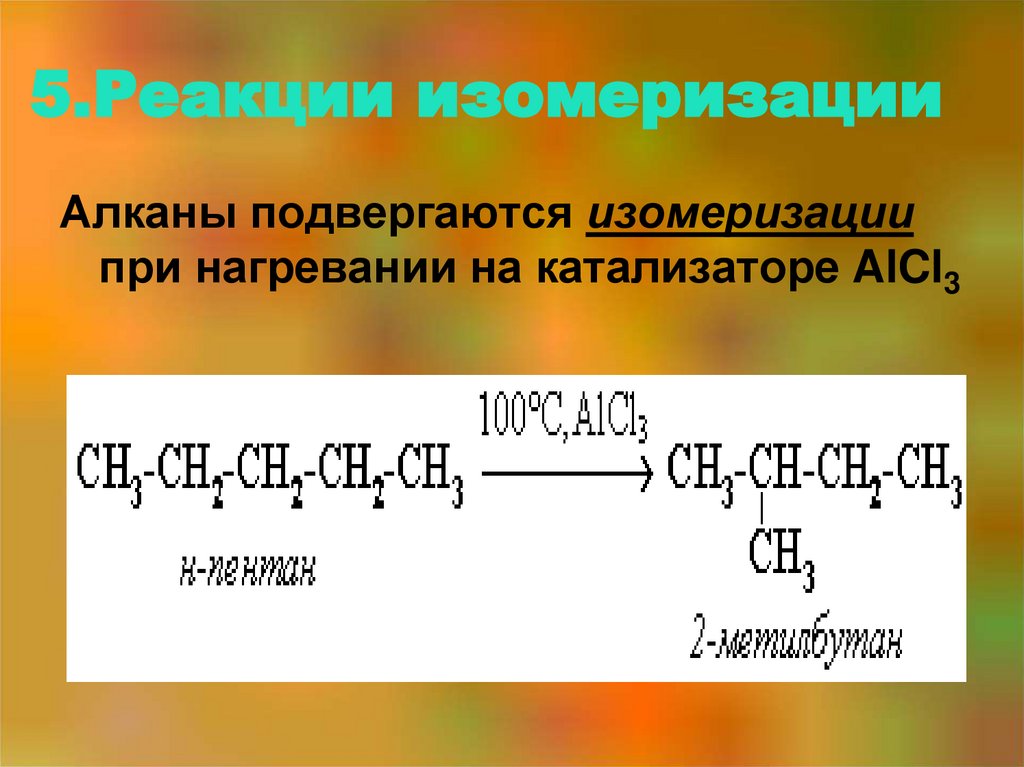
40. 5.Реакции изомеризации
Алканы подвергаются изомеризациипри нагревании на катализаторе AlCl3
41.
42.
43.
44.
45. Применение алканов
Широкоиспользуются в
качестве
топлива, в том
числе для
двигателей
внутреннего
сгорания.
46.
1-3 – производство сажи(1 – картрижи;
2 – резина;
3 – типографическая краска)
4-7 – получение
органических веществ
(4 – растворителей;
5 – хладогентов,
используемых
в холодильных установках;
6 – метанол;
7 - ацетилен)
47. Задача
Уровень А1. К природному газу, используемому в быту,
добавляют сильно пахнущие вещества меркаптаны. Для чего это делают?
1.1. Вспомните, какой газ является основным
компонентом природного газа.
1.2. Вспомните, физические и химические
свойства этого газа.
48. Задача
Уровень В2. Представьте себе, что вы тайный агент,
обнаружили засекреченную лабораторию, в
которой производится вещество, являющееся
сырьём для получения тетрахлорпроизводного
применяемого в огнетушителях. Вам удалось
взять пробы воздуха в лаборатории и
обнаружить в нём продукты горения этого
вещества: углекислый газ объёмом 22,4 л при
н.у., и пары воды массой 36 г. Составьте
шифровку в “Центр”:
1. Какое вещество производится в лаборатории?
2. Какое вещество применяется в огнетушителях?
49. Задача
Уровень С3. Эффективное средство против филлоксеры
винограда содержит 18,4% углерода и 81,6%
хлора по массе. Относительная плотность
вещества по водороду равна 130,5.
Определите молекулярную формулу
вещества.
50. Домашнее задание
Уровень А1. Учебник О.С. Габриелян
Химия с.189 – 199.
2. Составить текст на проверку знаний
свойств, строения, состава, применение
класса веществ (не менее 6 вопросов).
51. Напишите структурную формулу
Уровень В• В холодильных установках в качестве
хладоагента используется газ
дифтордихлорметан (фреон12),который под давлением сгущается в
жидкость,кипящую при -30ºС. Составьте
структурную формулу этого вещества.
• Для наркоза используется вещество
1,1,1-трифтор-2-хлор-2-бромэтан
(наркотан),лишенное недостатков
хлороформа(ядовитость,горючесть).
Напишите его структурную формулу.
52.
Уровень СВ романе Луи Буссенара “Похитители
бриллиантов” упоминается об этом
веществе: «Известно, что рудничный
газ, обладает свойством
воспламеняться на воздухе под
действием света и, смешавшись в
определённой пропорции с
атмосферным воздухом, даёт мощный
взрыв». Что это за вещество
53. Творческое задание
1. Кроссворд «Предельные углеводороды» (12–15 слов).
2. Рисунки – ребусы по теме.
3. Модели алканов изготовить.
54.
Человек рождается на свет,Чтоб творить, дерзать – и не иначе,
Чтоб оставить в жизни добрый след
И решить все трудные задачи
Человек рождается на свет…
Для чего?
Ищите свой ответ.
• С каким настроением вы
уходите с урока? Нарисуйте.








































 Химия
Химия








