Похожие презентации:
Лекция_№1_Основы_химической_структуры_и_введение_в_химию
1. ОСНОВЫ ХИМИЧЕСКОЙ СТРУКТУРЫ И ВВЕДЕНИЕ В ХИМИЮ
Преподаватель кафедры математики и естественных наукВеригина Анастасия Алексеевна
2. АЛХИМИЯ
«Наука, которая стремилась ктрансформации материи, поиску
драгоценных
металлов,
созданию
эликсиров бессмертия и обладания
философским камнем…»
3. ВАЖНЕЙШИЕ АЛХИМИЧЕСКИЕ ЗНАКИ
4. ЦЕЛИ АЛХИМИИ
ТРАНСМУТАЦИЯЭЛИКСИР ЖИЗНИ
ФИЛОСОФСКИЙ
КАМЕНЬ
5. САМЫЕ ИЗВЕСТНЫЕ АЛХИМИКИ
Зосима ПанополитскийДжабир ибн Хайян
Парацельс
6. ХИМИЯ
• Наука, изучающая вещества, их свойства,строение и взаимные превращения.
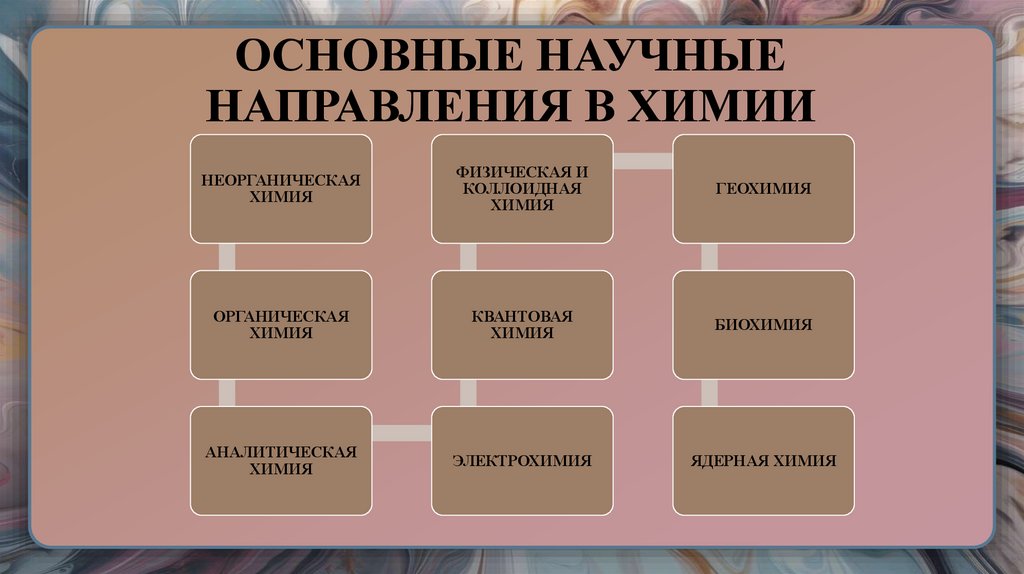
7. ОСНОВНЫЕ НАУЧНЫЕ НАПРАВЛЕНИЯ В ХИМИИ
НЕОРГАНИЧЕСКАЯХИМИЯ
ФИЗИЧЕСКАЯ И
КОЛЛОИДНАЯ
ХИМИЯ
ГЕОХИМИЯ
ОРГАНИЧЕСКАЯ
ХИМИЯ
КВАНТОВАЯ
ХИМИЯ
БИОХИМИЯ
АНАЛИТИЧЕСКАЯ
ХИМИЯ
ЭЛЕКТРОХИМИЯ
ЯДЕРНАЯ ХИМИЯ
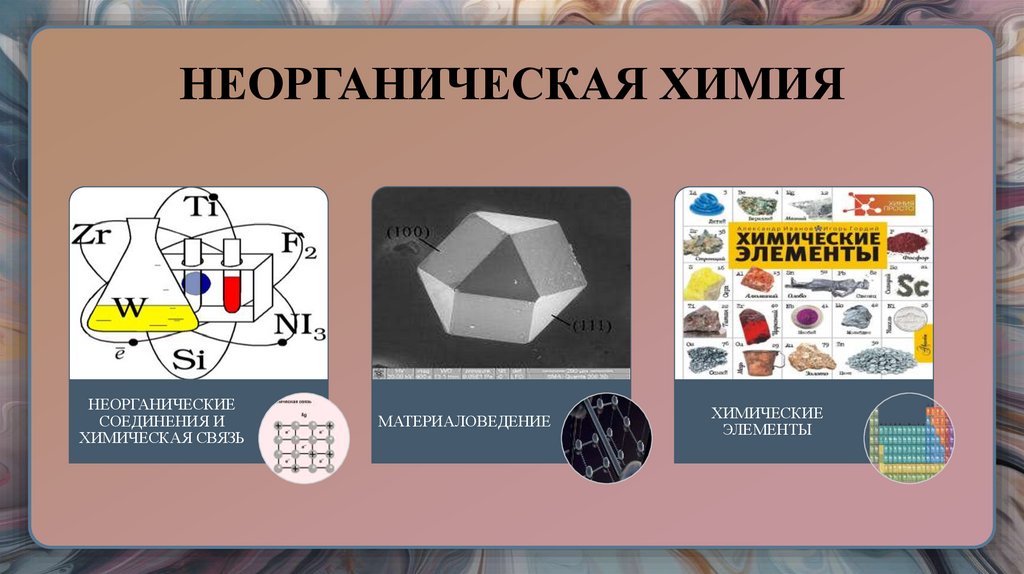
8. НЕОРГАНИЧЕСКАЯ ХИМИЯ
НЕОРГАНИЧЕСКИЕСОЕДИНЕНИЯ И
ХИМИЧЕСКАЯ СВЯЗЬ
МАТЕРИАЛОВЕДЕНИЕ
ХИМИЧЕСКИЕ
ЭЛЕМЕНТЫ
9. ОРГАНИЧЕСКАЯ ХИМИЯ
УГЛЕВОДОРОДЫИ ИХ
ПРОИЗВОДНЫЕ
СИНТЕЗ
ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
ПОЛИМЕРЫ
10. АНАЛИТИЧЕСКАЯ ХИМИЯ
Раздел химической науки, разрабатывающий на основе фундаментальныхзаконов химии и физики принципиальные методы и приёмы качественного и
количественного анализа.
Под химическим анализом понимают совокупность действий, которые имеют
своей целью получение информации о химическом составе объекта.
СОСТАВ
ВЕЩЕСТВА
Элементный
Молекулярный
Фазовый
Изотопный
Вещественный
11. ЯДЕРНАЯ ХИМИЯ
• Ядерная физика изучает строение, свойства и взаимодействияатомных ядер, то есть центральных частей атомов, включая протоны и
нейтроны.
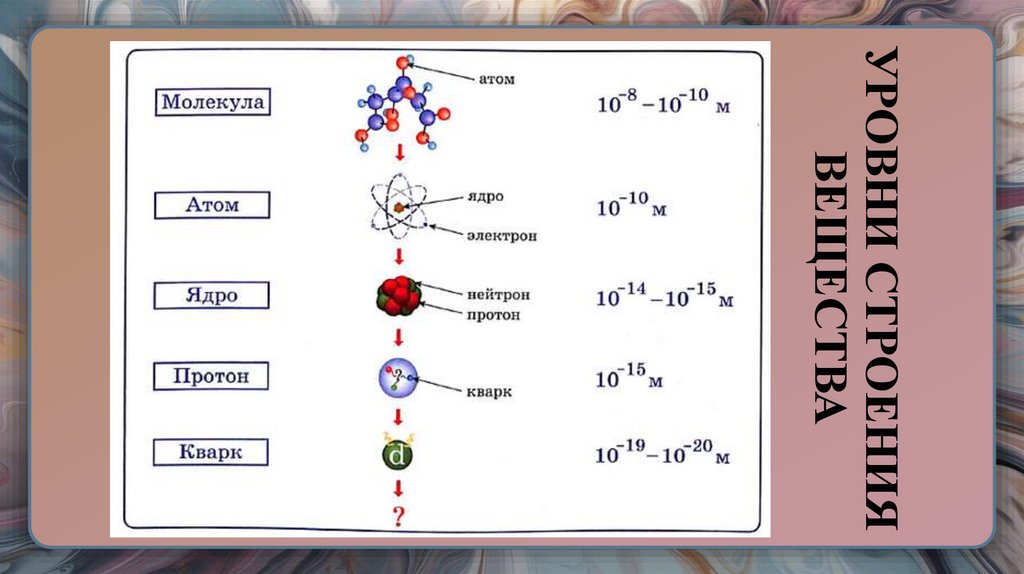
12. УРОВНИ СТРОЕНИЯ ВЕЩЕСТВА
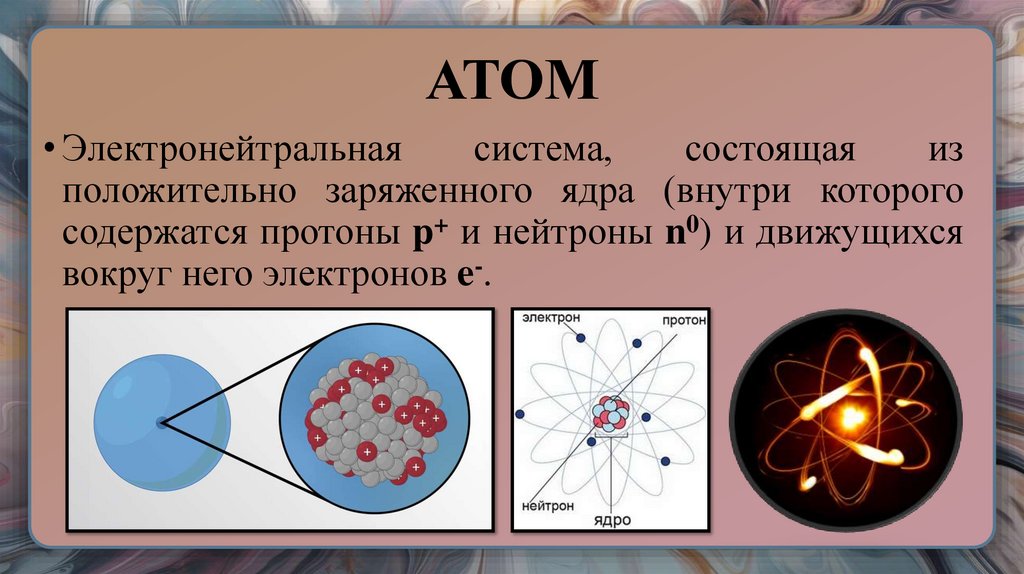
13. АТОМ
• Электронейтральнаясистема,
состоящая
из
положительно заряженного ядра (внутри которого
содержатся протоны p+ и нейтроны n0) и движущихся
вокруг него электронов e-.
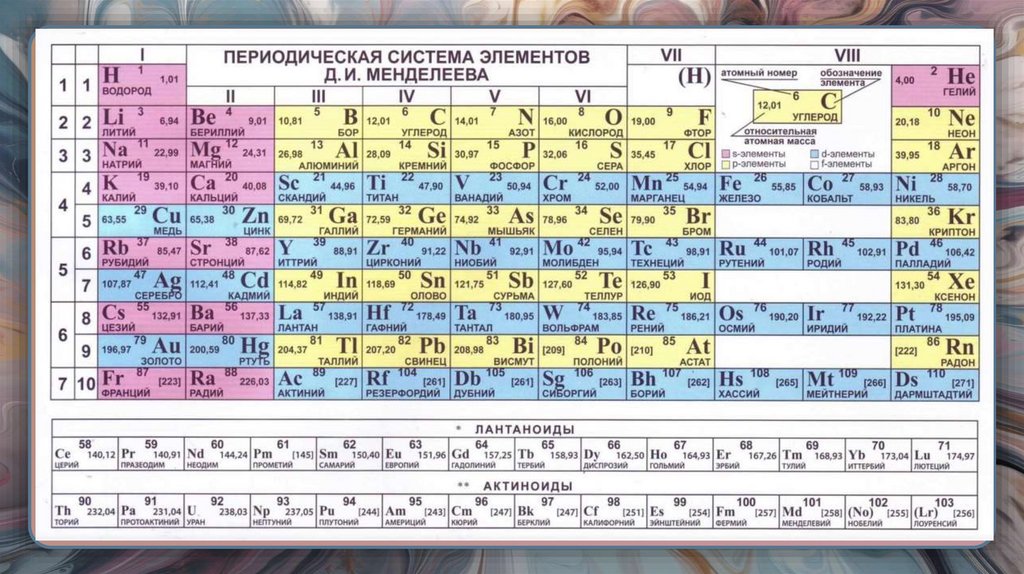
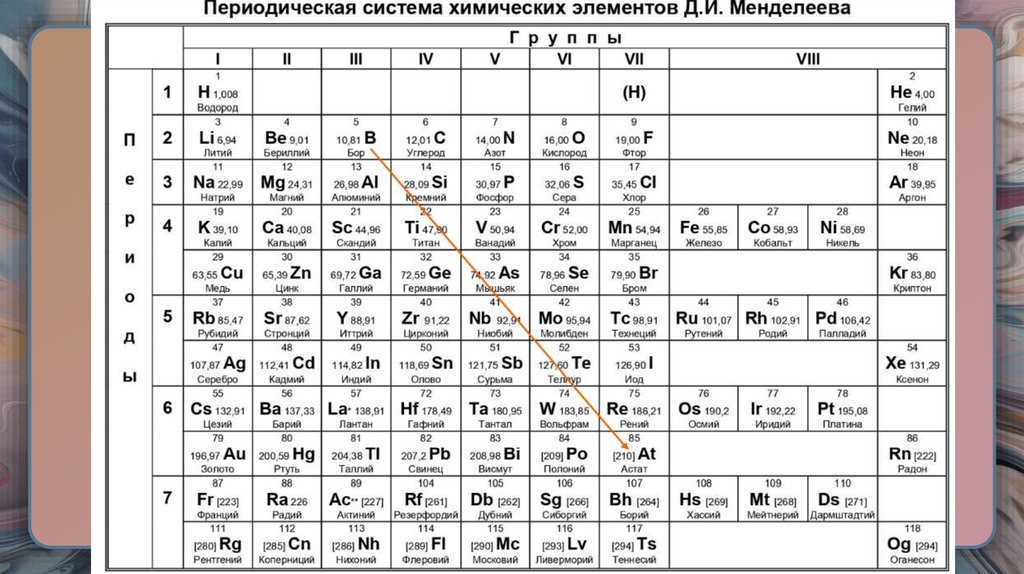
14. ЭЛЕМЕНТ
Совокупность атомов с одинаковым зарядом ядра (с одинаковымколичеством протонов).
15.
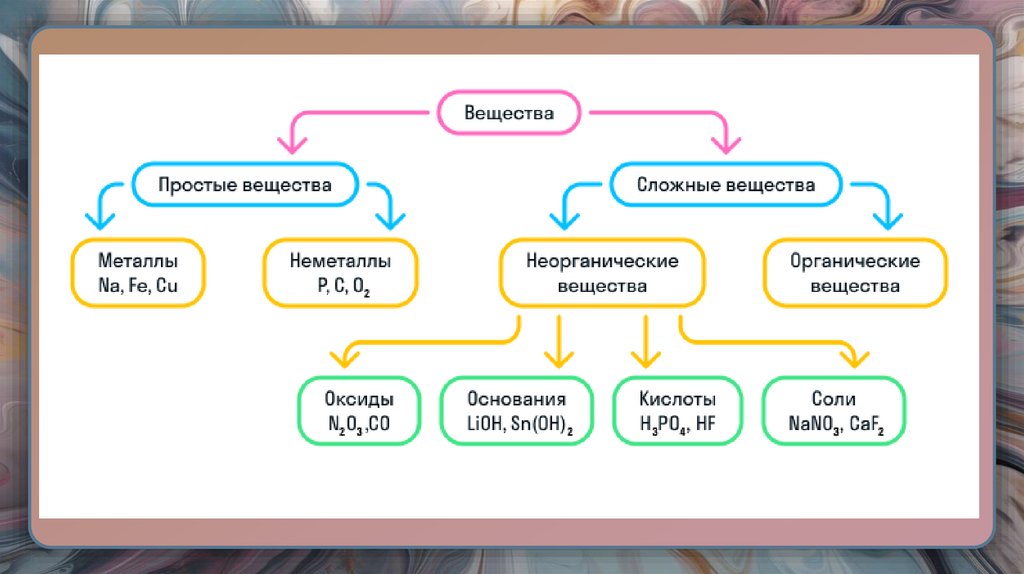
16. ПРОСТЫЕ ВЕЩЕСТВА
• Вещества, состоящие из атомов одного элемента.• Их обозначают химической формулой Аn, где А – символ химического
элемента, n – число атомов в молекуле.
Аргон
Бром
Золото
17. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
• К неметалламотносятся:
H, B, C, Si, N, P, O, As, S,
Se, Te, F, Cl, Br, I, At, He,
Ne, Ar, Kr, Xe, Rn.
18.
19. ФОРМА СУЩЕСТВОВАНИЯ ПРОСТЫХ ВЕЩЕСТВ
• Аллотропная модификация - существование двух иболее простых веществ одного и того же химического
элемента.
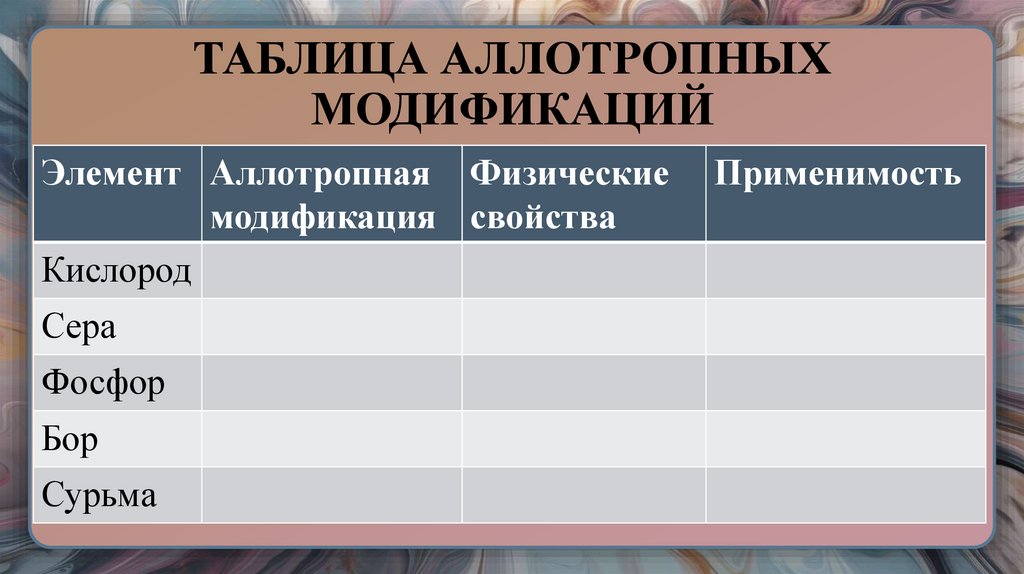
20. ТАБЛИЦА АЛЛОТРОПНЫХ МОДИФИКАЦИЙ
Элемент Аллотропная Физическиемодификация свойства
Кислород
Сера
Фосфор
Бор
Сурьма
Применимость
21.
22. СЛОЖНЫЕ ВЕЩЕСТВА
• Вещества, состоящие из двух и более различныхэлементов.
Вода
Поваренная
соль
Сахар
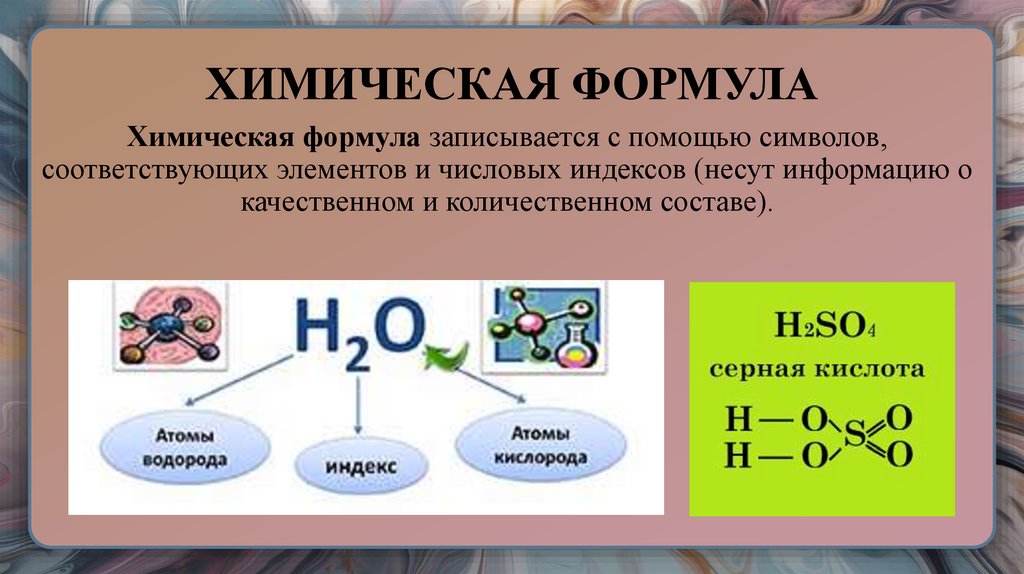
23. ХИМИЧЕСКАЯ ФОРМУЛА
Химическая формула записывается с помощью символов,соответствующих элементов и числовых индексов (несут информацию о
качественном и количественном составе).
24.
ХИМИЧЕСКАЯ ФОРМУЛАГРАФИЧЕСКАЯ
МОЛЕКУЛЯРНЫЕ
ФОРМУЛА
ФОРМУЛЫ
это разновидность
ЭМПИРИЧЕСКАЯ
химическая формула,
химической формулы,
ФОРМУЛА
составленная из символов
графически описывающая
химических элементов и
запись простейшего
расположение и порядок
выражения относительного
таких подстрочных
связи атомов в
числа каждого типа атомов
индексов, каждый из
(ковалентном) соединении,
которых равен числу атомов
в нём.
выраженное на плоскости
соответствующего элемента
или в трёхмерном
в молекуле вещества.
пространстве.
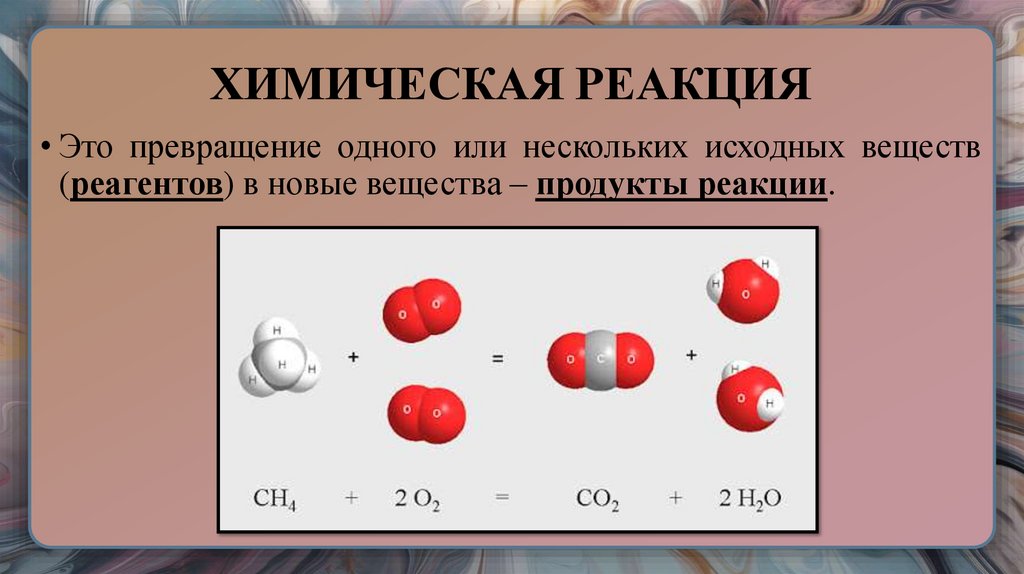
25. ХИМИЧЕСКАЯ РЕАКЦИЯ
• Это превращение одного или нескольких исходных веществ(реагентов) в новые вещества – продукты реакции.
26.
• Уравнение химической реакции - запись химическойреакции с использованием символов элементов и
формул соединений.
• Химическое
уравнение,
в
котором
указано
относительное количество реагентов и продуктов
реакции – стехиометрическое уравнение реакции.
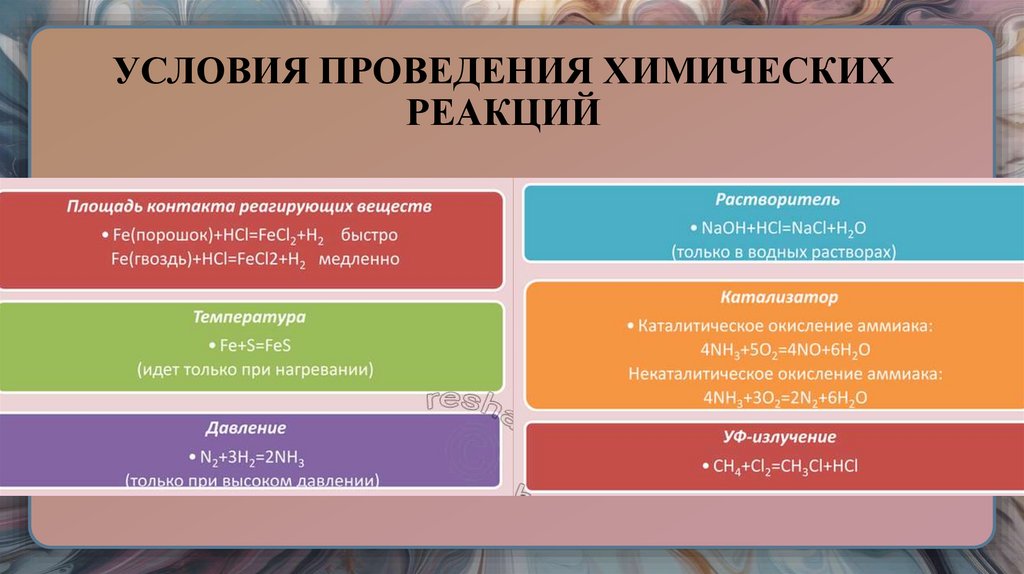
27. УСЛОВИЯ ПРОВЕДЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
28. ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
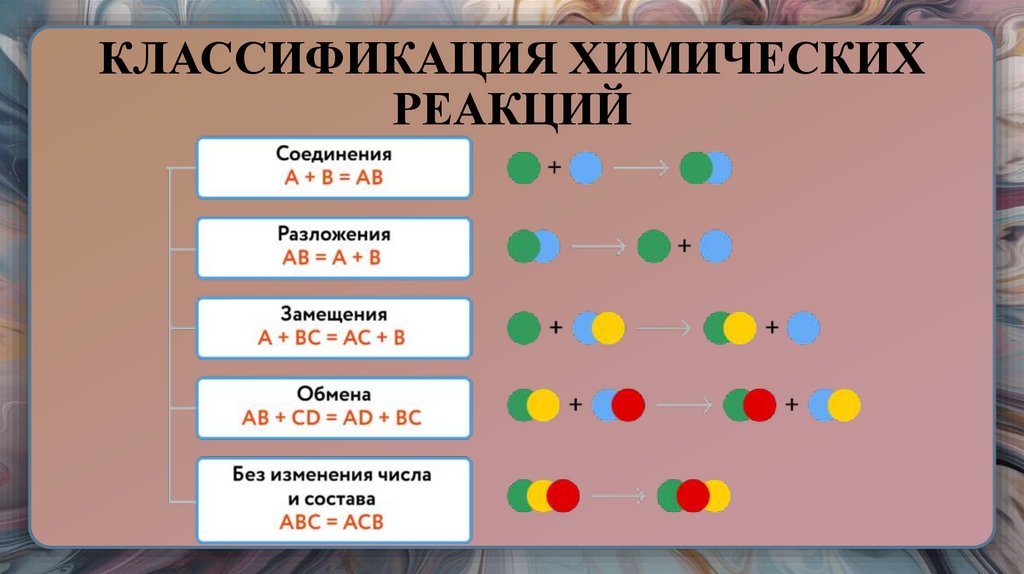
29. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
30. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ• Реакции, проходящие с изменением степеней окисления
некоторых элементов.
31. НОМЕНКЛАТУРА
правила составления химических формул и способынаименования индивидуальных химических
веществ.
• NaCl – хлорИД натрия – поваренная соль
• NaHCO3 – гидрокарбонат натрия – пищевая сода
• CuSO4*5H2O – пятиводный сульфат меди (II) –
медный купорос
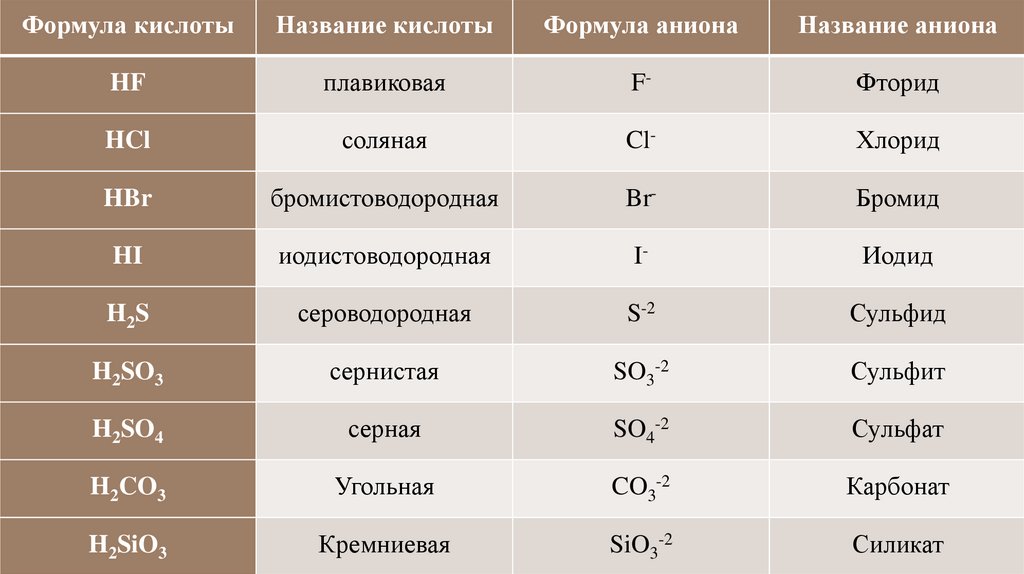
32.
Формула кислотыНазвание кислоты
Формула аниона
Название аниона
HF
плавиковая
F-
Фторид
HCl
соляная
Cl-
Хлорид
HBr
бромистоводородная
Br-
Бромид
HI
иодистоводородная
I-
Иодид
H2S
сероводородная
S-2
Сульфид
H2SO3
сернистая
SO3-2
Сульфит
H2SO4
серная
SO4-2
Сульфат
H2CO3
Угольная
CO3-2
Карбонат
H2SiO3
Кремниевая
SiO3-2
Силикат
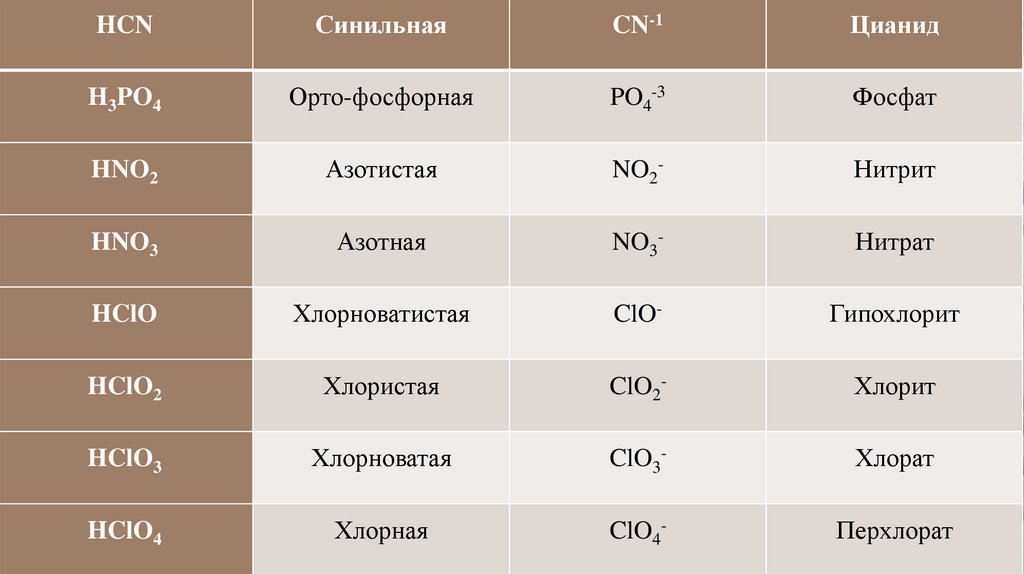
33.
HCNСинильная
CN-1
Цианид
H3PO4
Орто-фосфорная
PO4-3
Фосфат
HNO2
Азотистая
NO2-
Нитрит
HNO3
Азотная
NO3-
Нитрат
HClO
Хлорноватистая
ClO-
Гипохлорит
HClO2
Хлористая
ClO2-
Хлорит
HClO3
Хлорноватая
ClO3-
Хлорат
HClO4
Хлорная
ClO4-
Перхлорат



















 Химия
Химия








