Похожие презентации:
Место химии в системе естественных наук
1. Лекция № 1
Местохимии в системе естественных наук.
Современные направления развития химической
науки. Химическая форма эволюция материи.
Основные химические понятия: атом, молекула,
простое вещество, химическое соединение.
Химический элемент. Изотопы. Атомная и
элементная массы. Молекулярная масса. Моль,
молярная масса. Oсновные законы химии. Газовые
законы.
2. Литература
1.2.
3.
4.
5.
6.
7.
Коровин Н. В. Общая химия.- М.: Высшая школа,
2007.
Ахметов Н. С. Общая и неорганическая химия.М.: Высшая школа, 1981.
Карапетьянц М. Х., Дракин С. И. Общая и
неорганическая химия.- М.: Высшая школа, 1981.
Крестов Г. А. Теоретические основы
неорганической химии.- М.: Высшая школа,1981.
Глинка Н. Л. Задачи и упражнения по общей
химии.- Л.: Химия, 1985.
Гольбрайх З. Е. Сборник задач и упражнений по
химии. - М.: Высшая школа, с 1984.
Руководство к практическим работам по общей и
неорганической химии. Часть I. Теоретические
основы неорганической химии. Иваново. 2009.
3. «Основные понятия и законы химии»
1.Место химии в системе естественных наук.
Современные направления развития химической науки
Химия – наука о веществах и их превращениях,
сопровождающихся изменением их физических
и химических свойств.
4.
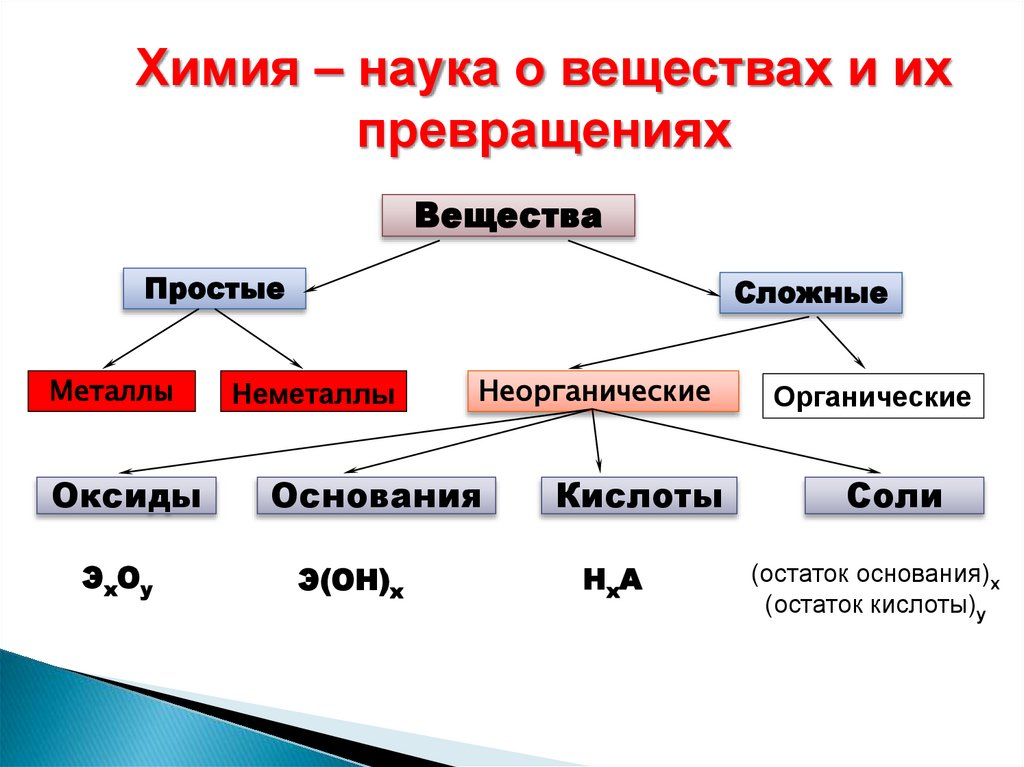
Химия – наука о веществах и ихпревращениях
Вещества
Простые
Металлы
Оксиды
ЭхОу
Сложные
Неметаллы
Неорганические
Основания
Э(ОН)х
Кислоты
НхА
Органические
Соли
(остаток основания)х
(остаток кислоты)у
5.
6.
Вещество– это устойчивое скопление
частиц, обладающих массой покоя,
которое
характеризуется
определенными в данных условиях
физическими и химическими свойствами.
Молекула
мельчайшая
частица
вещества, способная к самостоятельному существованию и сохраняющая
химические свойства этого вещества.
7.
Атомпредставляет собой электронейтральную
систему, состоящую из положительно заряженного
ядра и движущихся вокруг него отрицательно
заряженных электронов.
Совокупность атомов с одинаковым зарядом ядра
называют химическим элементом.
Атом
–
мельчайшая
частица
элемента,
обладающая его химическими свойствами.
Простыми называют вещества, состоящие из
атомов одного элемента.
Сложные
вещества,
или
химические
соединения, состоят из атомов двух и более
элементов
8.
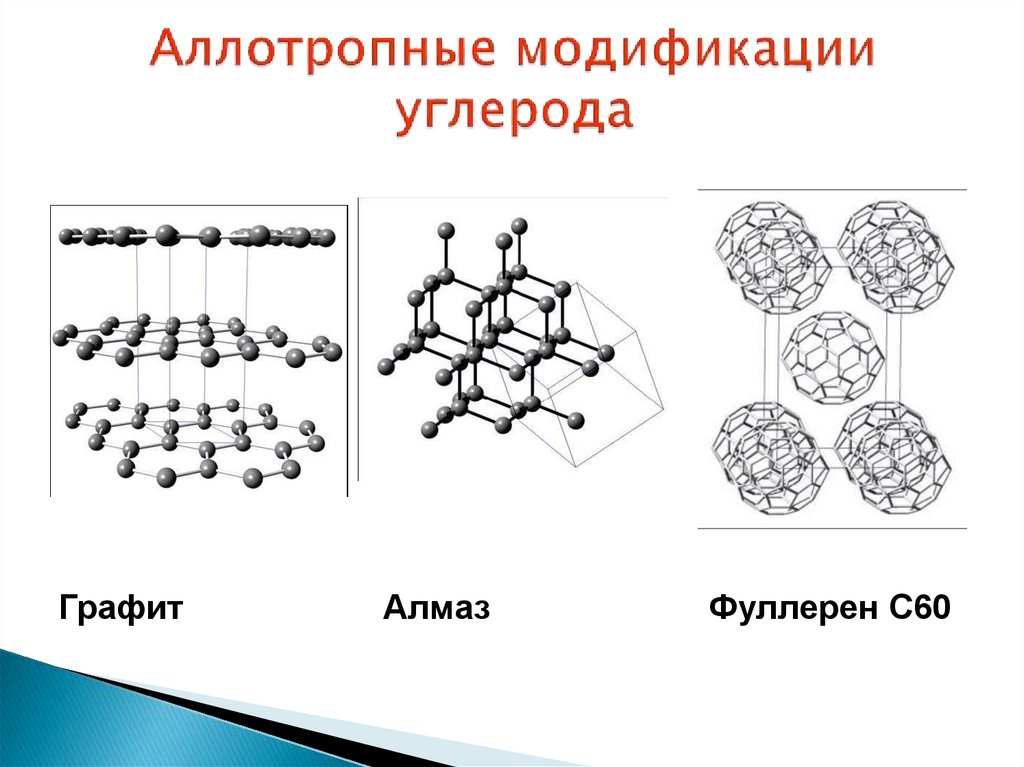
Химическиеэлементы могут существовать в
виде
нескольких
простых
веществ,
различающихся по количественному составу
или
кристаллическому
строению.
Такое
явление называют аллотропией, а различные виды одного и того же элемента —
аллотропными модификациями.
9.
Аллотропные модификации фосфора(белый, красный, жёлтый, чёрный фосфор)
Фосфор — имеет 11 аллотропных форм, различающихся числом
атомов в молекуле, химическими связями и свойствами, из
которых белый фосфор, красный фосфор и черный фосфор
имеют устойчивые формы и встречаются в природе, остальные
формы распадающиеся и в природе не встречаются
Аллотропные модификации фосфора
(белый, красный, жёлтый, чёрный
фосфор)
10. Аллотропные модификации углерода
ГрафитАлмаз
Фуллерен C60
11.
Ион(от греч. iṓn - идущий) – одноатомная
или
многоатомная
частица,
несущая
электрический заряд (H+, Li+, Al3+, NH4+, F–,
SO4 2–).
Положительные
ионы
называются
катионами
(katión
идущий
вниз),
отрицательные – анионами (anion - идущий
вверх).
Радикал – одноатомная или многоатомная
частица, имеющая на внешних орбиталях
неспаренные электроны
Изото́пы
(от греч. ισος — «равный»,
«одинаковый», и τόπος — «место») —
разновидности атомов (и ядер) одного
химического элемента с разным количеством
нейтронов в ядре.
12.
Формульнаяединица
вещества
—
реально существующие частицы: атомы (S,
С, Fe), молекулы (Н2О, СО), ионы ( Са2+, Н+),
радикалы (NO, NO2) и другие частицы
вещества.
Моль — количество вещества, содержащее
столько формульных единиц, сколько атомов
содержится в 0,012 кг изотопа углерода 12С.
Постоянная Авогадро NA — число частиц в
1 моль любого вещества;
NA = 6,022 • 1023 частиц/моль.
13.
Молярнаямасса М — масса 1 моль
вещества.
Молярная
масса
численно
совпадает с массами атомов и молекул,
выраженными в атомных единицах массы, и
измеряется в граммах на моль (г/моль).
Молярный объем VM — объем 1 моль газа,
измеряется в литрах на моль (л/моль).
14. Oсновные законы химии. Газовые законы
Закон сохранения массы и энергии. Массавсех веществ, вступающих в химическую
реакцию, равна массе продуктов реакции
Е=mc2
Δm=ΔЕ/с2
Суммарные массы и энергия веществ,
вступивших в реакцию, всегда равны
суммарным массе и энергии продуктов
реакции
15.
Закон постоянства состава.Каждое химически чистое соединение
независимо от способа его получения
имеет вполне определенный состав
Закон кратных отношений.
Если два элемента образуют друг с
другом
несколько
химических
соединений, то на одну и ту же массу
одного из них приходятся такие массы
другого, которые относятся между
собой, как простые целые числа
16.
Закон объемных отношений.Объемы вступающих в реакцию газов
относятся друг к другу как небольшие
целые числа
Закон Авагадро.
Равные объемы газов при одинаковой
температуре и давлении, содержат
одинаковое число молекул.
Один моль любого газа при нормальных
условиях занимает объем 22,4 л
17.
Закон ДальтонаДавление смеси идеальных газов равно
сумме парциальных давлений этих газов
рi - давление этого газа в предположении, что при температуре
смеси в объёме, занимаемом смесью, находится только
рассматриваемый газ
Уравнение Менделеева-Клапейрона описывает
состояние идеального газа
18.
где: P – давление газа, Па; V – объём газа, м3; T –температура газа, К; m – масса газа, кг; M – мольная масса
газа, кг/моль; R=8,31 Дж/(моль·К) – универсальная газовая
постоянная.
Уравнением, объединяющим газовые законы
Бойля-Мариотта и Гей-Люссака, является:
Плотность
газа: , кг/м3
где: Мг – мольная масса газа; Vст=22,4 л/моль – объём,
занимаемый 1 молем любого газа при н.у. (стандартный
объём)
19.
При постоянных давлении и температуреплотность газа определяется только его
молярной массой. Такой результат позволяет
ввести понятие относительной плотности одного
газа по другому:
20. Примеры решения задач Установление формулы химического соединения по его элементному составу
Пример 1. Вещество содержит 85,71 масс. % углерода и14,29 масс. % водорода. Молярная его масса равна 28
г/моль. Определите простейшую и истинную химические
формулы этого вещества.
Решение. Соотношение между количеством атомов в
молекуле СхНу определяется делением массовых долей
каждого элемента на его атомную массу:
х : у = 85,71/12 : 14,29/1 = 7,14:14,29 = 1 : 2.
Таким образом простейшая формула вещества - СН2..
Разделив 28 на 14 (сумму атомных масс, отвечающих
формульной единице СН2), получаем истинное
соотношение между числом атомов в молекуле:
х : у = 2 : 4.
Получаем истинную формулу вещества: С2Н4- этилен.
21. Определение молярной массы вещества
Пример2.
Плотность
паров
некоторого
органического соединения по кислороду равна
1,8125.
Определите
молярную
массу
этого
соединения.
Решение. Молярная масса неизвестного вещества
Мx равна произведению относительной плотности
этого вещества D на молярную массу вещества M, по
которому определено значение относительной
плотности:
Мx = D·M = 1,8125·32 = 58,0.
Веществами с найденным значением молярной
массы могут быть ацетон, пропионовый альдегид и
аллиловый спирт.
22.
Пример 3. При сгорании 5,6 л (н.у.) углеводорода получено 44,0г углекислого газа и 22,5 г воды. Относительная плотность
углеводорода по кислороду равна 1,8125. Определите истинную
химическую формулу углеводорода.
Решение. Уравнение реакции:
СхНy + 0,5(2x+0,5y)О2 = х СО2 + 0,5у Н2О.
Количество углеводорода 5,6:22,4=0,25 моль. В результате
реакции образуется 1 моль углекислого газа и 1,25 моль воды,
которая содержит 2,5 моль атомов водорода. При сжигании
углеводорода количеством вещества 1 моль получается 4 моль
углекислого газа и 5 моль воды. Таким образом, 1 моль
углеводорода содержит 4 моль атомов углерода и 10 моль
атомов водорода, т.е. химическая формула углеводорода С4Н10.
Молярная масса этого углеводорода равна М=4·12+10=58. Его
относительная плотность по кислороду D=58:32=1,8125
соответствует величине, приведенной в условии задачи, что
подтверждает правильность найденной химической формулы.
23.
Пример 4. Рассчитайте молекулярную массу газа, если7·10-3 кг. его при 20°С и 0,253·105 Па занимают объем
22,18·10-3 м3
Решение:
В данном случае, вычислить молярную массу газа
можно, используя уравнение Клапейрона –
Менделеева:
pV = nRT = (m/M)RT;
R=8,3144·103 Дж/моль·К
Т=273+20=293 К
М=mRT/pV=7·103·8,3144·103·293/(0,253·105·22,18·10-3) =
30,35 г/моль
Молярная масса газа равна 30,35 г/моль




















 Химия
Химия








