Похожие презентации:
угарный, углекислый газ
1. УГАРНЫЙ И УГЛЕКИСЛЫЙ ГАЗЫ
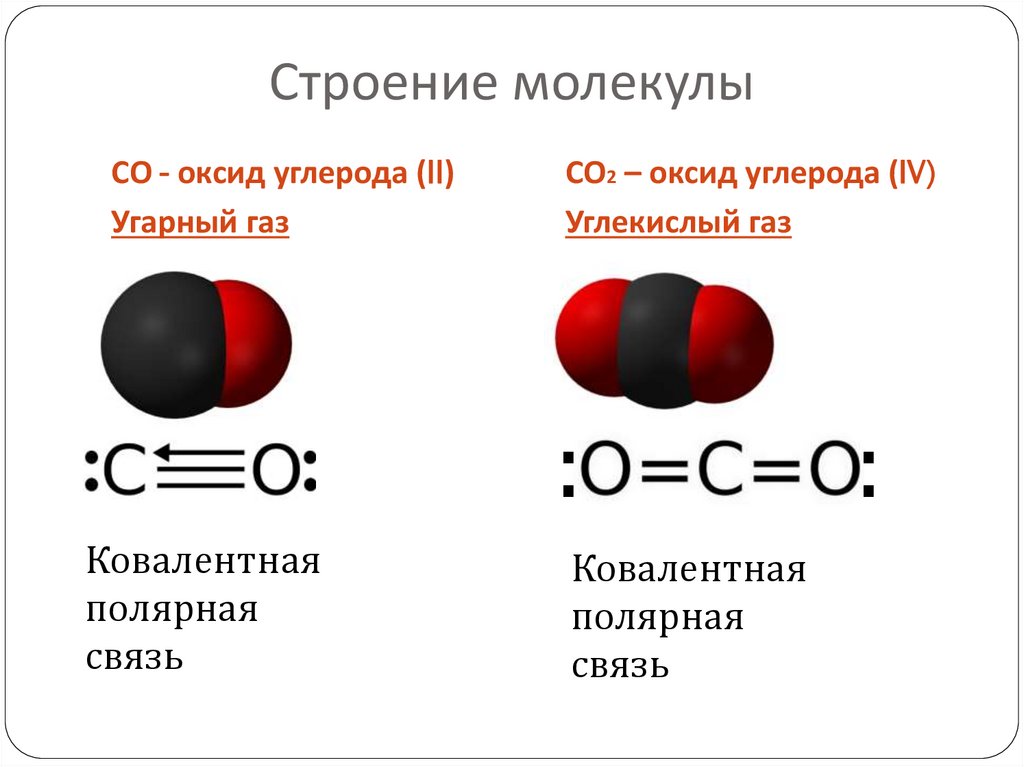
Сравнение свойств2. Строение молекулы
СО - оксид углерода (II)Угарный газ
СО2 – оксид углерода (IV)
Углекислый газ
:
Ковалентная
полярная
связь
Ковалентная
полярная
связь
:
3. Физические свойства
Угарный газ (СО)Углекислый газ (СО2)
Газ
Газ
Без цвета
Без цвета
Без запаха
Без запаха
Мало растворим в
Хорошо растворим в
воде
Трудно сжижается
Немного легче
воздуха
Яд
воде
Хорошо сжижается
(сухой лёд)
Тяжелее воздуха
Не ядовит
4. Получение угарного газа (СО)
В промышленности1) Получение
генераторного газа
2) Получение водяного
газа
В лаборатории
1) Действие H₂SO₄
(конц.) на
муравьиную
кислоту
CO₂ + C = 2CO (1000˚C)
C + H₂O = CO + H₂
(1000˚C)
HCOOH = H₂O + CO
5. Получение углекислого газа (СО2)
В промышленностиВ лаборатории
CaCO3 = CaO + CO2↑
CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O
CH4+2O2=CO2+2H2O
Другой способ
получения
C + O2 = CO2
CO2 + C = 2CO
6. Химические свойства угарного газа
СО – несолеобразующий оксид, хороший восстановительС кислородом
2C+2O + O2 t˚C → 2C+4O2↑
С оксидами металлов CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2↑
С хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
7. Химические свойства углекислого газа
СО2 - кислотный солеобразующий оксидСпецифические свойства
2Mg0+CO2+4=2Mg+2O+C0
CaO+CO2=CaCO3
CO2+H2O=H2CO3
CO2+NaOH=Na2CO3+H2O
CO2(изб.)+NaOH=NaHCO3
Ca(OH)2+CO2=CaCO3+H2O – качественная реакция
на углекислый газ
8. Применение
Угарный газ (СО)Применение
Газообразное
топливо
Органический синтез
Углекислый газ (СО2)
Тушение пожаров
(огнетушители)
Получение:
Сахара
Моющих средств
Соды
Лекарств
Газировки
Удобрений








 Химия
Химия








