Похожие презентации:
теория к азотной кислоте и нитратам
1. Азотная кислота. Соли азотной кислоты
Азотная кислота.Соли азотной
кислоты
Подготовка к самостоятельной
работе
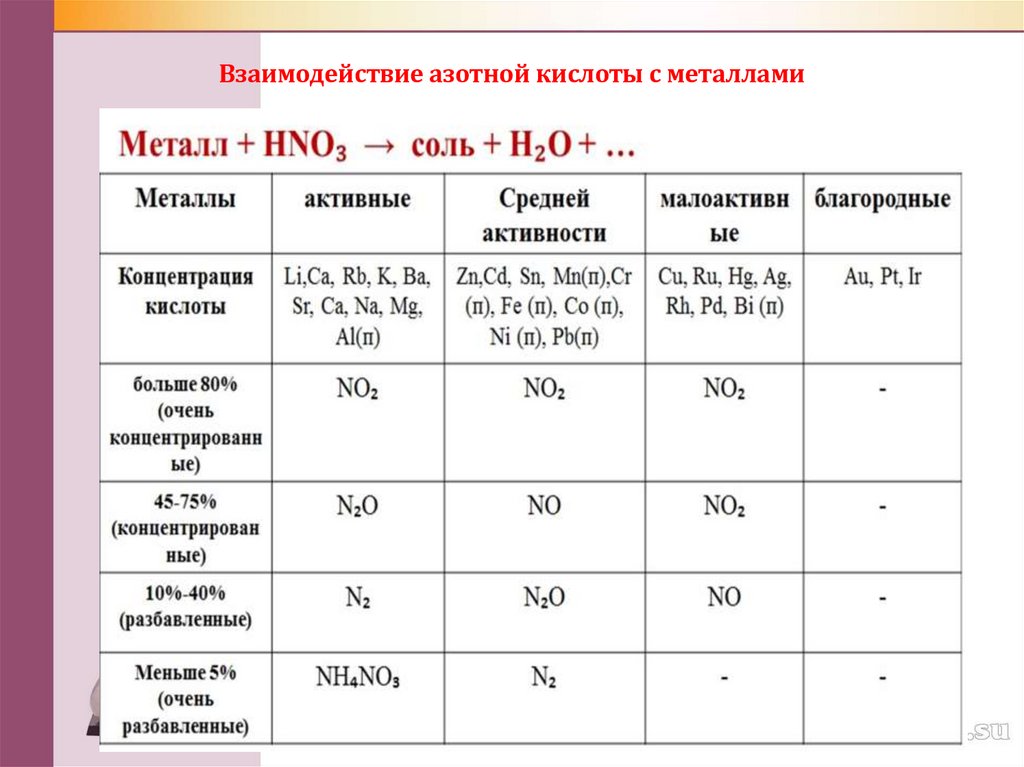
2. Взаимодействие азотной кислоты с металлами
3. Специфические свойства нитратов
Все нитраты термически неустойчивы.При нагревании они разлагаются с
образованием кислорода.
Характер других продуктов реакции зависит от
положения металла, образующего нитрат, в
электрохимическом ряду напряжений:
4.
• Исключения:• 4LiNO3 = 2Li2O + 4NO2 + O2
• Mn(NO3)2=MnO2 + 2NO2
• 4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
5.
Нитрат и нитрит аммония:
• Нитрат аммония разлагается в зависимости от
температуры так:
• NH4NO3 = N2O ↑+ 2H2O (190-245°C)
• 2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
• 2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
• Нитрит аммония:
• NH4NO2 = N2 ↑+ 2H2O
6. Качественная реакция на нитрат-ион NO3–
Качественная реакция нанитрат-ион NO3–
Взаимодействие нитратов c металлической
медью при нагревании в присутствии
концентрированной серной кислоты или с
раствором дифениламина в Н2SO4 (конц.).





 Химия
Химия








