Похожие презентации:
Подгруппа углерода
1.
• P-->P2O5-->H3PO4-->Ca 3(PO4)22.
Горныйхрусталь
кремень
Золотая
середина
агат
алмаз
3.
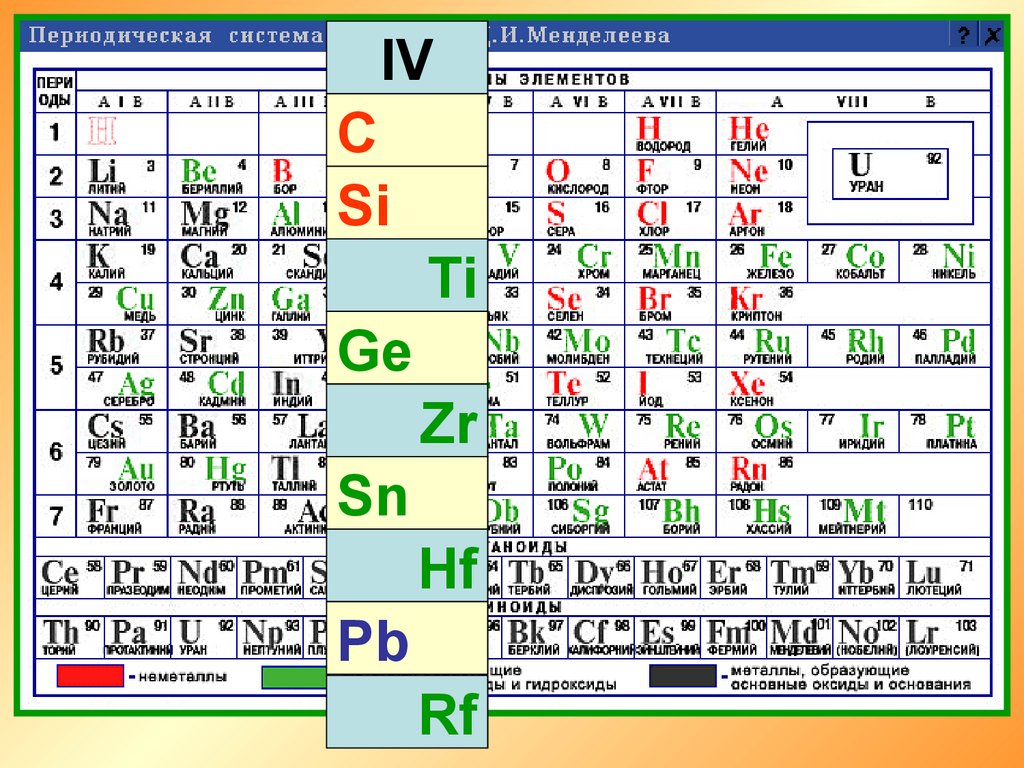
IVC
Si
Ti
Ge
Zr
Sn
Hf
Pb
Rf
4.
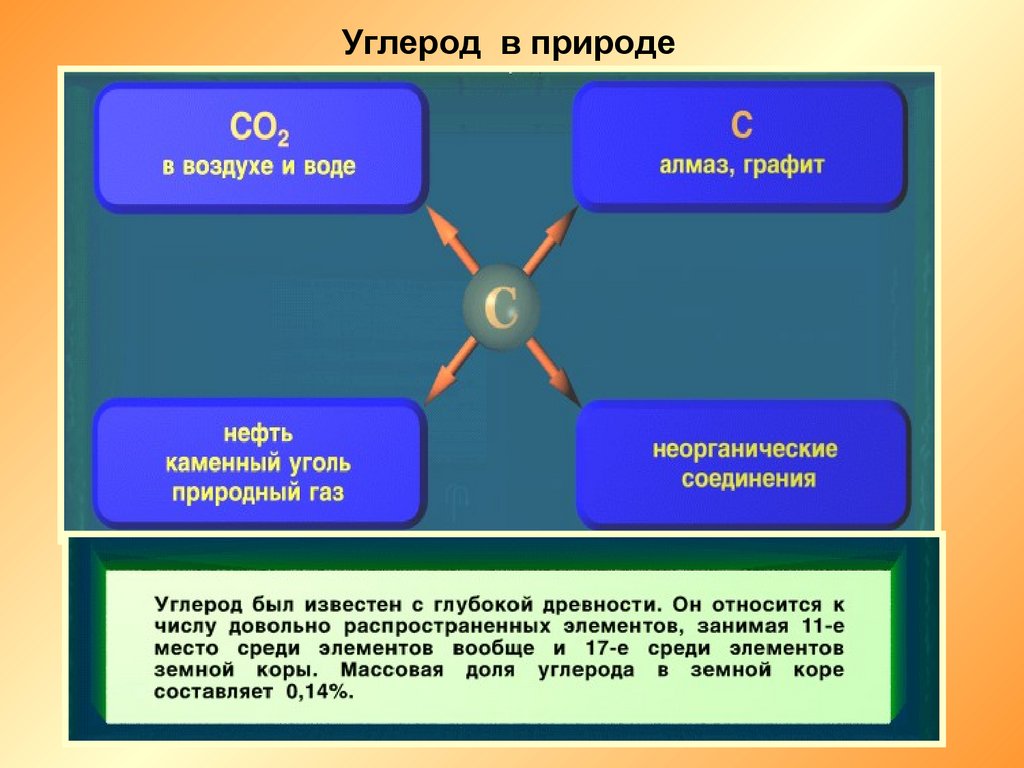
Углерод в природе5.
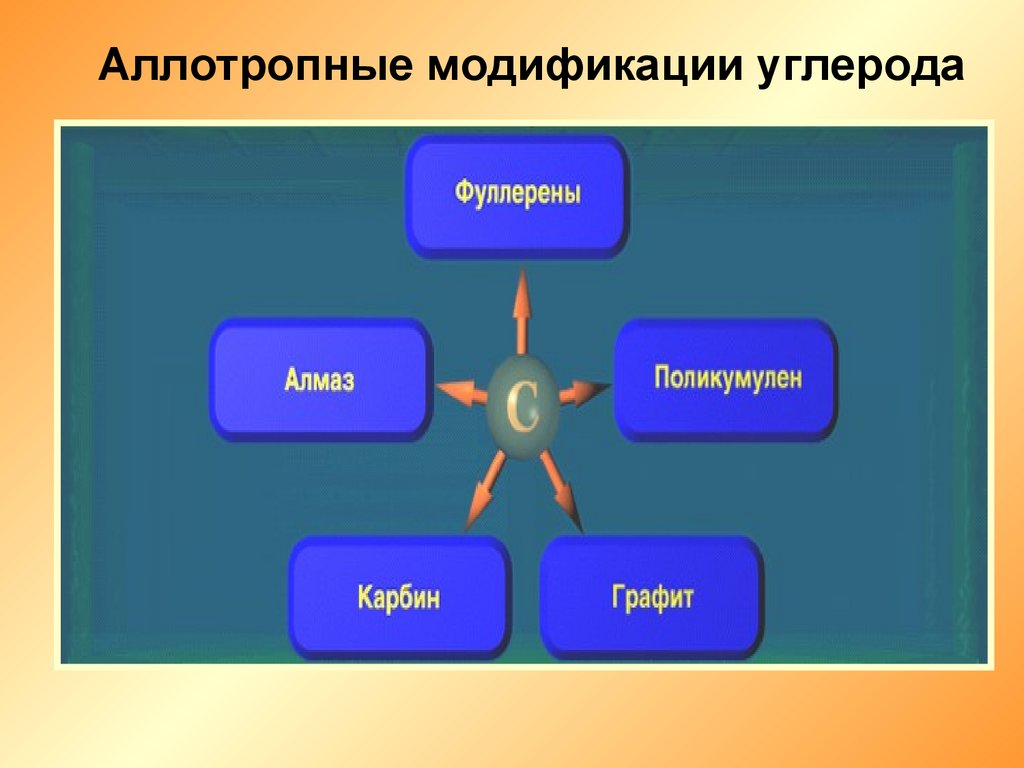
Аллотропные модификации углерода6.
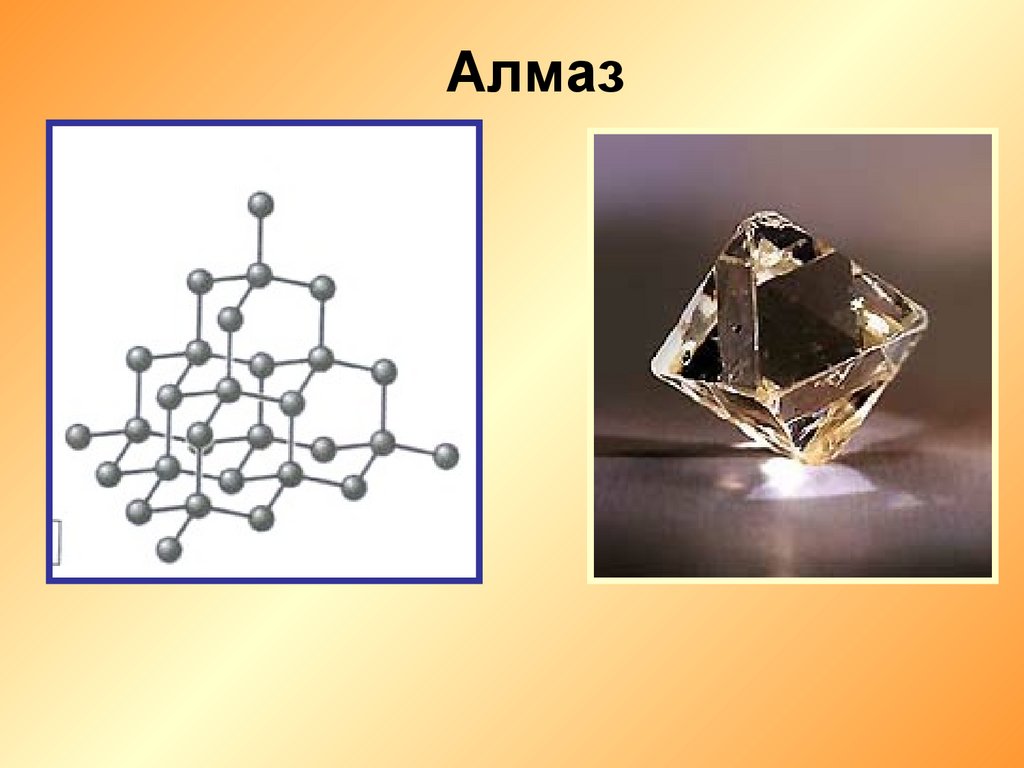
Алмаз7.
Графит8.
ФуллереныФуллерен представляет собой
мелкокристаллический порошок чёрного
цвета, не имеющий запаха.
Практически нерастворим в воде,
спирте, ацетоне и других растворителях.
Обладают высокой температурой
плавления и кипения.
9.
Фуллерены в природе.-существуют вблизи углеродных звезд, в межзвездном пространстве, в
местах попадания молний, вблизи кратеров вулканов, образуются при
горении газа
в домашней газовой плите или в пламени обычной зажигалки.
В местах скопления древних углеродных пород также обнаруживаются
фуллерены. Особое место принадлежит карельским минералам шунгитам.
Получение фуллеренов.
Термическое разложение графита.
Применение. Добавка небольшого их количества способна существенно
изменить свойства материала.
-добавка в чугун придает ему пластичность;
-Добавка к щелочному металлу приводит к сверхппроводимости
-Добавка к стали приводит к повышению её прочности, износо- и
термостойкости.
-В медицине используются в системах доставки лекарств, нацеленных
на конкретные клетки или ткани.
10.
Нанотехнологии –технологические процессы,
осуществляемые на
молекулярном уровне.
11.
12.
13.
ГрафитРазновидности:
кокс, сажа, древесный уголь
14.
Поглощение газообразныхили растворенных веществ
поверхностью твердого
вещества называется
адсорбцией.
15.
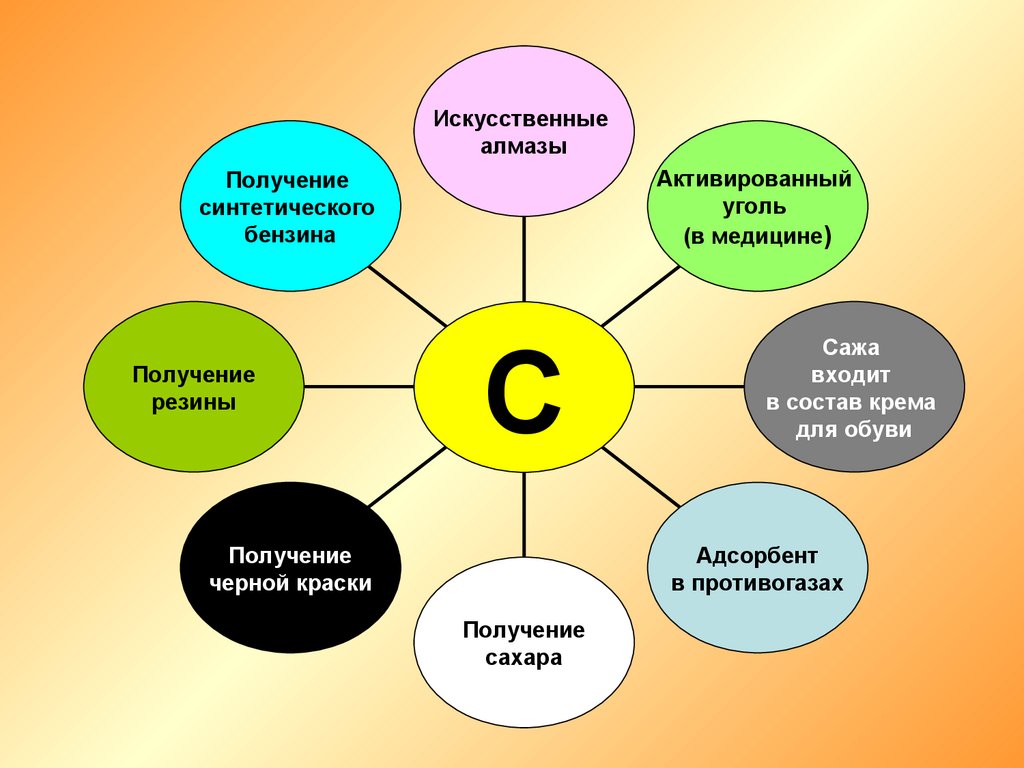
Искусственныеалмазы
Активированный
уголь
(в медицине)
Получение
синтетического
бензина
Получение
резины
С
Получение
черной краски
Сажа
входит
в состав крема
для обуви
Адсорбент
в противогазах
Получение
сахара
16.
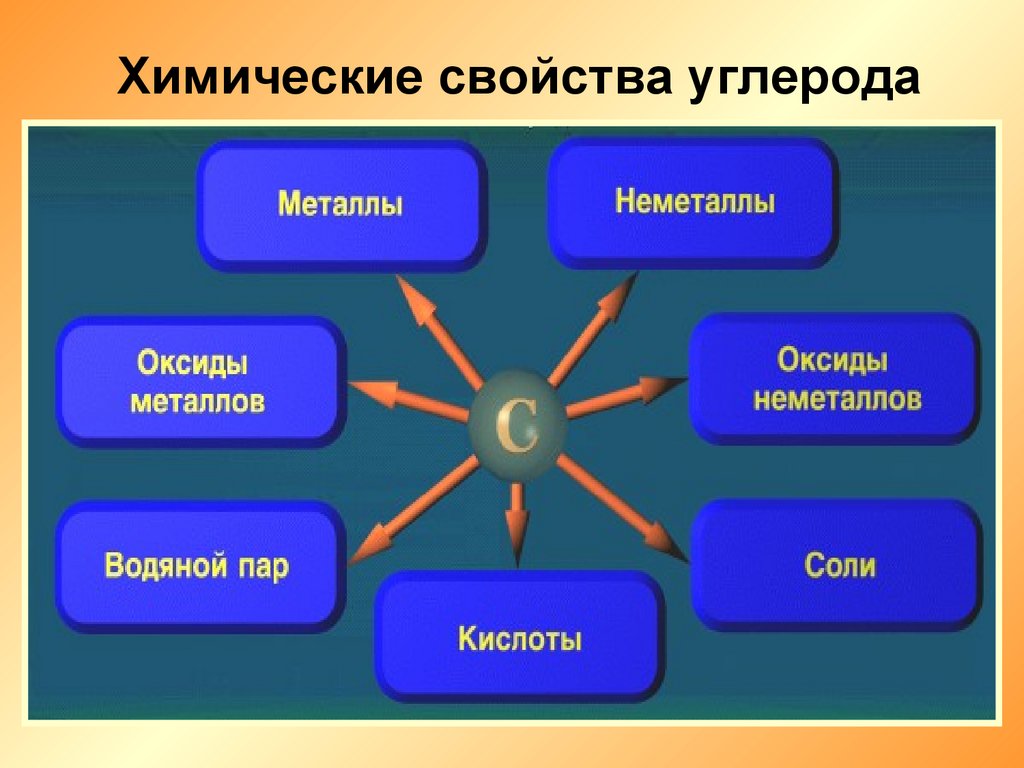
Химические свойства углерода17.
I. Восстановительные свойства1.Горение
С + О2 СО2
2С + О2 2СО
18.
I. Восстановительные свойства2. Взаимодействие с оксидами
металлов
С + ZnО Zn + СО
3C + 2Fe2O3 4Fe + 3CO2
3С + CaО CaC2 + СО
19.
I. Восстановительные свойства3. Взаимодействие с
кислотами
С + 4HNO3
С + 2H2SO4
(конц)
(конц)
СО2 + 4NO2 + 2H2O
СО2 + 2SO2 + 2H2O
20.
II. Окислительные свойства1.Взаимодействие с
водородом
С + 2Н2 СН4
21.
II. Окислительные свойства2. Взаимодействие с металлами
(образуются карбиды)
2С + Са СаС2
3С + 4Al Al4C3















 Химия
Химия








