Похожие презентации:
02_Презентация Диссертация (1)
1. Федеральное государственное бюджетное образовательное учреждение высшего образования Ивановский государственный
химико-технологический университетКафедра Технологии Керамики и Электрохимических Производств
Использование аммиачно-карбонатных солей
переходных металлов для синтеза
катализаторов гидрирования
Шахов Дмитрий Сергеевич
Научный руководитель: Прозоров Дмитрий
Алексеевич
ИГХТУ, Иваново 2026
2. Цели и задачи исследования
Цель работы – установить возможность использования аммиачно-карбонатных солей переходных
металлов для синтеза массивных и нанесённых катализаторов процесса жидкофазного восстановления Dглюкозы до D-сорбита. Работа выполнена на примере солей никеля, меди, кобальта и молибдена.
Теоретические и практические задачи:
1. Предложить методику синтеза аммиачно-карбонатных растворов переходных металлов;
2. Определить оптимальные температуры разложения аммиачно-карбонатных солей никеля, меди, кобальта и
молибдена;
3. Определить фазовый состав оксидных материалов, полученных при термическом разложении аммиачнокарбонатных солей металлов;
4. Определить основные текстурные характеристики полученных оксидных систем;
5. Установить возможность применения в качестве катализаторов реакции жидкофазного восстановления Dглюкозы в мягких условиях;
6. Синтезировать нанесённые на γ-Al2O3 медные катализаторы, используя аммиачно-карбонатные растворы
меди, определить их активность в процессе восстановления D-глюкозы.
3. Физико-химические методы анализа
МетодИК-спектроскопия (FT-IR, Avatar 360)
Описание принципа действия
Поглощение инфракрасного излучения молекулами; фиксирует
колебательные моды функциональных групп.
Дифракция рентгеновских лучей на кристаллической решётке;
определение межплоскостных расстояний (d), фазового состава,
Рентгенофазовый анализ (РФА, Bruker D8)
размеров области когерентного рассеяния (CSR) и
микродеформации по закону Брегга.
Низкотемпературная адсорбция азота; расчёт удельной
поверхности, объёма и радиуса пор по модели БЭТ.
Сканирование поверхности электронным пучком; формирование
Растровая электронная микроскопия (РЭМ,
изображений топографии и морфологии через вторичные/обратные
VEGA 3 TESCAN)
электроны.
Адсорбционный анализ (BET, Sorbi MS)
Рентгеновская энергодисперсионная
спектрометрия (EDS, Oxford Instruments
X-ACT)
Идентификация и полуколичественное определение элементов по
характерным рентгеновским линиям, возникающим при облучении
образца электронами.
Одновременное измерение изменения массы (ТГА) и тепловых
Синхронный термический анализ (STA 449
эффектов (ДСК/ДТА); масс-спектрометр – анализ эволюции газов при
F3 Jupiter NETZSCH + QMS 403 C Aeolos)
нагреве/разложении.
Разделение компонентов газовой хроматографией с последующей
Хромато-масс-спектрометрия (GC-MS,
идентификацией и анализом по масс-спектру (используется для проб
«Кристаллюкс-4000М» + Маэстро-αMC)
гидрогенизата).
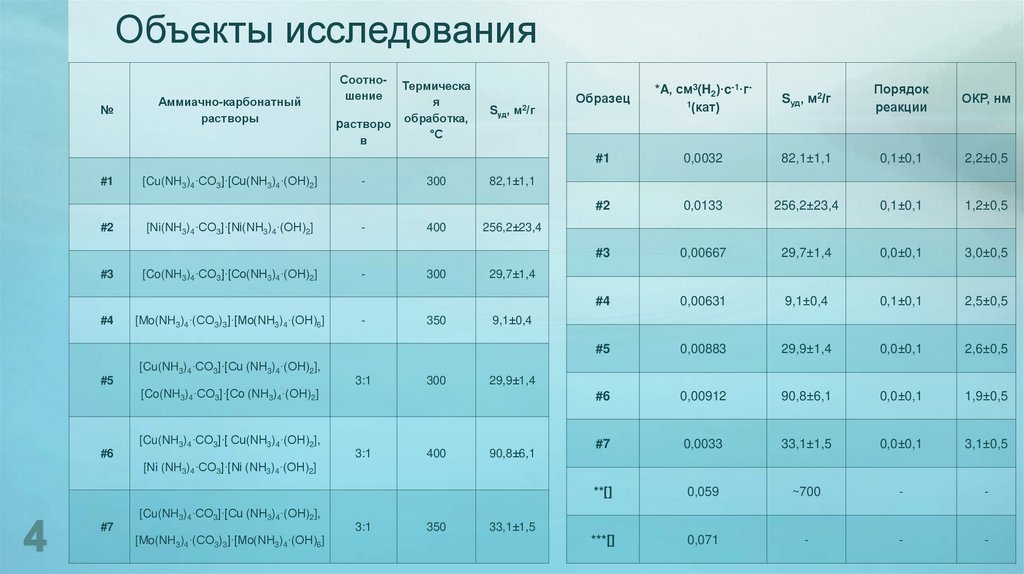
4. Объекты исследования
№#1
#2
#3
#4
Аммиачно-карбонатный
растворы
[Cu(NH3)4·CO3]·[Cu(NH3)4·(OH)2]
[Ni(NH3)4·CO3]·[Ni(NH3)4·(OH)2]
[Co(NH3)4·CO3]·[Co(NH3)4·(OH)2]
[Mo(NH3)4·(CO3)3]·[Mo(NH3)4·(OH)6]
Соотношение
Термическа
я
растворо обработка,
°С
в
-
-
-
-
300
400
300
350
Sуд, м2/г
Образец
*A, см3(H2)·c-1·г1(кат)
Sуд, м2/г
Порядок
реакции
ОКР, нм
#1
0,0032
82,1±1,1
0,1±0,1
2,2±0,5
#2
0,0133
256,2±23,4
0,1±0,1
1,2±0,5
#3
0,00667
29,7±1,4
0,0±0,1
3,0±0,5
#4
0,00631
9,1±0,4
0,1±0,1
2,5±0,5
#5
0,00883
29,9±1,4
0,0±0,1
2,6±0,5
#6
0,00912
90,8±6,1
0,0±0,1
1,9±0,5
#7
0,0033
33,1±1,5
0,0±0,1
3,1±0,5
**[]
0,059
~700
-
-
***[]
0,071
-
-
-
82,1±1,1
256,2±23,4
29,7±1,4
9,1±0,4
[Cu(NH3)4·CO3]·[Cu (NH3)4·(OH)2],
#5
3:1
300
29,9±1,4
[Co(NH3)4·CO3]·[Co (NH3)4·(OH)2]
[Cu(NH3)4·CO3]·[ Cu(NH3)4·(OH)2],
#6
3:1
400
90,8±6,1
[Ni (NH3)4·CO3]·[Ni (NH3)4·(OH)2]
[Cu(NH3)4·CO3]·[Cu (NH3)4·(OH)2],
#7
3:1
[Mo(NH3)4·(CO3)3]·[Mo(NH3)4·(OH)6]
350
33,1±1,5
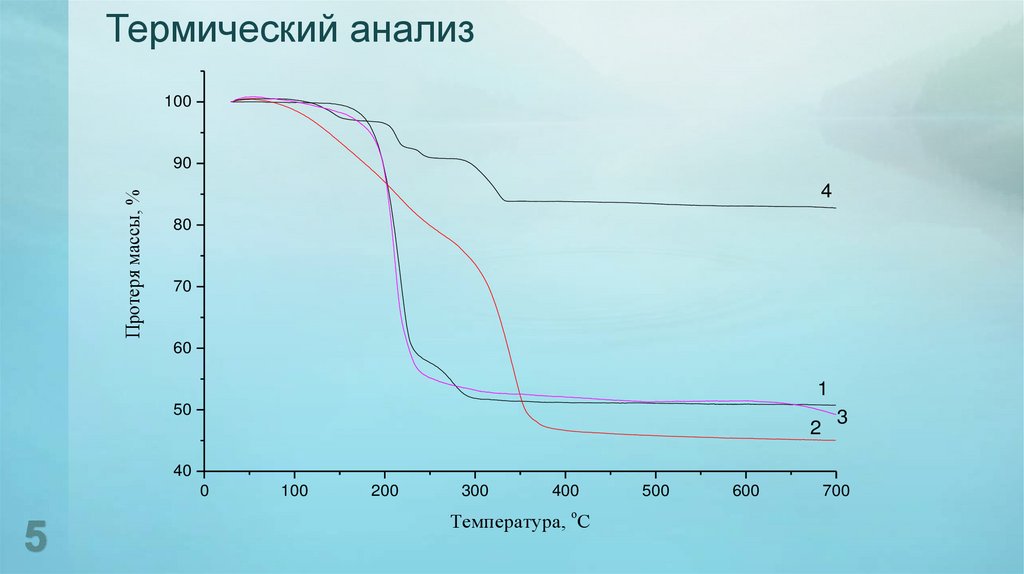
5. Термический анализ
100Протеря массы, %
90
4
80
70
60
1
50
2
3
40
0
100
200
300
400
Температура, oС
500
600
700
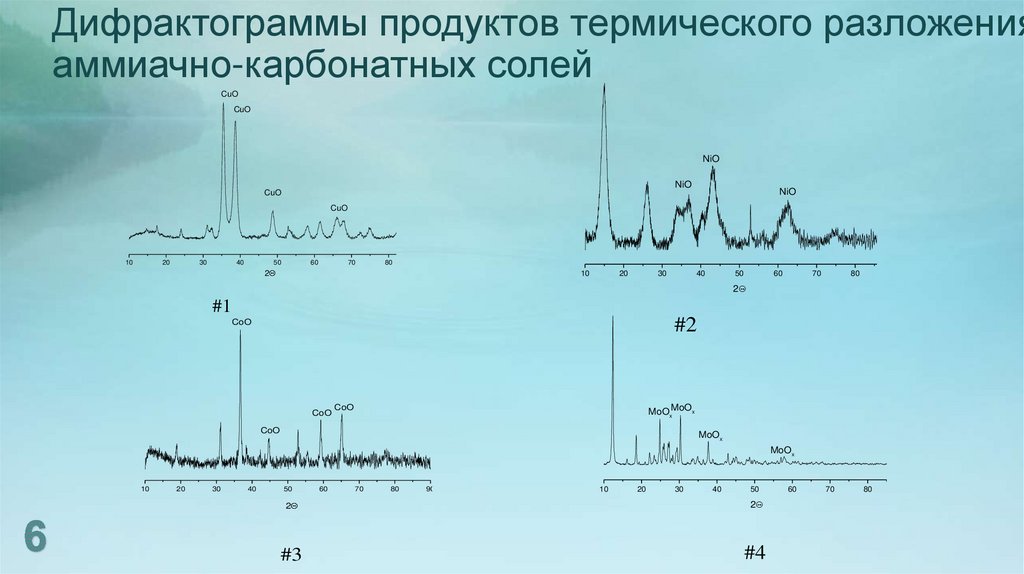
6. Дифрактограммы продуктов термического разложения аммиачно-карбонатных солей
CuOCuO
NiO
NiO
CuO
CuO
CuO
CuO
CuO
CuO
NiO
NiO
NiO
NiO
CuO
CuO
10
20
30
40
50
60
70
80
10
20
30
40
50
60
CuO 2
10
90
70
#1
80
20
NiO
10
90
30
30
10
40
50
NiO
40
50
60
70
80
40
50
20
2 30
60
70
80
40
50
10
90
60
20
70
30
40
80
90
50
60
70
102
20
30
80
90
40
50
CoO
CoO
CoO
MoO MoOx
CoO
20
50CoO
CoO
x
30
CoO
40
50
60
70
80
90
60
20
30
40
2
50
#3
60
70
80
MoOx
MoOx
90
MoO20
10
x
MoO
2
10
30
20
40
50
30
60
40
70
x
CoO
70
80
50
80
2
2
CoO
10
90
MoOxMoOx
CoO
MoOx
40
80
CoO
MoOx
10
70
#2
CoO
CoO
60
#2
#1
CoO
30
90
2
CoO
#1
20
90
#2
2
10
80
NiO
#2
2
70
2
NiO60
CuO
#1
20
30
NiO
CuO
CuO
10
20
NiO
2
MoOx
CoO
MoOx
#3
MoOxMoOx
#4
#4
90
10
20
30
40
50
60
70
80
MoO
90
60
90
70
80
90
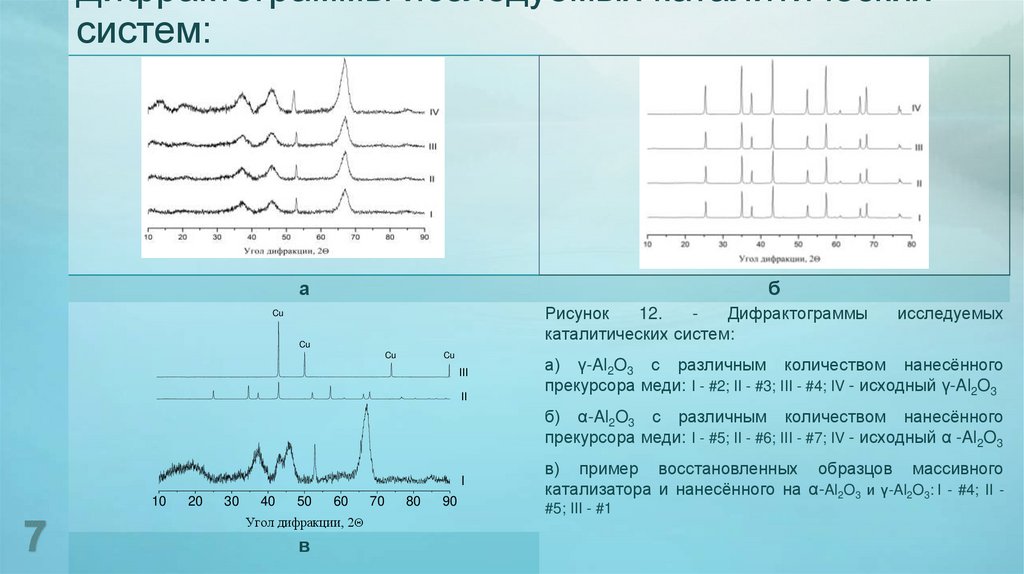
7. Дифрактограммы исследуемых каталитических систем:
аб
Рисунок
12.
Дифрактограммы
каталитических систем:
Cu
Cu
Cu
Cu
III
II
исследуемых
а) γ-Al2O3 с различным количеством нанесённого
прекурсора меди: I - #2; II - #3; III - #4; IV - исходный γ-Al2O3
б) α-Al2O3 с различным количеством нанесённого
прекурсора меди: I - #5; II - #6; III - #7; IV - исходный α -Al2O3
I
10
20
30
40
50
60
Угол дифракции, 2
в
70
80
90
в) пример восстановленных образцов массивного
катализатора и нанесённого на α-Al2O3 и γ-Al2O3: I - #4; II #5; III - #1
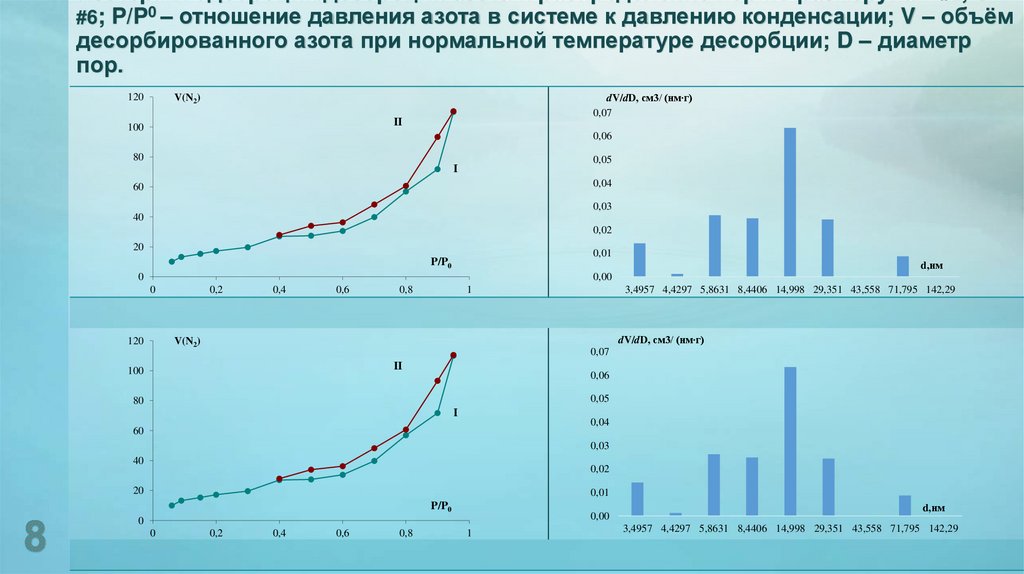
8. Изотермы адсорбции/десорбции азота и распределение пор по размеру: а – #2; б – #6; P/P0 – отношение давления азота в системе к
давлению конденсации; V – объёмдесорбированного азота при нормальной температуре десорбции; D – диаметр
пор.
120
dV/dD, см3/ (нм‧г)
0,07
V(N2)
II
100
0,06
80
0,05
I
0,04
60
0,03
40
0,02
20
0,01
P/P0
d,нм
0,00
0
0
120
0,2
0,4
0,6
0,8
3,4957 4,4297 5,8631 8,4406 14,998 29,351 43,558 71,795 142,29
1
dV/dD, см3/ (нм‧г)
V(N2)
0,07
II
100
0,06
0,05
80
I
0,04
60
0,03
40
0,02
20
0,01
P/P0
0,00
0
0
0,2
0,4
0,6
0,8
1
d,нм
3,4957 4,4297 5,8631 8,4406 14,998 29,351 43,558 71,795 142,29
9. Синхронная съёмка ЭДС и РЭМ для каталитической системы #4 и #5 после процесса восстановления в токе водорода при 470 °С
#4#5
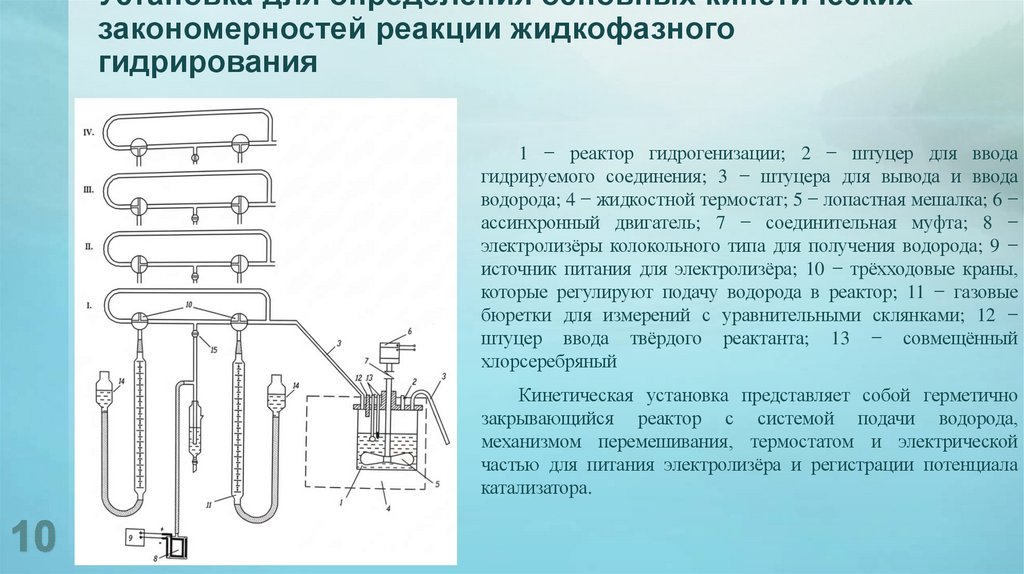
10. Установка для определения основных кинетических закономерностей реакции жидкофазного гидрирования
1 − реактор гидрогенизации; 2 − штуцер для вводагидрируемого соединения; 3 − штуцера для вывода и ввода
водорода; 4 − жидкостной термостат; 5 − лопастная мешалка; 6 −
ассинхронный двигатель; 7 − соединительная муфта; 8 −
электролизёры колокольного типа для получения водорода; 9 −
источник питания для электролизёра; 10 − трёхходовые краны,
которые регулируют подачу водорода в реактор; 11 − газовые
бюретки для измерений с уравнительными склянками; 12 −
штуцер ввода твёрдого реактанта; 13 − совмещённый
хлорсеребряный
Кинетическая установка представляет собой герметично
закрывающийся реактор с системой подачи водорода,
механизмом перемешивания, термостатом и электрической
частью для питания электролизёра и регистрации потенциала
катализатора.
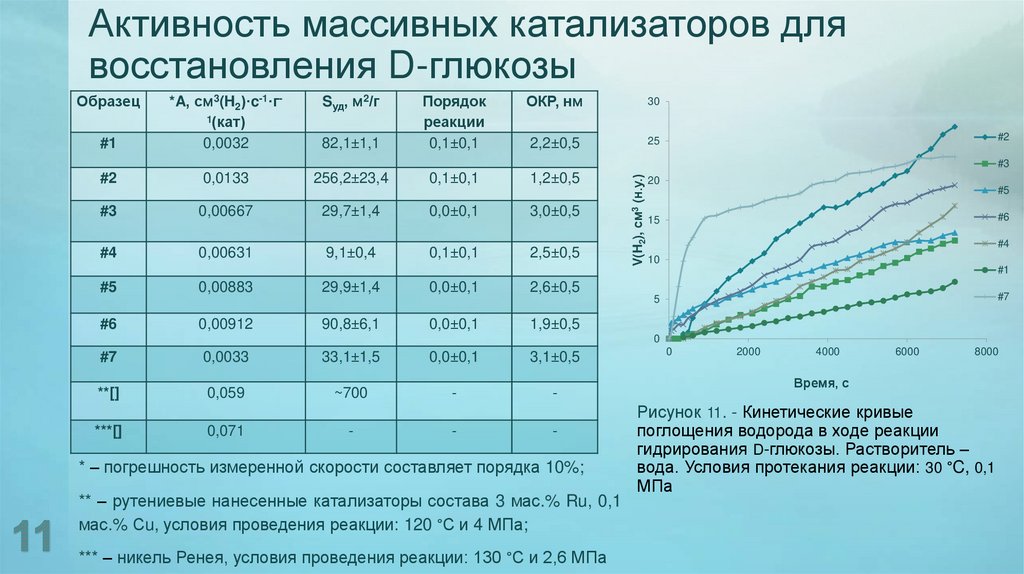
11. Активность массивных катализаторов для восстановления D-глюкозы
Образец#1
*A, см3(H2)·c-1·г1(кат)
0,0032
Sуд, м2/г
82,1±1,1
Порядок
реакции
0,1±0,1
ОКР, нм
30
2,2±0,5
25
#2
#2
0,0133
256,2±23,4
0,1±0,1
1,2±0,5
#3
0,00667
29,7±1,4
0,0±0,1
3,0±0,5
#4
0,00631
9,1±0,4
0,1±0,1
2,5±0,5
#5
0,00883
29,9±1,4
0,0±0,1
V(H2), см3 (н.у.)
#3
20
#5
#6
15
#4
10
#1
2,6±0,5
#7
5
#6
0,00912
90,8±6,1
0,0±0,1
1,9±0,5
0
#7
0,0033
33,1±1,5
0,0±0,1
3,1±0,5
**[]
0,059
~700
-
-
***[]
0,071
-
-
-
* – погрешность измеренной скорости составляет порядка 10%;
** – рутениевые нанесенные катализаторы состава 3 мас.% Ru, 0,1
мас.% Сu, условия проведения реакции: 120 °С и 4 МПа;
*** – никель Ренея, условия проведения реакции: 130 °С и 2,6 МПа
0
2000
4000
6000
8000
Время, с
Рисунок 11. - Кинетические кривые
поглощения водорода в ходе реакции
гидрирования D-глюкозы. Растворитель –
вода. Условия протекания реакции: 30 °C, 0,1
МПа