Похожие презентации:
Классификация кислот и оснований. Протолитическая теория Бренстеда - Лоури
1.
• ЗАНЯТИЕ №2. По наукам о жизни. 2024• Автор: доцент Головина Наталия
Владимировна, кафедра Химии Института
Фармации.
• Зав.кафедрой профессор Нестерова О.В.
Головина Н.В. Науки о жизни.
Москва,2024
2.
• Тема второго занятия:• « ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ КИСЛОТ И
ОСНОВАНИЙ. КИСЛОТНЫЕ СВОЙСТВА
ОРГАНИЧЕСКИХ С ОЕДИНЕНИЙ.БУФЕРНЫЕ
СИСТЕМЫ.ПОЛУЧНИЕ И СВОЙСТВА
БУФЕРНЫХ РАСТВОРОВ.»
3. Теория Аррениуса
• По теории Аррениуса силу кислот иоснований можно количественно
• определить с помощью К ионизации:
НАn
Н+ + Аn
С(Н+)*С(Аn-)
• К(ион.) = -------------------
С(НАn )
4.
• Электролитическая диссоциация –обратимый процесс, характеризующийся
константой равновесия, называемой
константой ионизации!
• Сила кислоты в водном растворе
выражается через константу кислотности
(К А ). СИЛА ОСНОВАНИЯ ХАРАКТЕРИЗУЕТСЯ
С ПОМОЩЬЮ КОНСТАНТЫ ОСНОВНОСТИ ( КВ ).
• чем больше К А , ТЕМ СИЛЬНЕЕ КИСЛОТА !
• К А и КВ - СПРАВОЧНЫЕ ВЕЛИЧИНЫ.!!!
5. СИЛОВЫЕ ПОКАЗАТЕЛИ
• рКА = - lgКА ; рКВ = - lgКВ• рКА и рКВ - СПРАВОЧНЫЕ ВЕЛИЧИНЫ.
• Чем меньше рКА , тем сильнее кислота !
6.
7.
8. ЛОГАРИФМИЧЕСКОЕ ВЫРАЖЕНИЕ ДЛЯ константы автопротолиза Кw
рН + рОН =14• рН= рОН=7 ( среда нейтральная
9.
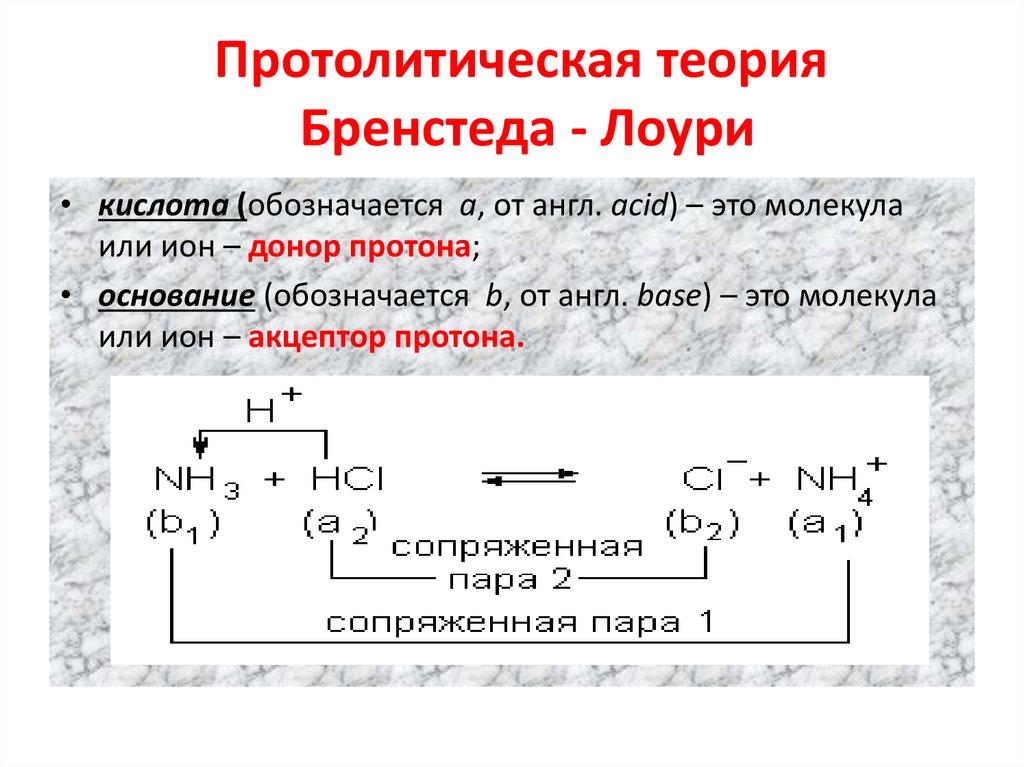
10. Протолитическая теория Бренстеда - Лоури
• кислота (обозначается а, от англ. acid) – это молекулаили ион – донор протона;
• основание (обозначается b, от англ. base) – это молекула
или ион – акцептор протона.
11.
• В растворе сопряженные кислоты иоснования существуют в равновесии.
• Прямая и обратная реакции ,которые
обусловлены переносом протона от
кислоты к основанию выражают уравнение
протолитического равновесия:
кислота-1 + основ.-2
кислота-2+основ.-1
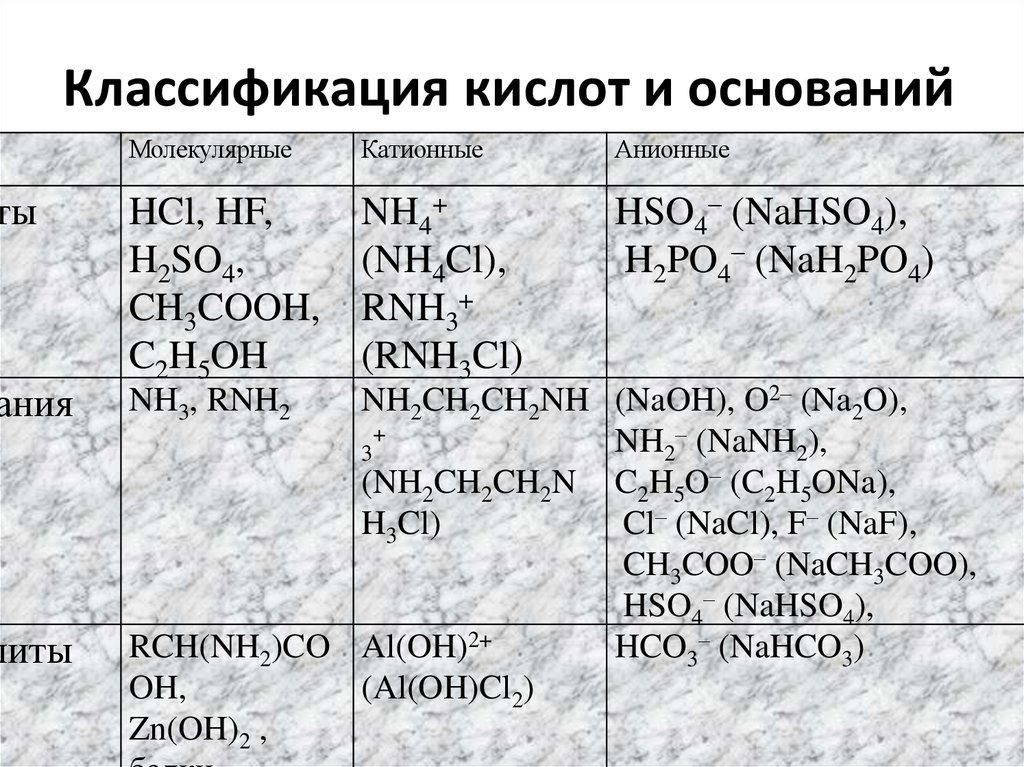
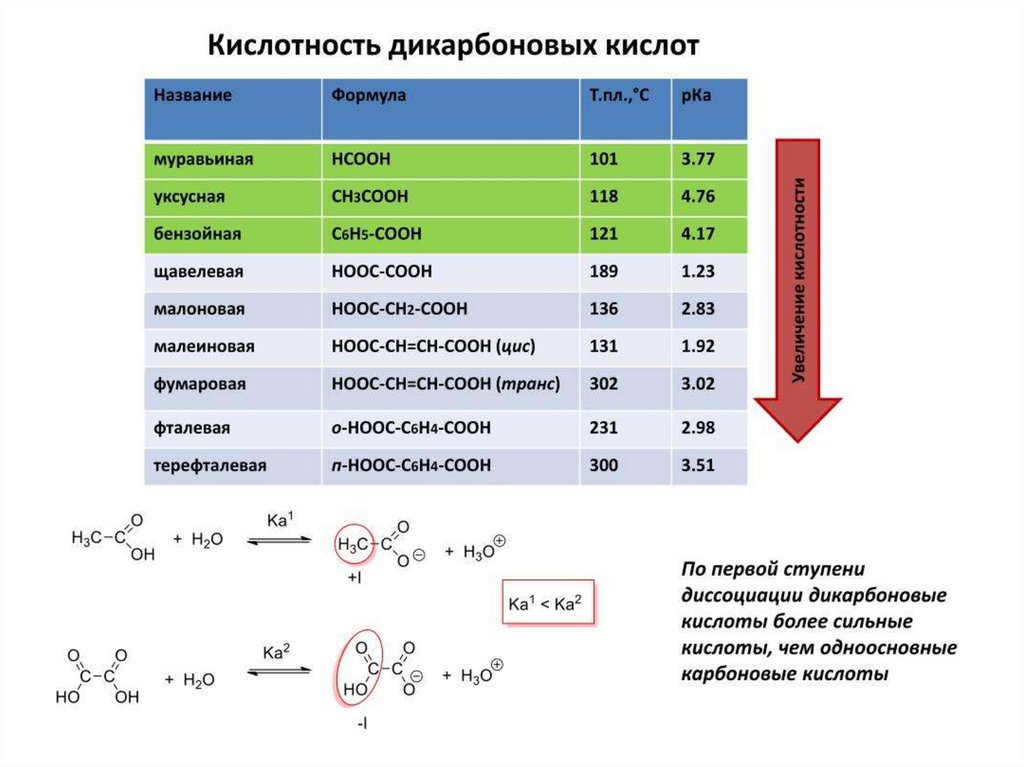
12. Классификация кислот и оснований
тыания
литы
Молекулярные
Катионные
Анионные
HCl, HF,
H2SO4,
CH3COOH,
C2H5OH
NH4+
(NH4Cl),
RNH3+
(RNH3Cl)
HSO4– (NaHSO4),
H2PO4– (NaH2PO4)
NH2CH2CH2NH (NaOH), O2– (Na2O),
+
NH2– (NaNH2),
3
(NH2CH2CH2N C2H5O– (C2H5ONa),
H3Cl)
Cl– (NaCl), F– (NaF),
CH3COO– (NaCH3COO),
HSO4– (NaHSO4),
RCH(NH2)CO Al(OH)2+
HCO3– (NaHCO3)
OH,
(Al(OH)Cl2)
Zn(OH)2 ,
NH3, RNH2
13. Протолитическая теория кислот и оснований
• Кислоты бывают трех типов:• 1) нейтральные молекулы: НCL, Н2SО4
• 2) катионные NН4+ NН3 + Н+
• 3) анионные Н2РО4Н+ + НРО42• Основания:
• 1) нейтральные молекулы: NН3
• 2) катионные Н2N-NН3+
• 3) анионные НРО42- +Н + Н2РО4
14. Протолитическая теория Бренстеда - Лоури
• Амфолит – молекула или ион, способный быть какдонором, так и акцептором протона в зависимости от
партнера по реакции.
HCO3- + H3O+ = H2CO3 + H2O
(b1)
(a2)
(a1)
(b2)
HCO3- + OH- = CO32- + H2O
(a1)
(b2)
(b1)
(a2)
H3N+ – CH(R) – COO- + H3O+ = H3N+ – CH(R) – COOH + H2O
(b1)
(a2)
(a1)
(b2)
H3N+ – CH(R) – COO- + OH- = H2N – CH(R) – COO- + H2O
(a1)
(b2)
(b1)
(a2)
15. Типы протолитических процессов
ПроцессНейтрализаци
я
Уравнение реакции (пример)
H3O+ + OH- = 2H2O
CH3COOH + CH3NH2 = CH3COO- + CH3NH3+
Ионизация
NH3 + H2O = NH4+ + OH-
CH3COOH + H2O = CH3COO- + H3O+
Автоионизация
H2O + H2O = H3O+ + OH-
(автопротолиз)
NH3 + NH3 = NH4+ + NH2-
Гидролиз
CO32- + H2O = HCO3- + OH-
(ионный)
Cu(H2O)2+ + H2O = Cu(OH)+ + H3O+
16. Протолитическая теория Бренстеда - Лоури
• Любая протолитическая реакция представляет собойконкуренцию оснований за протон. Выигрывает конкуренцию
более сильное основание, т.к. сильнее акцептирует протон.
• Кислотно-основные свойства вещества проявляются только при
взаимодействии его с другими веществами или растворителем,
т.е. понятия «кислота» и «основание» являются относительными.
• CH3COOH + H2O = CH3COO- + H3O+
• CH3COOH + H2SO4 (безводн) = CH3COOH2 + HSO4• !!!В водном растворе самой сильной кислотой является ион
гидроксония H3O+ , а самым сильным основанием –
гидроксильный ион ОН-.
17.
• Протолитическийпроцесс
идет
в
направлении переноса протона от более
сильной кислоты к более сильному
основанию.
18.
• ЗАДАНИЯ.• 1. Вычислите рН раствора соляной кислоты с =
0,003 моль/л.
• 2. Вычислите рН раствора гидроксида калия с =
0,009 моль/л.
• 3. Вычислите рН раствора пропионовой кислоты
с = 0,001 моль/л.
• рН = 0,5 (рКа - lg с(НВ) )
рКа = 4,87
• 4. Сопряженным основанием для H2O является
• 1). H+; 2). H3O+; 3). OH-; 4). H2O2
19.
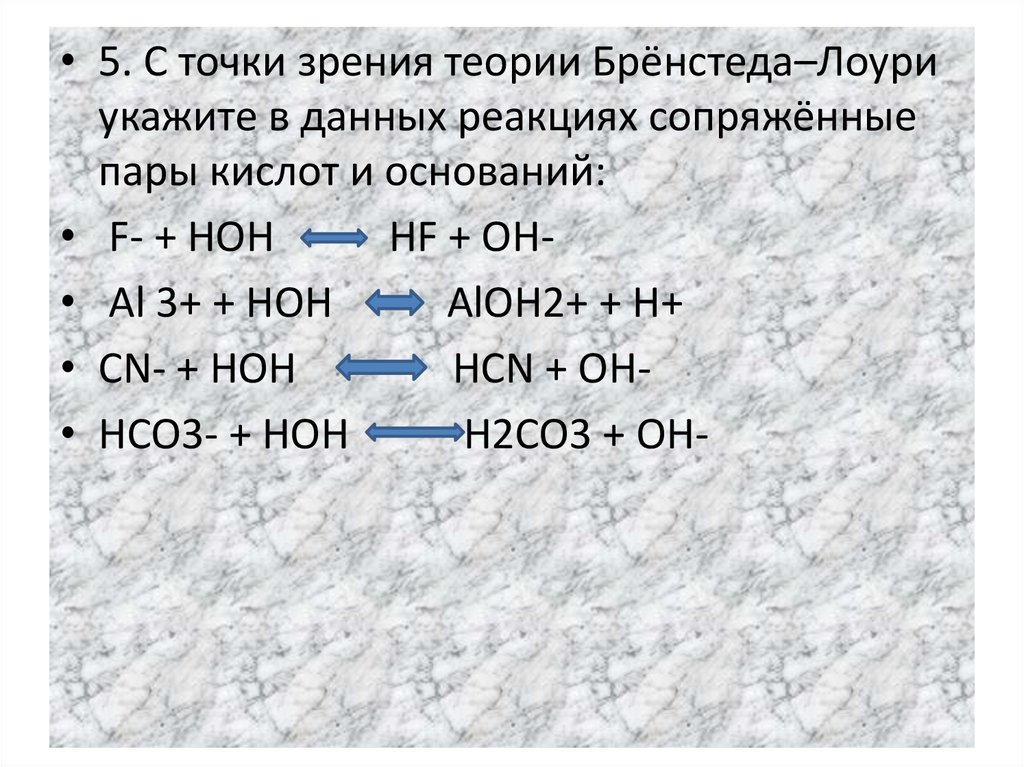
• 5. С точки зрения теории Брёнстеда–Лоуриукажите в данных реакциях сопряжённые
пары кислот и оснований:
• F- + HOH
HF + OH• Al 3+ + HOH
AlOH2+ + H+
• CN- + HOH
HCN + OH• HCO3- + HOH
H2CO3 + OH-
20.
!Чем сильнее основание, тем слабее
сопряженная с ним кислота.
• !Чем сильнее кислота, тем слабее сопряженное с
ней основание.
• Согласно протолитической теории кислот и
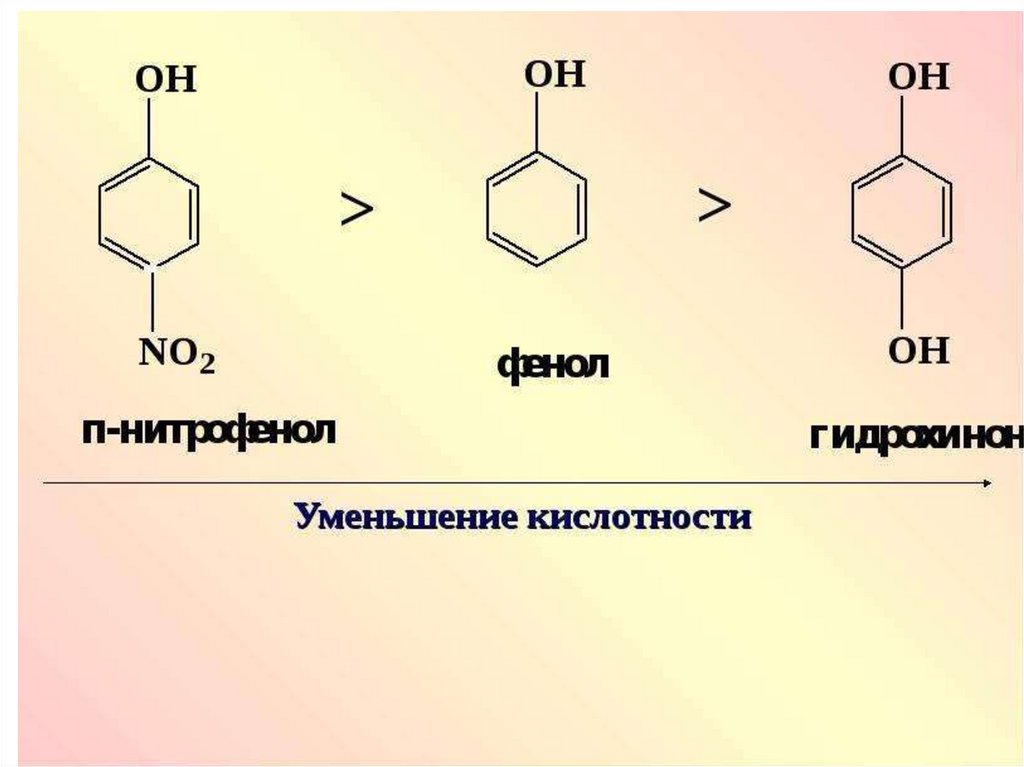
оснований, кислотные свойства амфолитов
обусловлены содержанием в их молекулах
кислотных групп, например — COOH, — NH+3,
являющихся донорами протонов, а основные
свойства — содержанием основных групп, напр.
— COO-, — NH2, являющихся акцепторами
протонов.
21. Концепция Бренстеда-Лоури дает:
• 1) критерий отнесения химической реакциик кислотно-основному типу;
• 2)
позволяет
расположить
водородсодержащие вещества в ряд по
возрастанию их химической активности;
22.
• c(A)) – молярная концентрация кислоты• c(B) –молярная концентрация основания
23.
24. р
25.
26.
27.
28.
29.
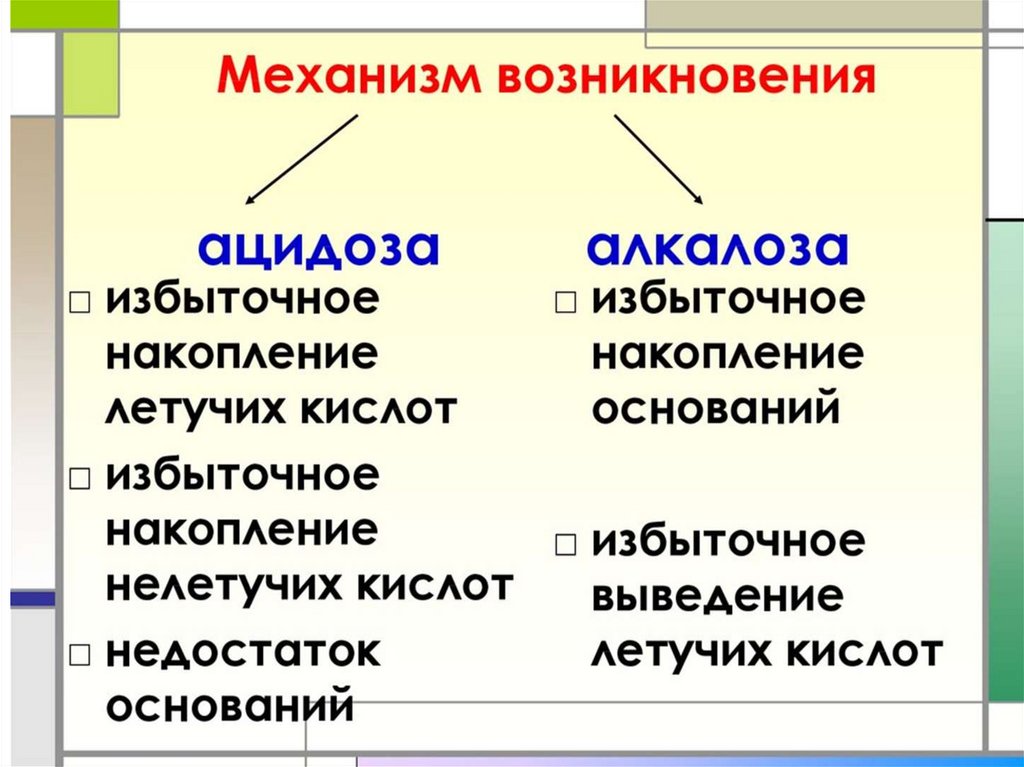
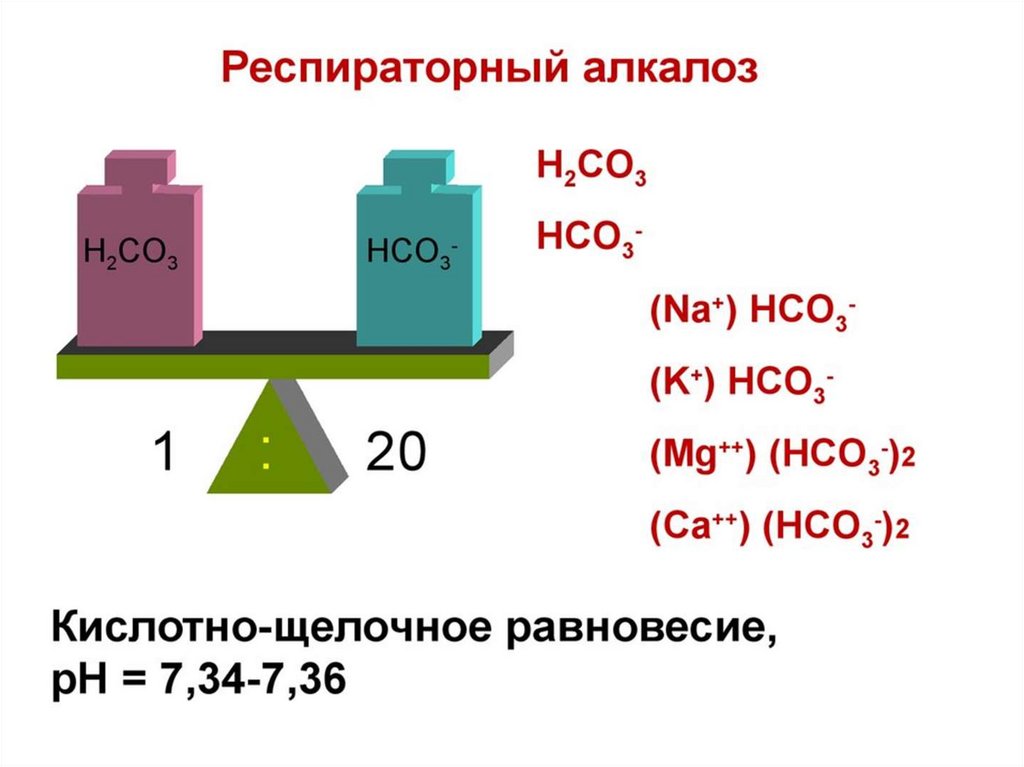
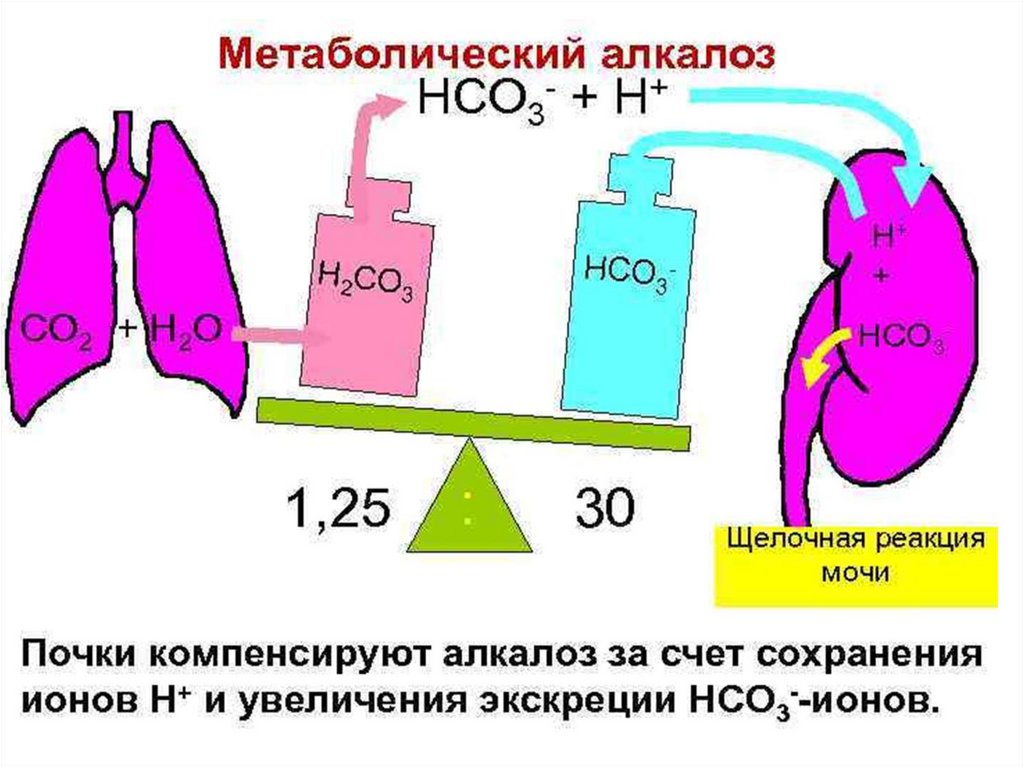
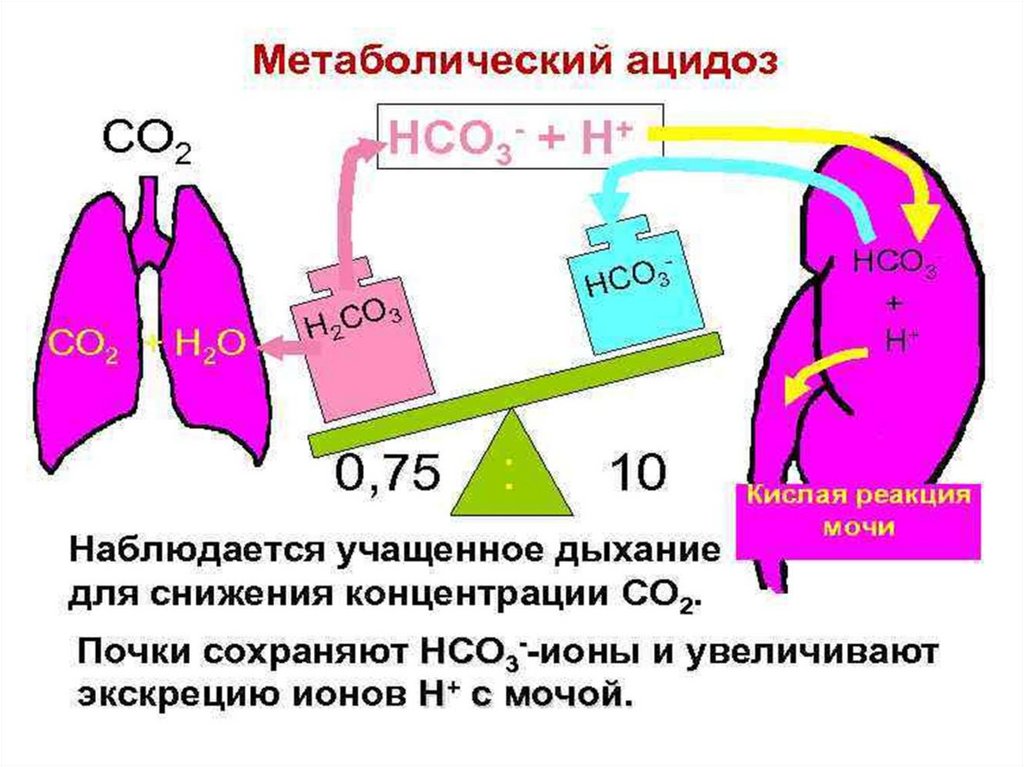
• Обсудим следующие вопросы:• А)Причинами метаболического алкалоза могут
являться:
• 1) внутривенное введение растворов NaHCO3
2) выраженная диарея
3) сильная рвота
4) декомпенсированный сахарный диабет 1 типа
Б). Причинами метаболического ацидоза может
являться:
• 1) декомпенсация сахарного диабета
2) неукротимая рвота
3) остеопороз
4) сердечная недостаточность
30.
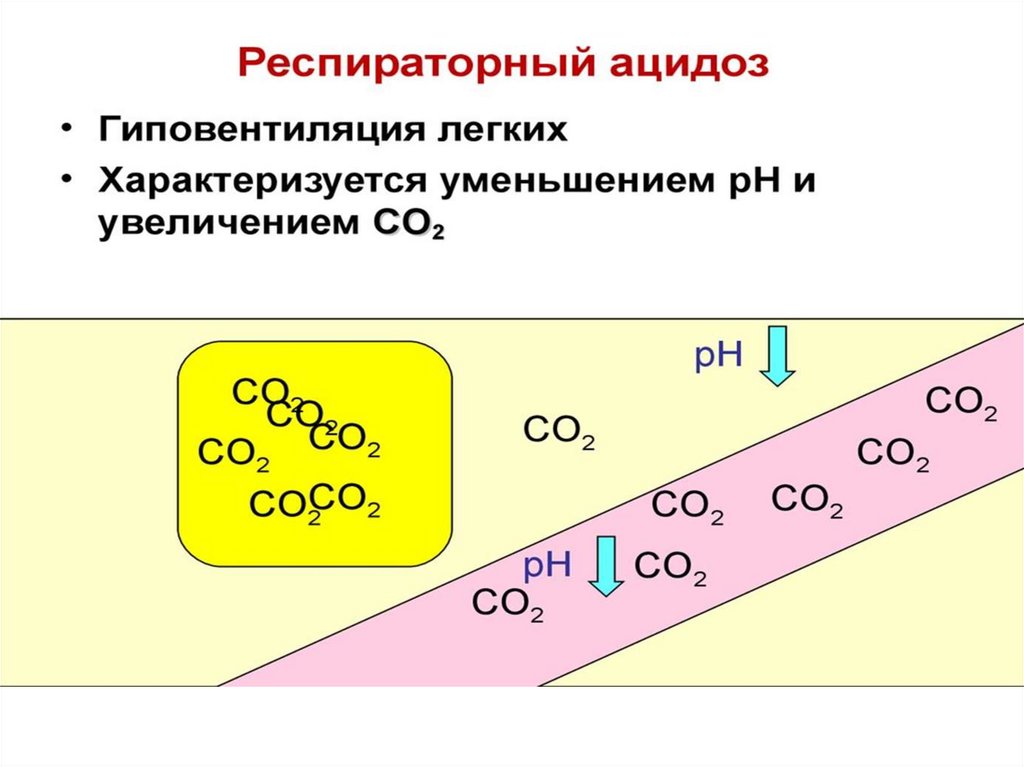
• В). Причинами метаболического ацидоза приинтенсивной мышечной работе является:
• 1) активный гликогенолиз в печени
2) выход из мышц в кровь молочной кислоты
3) накопление в крови угольной кислоты
4) недостаточное кровоснабжение мышцы
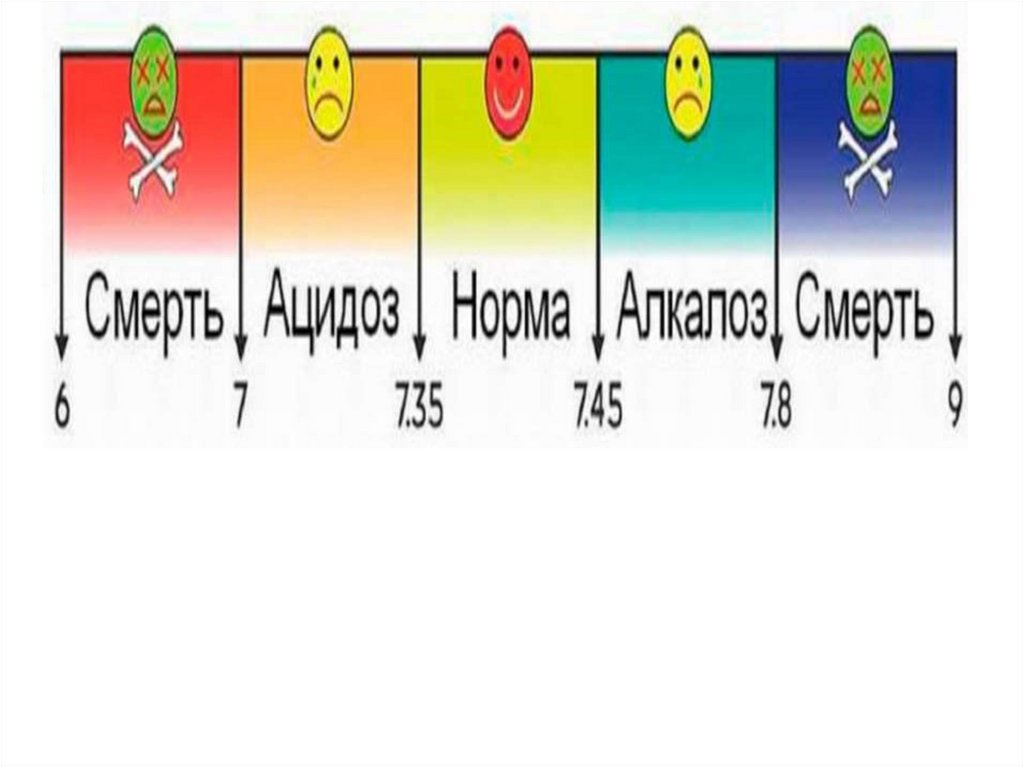
Г) Для респираторного алкалоза характерно:
• незначительное повышение содержания стандартных
гидрокарбонатов (SB)+
31. Кислотность биожидкостей
• Для количественной характеристики кислотных свойствбиожидкостей пользуются величинами общей, активной и
потенциальной кислотности.
• Общая кислотность – это концентрация всех имеющихся в
растворе ионов водорода.
• Она складывается из концентрации свободных (гидратированных)
ионов H+ - активной кислотности и концентрации ионов H+ ,
связанных в молекулы или ионы слабых кислот –
потенциальная кислотность, т.е.:
• C(H+) общ =C(H+)акт + C(H+)потенц.
• Мерой активной кислотности является значение pH !
32.
• Кислотность молока обусловлена наличием внем кислых солей. Кислотность молока
определяют в градусах Тернера. Один градус
кислотности соответствует 1 мл 0,1 М раствора
NaOH, израсходованного на нейтрализацию
кислот в 100 мл молока .
• Молоко, разбавленное водой или с примесью
соды, имеет кислотность меньше 16°Т.
• Кислотность молока, поступающего в
продажу, не должна превышать 21°Т.
• Несвежее - 23°Т и более.
33.
34.
• Определение свежести молока.• Свежесть молока выражают в градусах, под
которыми понимают сумму градусов
кислотности и числа свертывания молока.
Число свертывания- количество миллилитров
0,05 моль/л раствора серной кислоты,
необходимое для свертывания 100 мл молока.
• Градус свежести нормального молока не
должен быть ниже 60!!!
35.
• Кислая реакция желудочного сока обусловленаприсутствием соляной кислоты, гидрофосфатов, а при
патологических процессах – молочной кислоты и
жирных кислот. Совокупность всех веществ,
способных быть донорами протонов, желудочного
сока, составляют общую кислотность.
• Соляную кислоту, связанную с белками и продуктами
их переваривания, называют связанной соляной
кислотой, а находящуюся в несвязанном виде свободной соляной кислотой. Содержание
последней подвержено значительным колебаниям,
тогда как количество связанной соляной кислоты
достаточно постоянно.
36.
• Общую кислотность желудочного сокавыражают количеством миллилитров 0,1 М
раствора NaOH, пошедших на титрование 100
мл желудочного сока в присутствии
индикатора фенолфталеина (интервал
перехода окраски pH 8,2 – 10). В норме общая
кислотность составляет 40-60 титрационных
единиц (ед.)
37.
• Нормальная кислотность в антральном отдележелудка: pH = 1,3 — 7,4.
• Кислотность в глубине эпителиального слоя
желудка: около pH = 7,0.
38.
• Свободную соляную кислоту выражаютколичеством миллилитров 0,1 М раствора
NaOH, пошедших на титрование 100 мл
желудочного сока в присутствии индикатора
диметиламиноазобензола (интервал
перехода окраски рН 1,0 – 3,0). В норме
содержание свободной соляной кислоты
составляет 20-40 ед.
• Общая соляная кислота составляет сумму
свободной и связанной с белками соляной
кислоты (последнюю находят по разности
между общей и свободной соляной кислотой).
39.
• Выполнение работы• В колбу для титрования вносят из бюретки 5 мл
исследуемого желудочного сока. Добавляют 1
каплю раствора диметиламиноазобензола и 2
капли раствора фенолфталеина. Образуется
розово-малиновое окрашивание.
• Пробу титруют 0,1 М раствором NaOH до
оранжевого окрашивания и отмечают
количество миллилитров щелочи, пошедших
на титрование свободной соляной кислоты
(условно называется I пункт титрования).
40.
• Далее титрование продолжают до появлениялимонно-желтой окраски и отмечают общее
количество миллилитров NaOH, пошедших на
титрование от начала общего титрования
• (II пункт титрования).
• Затем титрование продолжают до появления
малинового окрашивания и отмечают
количество миллилитров щелочи, пошедших на
титрование вновь от начала общего титрования
(III пункт титрования).
41.
• Расчеты• Допустим, что на титрование 5 мл желудочного сока
до I пункта пошло от 0 до 1,5 мл 0,1 М раствора
NaOH,
• до II от 0 до 2 мл
• до III пункта – от 0 до 3 мл.
• Тогда общая кислотность составит 3 . 100/5 = 60 ед.,
количество свободной соляной кислоты 1,5 . 100/5 = 30 ед., количество общей соляной
кислоты (среднее арифметическое между II и III
пунктом титрования) - (2+3)/2 . 100/5 = 50 ед., а
количество связанной соляной кислоты находят по
разнице между содержанием общей и свободной
соляной кислоты: 50-30 = 20 ед.
42.
• Задача 1. При определении кислотностимолока израсходовано 1,8 мл 0,1 моль/л
раствора NаОН.
• А)Определите общую кислотность молока.
• На осаждение казеина в 10 мл молока
израсходовано 3,0 мл 0,05моль/л раствора
серной кислоты.
• Б) Чему равно число свертывания ?
• В) Определите доброкачественность
молока.
43.
• РЕШЕНИЕ.• Общая кислотность молока
• ( 18 оТ). Число свертывания равно 30.
• Градусы свежести : 18 + 30 = 48, значит,
молоко недоброкачественное!
44.
• Задача 2. Определите свободную,связанную, общую соляную кислоту и
общую кислотность желудочного сока.
• Находятся эти показатели в норме?
• Если на титрование 8 мл желудочного сока
до I пункта пошло от 0 до 2,0 мл 0,1 М
раствора NaOH, до II от 0 до 3,5 мл и до III
пункта – от 0 до 4,5 мл.
45.
• РЕШЕНИЕ.• Общая кислотность составит 4,5 . 100/8 =
56,25 ед.,
• количество свободной соляной кислоты –
2,0 . 100/8 = 25 ед.
• количество общей соляной кислоты
(среднее арифметическое между II и III
пунктом титрования) –
• (3,5+4,5)/2 . 100/8 = 50 ед.,
46.
• а количество связанной соляной кислотынаходят по разнице между содержанием
общей и свободной соляной кислоты:
• 50-25 = 25 ед.
• НОРМА!!
47.
48.
49.
50.
51.
52.
• Большинство реакций в организме протекаютпри строго определенных значениях рН.
Поддерживают протолитический гомеостаз.
• Поддержание на заданном уровне кислотноосновного равновесия(гомеостаза)
обеспечивается действием буферных систем.
• Протолитические буферные системы
способны поддерживать на постоянном
уровне величину рН при добавлении
небольших количеств сильных протолитов
(кислот, щелочей), а также при разбавлении.
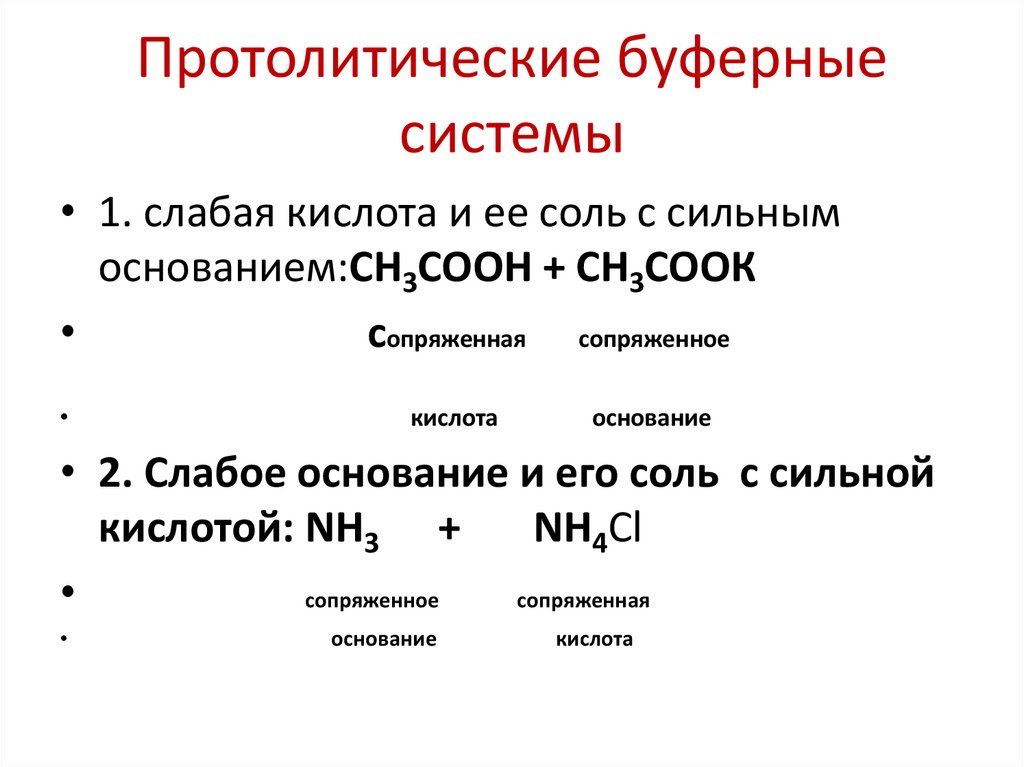
53. Протолитические буферные системы
• Буферные системы образованысопряженной кислотно-основной парой
и бывают следующих типов:
• 1)Слабая кислота и сопряженное ей сильное
основание (кислотная буферная система):
• CH3COOH/CH3COO- - ацетатный буфер
• HCO3-/CO32- - карбонатный буфер
• 2) Сильная кислота и сопряженное ей слабое
основание (основная буферная система):
• NH4+/NH3 – аммиачный буфер
• 3)Ионы и молекулы амфолитов:
• H2PO4-/HPO42- - гидрофосфатный буфер
54. Способы приготовления буферных растворов
• 1) частичная нейтрализация слабогоэлектролита сильным:
• СН3СООН(изб)+ КОН СН3СООК + Н2О
• NН3(изб) + HCl
NH4Cl
• 2) смешивание растворов слабых электролитов
с солями:
• СН3СООН и СН3СООК, NН3 и NН4Cl
• 3) смешивание растворов солей многоосновных
кислот: Н2РО4- и НРО42-
55. Протолитические буферные системы
• 1. слабая кислота и ее соль с сильнымоснованием:СН3СООН + СН3СООК
сопряженная сопряженное
кислота
основание
• 2. Слабое основание и его соль с сильной
кислотой: NН3 +
NH4Cl
сопряженное
сопряженная
основание
кислота
56. Механизм буферного действия
• ионы H3O+ сильной кислоты связываютсясопряженным основанием с образованием
малодиссоциирующего соединения:
• CH3COO- + H3O+ = CH3COOH + H2O
• а добавляемые ионы OH- – сопряженной
кислотой:
• OH- + CH3COOH = CH3COO- + H2O.
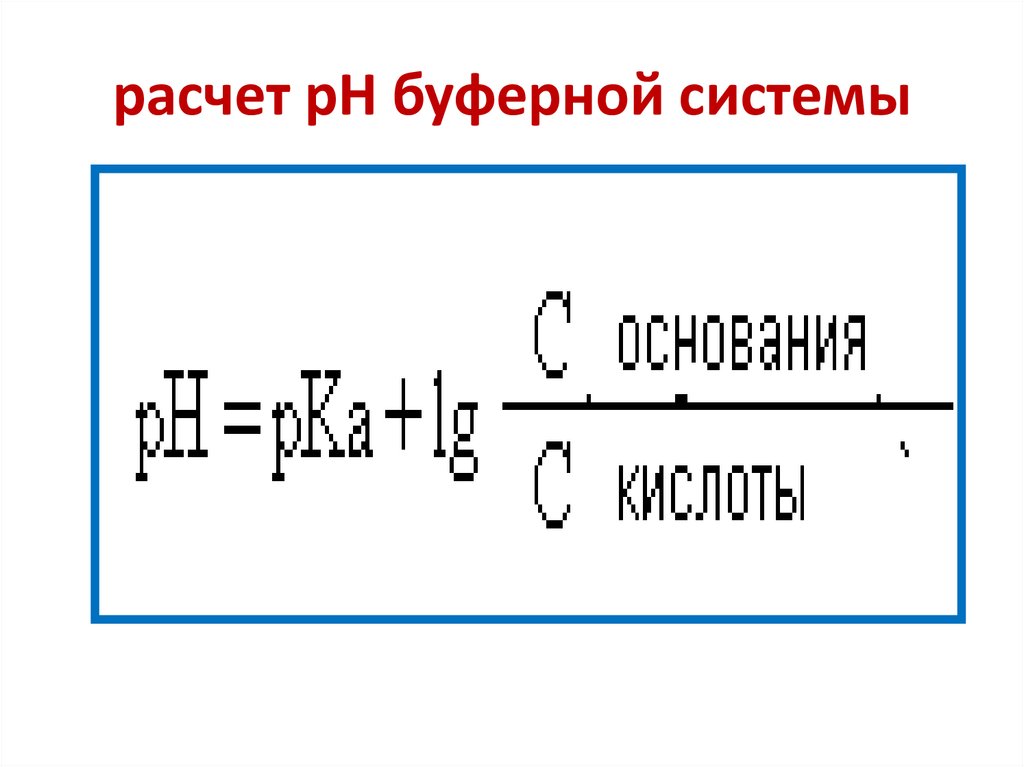
57. расчет рН буферной системы
58.
• Количественной характеристикойбуферной системы является буферная
емкость (В).
• В – численно равна количеству
экивалентов сильной кислоты или
сильного основания,
• которое надо добавить к 1л буферного
раствора, чтобы изменить его рН на
единицу.
59.
• Вa – буферная емкость покислоте
• Вв – буферная емкость по
основанию
• Определяется титрованием !
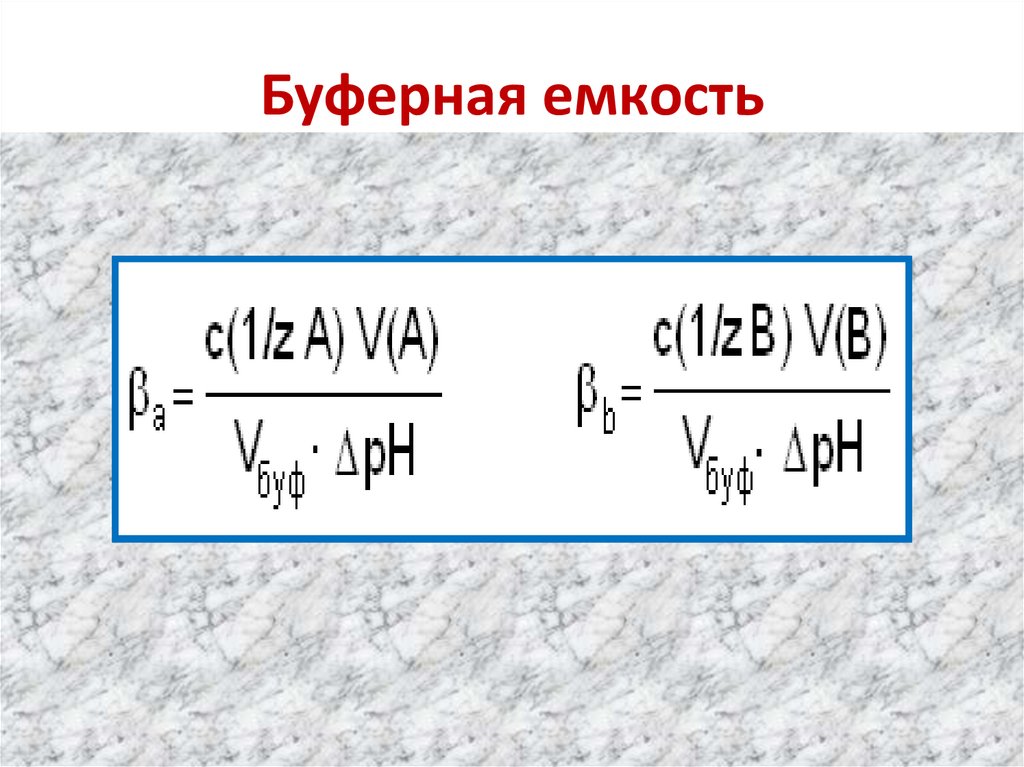
60. Буферная емкость
61.
• В = С( Т)х V( Т)V
(буферного х
рН
раствора)
• С( Т)- молярная концентрация титранта
• V( Т) – объем титранта
• V(буферного раствора) -объем
рН – изменение значения рН
62.
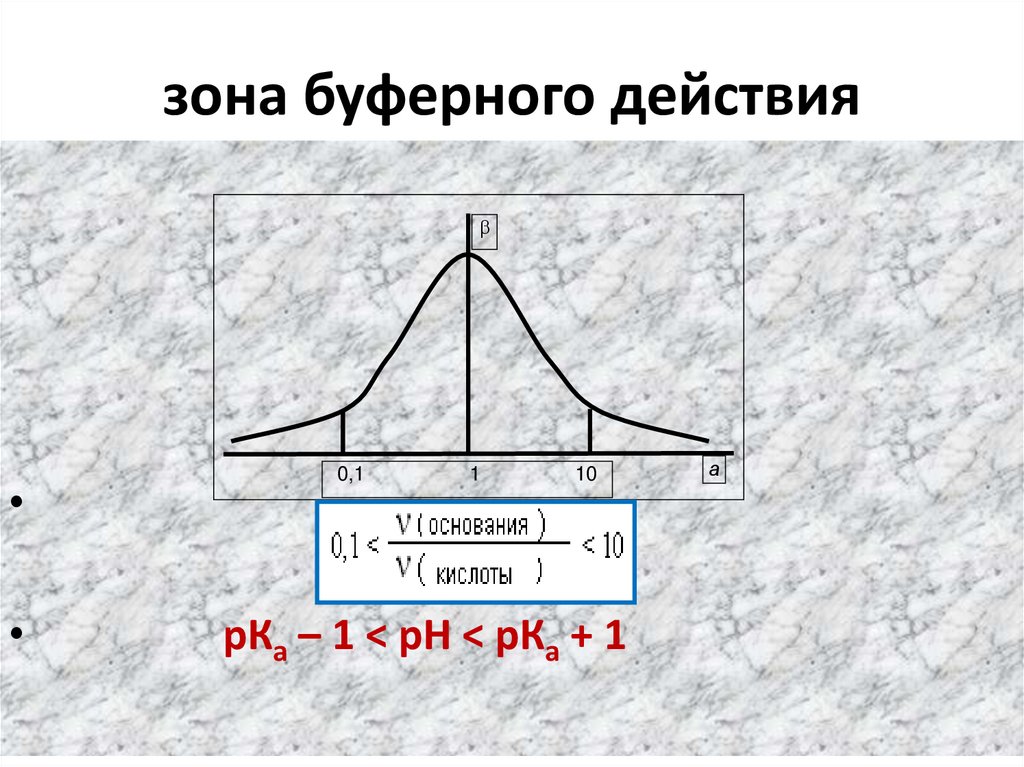
• Зона буферного действия (з.б.д.) – это интервалзначений рН, в котором буфер работает.
рН = pKa +- 1
• рКа (ацетатного буфера)= 4,76
• З.б.д. : р Н = 3,76 – 5,76
63. зона буферного действия
0,1
1
10
рКа – 1 < рН < рКа + 1
а
64. Зона буферного действия
• Зона буферного действия для ацетатногобуферного раствора находится в пределах:
• 4,76+- 1.
• рКа для уксусной кислоты = 4,76
• Зона буферного действия (з.б.д.):
• рН = 3,76 – 5,76
• В этих пределах ацетатный буфер
поддерживает рН на постоянном уровне !!
65.
• Максимальной буфер.емкостью обладаютконцентрированные растворы.
• Если растворы имеют одинаковые
концентрации, то макс. буферная емкость
будет у растворов , для которых
• С ( сопр.к-ты) /С ( сопр.основ.) = 1 !!!
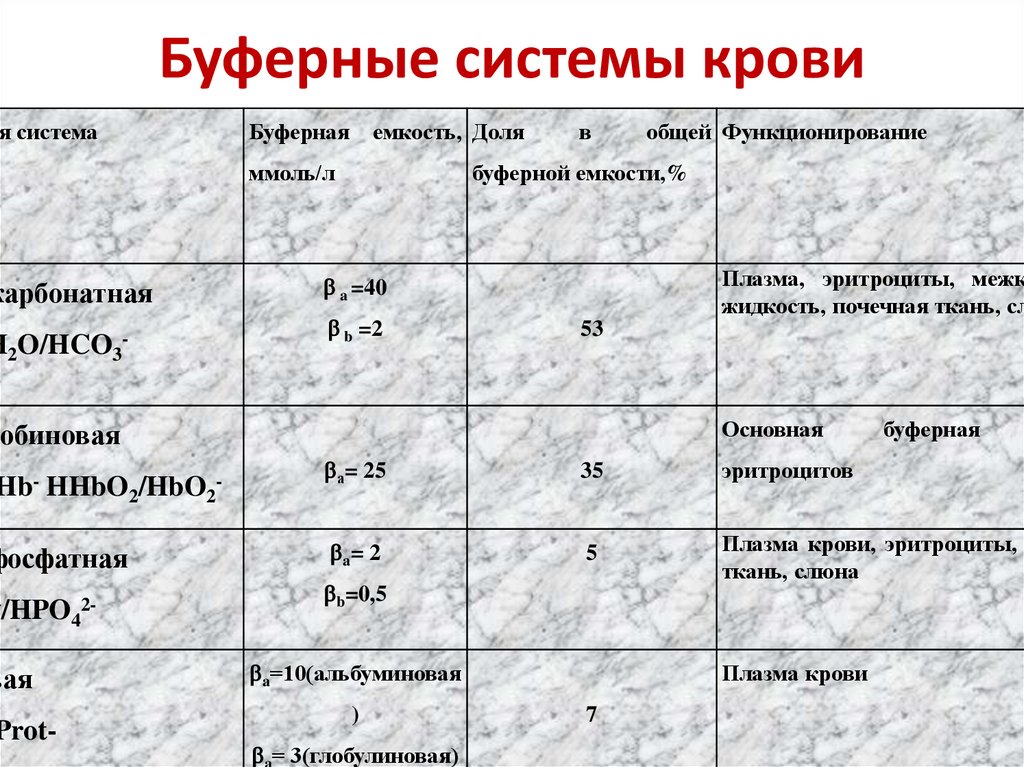
66. Буферные системы крови
ая системакарбонатная
H2O/HCO3-
Буферная
емкость, Доля
ммоль/л
в
буферной емкости,%
Плазма, эритроциты, межк
жидкость, почечная ткань, сл
a =40
b =2
53
Основная
лобиновая
Hb- HHbO2/HbO2-
фосфатная
/HPO 24
вая
Prot-
общей Функционирование
буферная
а= 25
35
эритроцитов
a= 2
5
Плазма крови, эритроциты, п
ткань, слюна
b=0,5
a=10(альбуминовая
)
a= 3(глобулиновая)
Плазма крови
7
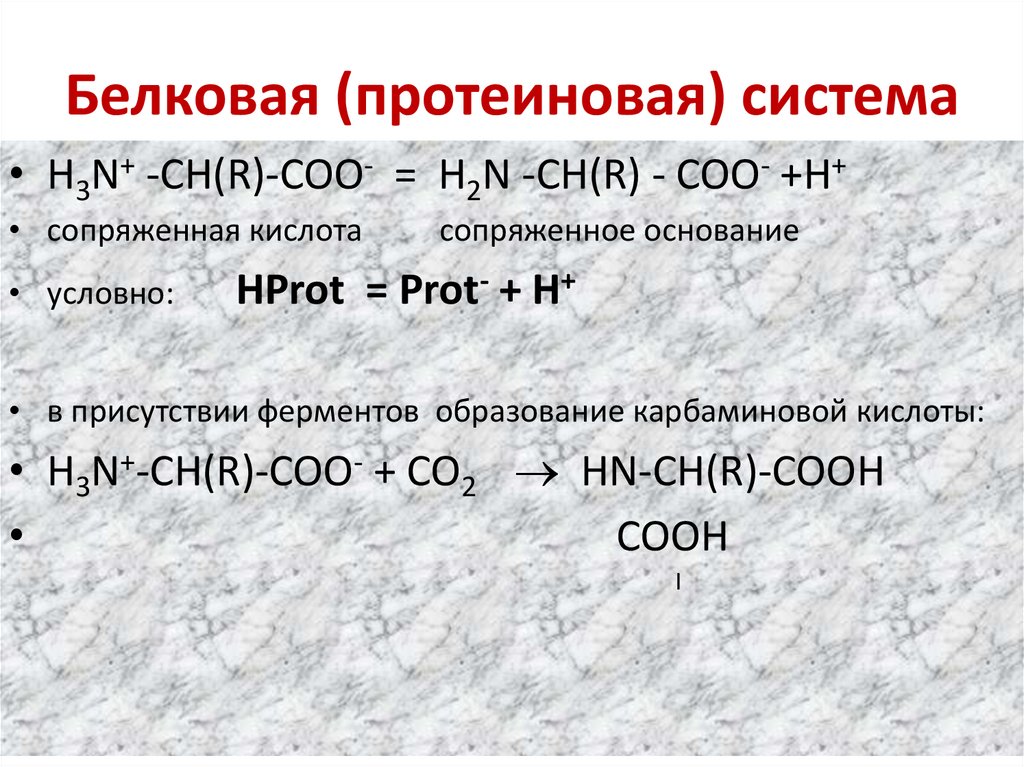
67. Белковая (протеиновая) система
• H3N+ -CH(R)-COO- = H2N -CH(R) - COO- +H+• сопряженная кислота
• условно:
сопряженное основание
HProt = Prot- + H+
• в присутствии ферментов образование карбаминовой кислоты:
• H3N+-CH(R)-COO- + CO2 HN-CH(R)-COOH
COOH
І
68. Гемоглобиновая система
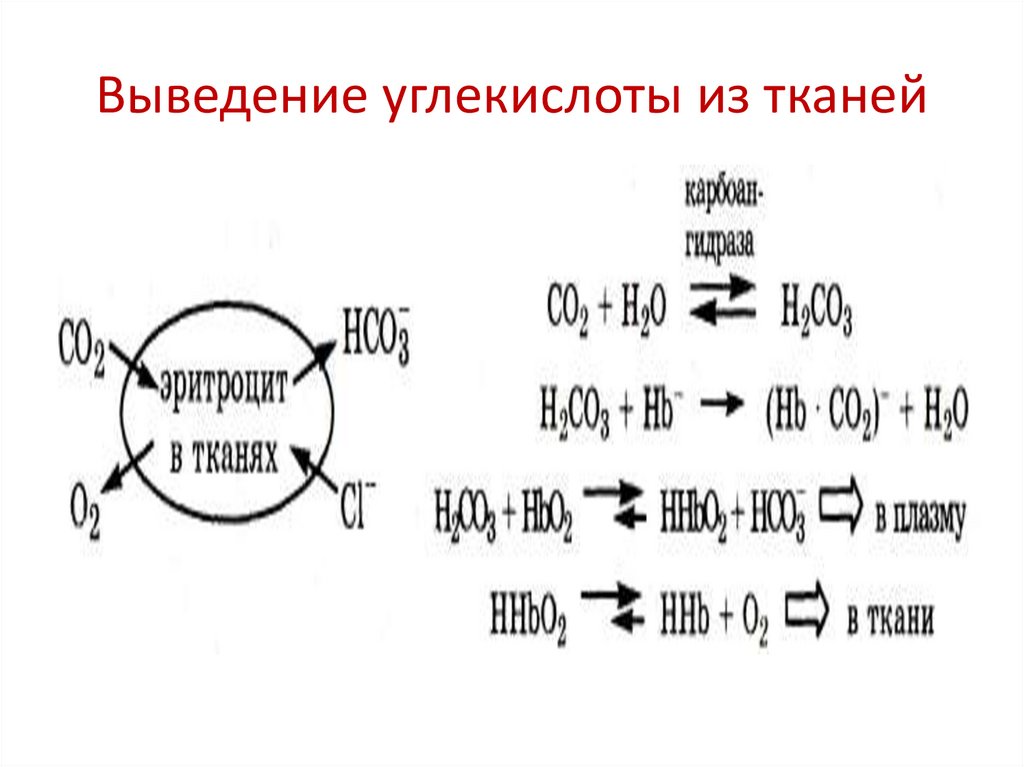
69. Выведение углекислоты из тканей
70. Выведение углекислоты из легких
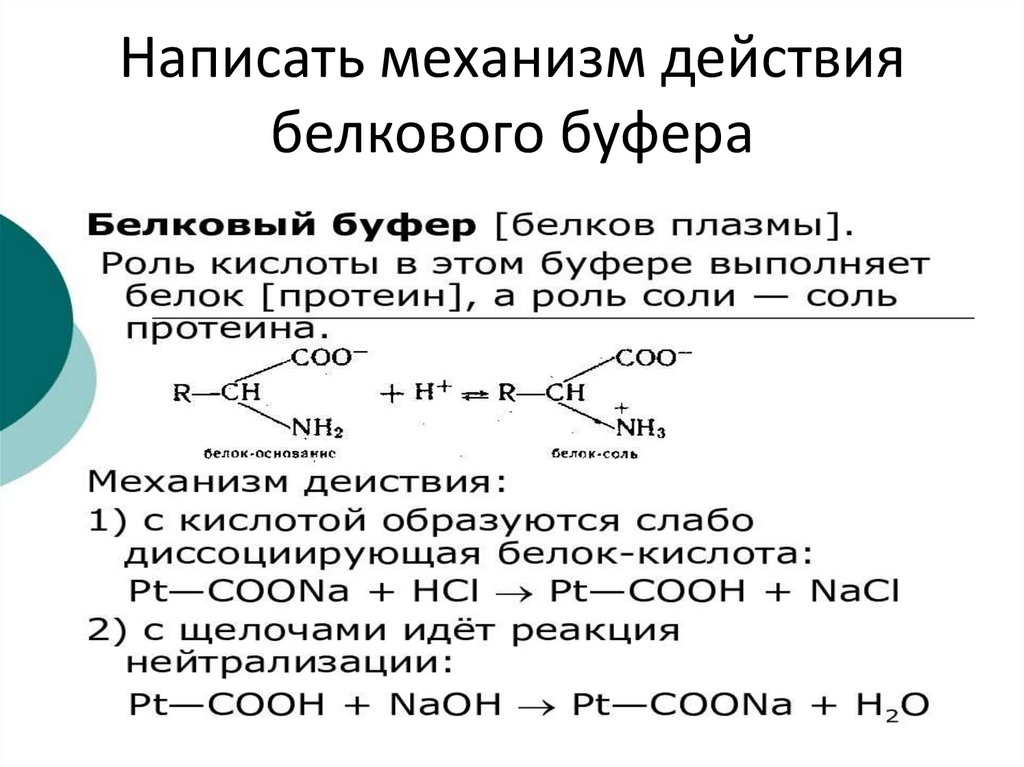
71. Написать механизм действия белкового буфера
72.
• . Задание. К основным буфернымсистемам крови не относятся:
• А. гидрокабонатная
• Б. белковая
• В. фосфатная
• Г. гемоглобиновая
• Д. ацетатная
73.
• Задание .• ВЫБЕРИТЕ КОМПОНЕНТЫ БУФЕРНЫХ СИСТЕМ :
хлорид аммония и гидроксид аммония
формиат натрия и уксусная кислота
соляная кислота и хлорид натрия
гидроксид железа (Ш) и хлорид железа (П)
формиат натрия и муравьиная кислот
формиат натрия и уксусная кислота
соляная кислота и хлорид натрия
гидроксид железа (Ш) и хлорид железа (П)
74.
• Задача.• При исследовании активности трансфераз
динитрофенилгидразиновым методом
применяют фосфатный буфер.
• Для его приготовления смешивают 840 мл
раствора гидрофосфата натрия с = 0,1
моль/л и 160 мл раствора дигидрофосфата
калия с = 0,1 моль/л.
• Вычислите рН такого раствора.
• рКа = 7,21
75.
• Решение.• После смешивания концентрация компонентов
буферной смеси стала равна:
• для гидрофосфата натрия с = 0,1 моль/л * 0,84 л : 1л =
0,084 моль/л,
• для дигидрофосфата калия с = 0,1 моль/л *0,160 л : 1 л =
0,016 моль/л ,
• тогда по уравнению буферной системы :
c(сопряж.
основания)
0,084
• рН = рКа + lg --------------------- = 7,21 + lg ---------- = 7,93
с(кислоты)
0,016

























































 Химия
Химия








