Похожие презентации:
Общие требования к стерилизации
1. ОБЩИЕ ТРЕБОВАНИЯ К ПРОВЕДЕНИЮ СТЕРИЛИЗАЦИИ SOP-01-086/03
Главный специалист ОСТ GMP ДОКЕрмолаева Е.К.
Февраль 2026 г.
1
2. Нормативная база
Требования к проведению стерилизации описаны в нормативныхдокументах:
Правила
надлежащей
производственной
практики
Евразийского
Экономического союза, утвержденные Решением № 77 от 03.11.2016,
Приложение 1;
ОФС.1.1.0016.18 «Стерилизация»;
Правила GMP Европейского Союза (GMP ЕС)
2
3.
ОБЛАСТЬ ПРИМЕНЕНИЯ• SOP-01-086/03 «Общие требования к проведению стерилизации» разработана
в рамках выполнения плана САРА 01007/26 по результатам внешнего аудита
МПТ (ППС)
Несоответствие: Не исключен риск использования нестерильных материалов при
производстве стерильных лекарственных средств. Фактические способы
загрузки материалов, оборудования, контейнеров и других предметов в
стерилизаторы не соответствуют способам загрузки прошедшим валидацию.
Не
обеспечена
минимизация
рисков
контаминации
при
загрузке
простерилизованных питательных сред.
• Требования распространяются на производственные подразделения,
подразделения фармацевтической разработки, департамент контроля
качества
3
4. ОБЛАСТЬ ПРИМЕНЕНИЯ
Единый регламентированный подход кпроцессу стерилизации является одним из
этапов
предотвращения
микробной
контаминации и обеспечения стерильности
продукта на Предприятии согласно EP-01010 «Стратегия контроля контаминации
CCS»
4
5. Термины и определения
Стерилизация - это процесс освобождения объектов (лекарственныхсредств, вспомогательных веществ, оборудования, упаковки, воздушной среды и
др.) от всех видов и форм жизнеспособных микроорганизмов. Стерилизация
является обязательным технологическим этапом производства стерильных
лекарственных средств, обеспечивающим их стерильность.
Стерильность - отсутствие всех видов и форм жизнеспособных
микроорганизмов
УОС – уровень обеспечения стерильности
Величина D – величина десятикратного сокращения: время выдержки,
необходимое для уменьшения популяции тест-микроорганизмов в 10 раз при
определенных условиях обработки
5
6. Ответственность персонала
Должностноелицо/подразделение
Руководитель ДОК
Руководитель подразделения
согласно области
распространения
Зона ответственности
своевременная актуализация SOP при изменении требований
внешней нормативной документации;
руководство, контроль внедрения и выполнения требований
процедуры в подразделениях
организация процессов стерилизации в подразделении в
соответствии с требованиями процедуры;
учет требований настоящей процедуры при разработке
инструкций и процедур подразделения по стерилизации;
контроль
за
своевременным
обучением
персонала
подразделения
по
утвержденным/актуализированным Добавлено в версию 03
процедурам подразделения по стерилизации;
контроль
своевременного
проведения
валидации/
ревалидации процессов стерилизации и загрузок
стерилизаторов;
контроль за ведением регистрационных записей при
проведении стерилизации в подразделении
6
7. Ответственность персонала
Сотрудникподразделения
ответственный за
процесс стерилизации
Руководитель
департамента
технического
сопровождения (ДТС)
выполнение требований действующих процедур при
выполнении процесса стерилизации
планирование
технического
обслуживания
стерилизаторов;
контроль
за
своевременным
проведением
технического обслуживания стерилизаторов и
ведения регистрационных записей;
контроль за наличием расходных материалов для
замены (дыхательные фильтры и др.)
Сотрудники
департамента
технического
сопровождения (ДТС)
ответственные за ТО
своевременное проведение ТО стерилизаторов,
ведение регистрационных записей
Добавлено в версию 03
7
8. Ответственность персонала
Начальник отделавалидации
департамента
обеспечения качества
(ОВ ДОК)
Сотрудники ОВ ДОК
планирование квалификации стерилизаторов и
валидации процессов стерилизации
контроль за своевременным проведением
квалификации и валидации, оформлением
протоколов и отчетов
своевременное проведение квалификации и
валидации, оформление протоколов и отчетов
8
9. Общая информация
В подразделениях ФГУП СПбНИИВС ФМБА России стерилизация можетбыть проведена одним из следующих методов:
1) Термические методы
- насыщенным водяным паром под давлением (автоклавирование);
- горячим воздухом (воздушная стерилизация);
2) Стерилизация фильтрованием (через фильтры с требуемым размером
пор).
При производстве/изготовлении стерильных лекарственных средств
допускается использование только валидированных методов стерилизации.
При изменении условий стерилизации, в том числе при изменении
объема загрузки стерилизатора, необходимо проводить повторную
валидацию.
9
10. Общая информация
Выбор метода стерилизации (термическая стерилизация паром поддавлением или горячим воздухом, или стерилизующая фильтрация) должен
проводиться с учетом таких показателей, как:
- чувствительность объекта стерилизации к действию стерилизующего
агента;
эффективность
воздействия
стерилизующего
агента
на
микроорганизмы;
- для ЛС - сохранение эффективности и безопасности.
При производстве/изготовлении ЛС предпочтительной является
стерилизация в окончательной упаковке с использованием термических
методов.
10
11. Общая информация
• Вслучаях,
когда
стерилизация
в
окончательной
упаковке
невозможна,
используют метод стерилизующей фильтрации
или производство в асептических условиях.
Метод
стерилизации
ЛС
должен
соответствовать
лицензии
на
производство и регистрационному досье.
• Упаковка
объектов
стерилизации
и
укупорочные средства для ЛС должны
обеспечивать стерильность объекта/ЛС в
течение всего срока годности.
11
12. Общая информация
В зависимости от характера стерилизуемых материаловиспользовать разные режимы стерилизации, которые
представляют собой комбинацию разных параметров:
- для стерилизации автоклавированием – комбинация
высокой температуры, повышенного давления и времени
экспозиции;
- для воздушной стерилизации – комбинация высокой
температуры и времени экспозиции;
- для стерилизующей фильтрации – комбинация условий:
размер пор стерилизующего фильтра, время фильтрации,
объем продукта, скорость фильтрации, перепад давления).
12
13. Общая информация
Руководителю подразделения необходимо обеспечить до начала валидации термических процессовстерилизации:
1) наличие процедур/инструкций стерилизации и определить и описать каждую загрузку, указать
режим стерилизации (температура, время, количество пульсаций), указать количество емкостей, объем,
количество групповых упаковок (например, биксов/пакетов), содержимое каждой групповой упаковки,
название материалов упаковки и т.д.
2) каждой загрузке присвоить уникальный код в формате Х_XXX/YY/ZZ, где:
Х_XXX – код оборудования в соответствии с VMP (изменено в версии 03 для гармонизации с
документами валидации/квалификации, необходимо учесть при актуализации процедур/инструкций
подразделений);
YY – код подразделения в соответствии с G-SOP-01-001 «Управление документации»;
ZZ – порядковой номер загрузки.
При квалификации стерилизатора и валидации процесса стерилизации код загрузки прописывать в
протоколе валидации, в дальнейшем, на основании данных из отчетов квалификации/валидации, внести
необходимую информацию в процедуры SOP, UI, TI, и другую нормативную документацию.
13
14. Общая информация
В рутинной работе использовать только валидированныезагрузки при стерилизации насыщенным паром и воздушной
стерилизации.
Выписки с актуальными валидированными загрузками с
уникальными кодами (из отчетов валидации или SOP
подразделений) должны быть размещены возле стерилизаторов
и использоваться ответственными сотрудниками как наглядный
материал для правильного размещения продуктов и материалов
в стерилизационной камере и выборе соответствующего
режима при проведении стерилизации различных продуктов и
материалов.
Код загрузки регистрировать в заполняемых формах
(журналах стерилизации, производственных протоколах,
журналах эксплуатации оборудования).
14
15. Стерилизация насыщенным паром под давлением
При выборе режима стерилизации (температура,время, давление) учитывать физико-химические
свойства объекта стерилизации, объем продукта или
стерилизуемого объекта/объектов.
Стерилизацию
автоклавированием
можно
проводить для: растворов, стеклянной посуды,
инструментов, расходных материалов, сборок,
текстильных материалов, технологической одежды,
питательных сред.
15
16. Стерилизация насыщенным паром под давлением
Автоклав необходимо загружать так, чтобыобеспечить однородность температуры в пределах
всей загрузки.
В ходе автоклавирования следует регистрировать
условия процесса стерилизации (температуру,
давление и время). Температуру измеряют с
помощью
термочувствительных
элементов,
помещенных в контрольные упаковки (при
возможности), в самые низкотемпературные места
стерилизационной
камеры,
которые
устанавливаются
во
время
квалификации
оборудования.
16
17. Стерилизация насыщенным паром под давлением
Условия каждого цикла стерилизации необходиморегистрировать.
Распечатки со стерилизующего оборудования,
проверенные и подписанные оператором, приложить
(оригинал или копию) к заполняемой форме или
хранить в соответствии с требованиями процедуры
подразделения.
Контролировать по распечаткам верхнее и нижнее
значение температуры, давления, количество пульсов
(для форвакуумных автоклавов), и другие важные
параметры.
17
18. Стерилизация насыщенным паром под давлением
Допускается использовать режимы стерилизации с сочетанием времени итемпературы при условии валидации процесса стерилизации для достижении УОС
не более 10 -6
Дыхательные стерилизующие фильтры, через которые проходит любой
поступающий внутрь воздух, необходимо регулярно проверять на целостность в
рамках ТО оборудования.
В случае, когда уменьшение количества воздуха в камере достигается с помощью
нескольких вакуумных и/или паровых пульсов, к контролируемым параметрам
добавить количество пульсов, верхнее и нижнее значение давления в каждом пульсе,
скорость изменения давления и температуры и интервал между каждым таким
изменением.
18
19. Стерилизация насыщенным паром под давлением
Применять тест Бови-Дика (во время квалификации оборудования и длярутинного контроля 1 раз в неделю) в качестве физико-химического индикатора
для проверки полноты удаления воздуха из камеры вакуумных стерилизаторов,
предназначенных для стерилизации пористой загрузки, например текстильных
изделий.
Применять химические (термовременные) индикаторы стерилизации в
качестве рутинного контроля эффективности каждого цикла стерилизации.
19
20. Стерилизация насыщенным паром под давлением
Проводить бактериологический контроль работыпаровых
стерилизаторов
с
использованием
биологических индикаторов, содержащих споры
микроорганизма Geobacillus stearothermophilus (или
другого микроорганизма с аналогичными свойствами),
после монтажа и ремонта оборудования, в процессе его
эксплуатации (плановый – 2 раза в год и при получении
неудовлетворительных
результатов
контроля)
в
соответствии с требованиями SOP-02-050 «Порядок
проверки эффективности работы стерилизаторов с
помощью биологических индикаторов».
20
21. Стерилизация горячим воздухом (воздушная стерилизация)
Использовать для воздушной стерилизации оборудование,обеспечивающее циркуляцию воздуха внутри камеры. Для
предотвращения попадания внутрь стерилизационной камеры
нестерильного воздуха оборудование должно быть оснащено
фильтрами высокой эффективности (НЕРА-фильтр), через
которые проходит любой поступающий внутрь воздух. Регулярно
проводить ТО стерилизационного оборудования и проверять на
целостность фильтры.
Стерилизационный шкаф загружать таким образом, чтобы
обеспечить однородность температуры в пределах всей загрузки.
21
22. Стерилизация горячим воздухом (воздушная стерилизация)
Измерять температуру в стерилизационномшкафу
с
помощью
термочувствительных
элементов, помещенных в контрольные упаковки
(при технической возможности), и помещенными
в
самые
низкотемпературные
места
стерилизационного
шкафа,
которые
устанавливаются
во
время
квалификации
оборудования. Для каждого цикла стерилизации
регистрировать
температуру
и
время
в
предусмотренных заполняемых формах.
22
23. Стерилизация горячим воздухом (воздушная стерилизация)
Применять воздушную стерилизацию при температуре более 220 °С длястерилизации и депирогенизации стеклянной упаковки, если в ходе валидации
доказано уменьшение на 3 порядка количества термостойких эндотоксинов
(вместо использования биологических индикаторов).
Использовать режимы стерилизации (сочетание времени и температуры), для
которых предварительно доказано, что они обеспечивают необходимый и
воспроизводимый уровень гибели микроорганизмов – обеспечивают УОС не более
10 -6.
Контролировать при проведении воздушной стерилизации температуру и время
стерилизации, регистрировать в утвержденных заполняемых формах.
23
24. Стерилизация горячим воздухом (воздушная стерилизация)
Для оценки эффективности каждого цикла стерилизациииспользовать химические (термовременные) индикаторы.
Бактериологический контроль работы стерилизаторов
проводить после монтажа и ремонта оборудования, а также в
процессе его эксплуатации (плановый - 2 раза в год и при
получении неудовлетворительных результатов контроля) в
соответствии с SOP-02-050 «Порядок проверки эффективности
работы
стерилизаторов
с
помощью
биологических
индикаторов». В качестве биологического контроля процесса
воздушной
стерилизации
использовать
биологические
индикаторы содержащие споры микроорганизма Bacillus subtilis
(или другого микроорганизма с аналогичными свойствами).
24
25. Стерилизация фильтрованием (стерилизующая фильтрация)
Стерильность растворов и лекарственных препаратов, которые немогут быть подвергнуты финишной стерилизации в первичной упаковке
ни одним из описанных выше методов ввиду особенностей их строения и
физико-химических свойств, может быть достигнута на завершающих
этапах производства фильтрованием приготовленного раствора с
использованием мембранных фильтров с номинальным размером пор не
более 0,22 мкм, способных удалять большинство бактерий и плесневых
грибов.
25
26. Стерилизация фильтрованием (стерилизующая фильтрация)
Операции, следующие за фильтрацией, проводить в асептических условиях.Необходимо
определить
уровень
микробной
контаминации
перед
фильтрованием для каждой серии продукции. Параметры процесса должны
соответствовать параметрам, установленным в ходе валидации процесса
фильтрации (объем продукта, время фильтрации, скорость фильтрации, давление).
Последнюю
стерилизующую
фильтрацию
лекарственного
препарата
необходимо осуществлять как можно ближе к месту фасовки.
В зависимости от свойств фармацевтической субстанции и уровня микробной
контаминации приготовленного раствора лекарственного препарата допускается
однократная стерилизация фильтрованием непосредственно перед розливом, что
должно быть подтверждено валидацией процесса.
26
27. Стерилизация фильтрованием (стерилизующая фильтрация)
Эффективность стерилизующей фильтрации зависит от размера пор фильтра,уровня микробной контаминации (бионагрузки) перед началом фильтрации и
адсорбции микроорганизмов на фильтре. В случаях, когда для снижения
бионагрузки требуется предварительная фильтрация, ее осуществляют через
мембранные фильтры с размером пор не более 0,45 мкм. Для стерилизующей
фильтрации растворы пропускают через мембранные фильтры с номинальным
размером пор не более 0,22 мкм, способные задерживать не менее
10 7 микроорганизмов Pseudomonas diminuta/Brevundimonas diminuta на
квадратный сантиметр поверхности. Допускается использование других типов
фильтров, обеспечивающих такую же эффективность фильтрации.
27
28. Стерилизация фильтрованием (стерилизующая фильтрация)
Уровень фильтрации определять как величину логарифма снижения (ВЛС)микробной загрязненности. Например, если при фильтрации через мембранный
фильтр с размером пор 0,22 мкм задерживается 107 микроорганизмов, ВЛС составляет
не менее 7.
Следует учитывать уровень микробной контаминации (бионагрузки) до начала
фильтрации, пропускную способность фильтра, объем серии продукта,
продолжительность фильтрации, а также избегать загрязнений продукта
микроорганизмами с фильтра. Срок использования фильтра не должен превышать
времени, установленного при валидации данного фильтра в сочетании с конкретным
фильтруемым продуктом. Не следует повторно использовать мембранные фильтры.
Производственная среда при проведении стерилизующей фильтрации должна
обеспечивать минимальный риск микробного загрязнения и требует регулярного
мониторинга.
28
29. Требования к валидации стерилизации
Для каждого цикла стерилизации необходимо продемонстрировать спомощью физических измерений и с помощью химических (термовременных) и
биологических индикаторов, что он подходит для данной продукции и
эффективен для достижения необходимых условий стерилизации во всех частях
каждого типа загрузки.
Валидировать процессы стерилизации в соответствии с VAP-03-007
«Порядок проведения квалификации паровых стерилизаторов», VAP-03-008
«Порядок проведения квалификации воздушных стерилизаторов», VAP-03-012
«Порядок проведения квалификации стерилизующей фильтрации».
Для валидации процесса термической стерилизации выбирать физические
условия, при которых предметы в загрузке стерилизуются до достижения
необходимого уровня обеспечения стерильности.
29
30. Требования к валидации стерилизации
В случае изменения загрузки стерилизатора или условий проведениятехнологического процесса стерилизующей фильтрации провести повторную
валидацию (ревалидацию) процесса.
До начала валидации/квалификации присвоить каждой загрузке уникальный код.
Код загрузки прописывать при выполнении валидации стерилизации в протоколе.
После выполнения валидации, загрузки с указанной кодировкой и описанием
загрузок включить в процедуры и/или инструкции подразделения по стерилизации
путём их актуализации.
Для обеспечения соответствия фактических загрузок валидированным, оформить
выписки «Схемы загрузок и режимов стерилизации» или «Описание загрузок
стерилизатора» из утвержденных регламентирующих процедур или инструкций.
Разместить выписки на видном месте рядом со стерилизатором для наглядности.
30
31. Требования к валидации стерилизации
Пригодность мембранных фильтров для стерилизующей фильтрацииустанавливают путем микробиологических испытаний с использованием
соответствующих
микроорганизмов,
например,
Pseudomonas
diminuta/Brevundimonas diminuta (ATCC 19146, NCIMB 11091 или CIP 103020).
Рекомендуется использовать не менее 10 7 КОЕ/см2 активной поверхности фильтра.
31
32. Контроль и подтверждение эффективности стерилизации
Для всех методов стерилизации для подтверждения обеспечения необходимыхусловий стерилизации на протяжении всего процесса необходимо проводить
контроль параметров стерилизации (температура, время, давление).
Контроль работы стерилизующих устройств организовать согласно следующим
требованиям:
− контроль должен осуществляться постоянно;
− средства контроля должны устанавливаться в наименее благоприятных для
стерилизующего воздействия местах;
− соблюдение мер предосторожности с целью предотвращения попадания
индикаторных микроорганизмов в сферу производства.
Средства управления стерилизационным оборудованием должны быть
независимы от средств контроля и записывающих устройств.
32
33. Контроль и подтверждение эффективности стерилизации
Подтверждатьэффективность
термической стерилизации с помощью
биологических индикаторов необходимо:
после монтажа и ремонта оборудования; во
время квалификации оборудования; планово
– 2 раза в год; при получении
неудовлетворительных результатов контроля
стерильности
материалов,
растворов,
подвергшихся стерилизации.
Для рутинного контроля каждого цикла
термической стерилизации использовать
химические (термовременные) индикаторы
стерилизации.
33
34. Контроль и подтверждение эффективности стерилизации
Закладывать в стерилизационную камеру биологические и/или химическиеиндикаторы стерилизации необходимо в количестве:
- Паровые стерилизаторы с объемом до 100 куб.дм. – 5 шт
- Паровые стерилизаторы с объемом от 100 до 700 куб.дм. – 11 шт.
- Паровые стерилизаторы с объемом свыше 750 куб.дм. – 13 шт.
- Воздушные стерилизаторы с объемом до 80 куб. дм. – 5 шт.
- Воздушные стерилизаторы однокамерные с объемом свыше 80 куб. дм. – 15 шт.
- Воздушные стерилизаторы двукамерные с объемом свыше 80 куб. дм. – 30 шт
(по 15 в каждой камере)
34
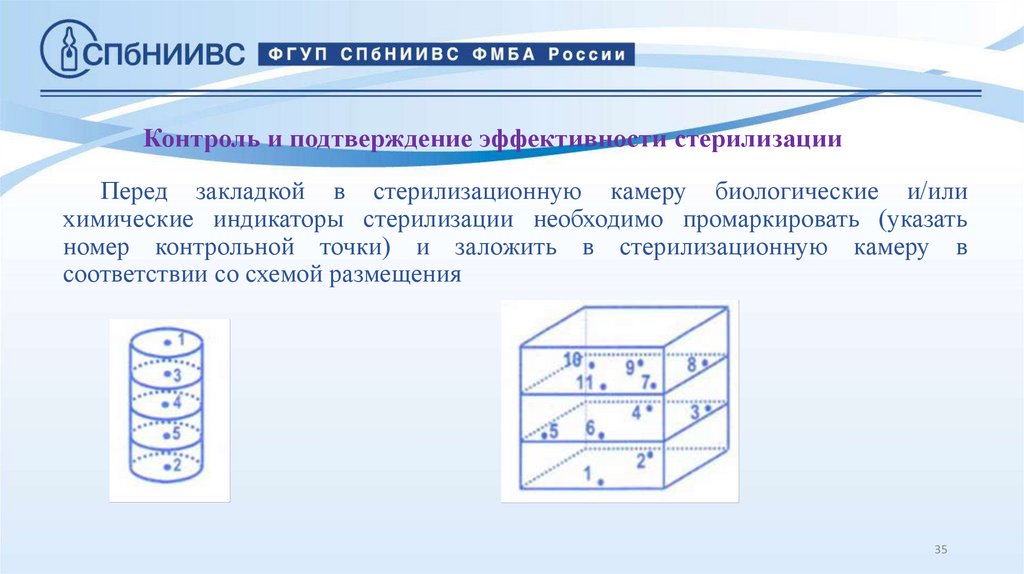
35. Контроль и подтверждение эффективности стерилизации
Перед закладкой в стерилизационную камеру биологические и/илихимические индикаторы стерилизации необходимо промаркировать (указать
номер контрольной точки) и заложить в стерилизационную камеру в
соответствии со схемой размещения
35
36. Контроль и подтверждение эффективности стерилизации
Считывать результаты с химических индикаторов стерилизации послеокончания цикла стерилизации в соответствии с требованиями инструкции
производителя индикаторов.
При использовании максимального термометра для контроля цикла
стерилизации его необходимо размещать в наиболее холодной точке
стерилизационной камеры, определенной при квалификации оборудования. При
регистрации цикла стерилизации и физических параметров стерилизации в
рабочем журнале необходимо обязательно указать заводской номер СИ,
используемого для контроля стерилизации, для обеспечения прослеживаемости
использования и поверки.
36



































 Медицина
Медицина








