Похожие презентации:
Кремний и его соединения
1. Кремний и его соединения.
Цель: рассмотреть формы существованиякремния как химического элемента:
атомы, простые вещества и важнейшие
соединения. Сравнить с
соответствующими формами углерода.
Выяснить значение кремния и его
соединений в природе и жизни человека.
2. Цель:
Рассмотреть формы существованиякремния как химического
элемента: атомы, простые вещества
и важнейшие соединения.
Сравнить с соответствующими
формами углерода.
Выяснить значение кремния и его
соединений в природе и жизни
человека.
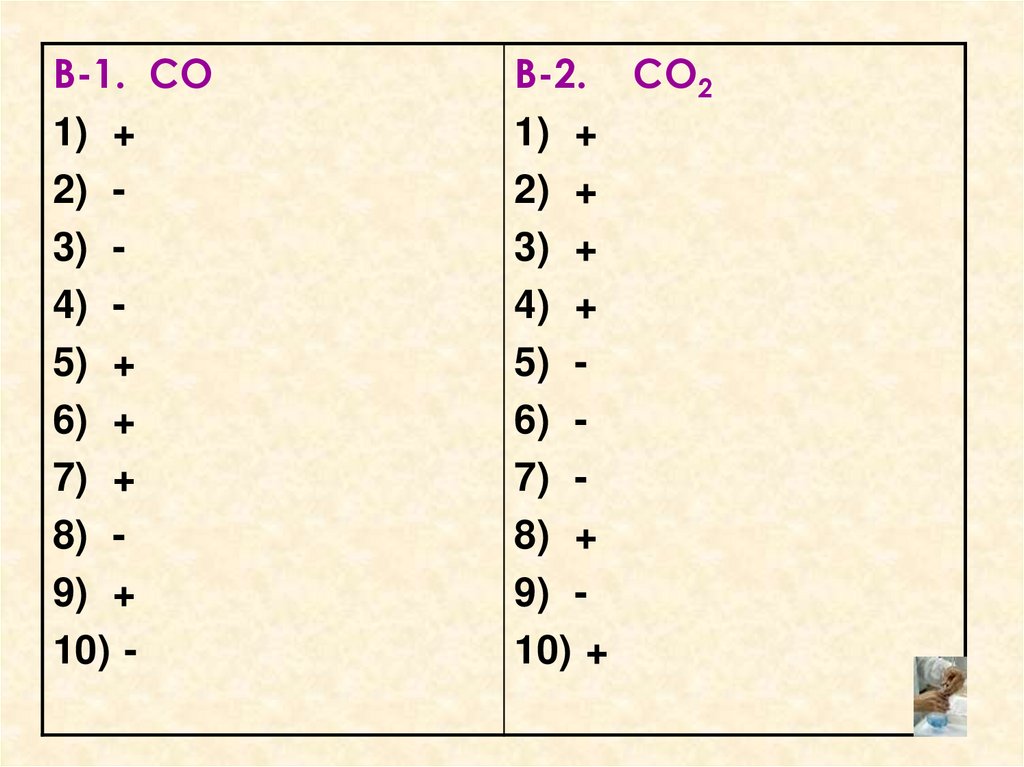
3. Графический диктант.
Взаимопроверка.• Оценка «5» - 10 правильных
ответов.
• Оценка «4» - 8,9 правильных
ответов.
• Оценка «3» - 6,7 правильных
ответов.
• Оценка «2» - 5 и менее
правильных ответов.
4.
В-1. СО1) +
2) 3) 4) 5) +
6) +
7) +
8) 9) +
10) -
В-2. СО2
1) +
2) +
3) +
4) +
5) 6) 7) 8) +
9) 10) +
5. Оглавление:
1. Кремний – химический элемент(характеристика элемента по
Si
положению в ПСХЭ).
2. Кремний – простое вещество
(аллотропные модификации,
химические свойства).
3. Нахождение кремния в природе.
4. Оксид кремния.
5. Кремниевая кислота.
6. Значение кремния и его
применение.
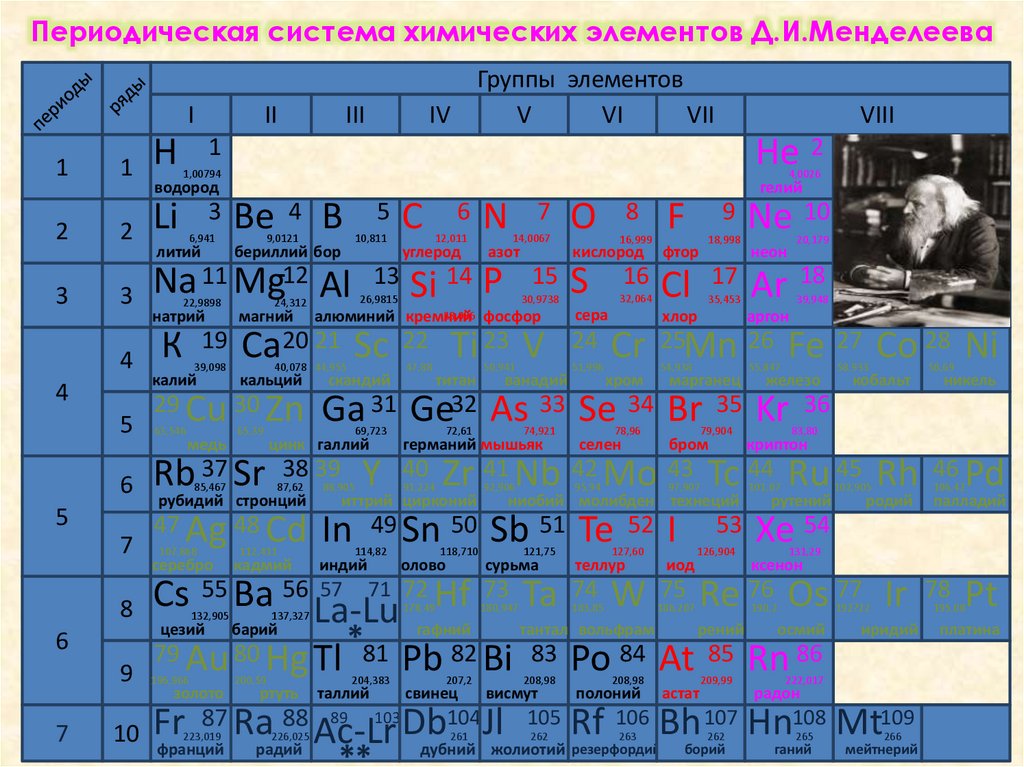
6.
Периодическая система химических элементов Д.И.МенделееваI
II
III
Группы элементов
V
VI
VII
IV
1
1 Н
2
2 Li
3
11 Mg12 Al 13 Si 14 Р
Na
3
1,00794
6,941
22,9898
натрий
5
9,0121
В
5 С
10,811
бериллий бор
24,312
магний
6 N
12,011
углерод
7
14,0067
азот
О
16,999
кислород
15 S
26,9815
9 Ne 10
18,998
фтор
20,179
неон
16 Cl 17 Ar 18
32,064
30,9738
28,086 фосфор
алюминий кремний
F
8
35,453
сера
хлор
39,948
аргон
К 19 Са20 21 Sc 22 Ti 23 V 24 Cr 25Mn 26 Fe 27 Co 28 Ni
39,098
калий
40,078 44,955
кальций
скандий
47,88
титан
50,941
ванадий
51,996
хром
54,938
марганец
55,847
железо
58,933
кобальт
58,69
никель
29 Сu 30 Zn Ga 31 Ge32 As 33 Se 34 Br 35 Kr 36
63,546
медь
65,39
69,723
цинк галлий
72,61
74,921
германий мышьяк
78,96
79,904
селен
бром
83,80
криптон
Rb 37 Sr 38 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd
рубидий стронций
иттрий цирконий
ниобий молибден технеций
рутений
родий палладий
47 Ag 48 Cd In 49 Sn 50 Sb 51 Te 52 I
53 Xe 54
7
6
85,467
107,868
серебро
87,62
112,411
кадмий
88,905
91,224
114,82
индий
92,906
118,710
олово
95,94
121,75
сурьма
97,907
127,60
теллур
иод
101,07
126,904
102,905
106,42
131,29
ксенон
55 Ba 56 57 71 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt
Cs
8
La-Lu
132,905
цезий
9
7
4,0026
гелий
3 Ве 4
литий
4
6
Не 2
1
водород
4
5
VIII
178,49
137,327
барий
79 Au 80 Hg Tl
196,966
золото
200,59
ртуть
*81
204,383
180,947
гафний
186,207
тантал вольфрам
190,2
рений
192?22
осмий
207,2
208,98
208,98
209,99
**
иридий
222,017
таллий
свинец
висмут
полоний астат
радон
104
105
106
107
108
88 89 103
радий
195,08
Pb 82 Bi 83 Po 84 At 85 Rn 86
87
10 Fr223,019 Ra226,025 Ac-Lr Db 261 Jl
франций
183,85
262
Rf
263
Bh
дубний жолиотий резерфордий
262
борий
Hn
265
ганий
Mt109
266
мейтнерий
платина
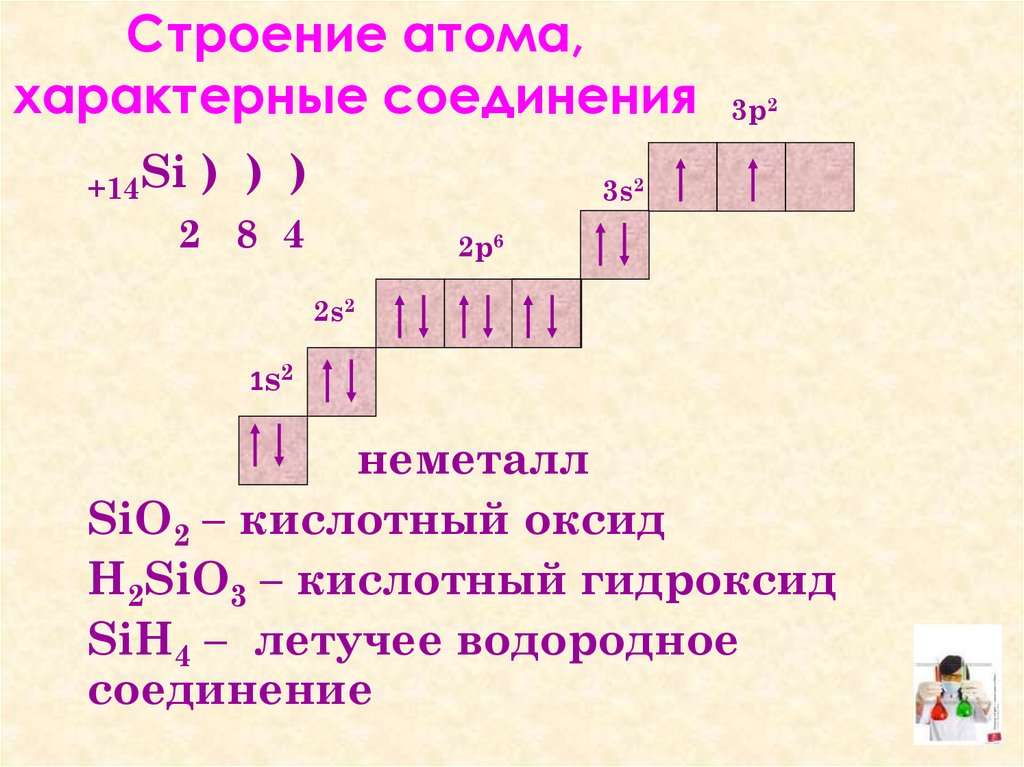
7. Cтроение атома, характерные соединения
3p2
+14Si )
) )
3s2
2 8 4
2p6
2s2
1 s2
неметалл
SiO2 – кислотный оксид
H2SiO3 – кислотный гидроксид
SiH4 – летучее водородное
соединение
8.
Аллотропные модификацииАморфный
бурый порошок,
не имеет определенной
температуры плавления.
Кристаллический
кристаллическая
решетка – атомная,
аналогична алмазу,
но менее прочная,
полупроводник,
темно-серого цвета,
с металлическим
блеском, тугоплавок.
9. Химические свойства кремния:
1) Реагирует с неметаллами (О2, F2, С)Si + O2 → SiO2 ; Si + 2F2 → SiF4 ;
Si + C → SiC карбид кремния (карборунд)
2) ) с металлами
Si + 2Mg → Mg2Si – силицид магния.
Mg2Si + 2H2SO4 → 2MgSO4 + SiH4↑
силан
3) с растворами щелочей
Si +2NaOH + H2O = Na2SiO3 +2H2↑
10.
Si – 27,6% в земнойкоре (2 место
после кислорода)
Кремнезем – SiO2
(песок, кварц;
опалы –
полудрагоценные камни)
Ортоклаз –
K2O · Al2O3 ·
6SiO2
(полевой
шпат).
Каолинит –
Al2O3 · 2SiO2 · 2H2O
(основа глины)
11. Сравнение оксида углерода (IV) и оксида кремния.
Признакисравнения
Оксид
углерода (IV)
Формула
СО2
Крист. решетка
молекулярная
без цвета, без
Физ.свойства Газ,
запаха
Хим.свойства а) с водой
СО2 + H2O = Н2СO3
б) с оксидом
кальция
СО2 + СаО= СаСО3
в) с известковой
водой
(качественная
реакция)
СО2 + Са(ОН)2 =
СаСО3 + H2O
Оксид кремния
12. Сравнение оксида углерода (IV) и оксида кремния.
Признакисравнения
Оксид
углерода (IV)
Оксид кремния
Формула
СО2
SiO2
Крист. решетка
молекулярная
Атомная
без цвета, без
Физ.свойства Газ,
запаха
Хим.свойства а) с водой
СО2 + H2O = Н2СO3
б) с оксидом
кальция
СО2 + СаО= СаСО3
в) с известковой
водой
(качественная
реакция)
СО2 + Са(ОН)2 =
СаСО3 + H2O
Прочный, тугоплавкий, не
растворим в воде
а) со щелочами,
б) с магнием
SiO2 + 2Mg → Si + 2MgO
в) с углеродом
SiO2 + 2C → Si + 2CO↑
г) с карбонатами
SiO2 + СаСО3 → СаSiO3 +
СО2↑
д) с плавиковой кислотой
(особое)
SiO2 + 4HF→ SiF4↑ + 2H2O.
13. Кремниевая кислота – Н2SiO3 (Н2SiO3)n
1. Является полимером, структурные звеньякоторой имеют тетраэдрическое строение.
2. Не растворима в воде.
3. Свежеприготовленная выделяется в виде
геля.
4. Очень слабая, слабее угольной.
5. При нагревании разлагается, образуя оксид
кремния в виде пористого материала –
силикагеля (применяется для поглощения
водяных паров и газов)
Н2SiO3 = SiO2 + H2O
14.
15.
1. Вещества, с которыми реагирует оксидкремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO,
е)H2O, ж)NaOH.
2. Реакции, в которых кремний проявляет
свойства восстановителя:
а)Si + O2 → SiO2 б) Si +2Cl2 → SiCl4
в) Si + C → SiC г) Si +2Mg →Mg2Si
д) Si + 2NaOH + H2O→ Na2SiO3 + 2H2↑
3. Сырье, необходимое для получения стекла:
а) глина, вода; б) глина, известняк,
в) песок, известняк, сода.
16.
1. Вещества, с которыми реагирует оксидкремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO,
е)H2O, ж)NaOH.
2. Реакции, в которых кремний проявляет
свойства восстановителя:
а)Si + O2 → SiO2 б) Si +2Cl2 → SiCl4
в) Si + C → SiC г) Si +2Mg →Mg2Si
д) Si + 2NaOH + H2O→ Na2SiO3 + 2H2↑
3. Сырье, необходимое для получения стекла:
а) глина, вода; б) глина, известняк,
в) песок, известняк, сода.
17.
1. Вещества, с которыми реагирует оксидкремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO,
е)H2O, ж)NaOH.
2. Реакции, в которых кремний проявляет
свойства восстановителя:
а)Si + O2 → SiO2 б) Si +2Cl2 → SiCl4
в) Si + C → SiC г) Si +2Mg →Mg2Si
д) Si + 2NaOH + H2O→ Na2SiO3 + 2H2↑
3. Сырье, необходимое для получения стекла:
а) глина, вода; б) глина, известняк,
в) песок, известняк, сода.
18.
1. Вещества, с которыми реагирует оксидкремния: а) HCl, б)C, в)HF, г)K2CO3, д)CaO,
е)H2O, ж)NaOH.
2. Реакции, в которых кремний проявляет
свойства восстановителя:
а)Si + O2 → SiO2 б) Si +2Cl2 → SiCl4
в) Si + C → SiC г) Si +2Mg →Mg2Si
д) Si + 2NaOH + H2O→ Na2SiO3 + 2H2↑
3. Сырье, необходимое для получения стекла:
а) глина, вода; б) глина, известняк,
в) песок, известняк, сода.
19. 9 класс Выполните тренировочный тест:
20.
1. Оксид серы (IV) называют:а) серным ангидридом,
б) сернистым газом,
в) триоксидом серы,
г) сернистым ангидридом,
д) диоксидом серы,
2. Оксид серы (VI) называют:
а) серным ангидридом,
б) сернистым газом,
в) триоксидом серы,
г) сернистым ангидридом,
д) диоксидом серы,
21.
3. Оксид серы (IV) в воде:а) мало растворяется,
б) хорошо растворяется,
в) плохо растворяется.
4. Оксид серы (VI) в воде:
а) мало растворяется,
б) хорошо растворяется,
в) плохо растворяется.
5. В серной кислоте хорошо растворяется:
а) серный ангидрид,
б) сернистый ангидрид.
22.
6. При н.у. сернистый ангидрид является:а) твердым веществом,
б) жидким веществом,
в) газообразным веществом.
7. При н.у. серный ангидрид является:
а) твердым веществом,
б) жидким веществом,
в) газообразным веществом.
8. Солями сернистой кислоты являются:
а) Na2SO4,
в) Na2SO3,
б) NaHSO3,
г) NaHSO4.
23.
9. Соль NaHSO3 называют:а) сульфитом натрия,
б) сульфатом натрия,
в) гидросульфитом натрия,
г) гидросульфатом натрия.
10. Соль Na2SO4 называют:
а) сульфитом натрия,
б) сульфатом натрия,
в) гидросульфитом натрия,
г) гидросульфатом натрия.
24.
11. Сильной кислотой является:а) сернистая кислота,
б) сероводородная,
в) серная кислота.
12. Серная кислота проявляет:
а) только восстановительные свойства,
б) только окислительные свойства,
в) и восстановительные, и окислительные свойства.
13. При разбавлении концентрированной
серной кислоты необходимо наливать:
а) воду в кислоту,
б) кислоту в воду.
25.
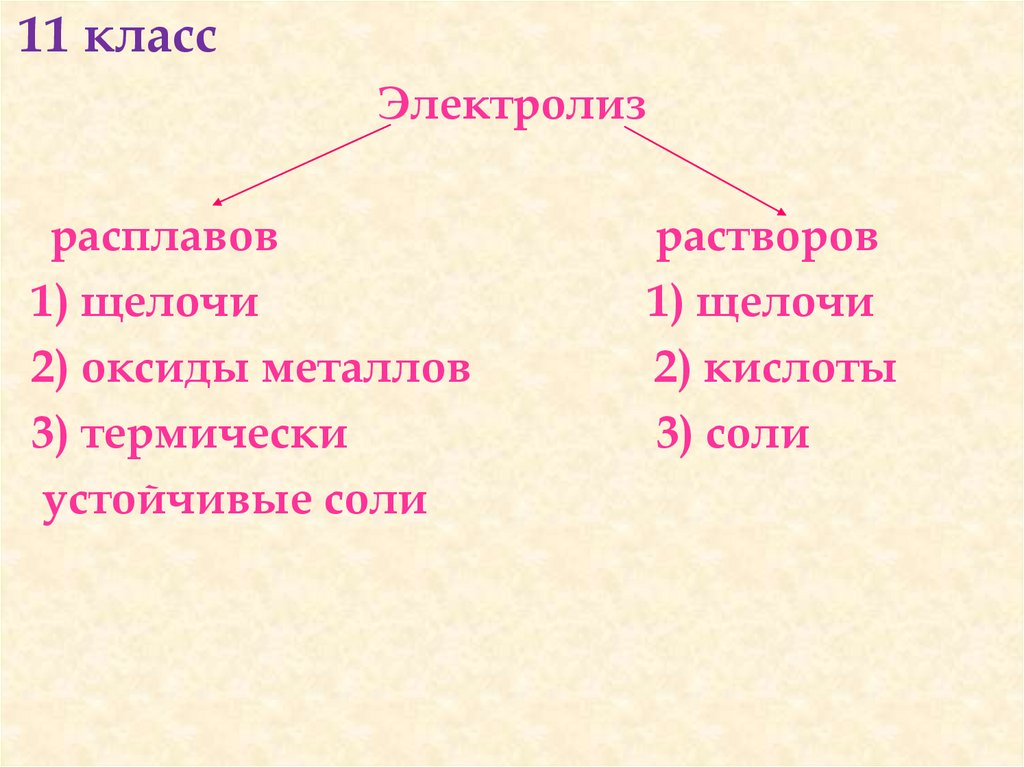
11 классЭлектролиз
расплавов
1) щелочи
2) оксиды металлов
3) термически
устойчивые соли
растворов
1) щелочи
2) кислоты
3) соли
26.
Порядок разрядки анионов(на аноде):1. Бескислородные анионы: S2-, I-, Br-, Cl-,
и анионы органических кислот
2RCOO- -2e- → 2CO2 + R – R
2. В щелочной среде:
4OH- - 4e- → O2 + 2H2O
в кислой и нейтральной:
2H2O - 4e- → O2 + 4H+
3. Не разряжаются анионы
кислородсодержащих кислотных остатков
и F-.
27.
Порядок разрядки катионов (на катоде):1. Катионы металлов, расположенных в
ряду напряжений металлов после Н2.
2. В кислой среде:
2Н+ + 2е- → Н2.
в нейтральной и щелочной:
2H2O + 2е- → Н2 + 2ОН3. Одновременно с водой могут
разряжаться катионы металлов,
расположенных в ряду напряжений от Al
до H2.
4. Не разряжаются катионы металлов в
ряду напряжений до Al (включительно).
28.
Mg + 2HCl = MgCl2 + H2↑(замещения, окислительно-восстанов., гетерогенная, некаталитическая, необратимая)
CaCO3 + 2HCl=CaCl2 +H2CO3
H2O
CO2 ↑
(обмена, неокислительно-восстанов., гетерогенная, некаталитическая, необратимая)
CO2 + H2O ↔ H2CO3
(соединения, неокислительно-восстанов., гетерогенная, некаталитическая, обратимая)
H2O + SO2 ↔ H2SO3
(соединения, неокислительно-восстанов., гетерогенная, некаталитическая, обратимая)
t
2Fe(OH)3 = Fe2O3 + 3H2O - Q
(разложения, неокислительно-восстанов., гетерогенная, некаталитическая, эндотермическая,
необратимая)
t
2Cu + O2 = 2CuO- Q
(соединения, ОВР, гетерогенная, некаталитическая, эндотермическая, необратимая)
























 Химия
Химия








