Похожие презентации:
Л- 8 группа 4 и 3 Менделеева
1.
Контроль качества жидкихлекарственных форм
«Контроль качества неорганических
лекарственных средств элементов IV и III
группы периодической системы
Д.И.Менделеева»
2.
ЦЕЛИ:Образовательные:
1.1. В ходе лекции студенты вспоминают общую характеристику элементов IIIА - IVА групп
ПСХЭ Д.И.Менделеева и основные химические свойства элемента бора, углерода.
1.2. В ходе лекции усвоить знания по лекарственным субстанциям: кислота борная, натрия
тетраборат, натрия гидрокарбонат.
Воспитательные:
2.1. В ходе лекции научить студентов выделять по изучению нового материала главное,
существенное; применять полученные ранее знания для решения поставленных задач.
2.2. Воспитывать ответственность за усвоение новых знаний.
Развивающие:
3.1. Учить прогнозировать качественный и количественный анализ лекарственных субстанций
на базе ранее полученных знаний.
3.2. Подготовить компетентного специалиста.
3.
План:1. Общая характеристика IV группы.
2. Лекарственные средства IV группы:
натрия гидрокарбонат
3. Общая характеристика III группы.
4. Лекарственные средства III группы:
кислота борная;
натрия тетраборат
4.
Лекарственные средства III группы ПСХЭим. Д.И. Менделеева
Главную подгруппу III группы ПСХЭ составляют бор, алюминий, галлий,
индий и талий.
На наружном электронном слое у них три электрона, поэтому процесс
принятия электронов для них не является характерным. Вследствие этого
отрицательную степень окисления они не проявляют. Металлические
свойства в сравнении с первой или второй группами выражены слабее, а у
бора преобладают неметаллические свойства. Все они проявляют степень
окисления +3. Однако с увеличением атомной массы и порядкового номера
внутри подгруппы металлические свойства элементов усиливаются.
В медицине значение имеют элементы бор и алюминий. Их соединения
являются лекарственными препаратами.
Бор довольно распространенный элемент в природе. Он входит в состав
многих минералов. Бор относится к одному из многих микроэлементов,
имеющих определенную физиологическую роль в организме. Известно, что
обмен бора в организме в какой-то степени связан с обменом калия.
В медицине соединения бора находят применение в виде борной кислоты и
буры, обладающих дезинфицирующим действием.
5.
Натрия гидрокарбонатNatrii hydrocarbonas
NaHCO3
Класс соединения:
кислая соль
Натрия гидрокарбонат был открыт в 1801 году
немецким аптекарем Б. Розе
6.
Получение:1. Натрия гидрокарбонат образуется как промежуточный продукт при
получении кальцинированной соды NaHCO3.
Для этого концентрированный раствор поваренной соли насыщают
аммиаком при охлаждении и одновременно под давлением пропускают
через него углекислый газ:
NH3 + CO2 + H2O → NH4HCO3
Гидрокарбонат аммония реагирует далее с поваренной солью с
образованием хлорида аммония и натрия гидрокарбоната:
NH3HCO3 + NaCl → NH4Cl + NaHCO3
Менее растворимый в воде натрия гидрокарбонат выпадает в осадок,
который отделяют фильтрованием.
2. Натрия гидрокарбонат получают при насыщении очищенного кристаллического карбоната натрия Na2C03 * 10Н2О углекислым газом.
Na2CO3 * 10H2O + CO2 → 2NaHCO3 + 9H2O
После перекристаллизации из теплой воды (60°С), насыщенной
углекислотой, выделяется чистый препарат, применяемый в медицине
7.
Описание:Белый кристаллический порошок, без запаха,
солено-щелочного вкуса, устойчив в сухом воздухе,
медленно разлагается во влажном
8.
Особые свойства:Постепенно, особенно при взбалтывании и нагревании
растворов, натрия гидрокарбонат переходит (при 70°С) в
двойную соль Na2C03 * NaHC03 , а при 100°С почти нацело
превращается в натрия карбонат Na2C03. Это необходимо
учитывать при приготовлении и хранении растворов
препарата
Растворимость:
Растворим в воде (1:11), практически не растворим в
спирте. Водные растворы имеют слабощелочную
реакцию (рН = 8,37)
9.
Подлинность:1. Открытие катиона - натрия.
Термическая реакция - окрашивание пламени в желтый цвет.
2. Открытие гидрокарбонат - аниона с минеральной кислотой
хлороводородной.
Реакция основана на вытеснении минеральной кислотой кислоты
угольной из ее солей. Кислота угольная нестойка и выделяет С02
(в виде пузырьков газа), который дает белый осадок при
пропускании через известковую воду.
10.
Подлинность:Т.В.: полумикрометодом.
В пробирку на кончике глазной
лопаточки поместить лекарственное
средство, растворить в воде и
прибавить несколько капель раствора
хлороводородной кислоты, наблюдать
выделение пузырьков газа
Химизм: NaHCO3 + HCl = NaCl + H2O + CO2↑
CO2 + Ca(OH)2 = CaCO3↓ + H2O
11.
Подлинность:Очень важно уметь быстро отличать натрия карбонат от натрия
гидрокарбоната, учитывая сходства их физических и химических
свойств.
Наиболее простой способ - добавление индикатора
фенолфталеина к раствору испытуемой соли. При этом растворы
карбонатов с концентрацией 0,1 моль/л окрашиваются в
малиновый цвет (карбонаты имеют сильно щелочную реакцию
среды за счет гидролиза), а раствор натрия гидрокарбоната
остается бесцветным или становится слабо - розовым (растворы
гидрокарбонатов имеют слабощелочную реакцию среды, т.к. в них
кроме гидролиза еще протекает процесс диссоциации
гидрокарбонат - иона:
HCO3- = CO32- + H+
12.
Количественное определение:ГФ: кислотно - основное титрование. Метод ацидиметричесий.
Метод основан на свойстве солей, образованных катионом
сильного основания и анионом слабой кислоты
Титрование прямое;
Рабочий раствор - 0,1М раствор хлороводородной
кислоты;
Индикатор - метиловый оранжевый
13.
Количественное определение:ГФ: кислотно - основное титрование. Метод ацидиметричесий.
Метод основан на свойстве солей, образованных катионом
сильного основания и анионом слабой кислоты
Титруют от желтой до розовой окраски раствора
14.
Количественное определение:Т.В.:
точную навеску лекарственного средства растворить в
свежепрокипяченой и охлажденной воде (воду кипятят для
удаления растворенного углекислого газа), добавить 1-2
капли индикатора метилоранжа и титровать ОД М раствором
хлороводородной кислоты от желтой до розовой окраски
раствора
Химизм: NaHCO3 + HCl = NaCl + H2O + CO2↑
В точке эквивалентности, когда все лекарственное средство
оттитруется, избыточная капля рабочего раствора создаст кислую
реакцию среды и индикатор изменит свой цвет
Расчет ведут по формуле:
То * V * Кп * 100
%С =
а
Хранение:
В хорошо укупоренной таре
15.
Применение:Как антацидное средство при повышенной кислотности
желудочного сока, язвенной болезни желудка и 12-перстной кишки.
Однако при нейтрализации избыточной кислоты происходит
выделение С02 - углекислоты, которая оказывает возбуждающее
действие на рецепторы слизистой оболочки желудка и вызывает
вторичное усиление секреции. Учитывая это, натрия гидрокарбонат,
часто назначают с обволакивающими, адсорбирующими
веществами, которые снижают это побочное действие.
Иногда раствор натрия гидрокарбоната применяется в виде
капельных в/в вливаний при гипертонии, хронической почечной
недостаточности.
Местно (в виде полосканий, промываний) применяется раствор
натрия гидрокарбоната при воспалительных заболеваниях глаз,
слизистых оболочек, верхних дыхательных путей, а также при
попадании на слизистые оболочки и кожу кислот.
16.
Форма выпуска:Таблетки по 0,3 и 0,5;
Раствор 4% в ампулах по 20 мл;
Свечи; порошок;
Таблетки «Бекарбон», «Викалин», «Викаир»
Форма отпуска:
Тоже + простые и сложные растворы
Примеры:
Возьми: Натрия гидрокарбоната – 4,0
Д.О.:
Возьми: Ментола – 0,3
Натрия бензоата – 5,0
Натрия гидрокарбоната – 4,0
Капель нашатырно-анисовых – 1,0
Натрия хлорида по 0,5
Воды очищенной – 200 мл
Воды очищенной – 200 мл
Полоскание
Д.О.:
Полоскание
17.
Лекарственные средства VI группы ПСХЭим. Д.И. Менделеева
Углерод (С), кремний (Si), германий (Ge), олово
(Sn), свинец (РЬ) элементы 4 группы главной
подгруппы ПСЭ. На внешнем электронном слое
атомы этих элементов имеют 4 электрона: ns 2 np 2.
В подгруппе с ростом порядкового номера элемента
увеличивается атомный радиус, неметаллические
свойства ослабевают, а металлические
усиливаются: углерод и кремний – неметаллы;
германий, олово, свинец амфотерные металлы.
Элементы этой подгруппы проявляют как
положительную, так и отрицательную степени
окисления: -4, 0, +2, +4.
.
18.
Высшие оксиды углерода и кремния (С0 2, Si0 2) обладают кислотнымисвойствами, оксиды остальных элементов подгруппы - амфотерны (Ge0
2, Sn0 2, Pb0 2). Угольная и кремниевая кислоты (Н 2 СО 3, H 2 SiO 3)
слабые кислоты. Гидроксиды германия, олова и свинца амфотерны,
проявляют слабые кислотные и основные свойства: H 2 GeO 3 = Ge(OH)
4, H 2 SnO 3 = Sn(ОН) 4, Н 2 РЬО 3 = Pb(OH) 4. Водородные
соединения: СН 4 ; SiH 4, GeH 4. SnH 4, PbH 4. Метан CH 4 прочное
соединение, силан SiH 4 - менее прочное соединение, остальные же
неустойчивые. Химические свойства соединений олова и свинца.
Оксиды олова (II) и свинца (II), SnО и РbО амфотерны, так же как и
соответствующие им гидроксиды Sn(ОН)2 и Рb(ОН)2. Соли Рb2+ -ацетат, нитрат -- хорошо растворимы в воде, малорастворимы хлорид и
фторид, практически нерастворимы сульфат, карбонат, хромат, сульфид.
Все соединения свинца (II), в особенности растворимые, ядовиты.
Биологическая активность свинца определяется его способностью
проникать в организм и накапливаться в нем. Свинец и его соединения
относятся к ядам, действующим преимущественно на нервнососудистую систему и непосредственно на кровь. Химизм токсического
действия свинца весьма сложен. Ионы Рb2+ являются сильными
комплексообразователями по сравнению с катионами остальных рэлементов IVА-группы. Они образуют прочные комплексы с
биолигандами
19.
Кислота борнаяAcidum boricum
Н 3BO3
Класс соединения:
основная кислота
Впервые получен в 1808 году Гей-Люссакои м
Теннаром
Нахождение в природе: воды минеральных источников,
встречается в виде кислородных
соединений (например,
природного материала тинкала и
ашарита).
20.
Получение:1. Из вод горячих минеральных источников.
2. Из природного минерала тинкала по реакции:
Na2B407 * 10Н2O + 2HCI = 4Н3ВO3 + 2NaCI + 5Н2O
горячий раствор
По охлаждению кислота выпадает в осадок, ее
отделяют и очищают перекристаллизацией
21.
Описание:Бесцветные, блестящие, слегка жирные на ощупь
чешуйки или белый кристаллический порошок, без
запаха, кислого вкуса
22.
Особые свойства:1. Борная кислота возгоняется с парами воды и спирта.
2. При нагревании кристаллов она постепенно теряет воду, образуя вначале
(при 100°С) метаборную кислоту, затем стекловидную сплавленную массу
(тетра-борная кислота), которая при последующем прокаливании теряет
воду, оставляя остаток оксида бора (III):
H3BO3
100°С
- H2O
HBO2
3. Водные растворы кислоты борной имеют рН от 3,8 до 4,8 (слабокислая
реакция).
4. Кислота борная является слабой одноосновной кислотой (Кд = 6,4*10-10). В
отличие от других кислот протолические свойства борной кислоты связаны
не с отщеплением протона, а с присоединением гидроксид-иона:
H3BO3 +HOH
[B(OH)4]- + H+
5. При нейтрализации гидроксидами щелочных металлов образуются соли тетраборной кислоты Н2В4О7 (тетрабораты) или реже метаборной НВ02
(метабораты). Соли ортоборной кислоты Н3ВО3 неизвестны.
6. Кислотные свойства кислоты борной усиливаются при ее взаимодействии с
многоатомными спиртами (например, с глицерином), что используется в ее
анализе.
23.
Растворимость:Растворяется в 25 ч. воды и спирта. Лучше в кипящей
(1:4) и медленно в глицерине
Подлинность:
1. Открытие Н+ - с синей лакмусовой бумажкой.
Реакция основана на кислых свойствах
лекарственного средства.
24.
Подлинность:2. Открытие борат – иона:
a. с куркумовой бумагой (фильтровальная бумага, пропитанная
раствором куркумина и высушенная). Реакция основана на
способности лекарственного средства с куркумином
образовывать внутрикомплексное окрашенное соединение
по типу эфира.
25.
Подлинность:Т.В.:
реактивную бумагу поместить на часовое стекло + 1к.
раствора лекарственного средства + 1к. соляной кислоты,
подсушить → розовый или красновато-бурый цвет, + раствор
аммиака → окрашивание переходит в зеленовато-черное
26.
Подлинность:b. получение борно-этилового эфира
Реакция основана на способности борной кислоты вступать в
реакцию этерификации.
Т.В.:
в выпарительную чашку поместить лекарственное средство
+ спирт + конц. H2SO4 и поджечь → пламя с зеленой каймой
Химизм: В
OH
HO - C2H5
OH + HO - C2H5
HO - C2H5
OH
H2SO4
конц.
В
O - C 2H 5
O - C 2H 5
O - C 2H 5
+ 3H2O
27.
Количественное определение:Кислотно - основное титрование. Метод алкалиметрический.
Метод основан на свойстве борной кислоты с глицерином
образовывать глицероборную кислоту - более сильную кислоту, чем
исходная борная кислота.
Титрование прямое;
Рабочий раствор - 0,1М раствор натрия гидроксида;
Индикатор - фенолфталеин;
Вспомогательное вещество - глицерин, нейтральный по
фенолфталеину.
28.
Количественное определение:Условия для проведения титрования:
1. Для растворения навески лекарственного средства следует
использовать прокипяченную воду, не содержащую С02.
2. Раствор гидроксида натрия, применяемый для титрования Н3ВО3 ,
также должен быть свободен от карбонатов, т.к. С02 как более сильная
кислота может вытеснять борную кислоту из ее солей. При этом
результаты титрования будут искажены.
3. Титровать следует при комнатной температуре, т.к. комплекс Н3ВО3 с
глицерином начинает разрушаться при t° выше 50°С.
Мы отметили, что борная кислота очень слабая, оттитровать ее
щелочью нельзя, т.к. точка эквивалентности ее находится при
рН=11. В этой области трудно найти индикатор. Поэтому ее
переводят в более сильную кислоту - глицероборную (глицеринборную). Следовательно, берем в качестве вспомогательного
вещества - глицерин
29.
Количественное определение:Приготовление нейтрализованного раствора глицирина:
В колбу отмерить определенный объем глицерина + несколько капель
фенолфталеина и ОДМ раствор щелочи до слабо-розовой окраски
раствора.
30.
Количественное определение:Т.В.:
точную навеску лекарственного средства растворить в горячей воде,
добавить нейтрализованный глицерин, окраска его исчезает +
несколько капель фенолфталеина и титровать ОДМ раствором
щелочи до розовой окраски от первой лишней капли рабочего
раствора. В конце титрования проводится проверка титрования, т.е. к
титрованному розовому раствору добавляется 2 мл глицерина
нейтрального, при этом розовая окраска в колбе может исчезнуть,
тогда дотитровывают снова ОДМ раствором щелочи
31.
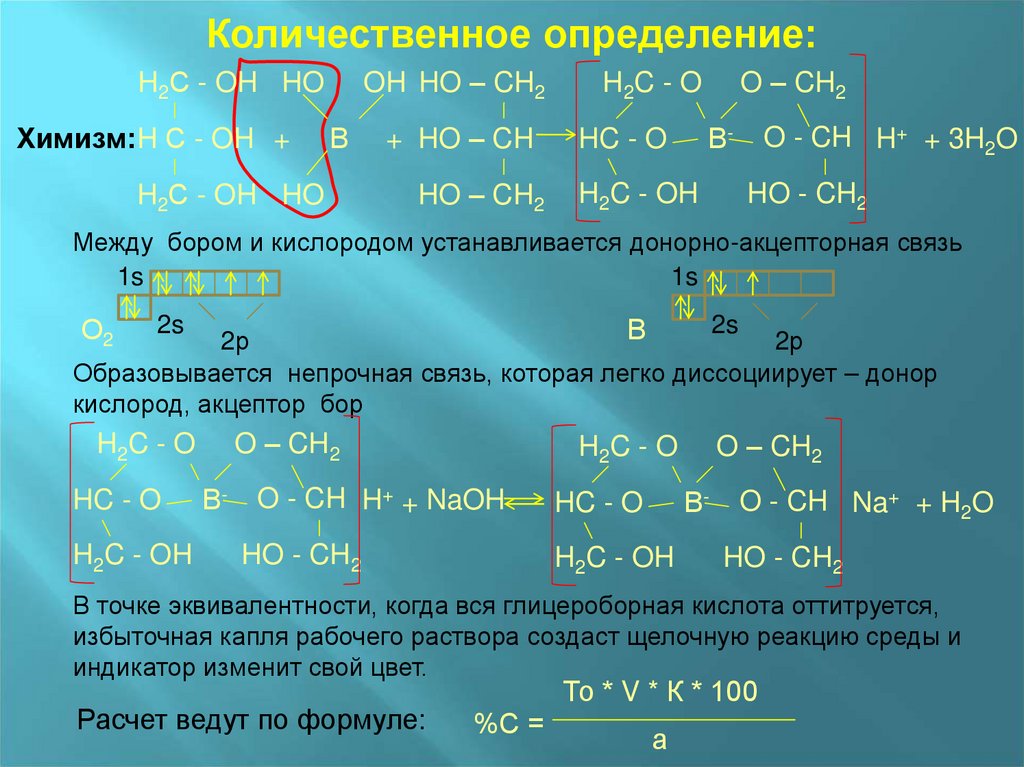
Количественное определение:H2С - OH HO
Химизм:H С - OH +
OH HO – CH2
В
H2С - OH HO
+ HO – CH
HO – CH2
O – CH2
H 2C - O
В-
HC - O
H2C - OH
O - CH H+ + 3H2O
HO - CH2
Между бором и кислородом устанавливается донорно-акцепторная связь
1s
1s
О2
2s
В
2р
2р
Образовывается непрочная связь, которая легко диссоциирует – донор
кислород, акцептор бор
2s
O – CH2
H 2C - O
HC - O
H2C - OH
В-
O – CH2
H2C - O
В-
O - CH H+ + NaOH
HC - O
HO - CH2
H2C - OH
O - CH Na+ + H2O
HO - CH2
В точке эквивалентности, когда вся глицероборная кислота оттитруется,
избыточная капля рабочего раствора создаст щелочную реакцию среды и
индикатор изменит свой цвет.
Расчет ведут по формуле:
То * V * К * 100
%С =
а
32.
Хранение:По общему списку в закрытых банках
Применение:
Антисептическое Борная кислота не назначается внутрь, т.к.
средство
антисептическое свойство ее проявляется в
больших концентрациях, которые токсичны для
организма. Не назначается в детской практике,
беременным и кормящим женщинам
Применяются:
водные, масляные, глицериновые, спиртовые
растворы (ушные капли, в глазных каплях часто с
сульфацилом цинка)
33.
Форма выпуска:Порошок;
Спиртовые р-ры – 0,5%, 1%, 2%, 3%, 5%;
10% р-р в глицерине;
Борная мазь на вазелине
Форма отпуска:
Готовые лекарственные формы;
Растворы разной концентрации
Примеры:
Возьми: Раствора кислоты борной – 0,2
Возьми: Раствора кислоты борной –
0,3
Раствора цинка сульфата –
0,25-10 мл
Д.О.:
Глазные капли
Спирта этилового – 10 мл
Д.О.:
Капли в ухо
34.
Натрия тетраборат (Бура)Natrii tetraboras (Borax)
Na2B4O7 * 10H2O
Класс соединения:
средняя соль
Нахождение в природе: в природе натрия тетраборат
встречается в свободном
состоянии в виде минерала
тинкала, представляющего собой
натриевую соль тетраборной
кислоты
35.
Получение:1. Природную буру очищают от примесей
перекристаллизацией.
2. Буру можно получить из борной кислоты
действием водного горячего раствора
карбоната натрия:
горячий раствор
4Н3B03 + Na2CO3 → Na2B407 + 6Н2O + CO2↑
При прокаливание образующегося в водном
растворе кристаллогидрата (бура) образуется
безводная соль
36.
Описание:Бесцветные, прозрачные, легко выветривающиеся
кристаллы или белый кристаллический порошок.
Водные растворы имеют солоновато-щелочной вкус
и щелочную реакцию (рH=9,0 - 9,6). Реакция
глицериновых растворов кислая
Растворимость:
Растворим в воде (1:25), легко растворим в кипящей
воде (2:1), практически не растворим в спирте, легко в
глицерине
37.
Подлинность:Бура дает все реакции характерные для борной
кислоты
1. Открытие Na+
Реакция термическая, окрашивание бесцветного
пламени в желтый цвет.
38.
Подлинность:2. Открытие борат – иона:
a. раствор препарата, подкисленный соляной кислотой
окрашивает куркумовую бумагу в розовый цвет или буроватокрасный цвет, особенно заметный после подсушивания. При
смачивании раствором аммиака окраска переходит в
зеленовато-черную.
39.
Подлинность:40.
Подлинность:b. получение борно-этилового эфира
Т.В.:
в тигель помещают лекарственное средство, добавляют
концентрированную серную кислоту и спирт. При поджигании
смесь горит пламенем с зеленой каймой
Химизм: Na2B407 * 10Н2O + H2SO4 = 4Н3ВO3 + NaSO4 + 5Н2O
В
OH
HO - C2H5
OH + HO - C2H5
HO - C2H5
OH
H2SO4
конц.
В
O - C 2H5
O - C 2H 5
O - C 2H 5
+ 3H2O
41.
Количественное определение:Кислотно - основное титрование. Метод ацидиметричесий.
Метод основан на свойстве солей, образованных катионом
сильного основания и анионом слабой кислоты
Титрование прямое;
Рабочий раствор - 0,1М раствор хлороводородной
кислоты;
Индикатор - метиловый оранжевый
42.
Количественное определение:ГФ: кислотно - основное титрование. Метод ацидиметричесий.
Метод основан на свойстве солей, образованных катионом
сильного основания и анионом слабой кислоты
Титруют от желтой до розовой окраски раствора
43.
Количественное определение:Т.В.:
в колбу для титрования поместить точную навеску
лекарственного средства, растворить в воде, добавить 2
капли индикатора и титровать ОДМ раствором
хлороводородной кислоты от желтой до розовой окраски
раствора от лишней капли рабочего раствора
Химизм: Na2B4O7 + 2HCl + 5H2O → 2NaCl + 4Н3ВO3
В точке эквивалентности, когда все лекарственное средство
оттитруется, избыточная капля рабочего раствора создаст кислую
реакцию среды и индикатор изменит свой цвет
Расчет ведут по формуле:
То * V * К * 100
%С =
а
44.
Хранение:По общему списку. В хорошо укупоренных склянках, т.к.
препарат выветривается
Применение:
Антисептическое Применяют наружно как
средство
антисептическое средство у взрослых
для полосканий, смазывания кожи
(при опрелостях, пролежнях),
спринцеваний
45.
Форма выпуска:Порошок;
20% р-р в глицерине;
Входит в состав таблеток «Бикарминт»
Форма отпуска:
Порошок;
Растворы спирто-глицериновые, глицериновые;
Сложные таблетки, «Бикарминт»
Примеры:
Возьми: Раствора кислоты борной 2% – 10мл
Д.О.:
По 1 капле в оба глаза 3 раза в день
46.
По приказу № 751-Н данная лекарственная формаподвергается обязательно::
письменному контролю;
органолептическому контролю;
полному химическому контролю до
стерилизации выборочно;
обязательно контролю при отпуске.
47.
Предварительный расчет:1. Сколько граммов кислоты борной содержится в лекарственной форме по
рецепту?
2,0 * 10
2,0 – 100 мл
Х – 10 мл
Х=
= 0,2
100
2. Чему равна навеска ЛФ для анализа?
B = 1 мл
3. Сколько граммов кислоты борной содержится в навеске ЛФ?
2,0 – 100 мл
Х – 1 мл
Х=
2,0 * 1
= 0,02
100
4. Сколько мл 0,1 моль/л раствора натрия гидроксида пойдет на титрование
навески, если Т0 = 0,00618 г/мл.
1 мл 0,1 моль/л NaOH оттитровывает 0,00618 г кислоты борной
х мл 0,1 моль/л NaOH оттитровывает 0,02 г кислоты борной
Х=
1 * 0,02
0,00618
= 3,236 или 3,24 мл
Вывод: Расход рабочего раствора не укладывается в интервал 1 - 3 мл, а
именно больше 3 мл. Для данной лекарственной формы надо
уменьшить навеску в 2 раза. Тогда расход рабочего раствора
уменьшится в 2 раза, то есть составит 3,24 : 2 = 1,62 мл.
Следовательно, на титрование берем навеску 0,5 мл и титруем 0,1
моль/л рабочим раствором.
48.
Расчет интервала расхода рабочего раствора :По приказу №751-Н допустимое отклонение на вес
0,2 составляет + 10%. (строка свыше 0,1 до 0,2
включительно).
A min = 1,62 * 0,9 = 1,458 « 1,46 мл
А mах = 1,62 * 1,1 = 1,782 * 1,78 мл
Титруем из пипетки на 2 мл.
















































 Химия
Химия








