Похожие презентации:
e7acf692b6e642c6a8161a13d0e92dd4
1.
Тема урока :Основания
2.
Основаниями называютсясложные неорганические
соединения состоящие из
атома металла и одной или
нескольких гидроксильных
групп ОН .
Ме(ОН)n
3.
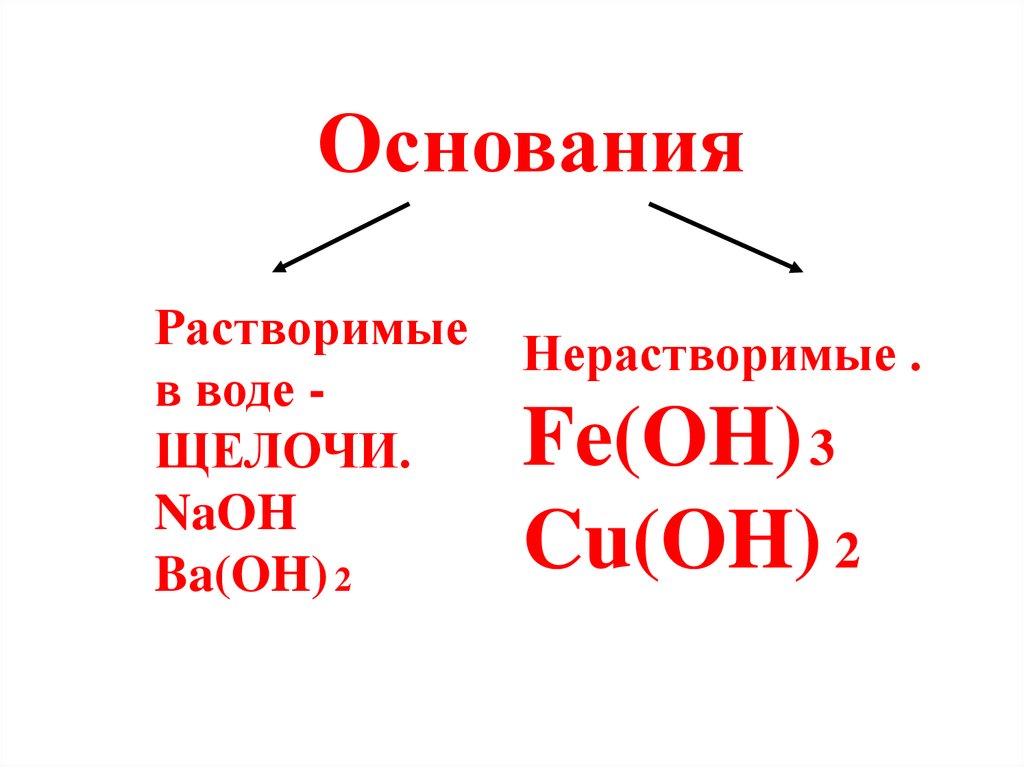
ОснованияРастворимые
в воде ЩЕЛОЧИ.
NaOH
Ba(OH) 2
Нерастворимые .
Fe(OH) 3
Cu(OH) 2
4.
Щёлочи разъедают кожу,ткани, бумагу.
Осторожно!
При попадании на кожу,
промыть большим
количеством воды,
нейтрализовать. Раствором
уксуса или борной кислоты.
5.
Химическиесвойства .
6.
Щёлочи1.Щёлочи изменяют окраску
индикаторов:
Лакмус-синий
Метилоранж-жёлтый
Фенолфталеин-малиновый
7.
2.Реакция нейтрализацииМе(ОН) +HR=H2O+MeR
n
2NaOH+H2SO4=Na2SO4+2H2O
!
Осторожно !
Едкие вещества !
8.
Реакция междущелочью и кислотой в
результате которой
образуется соль и воданазывается реакцией
нейтрализации.
9. 3. Щелочь взаимодействует с кислотным оксидом
Ме(ОН)n+ЭО=МеА+H2OCa(OH)2+CO2=CaCO3+H2O
10. 4. Щелочи взаимодействуют с растворимыми солями, если образуется нерастворимое основание
Me(OH)n + Me1A = Me1(OH)n + MeA2NaOH + CuCl2 = Cu(OH)2 + 2NaCl
11.
Нерастворимыеоснования .
Реакция с кислотой .
1.
Ме(ОН) +HА=MeА+H O
n
2
Fe(OH)2+H2SO4=FeSO4+2H2O
12.
2.Термическое разложение.Ме(ОН)n MeO+H2O
Cu(OH)2=CuO+H2O
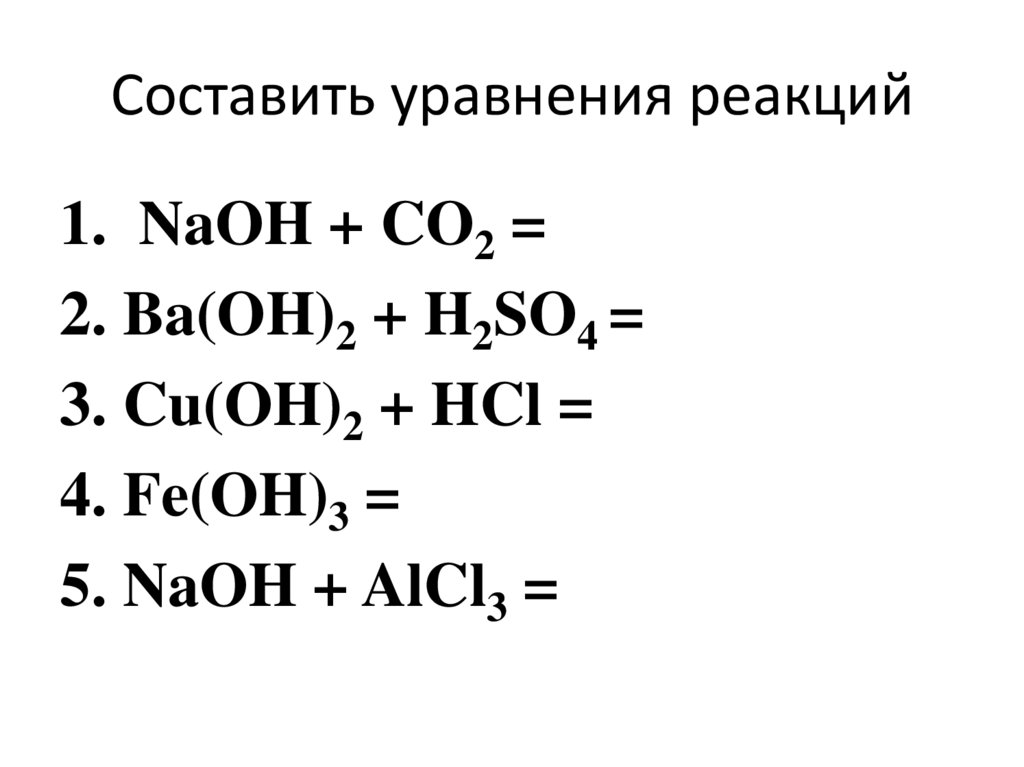
13. Составить уравнения реакций
1. NaOH + CO2 =2. Ba(OH)2 + H2SO4 =
3. Cu(OH)2 + HCl =
4. Fe(OH)3 =
5. NaOH + AlCl3 =
14. Составить уравнения реакций 8 б
1 вариантСоставить уравнения реакций 8 б
1. Гидроксид натрия с
углекислым газом
2. Гидроксид кальция с
соляной кислотой
3. Гидроксид железа (III) с
серной кислотой
4. Гидроксид калия с
сульфатом алюминия
5. Разложение гидроксида
свинца (II) при
нагревании.
2 вариант
1. Гидроксид калия с
нитратом цинка.
2. Гидроксид натрия с
серной кислотой
3. Гидроксид бария с
углекислым газом
4. Разложение
гидроксида железа (II)
при нагревании.
5. Гидроксид меди(II) с
соляной кислотой.












 Химия
Химия








