Похожие презентации:
f82327296d3f412ba7dd59591bf67ed4
1.
Классификация неорганическихсоединений и их свойства.
Основания в свете теории ЭД
Айрапетян Л.Р.
2020 г
2.
Основания в свете теории ЭДОснования — это электролиты, которые
диссоциируют на катионы металла и анионы
гидроксогрупп.
3.
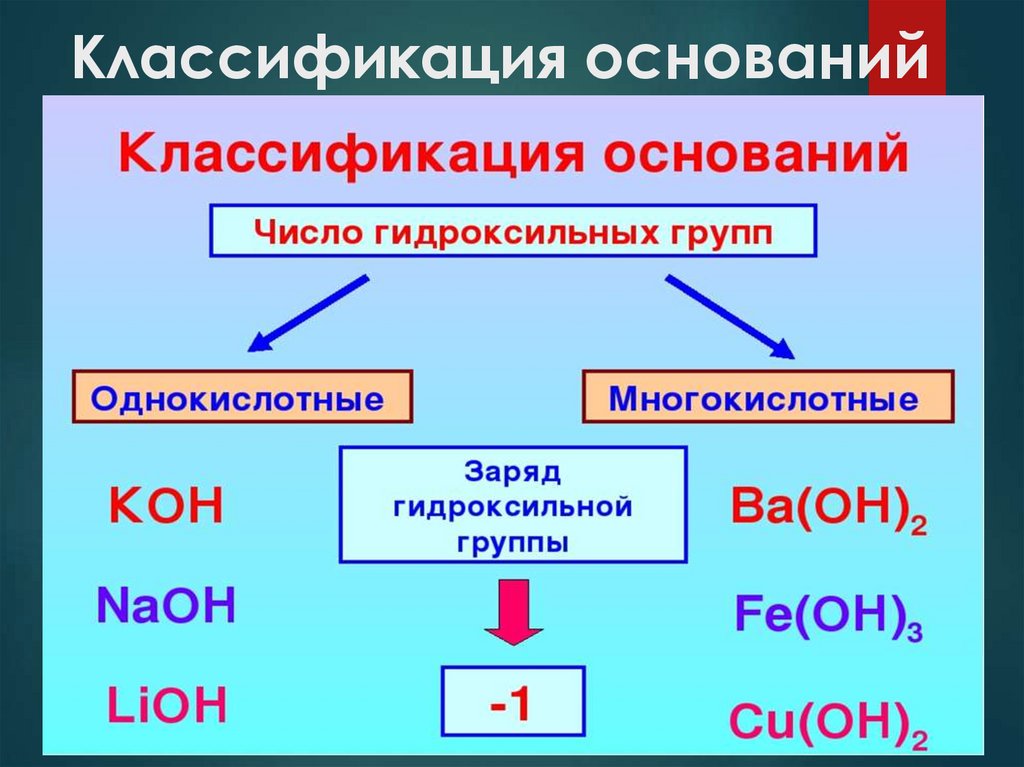
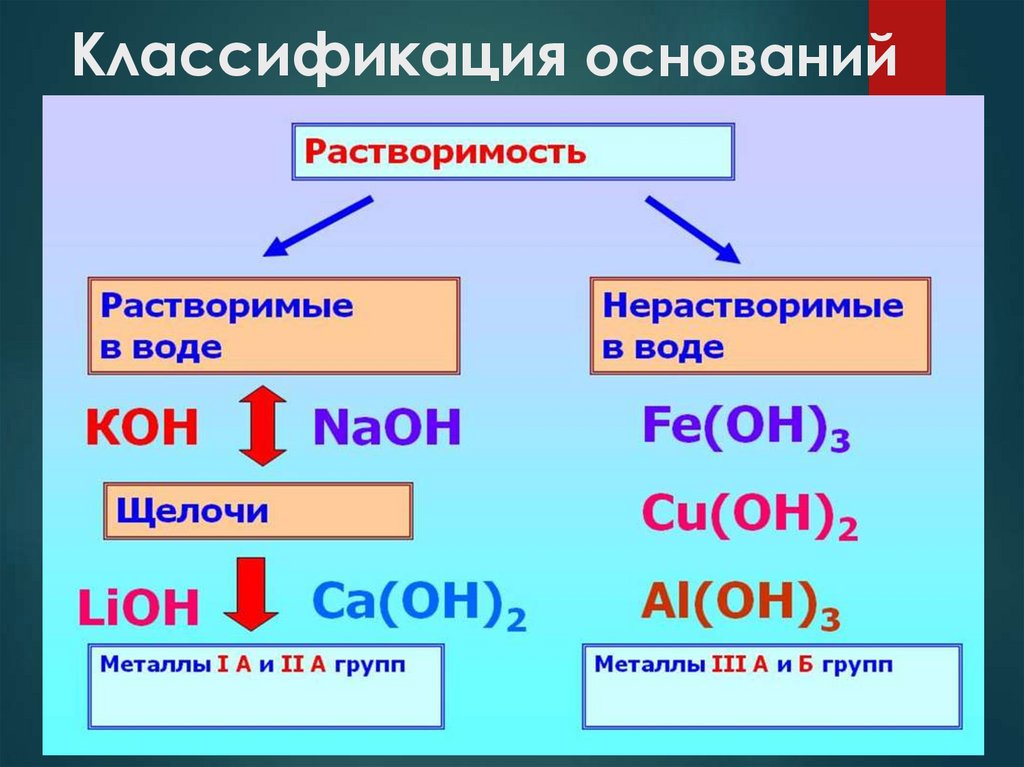
Классификация оснований4.
Классификация оснований5.
Классификация оснований6.
Классификация оснований7.
Классификация основанийПризнак
Наличие
кислорода
Группа оснований
атома Кислородсодержащие
Бескислородные
Примеры
КOH, Cа(OH)2
NH3·H2O
Кислотность
(число Однокислотные
групп
ОН
или
Двухкислотные
присоединяемых
ионов водорода)
Растворимость
Растворимые
Нерастворимые
NaOH, КOH, NH3·H2O
Летучесть
Летучие
Нелетучие
NH3·H2O
NaOH, Cа(OH)2
Степень ЭД
Сильные (α→1)
Слабые (α→0)
LiOH, NaOH, Cа(OH)2
NH3·H2O
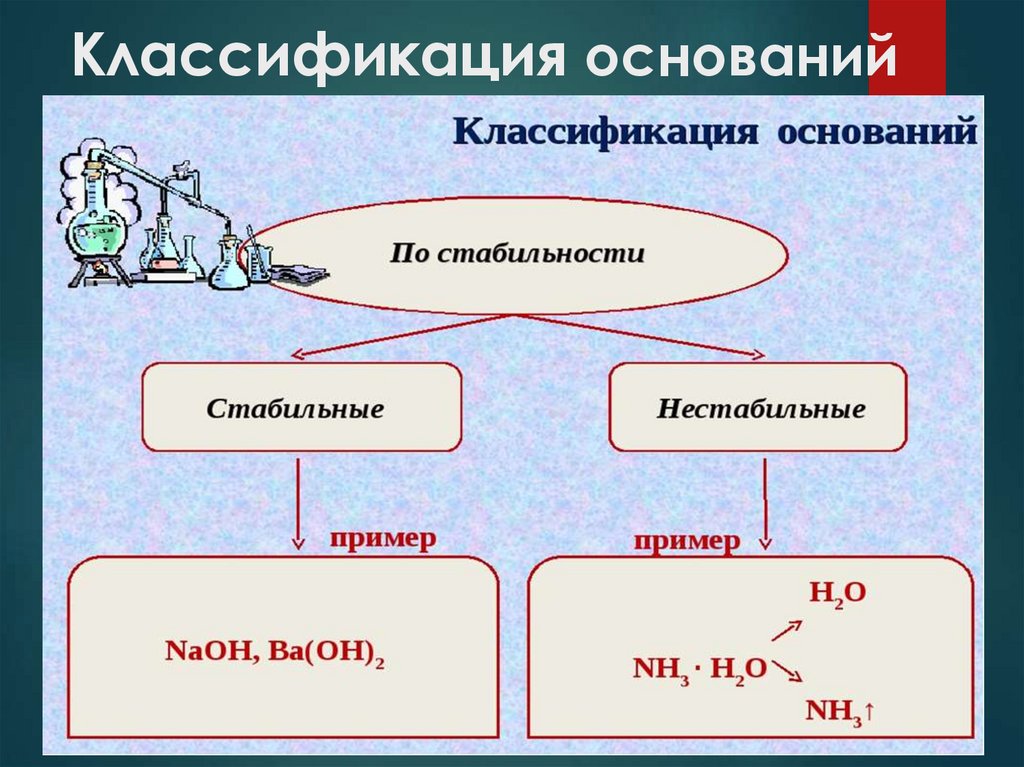
Стабильность
Стабильные
Нестабильные
КOH, Ва(OH)2
NH3·H2O
Cа(OH)2, Mg(OH)2
NaOH, КOH, Ва(OH)2
Cr(OH)2, Mn(OH)2
8.
Химические свойства оснований1. Растворы оснований действуют на индикаторы.
Индикаторы меняют свою окраску в зависимости
от взаимодействия с разными химическими
веществами. При взаимодействии с основаниями
они меняют свою окраску: индикатор метиловый
оранжевый окрашивается в жёлтый цвет,
индикатор лакмус – в синий цвет, а
фенолфталеин - в малиновый цвет.
9.
Химические свойства оснований2. Взаимодействуют с кислотными оксидами с
образованием соли и воды. Это свойство характерно
для щелочей.
2 Cа(OH)2 + СO2 = СaСO3 ↓+ H2O.
3. Вступают в реакцию с кислотами, образуя соль и
воду. Реакция взаимодействия основания с кислотой
называется реакцией нейтрализации, так как после
её окончания среда становится нейтральной:
Ва(OH)2
Fe(OH)3
+ 2HNO3 = Ва(NO3)2 + 2H2O. (щелочи)
+ 3HCl = FeCl3 + 3H2O. (нерастворимые
основания)
10.
Химические свойства оснований4. Реагируют с солями, образуя новые соль и
основание. В результате реакции должны
образоваться осадок или газ.
FeCl3 + 3NaOH = Fe(OH)3↓ + NaCl. (образование
осадка)
NH4Cl + KOH = KCl + NH3↑ + H2O (образование газа)
5. Нерастворимые основания способны при
нагревании разлагаться на воду и основный оксид:
Cu(OH)2 = CuO + H2O.
11.
Способы получения оснований1. Электролиз растворов солей щелочных металлов.
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑ (промышленный
способ)
2. Обжиг карбонатов щелочноземельных металлов с
последующим гашением образующихся оксидов
водой.
СaСO3 = CаO + СO2 ↑
CаO + Н2O = Cа(OH)2
3. Взаимодействие щелочных (литий, натрий, калий.
рубидий, цезий) и щелочноземельных (кальций,
стронций и барий) металлов с водой.
Калий реагирует с водой очень бурно:
2K + 2H2O = 2KOH + H2 ↑
12.
Способы получения оснований4. Взаимодействие основных оксидов с водой. При
этом с водой реагируют в обычных условиях только те
оксиды, которым соответствует растворимое
основание (щелочь). Т.е. таким способом можно
получить только щёлочи:
Оксид натрия в воде образует гидроксид натрия
(едкий натр):
Na2O + H2O = 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
13.
Способы получения оснований5. Основания образуются при взаимодействии
других щелочей с солями. При этом
взаимодействуют только растворимые вещества, а в
продуктах должна образоваться нерастворимая
соль, либо нерастворимое основание:
K2CO3 + Ca(OH)2 = CaCO3↓ + 2KOH
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
14.
Домашнее заданиеРаздел 5.2.
Упр.1- 4 стр. 82.












 Химия
Химия