Похожие презентации:
d4bbee923f04432aabe2996fe1d770db
1.
Классификация химическихреакций
Айрапетян Л.Р.
2020 г
2. Классификация химических реакций
1. По составу и числу реагирующих и образующихсявеществ в неорганической химии различают реакции
соединения, разложения, замещения и обмена.
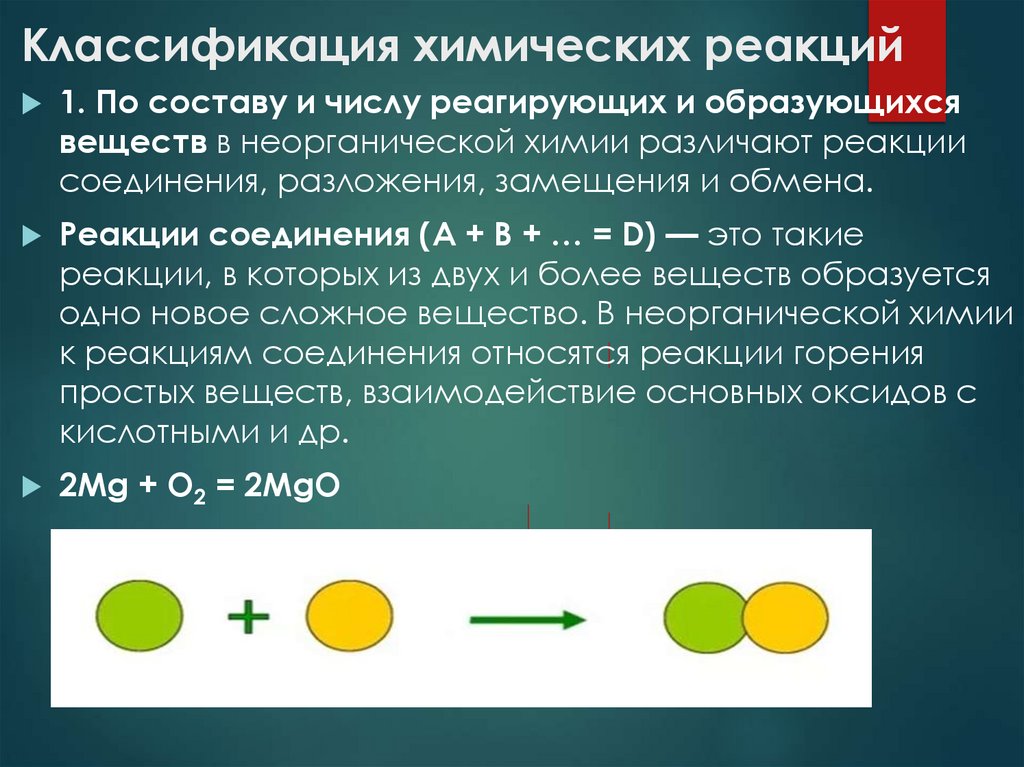
Реакции соединения (A + B + … = D) — это такие
реакции, в которых из двух и более веществ образуется
одно новое сложное вещество. В неорганической химии
к реакциям соединения относятся реакции горения
простых веществ, взаимодействие основных оксидов с
кислотными и др.
2Mg + O2 = 2MgO
3. Классификация химических реакций
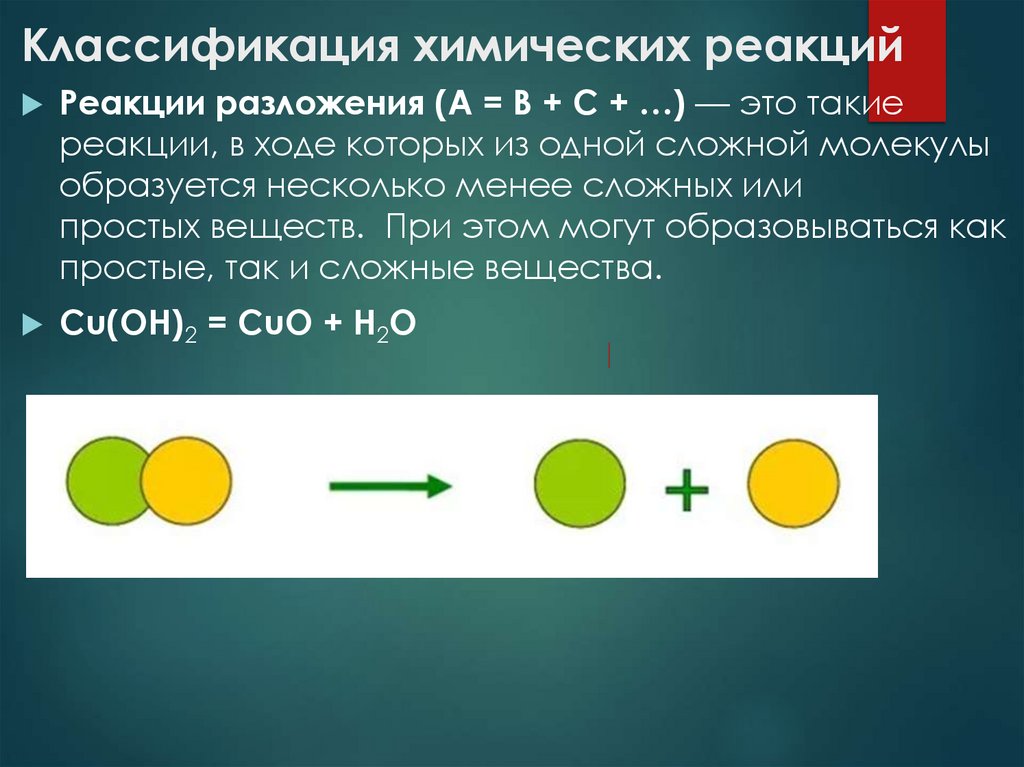
Реакции разложения (A = B + C + …) — это такиереакции, в ходе которых из одной сложной молекулы
образуется несколько менее сложных или
простых веществ. При этом могут образовываться как
простые, так и сложные вещества.
Cu(OH)2 = CuO + H2O
4. Классификация химических реакций
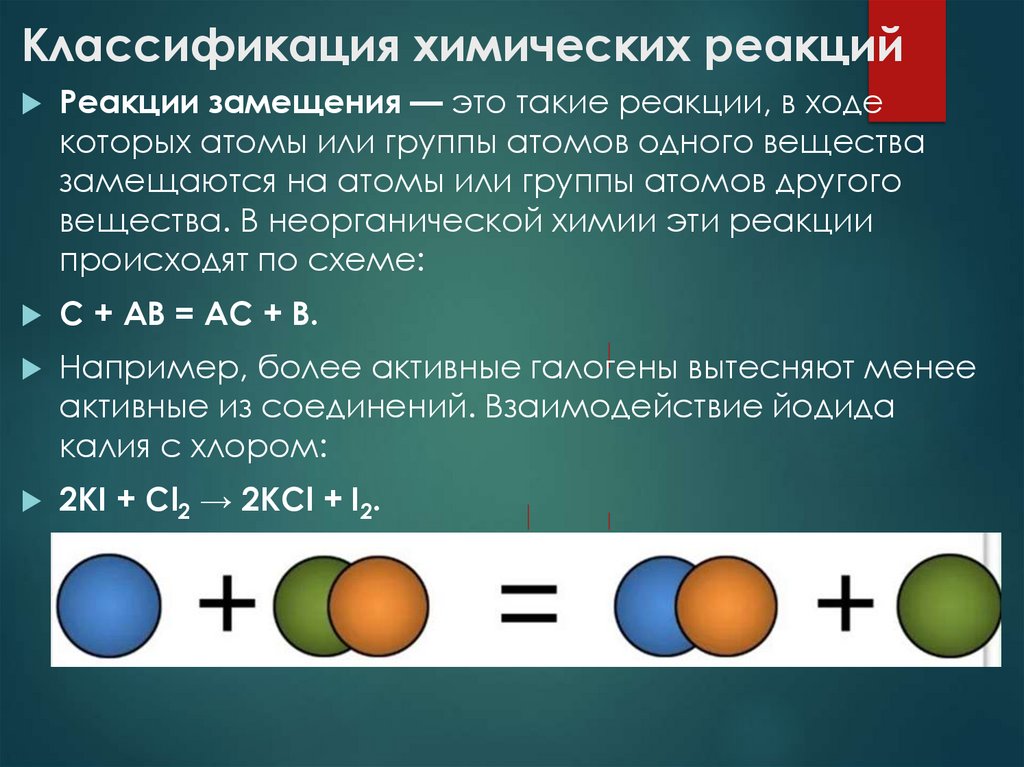
Реакции замещения — это такие реакции, в ходекоторых атомы или группы атомов одного вещества
замещаются на атомы или группы атомов другого
вещества. В неорганической химии эти реакции
происходят по схеме:
C + AB = AC + B.
Например, более активные галогены вытесняют менее
активные из соединений. Взаимодействие йодида
калия с хлором:
2KI + Cl2 → 2KCl + I2.
5. Классификация химических реакций
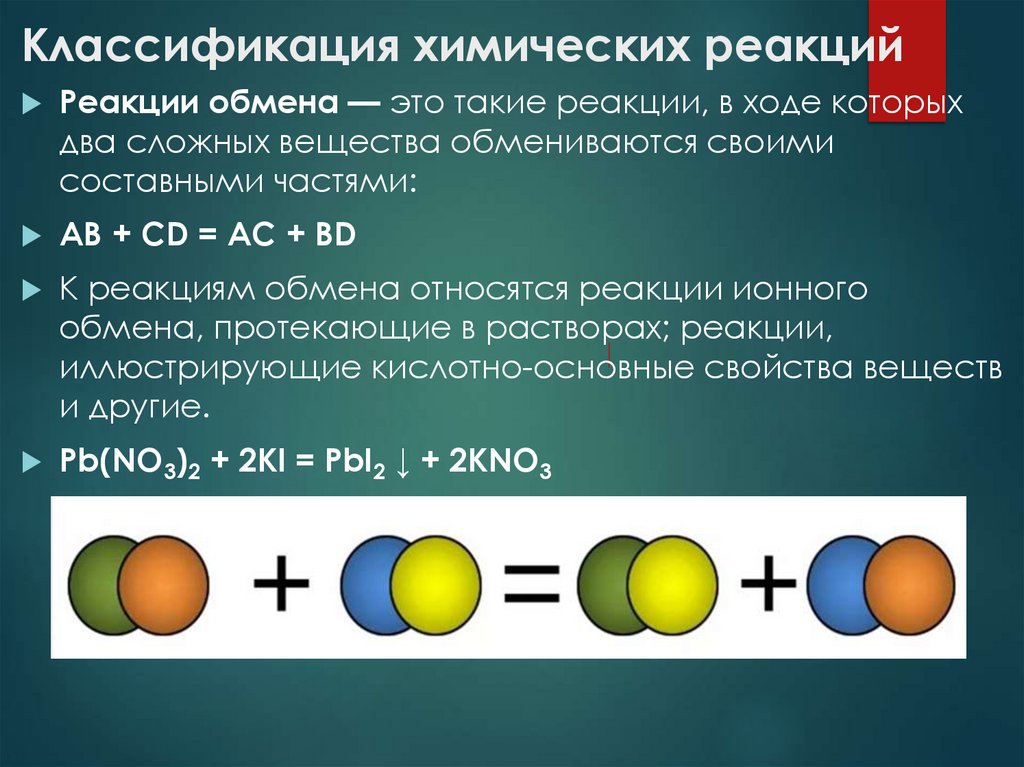
Реакции обмена — это такие реакции, в ходе которыхдва сложных вещества обмениваются своими
составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного
обмена, протекающие в растворах; реакции,
иллюстрирующие кислотно-основные свойства веществ
и другие.
Pb(NO3)2 + 2KI = PbI2 ↓ + 2KNO3
6. Классификация химических реакций
Особый тип реакции обмена между растворами кислоти щелочей — реакция нейтрализации:
H2 SO4 + KОН = К2SO4 + 2H2O
2. По участию катализатора различают каталитические
и некаталитические реакции.
Катализатор — это такое вещество, которое ускоряет
реакцию, но не входит в состав продуктов реакции.
Катализатор участвует в реакции, но практически не
расходуется в ходе реакции.
Каталитические реакции — это реакции, которые идут с
участием катализаторов. Например, синтез аммиака в
присутствии катализатора - железа:
N2 + 3H2 = 2NH3
7. Классификация химических реакций
Некаталитические реакции — это реакции, которыеидут без участия катализатора. Например,
взаимодействие железа с соляной кислотой
некаталитическая реакция:
Fe + 2HCl = FeCl2 + H2↑
3. По способности протекать в двух противоположных
направлениях – обратимые и необратимые реакции.
Обратимые реакции — это реакции, которые могут
протекать и в прямом, и в и обратном направлении, т.е.
когда при данных условиях продукты реакции могут
взаимодействовать друг с другом. Например, синтез
аммиака протекает в прямом и обратном
направлении.
N2 + 3H2 ↔ 2NH3
8. Классификация химических реакций
Необратимые реакции — это реакции, которые протекаютпреимущественно в одном направлении, т.е. продукты
реакции не могут взаимодействовать друг с другом при
данных условиях. Например
MgO + H2 SO4 = MgSO4 + H2O
4. По агрегатному состоянию реагирующих веществ (по
фазовому составу) разделяют реакции гомогенные и
гетерогенные.
Гомогенные реакции — это такие реакции, в которых
реагирующие вещества и продукты находятся в одной
фазе. К гомогенным реакциям относят взаимодействия
жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
9. Классификация химических реакций
Гетерогенные реакции — это реакции, в которыхреагирующие вещества и продукты находятся в разных
фазах. К таким реакциям относятся взаимодействия газжидкость, газ-твердая фаза, твердая-твердая, и твердая
фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида
кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
5. По тепловому эффекту реакции разделяют на
экзотермические и эндотермические.
Экзотермические реакции — это реакции,
сопровождающиеся выделением энергии в форме теплоты
(+Q). К таким реакциям относятся почти все реакции
соединения.
Например, горение метана:
CH4 + 2O2 = CO2 + 2H2O + 800 кДж
10. Классификация химических реакций
Эндотермические реакции — это реакции,сопровождающиеся поглощением энергии в форме
теплоты (- Q). Как правило, с поглощением теплоты
идет большинство реакций разложения. Например,
разложение известняка:
CaCO3 = CaO + CO2 – 187 кДж
6. По изменению степени окисления элементов
химические реакции делят на окислительновосстановительные реакции, и реакции, идущие без
изменения степеней окисления химических
элементов.
11. Классификация химических реакций
Окислительно-восстановительные реакции (ОВР) — этореакции, в ходе которых степени окисления веществ
изменяются. При этом происходит обмен электронами.
+3
-2
0
0
+3
-2
Fe2O3 + 2Al = 2Fe + 2Al2O3
0
+3
Al -3e → Al
Элемент, отдающий электроны, называется
восстановителем, сам он при этом окисляется.
+3
0
Fe + 3e → Fe
Элемент, принимающий электроны, называется
окислителем, сам он при этом восстанавливается.
12. Домашнее задание
Раздел 6.1.Упр.1- 3, 6, 7 стр. 103,104.









 Химия
Химия








