Похожие презентации:
СОЕДИНЕНИЯ УГЛЕРОДА1
1. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ УГЛЕРОДА
2. Выберите из предложенных утверждений только те, которые справедливы: I вариант – для алмаза II вариант – для графита
1. Прозрачный, бесцветный.2. Очень твердый.
3. Ковалентная неполярная связь.
4. Не проводит электрический ток.
5. Используют как добавку в смазке.
6. Непрозрачный, серого цвета, с металлическим блеском.
7. Электропроводен.
8. Атомная кристаллическая решетка.
9. Легко расслаивается на отдельные мельчайшие пластинки.
10.При обычных условиях химически инертен, при высокой
температуре становится активным.
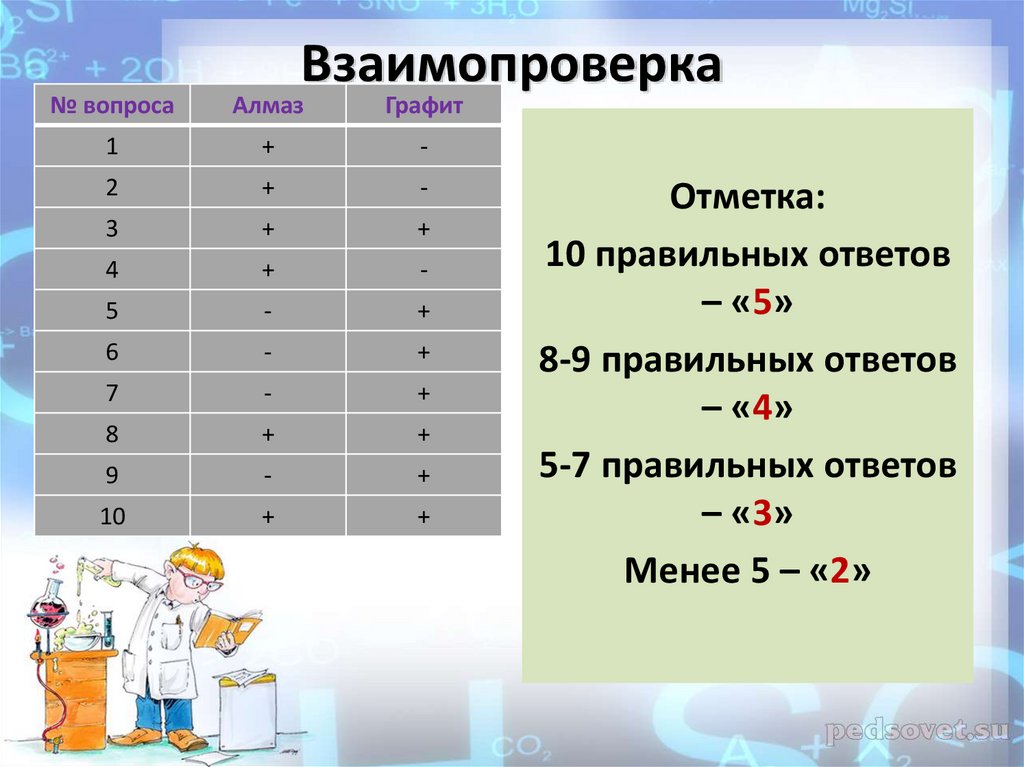
3. Взаимопроверка
№ вопросаАлмаз
Графит
1
+
-
2
+
-
3
+
+
4
+
-
5
-
+
6
-
+
7
-
+
8
+
+
9
-
+
10
+
+
Отметка:
10 правильных ответов
– «5»
8-9 правильных ответов
– «4»
5-7 правильных ответов
– «3»
Менее 5 – «2»
4.
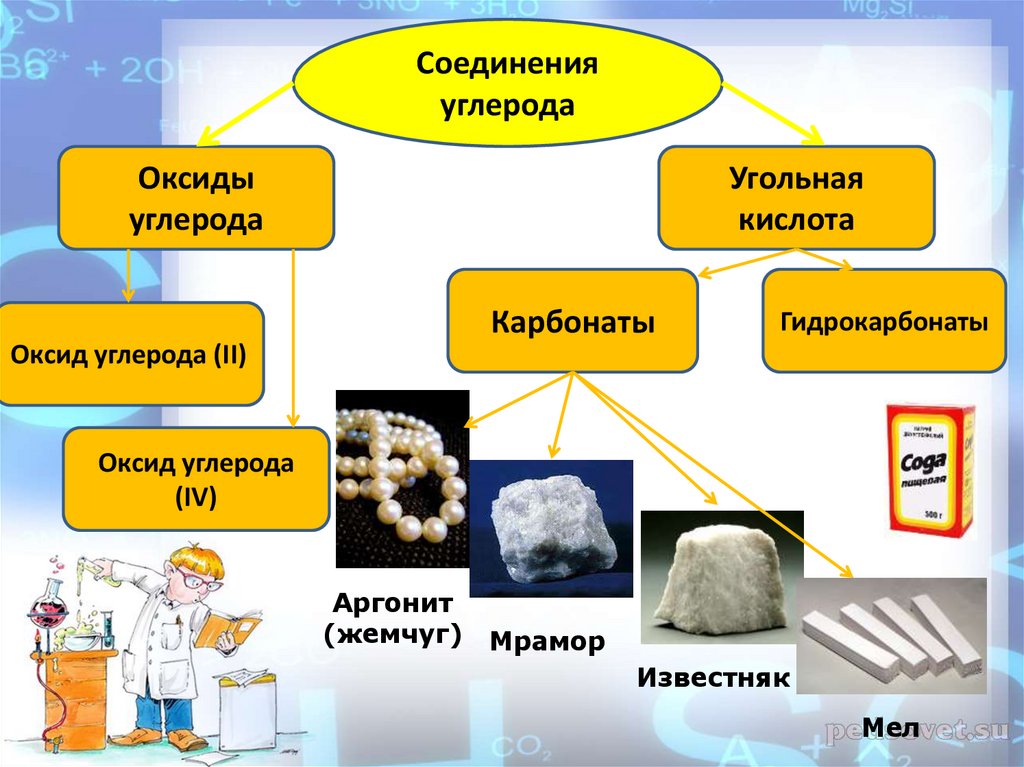
Соединенияуглерода
Оксиды
углерода
Угольная
кислота
Карбонаты
Гидрокарбонаты
Оксид углерода (II)
Оксид углерода
(IV)
Аргонит
(жемчуг)
Мрамор
Известняк
Мел
5. ФИЗИЧЕСКИЕ СВОЙСТВА
СвойстваОксид углерода (II)
Формула
СО
СО2
Агрегатное состояние
Газ
Газ
Плотность по воздуху
0,97
1,5
Цвет
Бесцветный
Бесцветный
Вкус
Нет
Нет
Запах
Нет
Нет
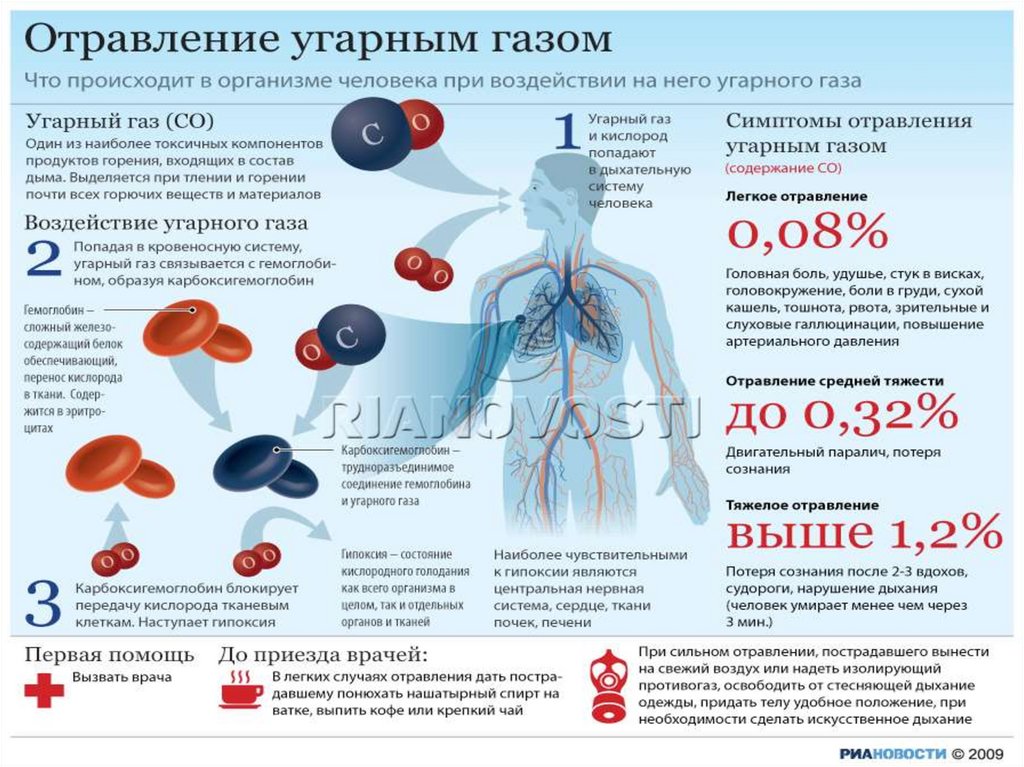
Токсичность
Характер оксида
Оксид углерода (IV)
Очень ядовит
Не токсичен
Несолеобразующий
Кислотный
6.
7. ПОЛУЧЕНИЕ
Оксид углерода (II) - СО Оксид углерода (IV) - СО21) С + О2 = 2СО +Q
( недостаток О2)
2) В промышленности:
С + СО2 → 2СО - 175 kДж
1) С + О2 = СО2 +Q
(избыток О2)
2) В промышленности:
t
СаСО3 → СаО + СО2
3) В лаборатории:
СаСО3 +2НСl → СаСl2 +Н2О + СО2
۟
8. ХИМИЧЕСКИЕ СВОЙСТВА
Оксид углерода (II)- СО Оксид углерода (IV)- СО2СО2 – кислотный оксид
неподдерживает горение!(кроме Mg)
СО – несолеобразующий 1 )Взаимодействует с водой
оксид
1) Горит синим пламенем
СО + О2 → 2СО2 +572кДж
2) С галогенами
СО + Сl2 → СОCl2 (фосген –
ЯД! )
3) СО - восстановитель
СО +СuO →Cu + CO2
Fe2O3 + 3CO = 2Fe + 3CO2
СО2 + Н2О
Н2СО3
2) Взаимодействует со щелочами
СО2 +2NaОН→ Na2СО3 + Н2О
СО2 + NaОН→ NaНСО3(изб.СО2)
Качественная реакция:
СО2 +Сa(ОН)2→ СаСО3 ↓ + Н2О
3) Взаимодействует с оксидами
СО2 + ВaО→ ВaСО3
4) СО2 –окислитель
2Мg + CO2 →2MgO + C
9.
Нестойкая, разлагается:СО2 + Н2О = Н2СО3
Н2СО3 = СО2 + Н2О
Образует два типа солей:
10.
CaCO3 + H2O + CO2 = Ca(HCO3)2временная жесткость водыCa(HCO3)2 = CaCO3 + H2O + CO2
11. Наличие карбонатов и гидрокарбонатов в воде делает её жесткой. В ней плохо мылится мыло, на стенках чайников и паровых котлов
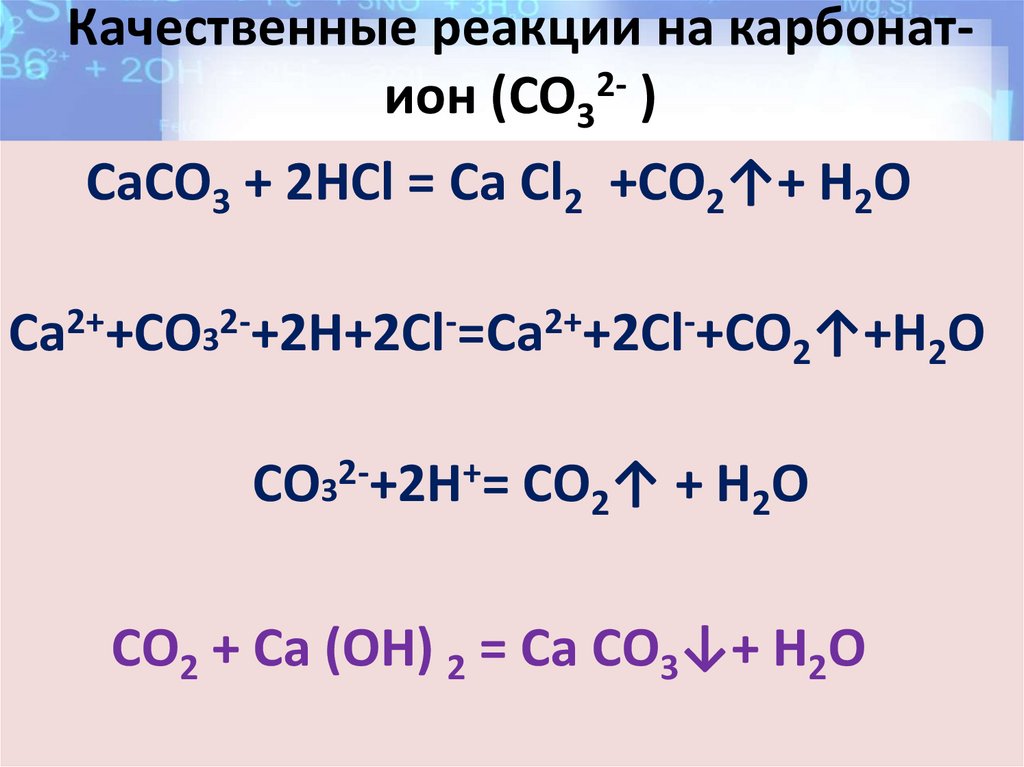
образуется накипь12. Качественные реакции на карбонат- ион (CO32- )
Качественные реакции на карбонатион (CO32- )CaCO3 + 2HCl = Ca Cl2 +CO2↑+ H2O
Ca2++CO32-+2H+2Cl-=Ca2++2Cl-+CO2↑+H2O
CO32-+2H+= CO2↑ + H2O
CO2 + Ca (OH) 2 = Ca CO3↓+ H2O
13.
• Соли кальция и магния - хлориды исульфаты- придают воде постоянную
жёсткость.
• Кипячением постоянную жёсткость воды
устранить нельзя. Приходится использовать
другой карбонат - соду Na2CO3, которая
переводит ионы Са2+ в осадок:
СаСl2+ Na2CO3 = CaCO3 ↓ + 2NaCl
14. Сталактиты и сталагмиты
15.
16. ПРИМЕНЕНИЕ СО
Производство чугунаи метанола
17. ПРИМЕНЕНИЕ СО2
18. На земле живут три брата Из семейства карбонатов. Старший брат – красавец Мрамор, Славен именем Каррары. Превосходный зодчий,
СаСО3На земле живут три брата
Из семейства карбонатов.
Старший брат – красавец Мрамор,
Славен именем Каррары.
Превосходный зодчий, он
Строил Рим и Парфенон.
19. Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Строит он за домом дом.
СаСО320. И способен, и умел Младший мягкий братец Мел. Как рисует, посмотри, Этот СаСО3
21. Закрепление материала
Генетические ряды C+2, C+4. (работа в парах)Задание. Осуществить превращения:
1) C CO CO2 H2CO3
2) C2H2 CO2 CaCO3 CO2


















 Химия
Химия