Похожие презентации:
Углерод. Оксиды углерода. Угольная кислота. Карбонаты. Жёсткость воды
1.
Углерод.Оксиды углерода
2.
Строение атома6
C
12,011
IVA группа
3.
Аллотропные модификации углеродаи применение
4.
Химические свойства углерода5.
Применение углерода6.
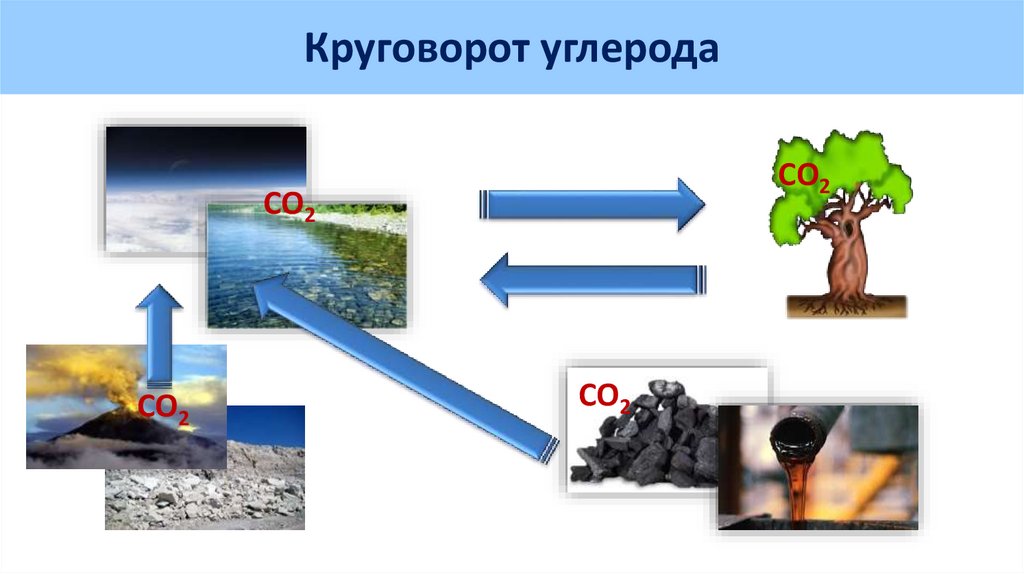
Круговорот углеродаCO2
CO2
CO2
CO2
7.
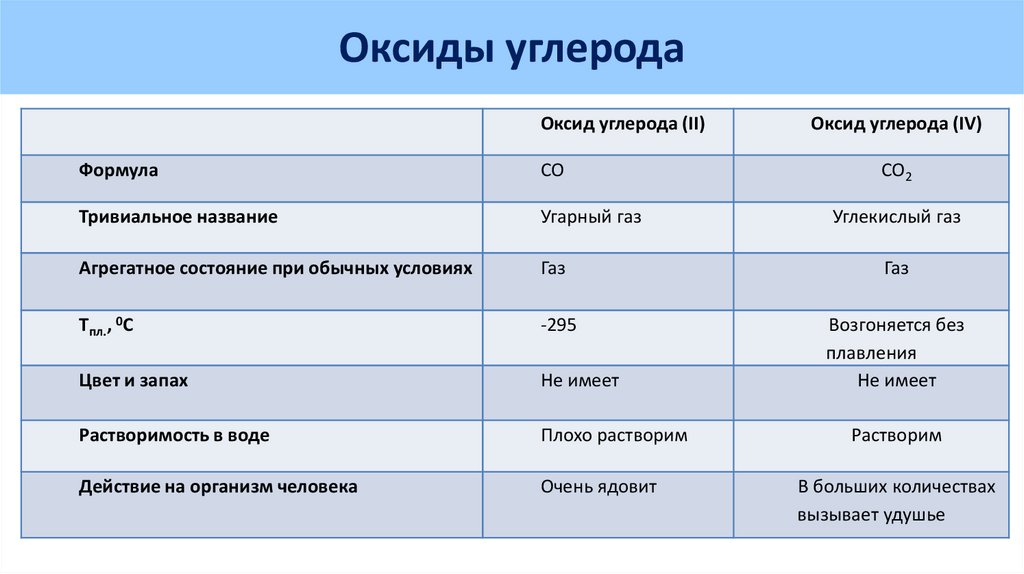
Оксиды углеродаОксид углерода (II)
Оксид углерода (IV)
Формула
СО
СО2
Тривиальное название
Угарный газ
Агрегатное состояние при обычных условиях
Газ
Газ
Tпл., 0С
-295
Цвет и запах
Не имеет
Возгоняется без
плавления
Не имеет
Растворимость в воде
Плохо растворим
Действие на организм человека
Очень ядовит
Углекислый газ
Растворим
В больших количествах
вызывает удушье
8.
Химические свойства оксида углерода (II)Получение СО
Горение в кислороде
t +2
2С + О2 (нед) = 2СО
+2
2ē
0
t +4 -2
2CO + O2 = 2CO2
Восст-ль Ок-ль
Восстановление металлов из
оксидов
+3
2ē
+2
t
0
+4
Fe2O3 + 3CO = 2Fe + 3CO2↑
Ок-ль
Восст-ль
9.
Физические свойства CO2При давлении около 60 атм. углекислый
газ превращается в бесцветную жидкость.
При испарении этой жидкости получается
снегообразная масса, которую называют
«сухой лёд», используемый для хранения
пищевых продуктов.
сухой лёд
Углекислый газ не горит и
не поддерживает горение.
CO2
10.
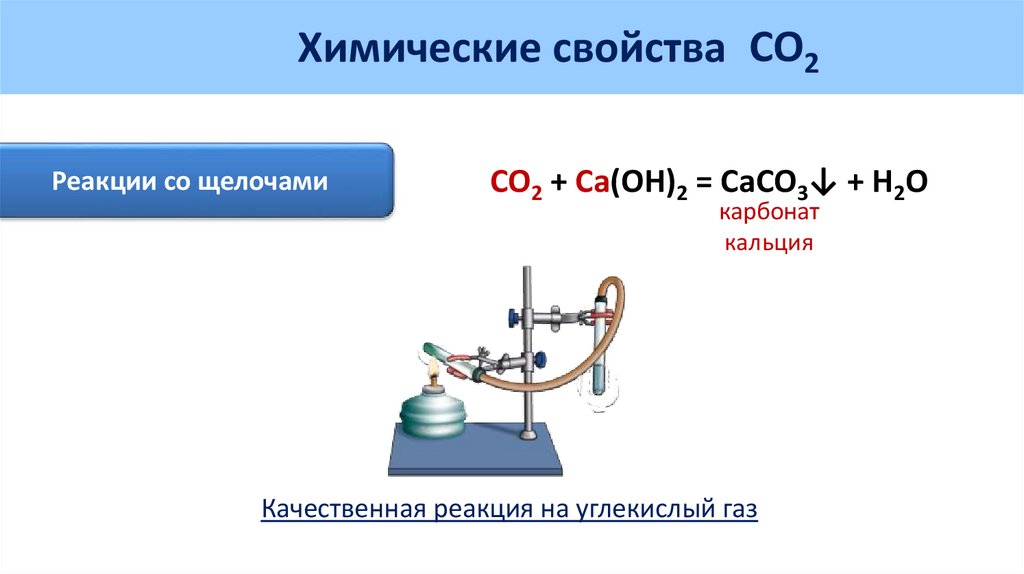
Химические свойства CO2Реакции со щелочами
CO2 + Ca(OH)2 = CaCO3↓ + H2O
карбонат
кальция
Качественная реакция на углекислый газ
11.
Химические свойства CO2Реакции
Реакция
со щелочами
с Mg
t
CO2 + 2Mg
Ca(OH)
= 2MgO
+ C3↓ + H2O
2 = CaCO
карбонат
кальция
Реакции с основными
оксидами
CO2 + MgO = MgCO3
Реакция с водой
CO2 + H2O ↔ H2CO3
t
карбонат
магния
угольная
кислота
12.
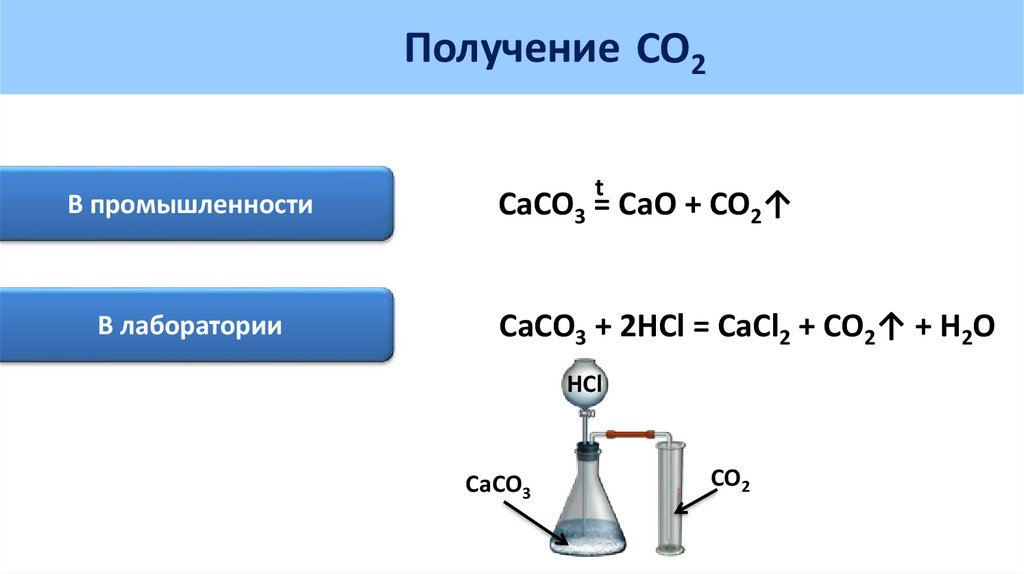
Получение CO2В промышленности
В лаборатории
t
CaCO3 = CaO + CO2↑
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
HCl
CaCO3
CO2
13.
Применение CO21
1. изготовление шипучих напитков
3
2. получение соды
3. создание «дыма» на сцене
2
4
5
4. для хранения мороженого
5. в пенных огнетушителях
14.
Угольная кислота.Карбонаты.
Жёсткость воды
15.
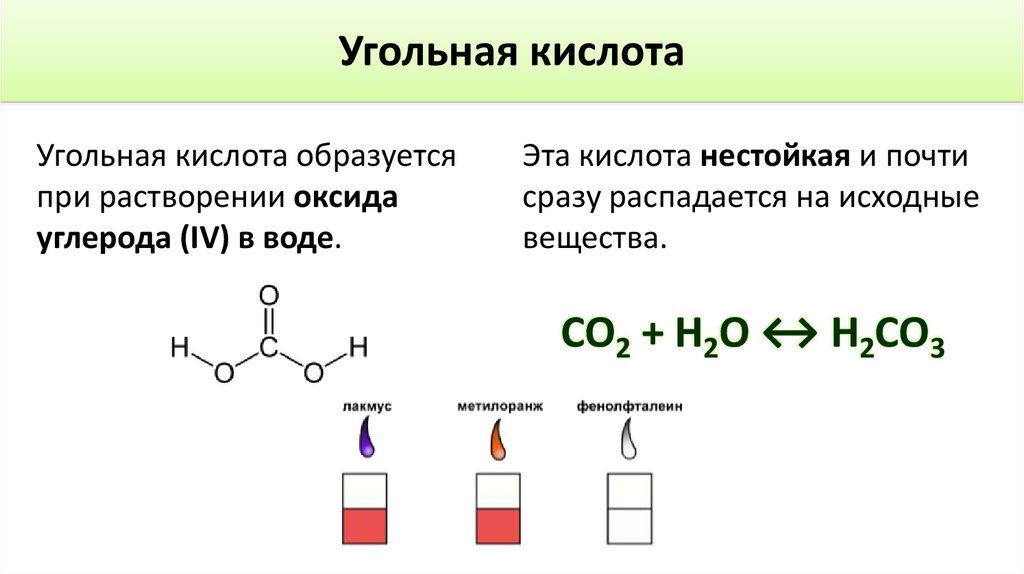
Угольная кислотаУгольная кислота образуется
при растворении оксида
углерода (IV) в воде.
Эта кислота нестойкая и почти
сразу распадается на исходные
вещества.
СО2 + Н2О ↔ Н2СО3
16.
Получение угольной кислоты и исследование еёсвойств
СО2 + Н2О ↔ Н2СО3
17.
Свойства угольной кислотыДиссоциация
Н2CO3 ↔ H+ + HCO3HCO3- ↔ H+ + CO32-
Соли
Средние
СаСО3 – карбонат кальция
Кислые
Са(НСО3)2 – гидрокарбонат кальция
18.
Соли угольной кислотыВ воде растворимы только карбонаты калия, натрия и
аммония.
Карбонаты других металлов нерастворимы в воде.
При нагревании эти карбонаты разлагаются на оксид металла
и углекислый газ.
t
MgCO3 = MgO + CO2↑
Кислые соли растворимы
t
CaCO3 = CaO + CO2↑
в воде.
t
(NH4)2CO3 = 2NH3↑ + CO2↑ + H2O
19.
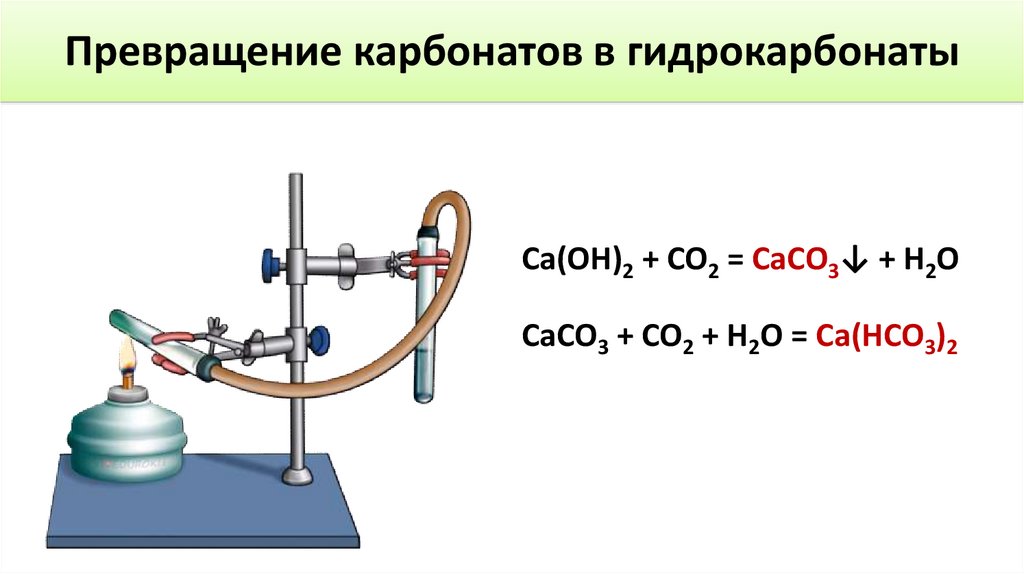
Превращение карбонатов в гидрокарбонатыCa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
20.
Жёсткость водыЖёсткость воды
Временная
Ca2+ HCO3Mg2+
Постоянная
t
Ca(HCO2)2 = CaCO3↓ + H2O + CO2↑
21.
Образование накипи на стенках котлов,чайников, труб парового отопления.
22.
Сталактиты и сталагмиты23.
Жёсткость водыЖёсткость воды
Временная
Постоянная
Mg2+
Ca2+
SO42-
Cl-
Na2CO3
сода
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
24.
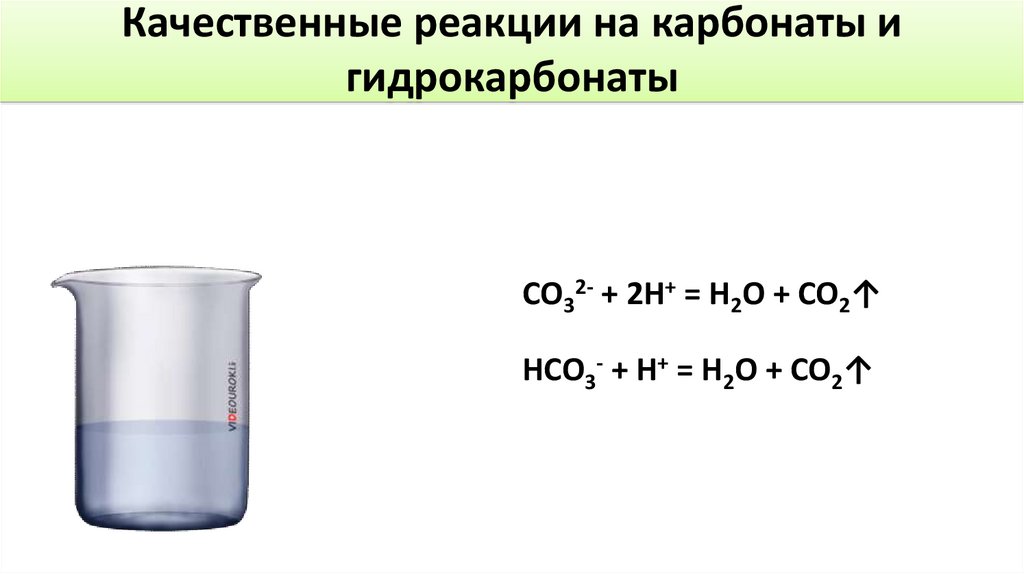
Качественные реакции на карбонаты игидрокарбонаты
CO32- + 2H+ = H2O + CO2↑
HCO3- + H+ = H2O + CO2↑
25.
Применение солей угольной кислотыNa2CO3 · 10H2O
кристаллическая сода
Na2CO3
кальцинированная сода
26.
Применение солей угольной кислотыNaHCO3
питьевая сода
K2CO3
поташ
27.
Применение солей угольной кислотыСаСО3
известняк,
или мрамор
28.
ВыводыУгольная кислота – это двухосновная слабая неустойчивая кислота.
Угольная кислота образуется при растворении в воде углекислого газа.
Она диссоциирует по двум ступеням.
Угольная кислота образует два типа солей – карбонаты и гидрокарбонаты.
Карбонаты многих металлов нерастворимы в воде и при нагревании
разлагаются, а гидрокарбонаты – это растворимые соли.
29.
ВыводыКарбонаты можно перевести в гидрокарбонаты и наоборот: для перевода
карбоната в гидрокарбонат через карбонат пропускают углекислый газ в
воде, а при нагревании гидрокарбонатов образуются карбонаты.
Различают
Качественными
реакциями
на карбонат
и гидрокарбонат-ион является
временную
и постоянную
жёсткость.
действие кислот на эти соли, при этом наблюдается бурное выделение
углекислого газа.
Временная жёсткость обусловлена наличием гидрокарбонатов кальция и
магния и устраняется кипячением, постоянная жёсткость обусловлена
солей кальция
и магния,
а устраняется
добавлением
наличием
Карбонатыдругих
и гидрокарбонаты
многих
металлов
находят широкое
соды.
применение во многих отраслях народного хозяйства.






















 Химия
Химия








