Похожие презентации:
Процессы и аппараты обогащения. Флотация
1. основы обогащения полезных ископаемых
ОСНОВЫ ОБОГАЩЕНИЯПОЛЕЗНЫХ ИСКОПАЕМЫХ
Лекция 5
Процессы и аппараты обогащения
Флотация
2. Флотация
• Единственный производительный процесс обогащениятонковкрапленных руд
• Флотация позволяет выделить из полезных ископаемых
свыше 100 минералов. С ее применением связано
получение в промышленных масштабах примерно 70 %
химических элементов Периодической системы элементов
Д.И. Менделеева.
• Процесс извлечения твердых минеральных частиц (реже
жидких) из тонкодисперсных трехфазных систем, основан
на различиях разделяемых частиц по смачиванию водой.
Плохо смачиваемые водой (гидрофобные) частицы при
столкновении с воздушными пузырьками
концентрируются на поверхности раздела фаз Ж- Г и
выводятся из пульпы в пену.
проф. Игнаткина В.А.,2017
2
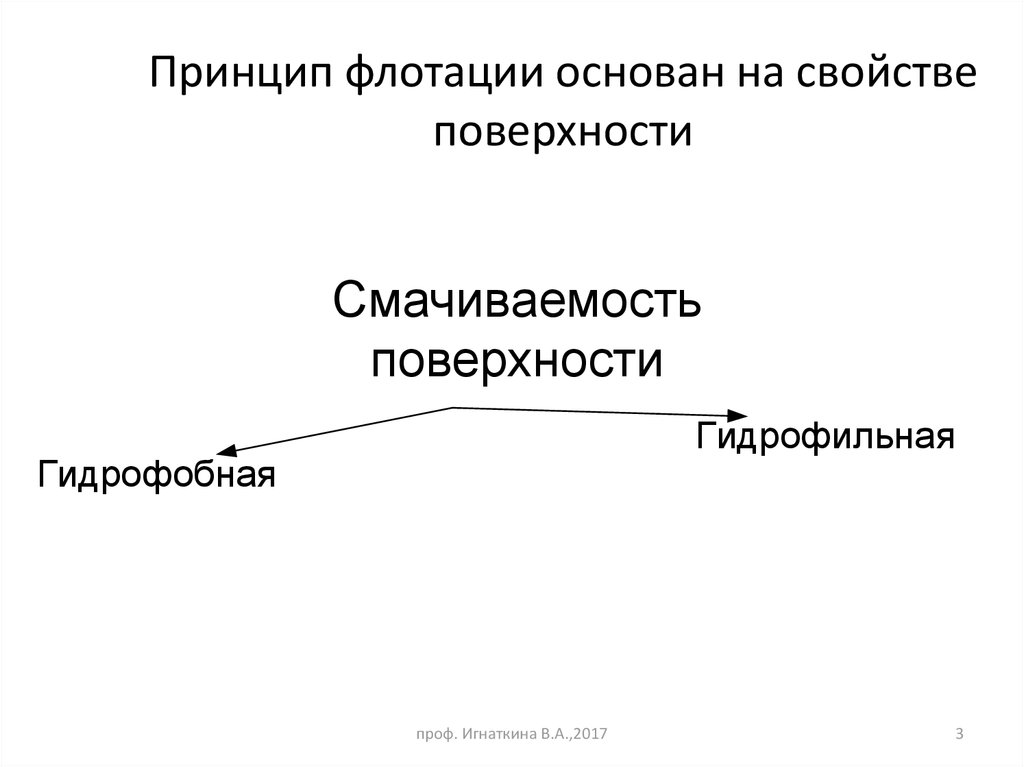
3. Принцип флотации основан на свойстве поверхности
Смачиваемостьповерхности
Гидрофильная
Гидрофобная
проф. Игнаткина В.А.,2017
3
4. Флотация
Положительные моменты• Высокая степень
концентрирования
• Высокая
производительность
• Высокая селективность
разделения
Отрицательные моменты
• Высокие удельные расходы
воды (2,5-4,0 м3/т)
• Организация складирования
отходов флотационного
обогащения (выход хвостов
от 60 до 98 %)
• Потери ценных компонентов
со сростками (>100 мкм) и
шламами (< 20 (10) мкм)
проф. Игнаткина В.А.,2017
4
5. Подготовка руды к флотации
• Измельчение до минус 0,1 мм• Разбавление водой до содержания
твердого (% тв.) – 25-40 %
проф. Игнаткина В.А.,2017
5
6. Фазы при флотации
• Твердая (поверхность минерала, осадок ит.д.)
• Жидкая (вода, реже «масло-вода»,
эмульсия,)
• Газовая (воздух, кислород, азот, углекислый
газ и др.)
проф. Игнаткина В.А.,2017
6
7. Виды флотации
• Масляная «Г-М-Т»• Пленочная «Г-Ж-Т»
• Пенная «Г-Ж-Т»
проф. Игнаткина В.А.,2017
7
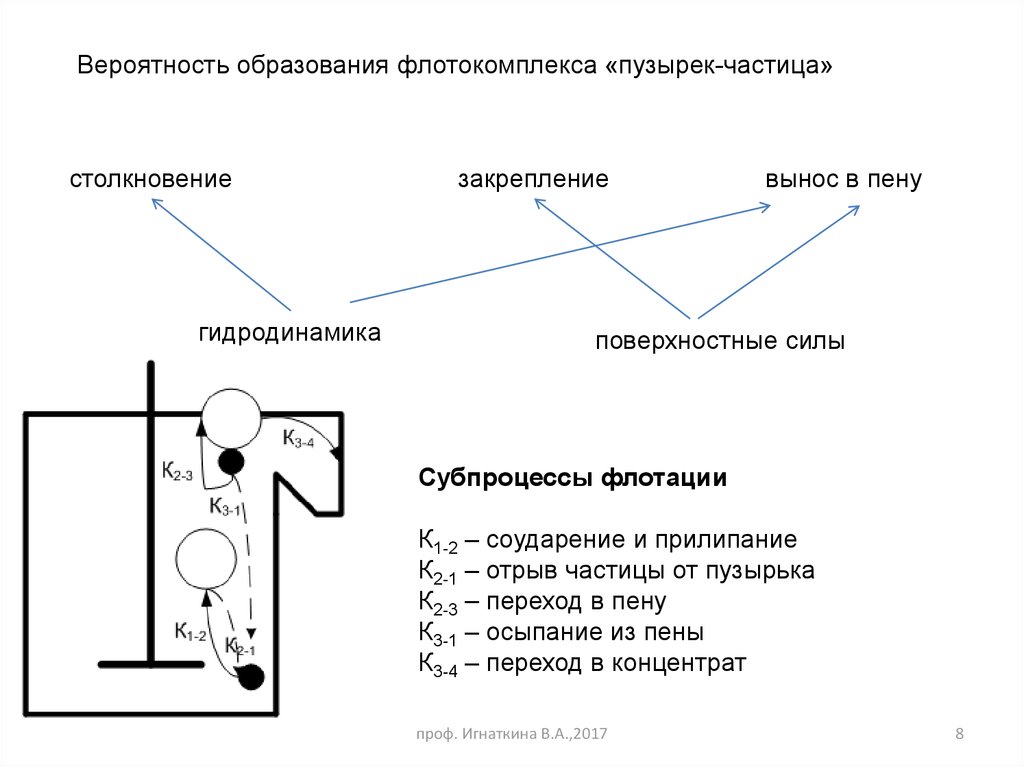
8.
Вероятность образования флотокомплекса «пузырек-частица»столкновение
гидродинамика
закрепление
вынос в пену
поверхностные силы
Субпроцессы флотации
К1-2 – соударение и прилипание
К2-1 – отрыв частицы от пузырька
К2-3 – переход в пену
К3-1 – осыпание из пены
К3-4 – переход в концентрат
проф. Игнаткина В.А.,2017
8
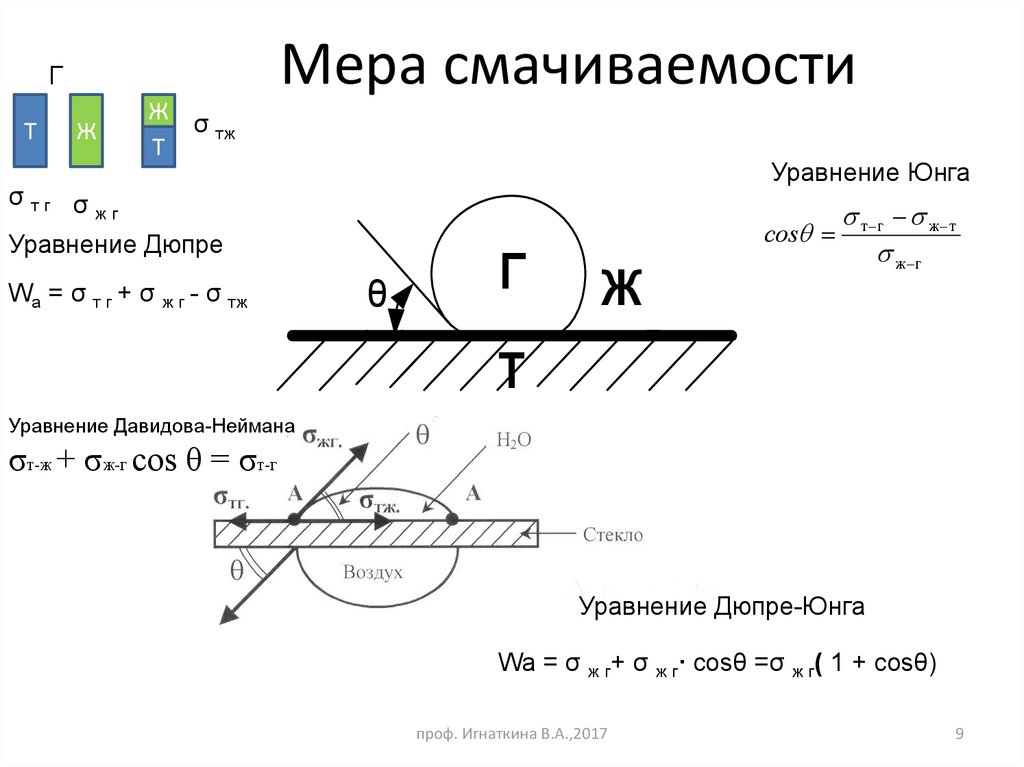
9. Мера смачиваемости
ГТ
Ж
Ж
σ тж
Т
Уравнение Юнга
σ тг σ
жг
Уравнение Дюпре
Wa = σ т г + σ ж г - σ тж
θ
Г
сos
Ж
т г ж т
ж г
Т
Уравнение Давидова-Неймана
σт-ж + σж-г сos θ = σт-г
Уравнение Дюпре-Юнга
Wa = σ ж г+ σ ж г∙ cosθ =σ ж г( 1 + cosθ)
проф. Игнаткина В.А.,2017
9
10.
Значения краевых углов смачивания (в градусах)Название
минерала
Самородная сера
Графит
Молибденит
Халькопирит
Пирит
Кварц
Угол смачивания,
θ
78°
60°
60-86°
47°
33°
0-10°
проф. Игнаткина В.А.,2017
10
11.
Гистерезис смачиванияcos о cos н cos р
2
1
cos р 1 2
жг
жг
жг
проф. Игнаткина В.А.,2017
11
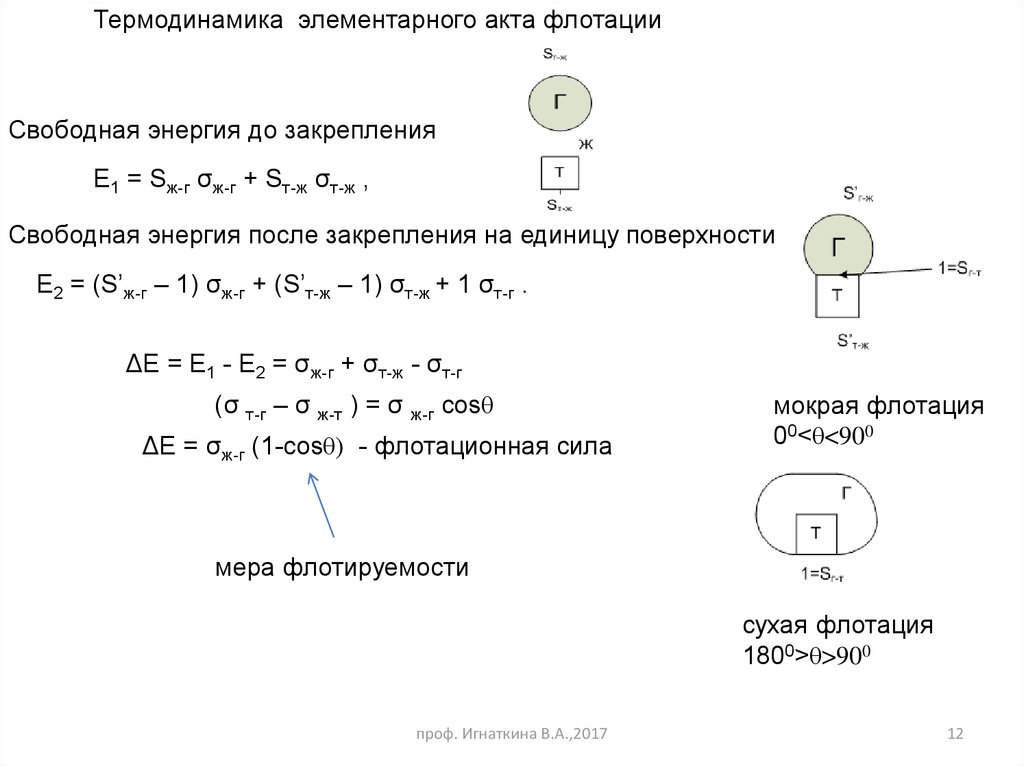
12.
Термодинамика элементарного акта флотацииСвободная энергия до закрепления
Е1 = Sж-г σж-г + Sт-ж σт-ж ,
Свободная энергия после закрепления на единицу поверхности
Е2 = (S’ж-г – 1) σж-г + (S’т-ж – 1) σт-ж + 1 σт-г .
ΔЕ = Е1 - Е2 = σж-г + σт-ж - σт-г
(σ т-г – σ ж-т ) = σ ж-г cosθ
ΔЕ = σж-г (1-cosθ) - флотационная сила
мокрая флотация
00<θ<900
мера флотируемости
сухая флотация
1800>θ>900
проф. Игнаткина В.А.,2017
12
13.
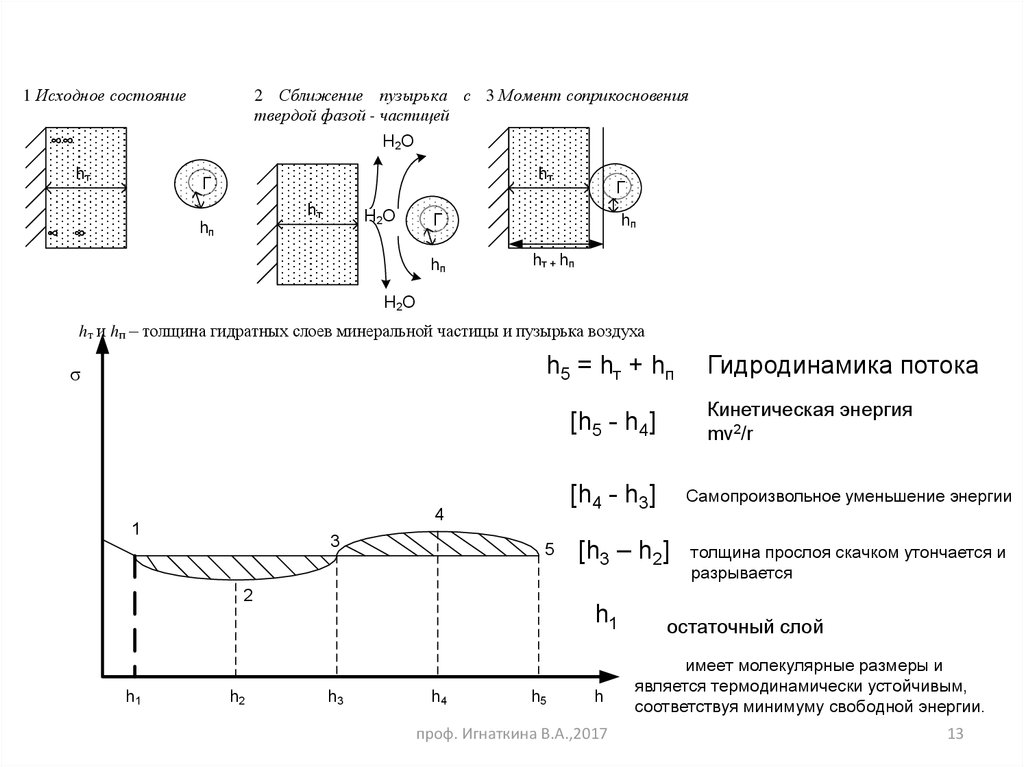
1 Исходное состояние2 Сближение пузырька с 3 Момент соприкосновения
твердой фазой - частицей
∞∞
Н2О
hт
Г
∞ ∞
hп
hт
hт
Н 2О
Г
Г
hп
hп
h т + hп
Н2О
hт и hп – толщина гидратных слоев минеральной частицы и пузырька воздуха
h5 = hт + hп
σ
Кинетическая энергия
mv2/r
[h5 - h4]
[h4 - h3]
4
1
3
5
2
h1
h2
h3
h4
h5
Самопроизвольное уменьшение энергии
[h3 – h2]
h1
h
проф. Игнаткина В.А.,2017
Гидродинамика потока
толщина прослоя скачком утончается и
разрывается
остаточный слой
имеет молекулярные размеры и
является термодинамически устойчивым,
соответствуя минимуму свободной энергии.
13
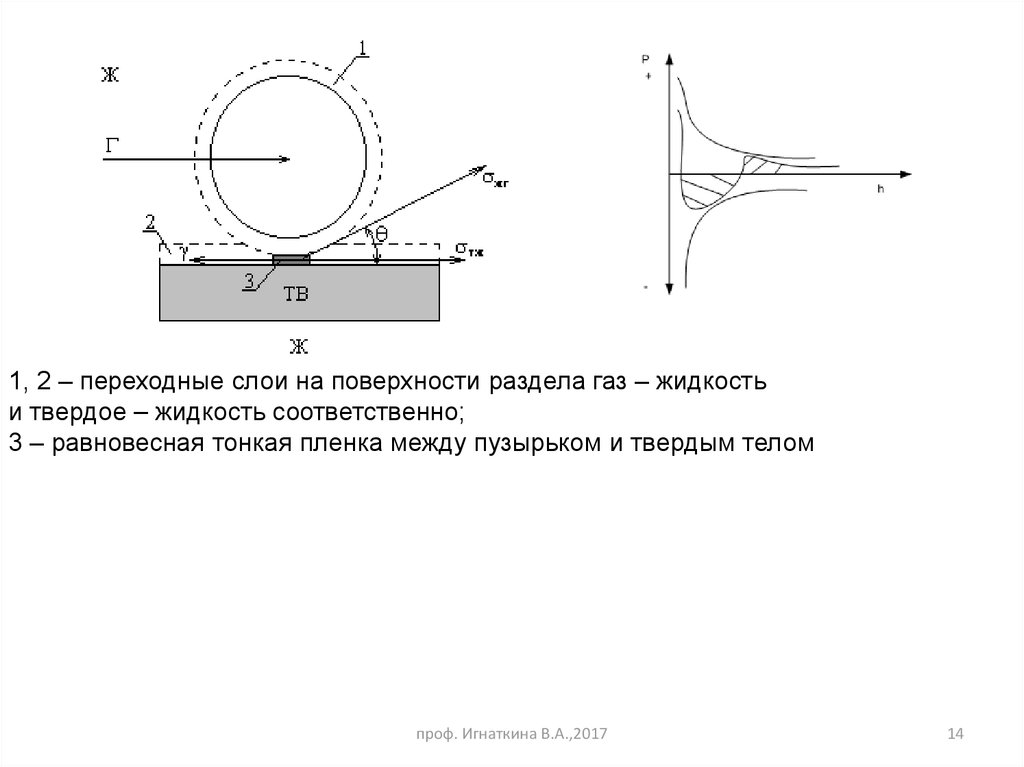
14.
1, 2 – переходные слои на поверхности раздела газ – жидкостьи твердое – жидкость соответственно;
3 – равновесная тонкая пленка между пузырьком и твердым телом
проф. Игнаткина В.А.,2017
14
15.
hpE ж г (1 cos ) п(h )dh
h0
п(h) пe (h) пM (h) пS (h)
П ( h) 0
П e (h)— электростатическая составляющая, возникающая при перекрытии (или деформации);
толщина диффузионного слоя; мкм
П M (h)
— молекулярная составляющая, обусловленная вандерваальсовыми силами ; 1000 А0
— структурная составляющая, зависящая от степени гидратированности
П S ( h) поверхности или от гидрофобности.
10-100 нм
проф. Игнаткина В.А.,2017
15
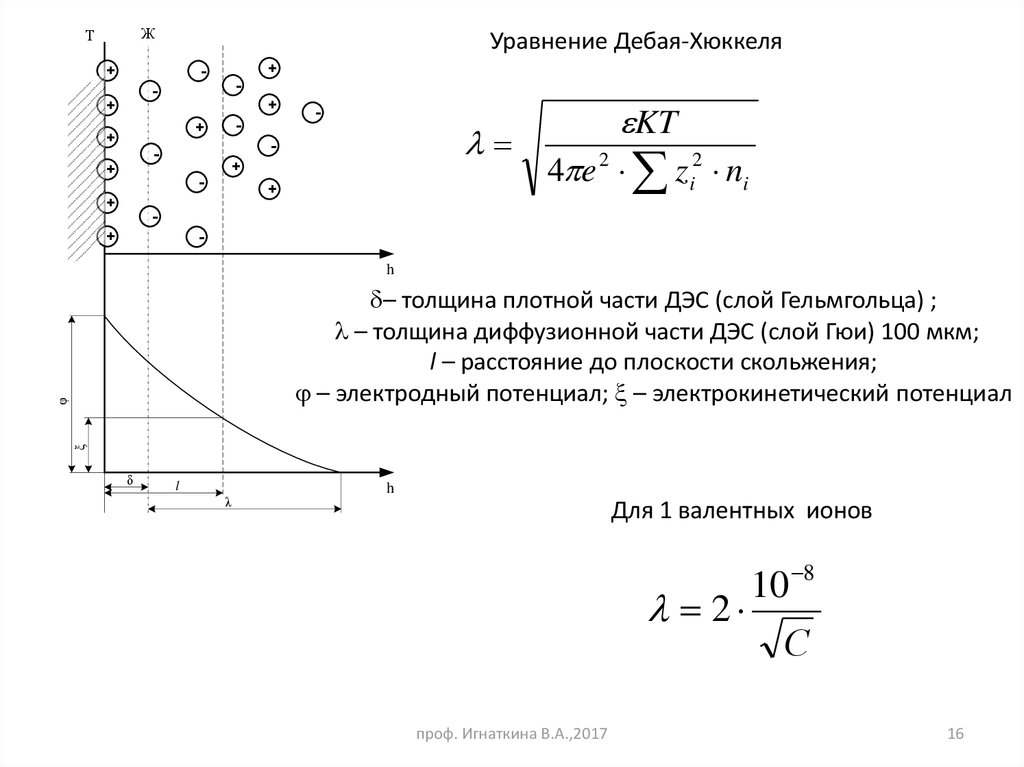
16.
ЖТ
Уравнение Дебая-Хюккеля
+
+
-
-
-
+
+
-
+
+
-
-
+
+
-
+
-
+
KT
4 e 2 z i2 ni
-
+
h
ξ
φ
– толщина плотной части ДЭС (слой Гельмгольца) ;
– толщина диффузионной части ДЭС (слой Гюи) 100 мкм;
l – расстояние до плоскости скольжения;
– электродный потенциал; – электрокинетический потенциал
δ
l
λ
h
Для 1 валентных ионов
2
проф. Игнаткина В.А.,2017
10 8
С
16
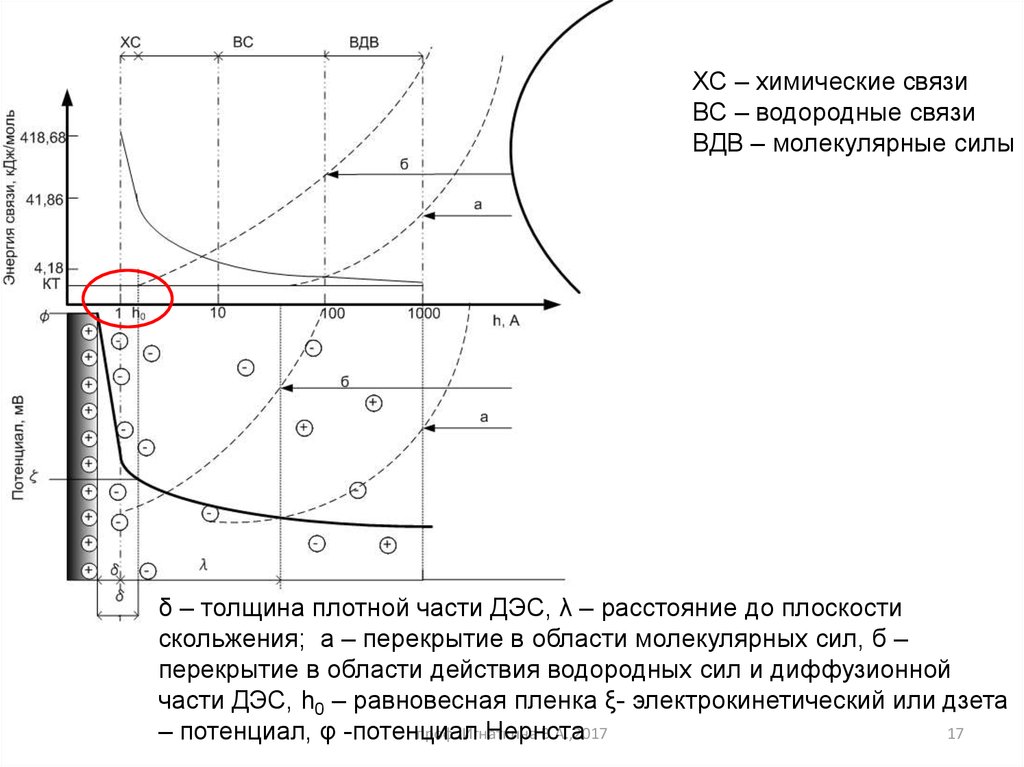
17.
ХС – химические связиВС – водородные связи
ВДВ – молекулярные силы
И
И
λ
λ
δ – толщина плотной части ДЭС, λ – расстояние до плоскости
скольжения; а – перекрытие в области молекулярных сил, б –
перекрытие в области действия водородных сил и диффузионной
части ДЭС, h0 – равновесная пленка ξ- электрокинетический или дзета
проф. Игнаткина
В.А.,2017
17
– потенциал, φ -потенциал
Нернста
18.
Уравнение равновесия «пузырек-частица»Фрумкина-Кабанова – вероятность закрепления
F ф + FА = F т + Fк
Лапласово давление
Гидростатическое давление
π a σж-г Sin θ = ρgVпуз + (πa2/4 (2σж-г/ R – ρgh) .
Силы отрыва
Флотационная сила (сила прилипания)
проф. Игнаткина В.А.,2017
18
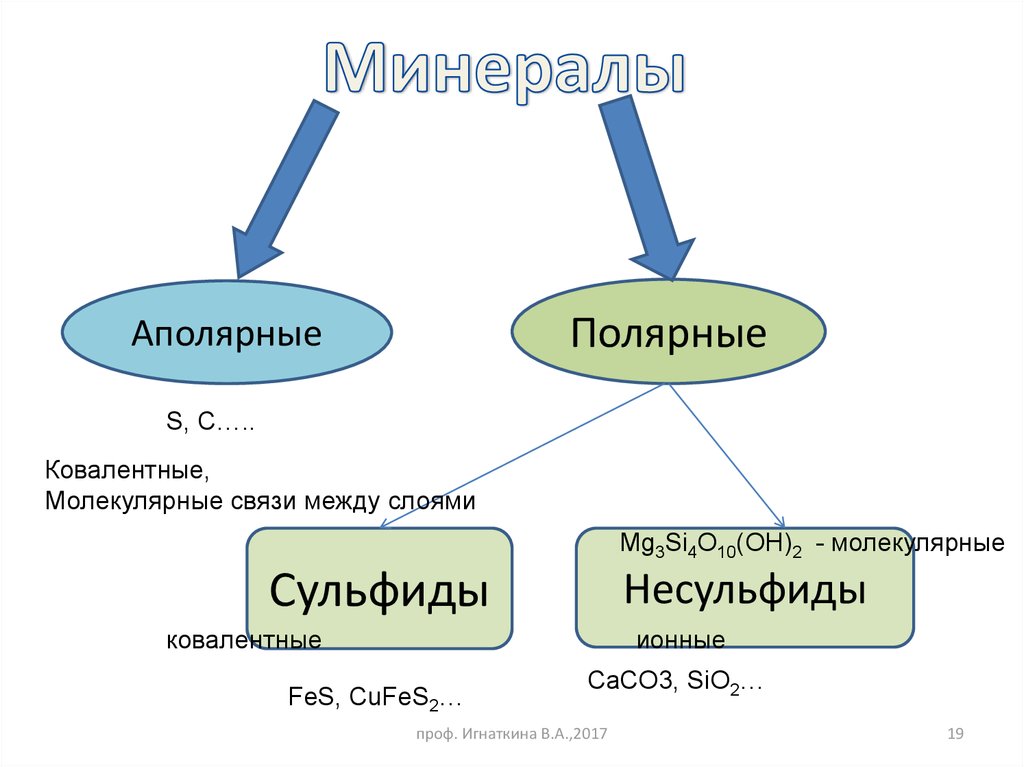
19.
ПолярныеАполярные
S, C…..
Ковалентные,
Молекулярные связи между слоями
Mg3Si4O10(OH)2 - молекулярные
Сульфиды
Несульфиды
ковалентные
ионные
FeS, CuFeS2…
CaCO3, SiO2…
проф. Игнаткина В.А.,2017
19
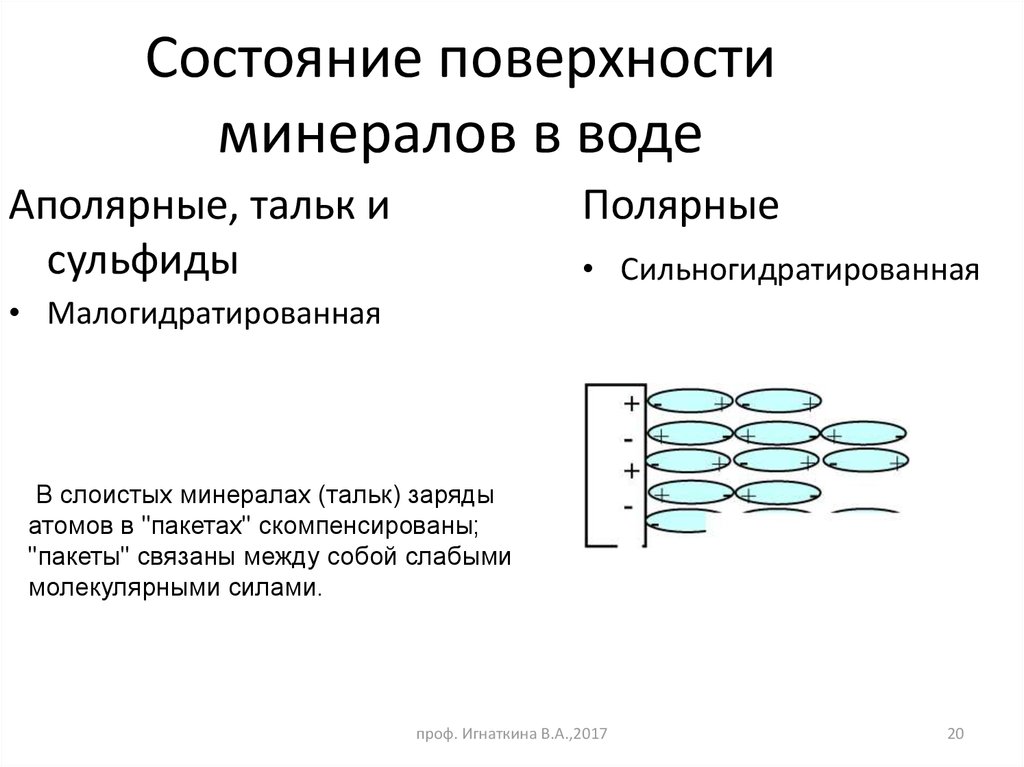
20. Состояние поверхности минералов в воде
Аполярные, тальк исульфиды
Полярные
• Сильногидратированная
• Малогидратированная
В слоистых минералах (тальк) заряды
атомов в "пакетах" скомпенсированы;
"пакеты" связаны между собой слабыми
молекулярными силами.
проф. Игнаткина В.А.,2017
20
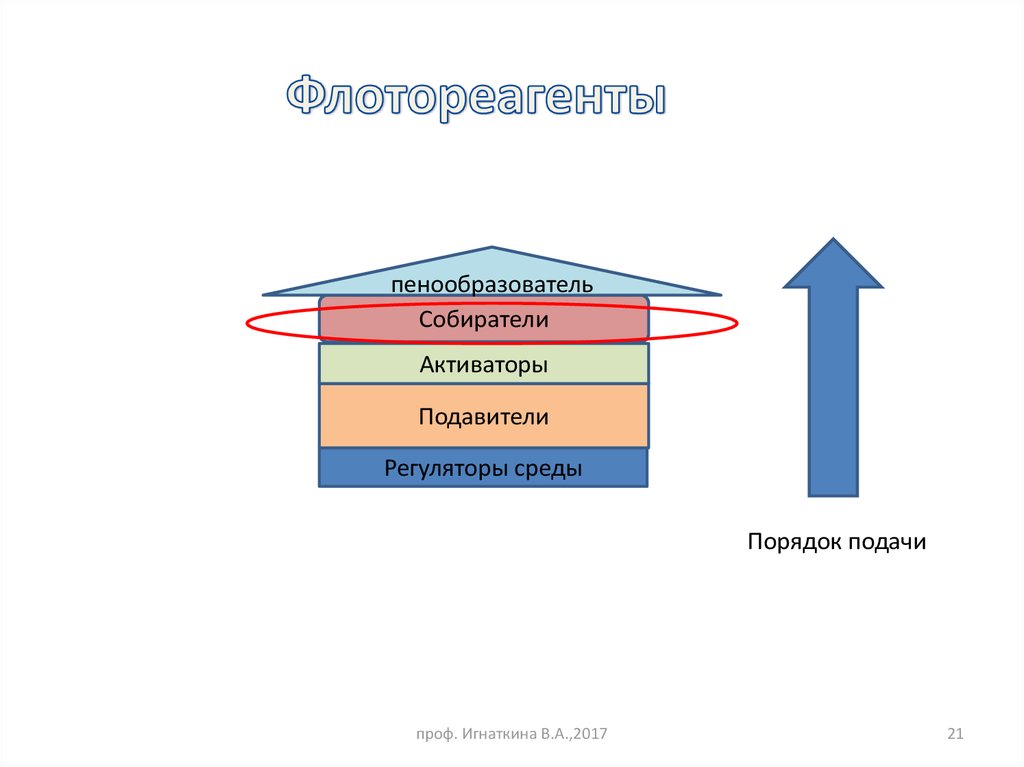
21.
пенообразовательСобиратели
Активаторы
Подавители
Регуляторы среды
Порядок подачи
проф. Игнаткина В.А.,2017
21
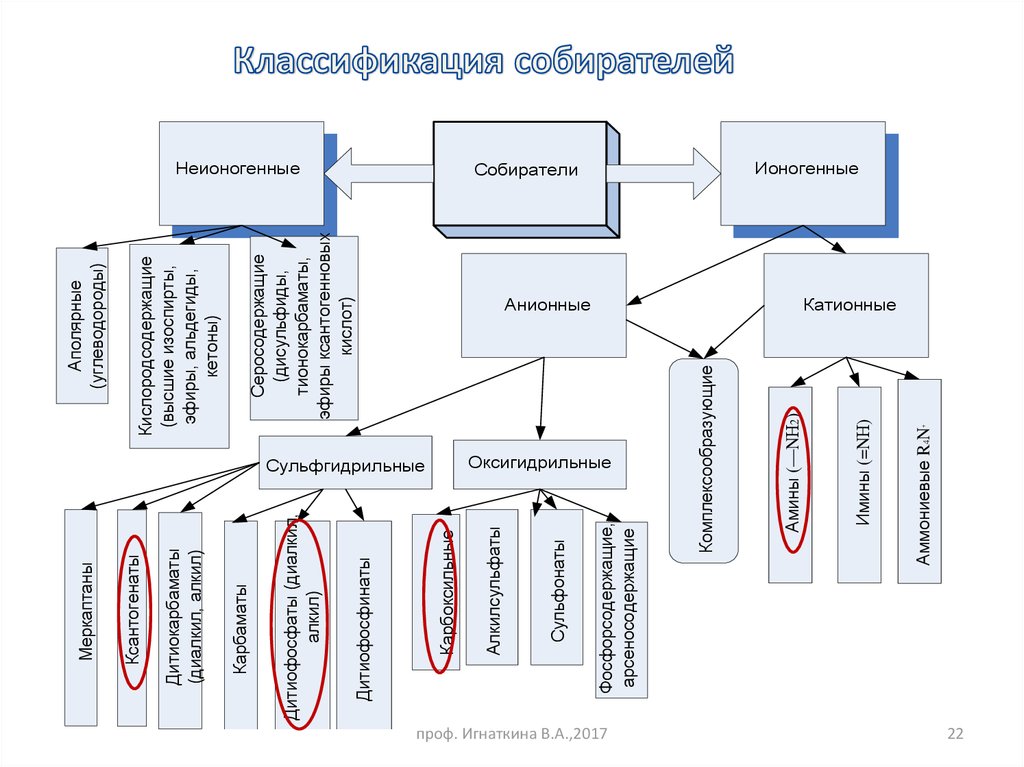
22.
Оксигидрильныепроф. Игнаткина В.А.,2017
Серосодержащие
(дисульфиды,
тионокарбаматы,
эфиры ксантогенновых
кислот)
Кислородсодержащие
(высшие изоспирты,
эфиры, альдегиды,
кетоны)
Аполярные
(углеводороды)
Аммониевые R4N
+
Анионные
Имины (=NН)
Собиратели
Амины (—NН2)
Комплексообразующие
Фосфорсодержащие,
Фосфонаты
арсеносодержащие
Сульфонаты
Сульфгидрильные
Алкилсульфаты
Карбоксильные
Дитиофосфинаты
Дитиофосфаты (диалкил,
алкил)
Карбаматы
Дитиокарбаматы
(диалкил, алкил)
Ксантогенаты
Меркаптаны
Неионогенные
Ионогенные
Катионные
22
23. Требования к собирателям
Технологическая эффективность
Низкая токсичность (3,4 класс)
Промышленное производство
Доступная стоимость
проф. Игнаткина В.А.,2017
23
24.
Сульфидные минералыПриродногидрофобные
минералы
Сульфгидрильные
собиратели
Аполярные
собиратели
Несульфидные минералы
Оксигидрильные
собиратели
Катионные
собиратели
проф. Игнаткина В.А.,2017
24
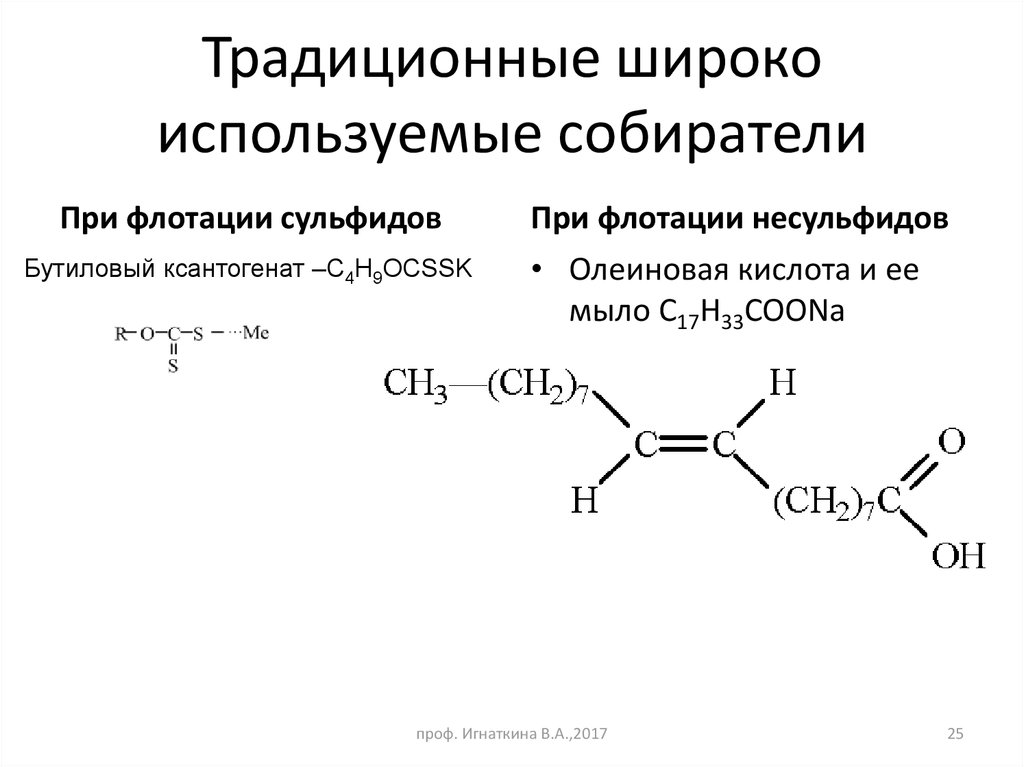
25. Традиционные широко используемые собиратели
При флотации сульфидовБутиловый ксантогенат –С4H9OCSSK
При флотации несульфидов
• Олеиновая кислота и ее
мыло C17H33COONa
проф. Игнаткина В.А.,2017
25
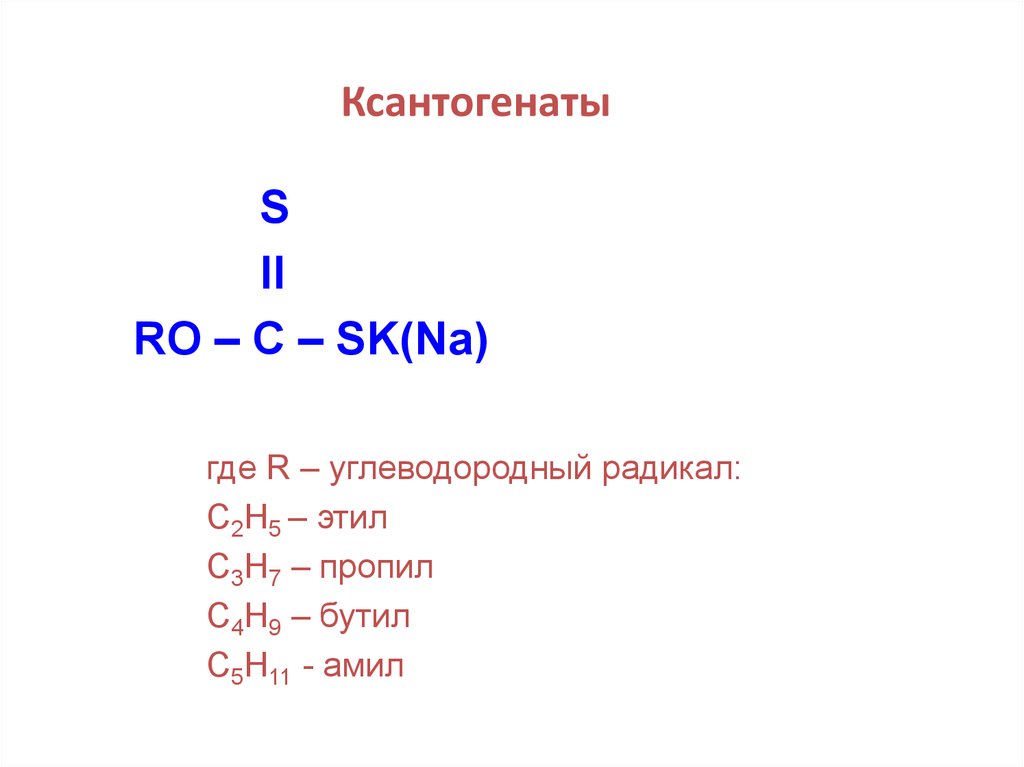
26.
КсантогенатыS
II
RO – C – SK(Na)
где R – углеводородный радикал:
С2Н5 – этил
С3Н7 – пропил
С4Н9 – бутил
С5Н11 - амил
27.
СинтезROH + KOH + CS2 = ROCSSK
Диссоциация
ROCSSK
(ROCSS)- + K+
Окисление
2ROCSSK - 2e
(ROCSS)-2 + 2K+
28.
Регуляторы средырН
проф. Игнаткина В.А.,2017
28
29.
Сводная информация по регуляторам средыизменяют значение рН среды
рК1=6,37 рК2=10,33
щелочные -гидроксиды или соли сильных оснований и слабых
кислот
Na2CO3 → 2Na+ + CO3 2-
связывание катионов Са2+
CO3 2+ HOH→HCO3- + OH- Ka; pKa
NaHCO3
бикарбонат или
гидрокарбонат натрия
каустическая сода - гидрооксид
натрия
известковое молоко - сильный
электролит
подавление пирита
вытеснение собирателя
Сa(OH)2 →CaOH+ + OH- 1 ступень диссоциации
CaOH+ →Ca2+ + OH-
2 ступень диссоциации
Me(OH)n
=
Men+ n[OH-]
[OH-]=[X-]√ПР(Me(ОН/ПРМеХ)
MeXn= Men+ nX[H+]=10-14[X]√ПРМе(ОН)/ПРМеХ
кислая среда
серная, соляная, реже
плавиковая
проф. Игнаткина В.А.,2017
29
30. Подавители Механизмы действия
• Вытеснение собирателя (ПР) - Na2S• Окисление или восстановление
поверхности минералов (кислород O2, Fe3+,
NaOCl; сернистый Na2S, NaHS)
• Растворение (цианид NaCN)
• Гидрофилизация без вытеснения
собирателя (КМЦ, крахмал, Na2SiO3)
проф. Игнаткина В.А.,2017
30
31. Активаторы
• Соли меди для повышения вероятностизакрепления ионогенных собирателей
(CuSO4)
• Кислоты (H2SO4, HF)
• Кремнефтористый натрий (Na2SiF6)
проф. Игнаткина В.А.,2017
31
32.
Сводная информация по активаторам флотацииактивирующее действие кислорода на флотацию
сульфидов
применение углекислого газа для активации
кальцита
медный купорос ZnSǀтв + Cu2+ → CuSǀтв +
Zn2+
cульфидизация
S2-
HS-
оптимум сорбции меди 5,5-6,0
Cu2+=ПР/[OH-]2
поверхность окисленных минералов гидратирована,
церуссит PbCO3
активация кварца катионами щелочноземельных или поливалентных
металлов
активация силикатов плавиковой
кислотой HF
проф. Игнаткина В.А.,2017
32
33. Модификаторы сульфидных руд
Сернистый натрий - Na2S
Гидросульфид натрия NaHS
Бисульфит натрия NaHSO3
Натрий персульфат, натрий пероксидсульфат Na2S2O8
Тиосульфат натрия Na2S2O3
Метабисульфит натрия Na2S2O5
Сернистый газ SO2
МФТК – низкомолекулярный депрессор сульфидов меди и
пирита на основе тиокарбаминовой кислоты
• Модифицированный КМЦ
проф. Игнаткина В.А.,2017
33
34. Модификаторы несульфидных руд
Жидкое стекло Na2SiO3
Крахмал
КМЦ
Полифосфаты
проф. Игнаткина В.А.,2017
34
35. Активные центры на поверхности
• Активными центрами являются анионы, катионы, атомы сненасыщенными валентными связями, которые возникают при
образовании поверхности и которые стремятся компенсировать
избыток энергии
• Активными центрами поверхности являются также макро- и
микродефекты кристаллической структуры твердых тел.
Макродефекты - микротрещины и микропоры, а также
межкристаллические границы зерен; микродефекты - это
нарушение стехиометрического состава кристаллов, а также
нарушение в периодичности расположения атомов в
кристаллической решетке (линейные и винтовые дислокации).
Поверхностные соединения образуются в результате
конкуренции молекул воды с ионами и молекулами
флотореагентов за активные центры
проф. Игнаткина В.А.,2017
35
36.
SR
X
Мe(XR)n
Me
S
X
I
II
R
III
Мe(OH)z(XR)n
IV
R-X-R
R-R
V
I – объем сульфида; II –закрепление по механизму гетерогенной обменной реакции
с активным центром поверхности; III – закрепление в плотном слое ДЭС
(адсорбционный слой); IV - соадсорбция объемных соединений во внешнем ДЭС
V – соадсорбция молекулярной формы во внешнем диффузионном слое
проф. Игнаткина В.А.,2017
36
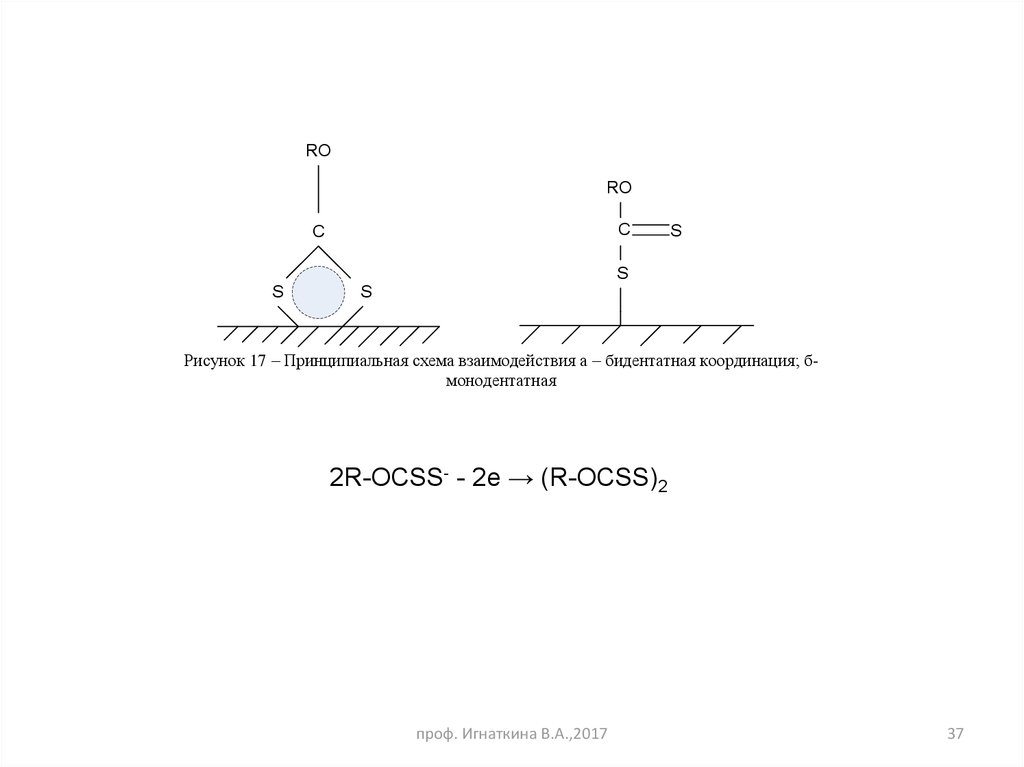
37.
RORO
C
C
S
S
S
S
Рисунок 17 – Принципиальная схема взаимодействия а – бидентатная координация; бмонодентатная
2R-OCSS- - 2e → (R-OCSS)2
проф. Игнаткина В.А.,2017
37
38. Успех элементарного акта флотации зависит от
• Присутствия на минерале 2-х форм сорбции• Создание условий достижения точки
нулевого заряда поверхности (ТНЗ), когда
электрокинетический потенциал
поверхности (ЭКП) равен нулю, а величина
свободной поверхностной энергии
максимальна.
проф. Игнаткина В.А.,2017
38
39.
проф. Игнаткина В.А.,201739
40. Собиратели для несульфидных минералов и руд
• Олеиновая кислота или олеат натрия – OlNa С17Н33СООNa• Заменители олеиновой кислоты – таловые масла,
синтетические жирные кислоты С12-С18 ненасыщенные
карбоновые кислоты и их мыла
• Алкилсульфаты, алкилсульфонаты – ROSO3; RSO3
• Производные фосфорных кислот
• Катионные собиратели
проф. Игнаткина В.А.,2017
40
41.
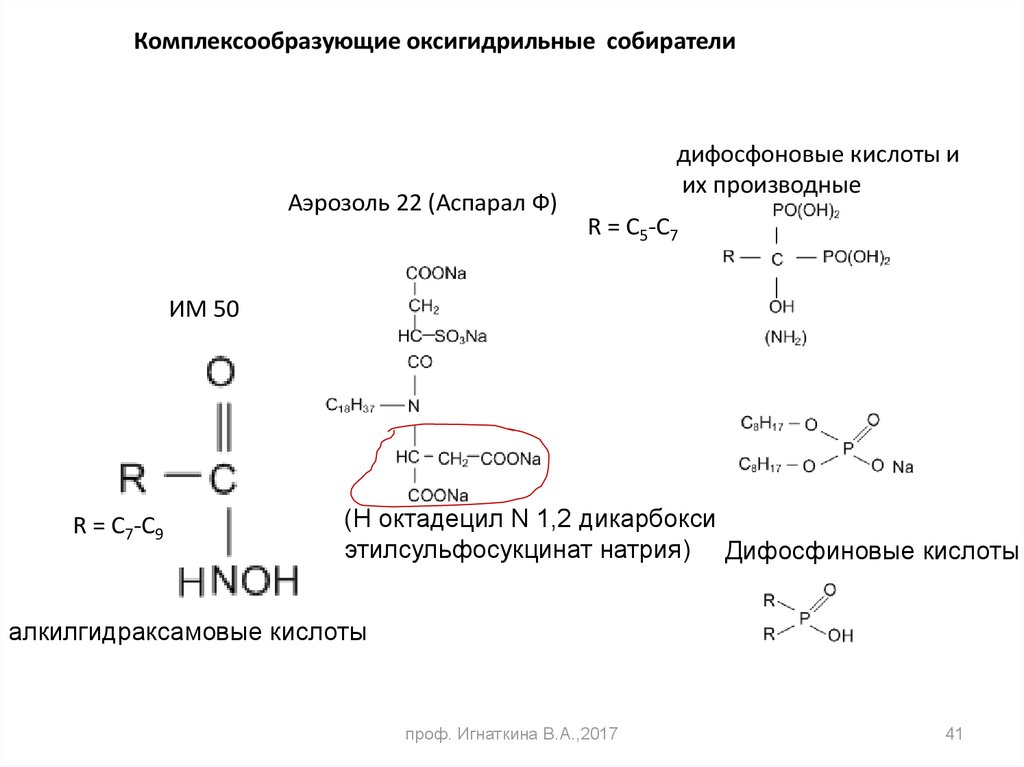
Комплексообразующие оксигидрильные собирателиАэрозоль 22 (Аспарал Ф)
дифосфоновые кислоты и
их производные
R = C5-C7
ИМ 50
R = C7-C9
(Н октадецил N 1,2 дикарбокси
этилсульфосукцинат натрия) Дифосфиновые кислоты
алкилгидраксамовые кислоты
проф. Игнаткина В.А.,2017
41
42.
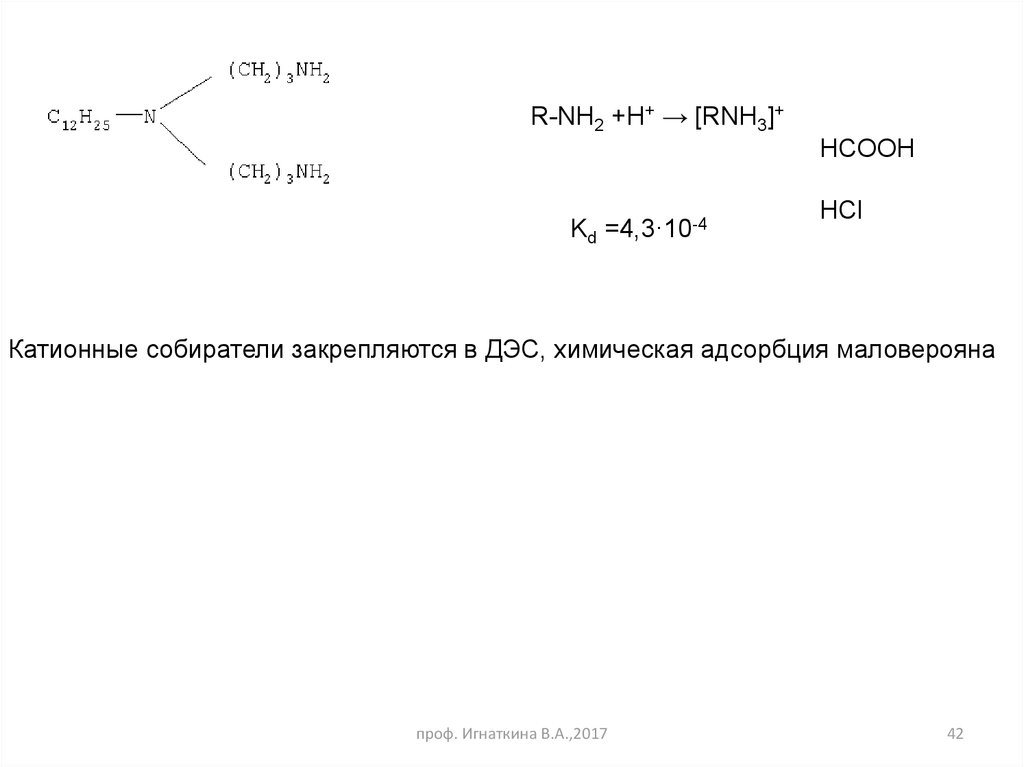
R-NH2 +H+ → [RNH3]+HCOOH
Kd =4,3·10-4
HCl
Катионные собиратели закрепляются в ДЭС, химическая адсорбция маловерояна
проф. Игнаткина В.А.,2017
42
43. Пенообразователь
• Повышает дисперсность газовой фазы• Препятствует коалесценции пузырьков
• Снижает скорость подъема пузырька –
увеличивает вероятность столкновения
• Увеличивает прочность пузырька и
устойчивость пены при подъеме
• Собирательное действие
пенообразователей
проф. Игнаткина В.А.,2017
43
44.
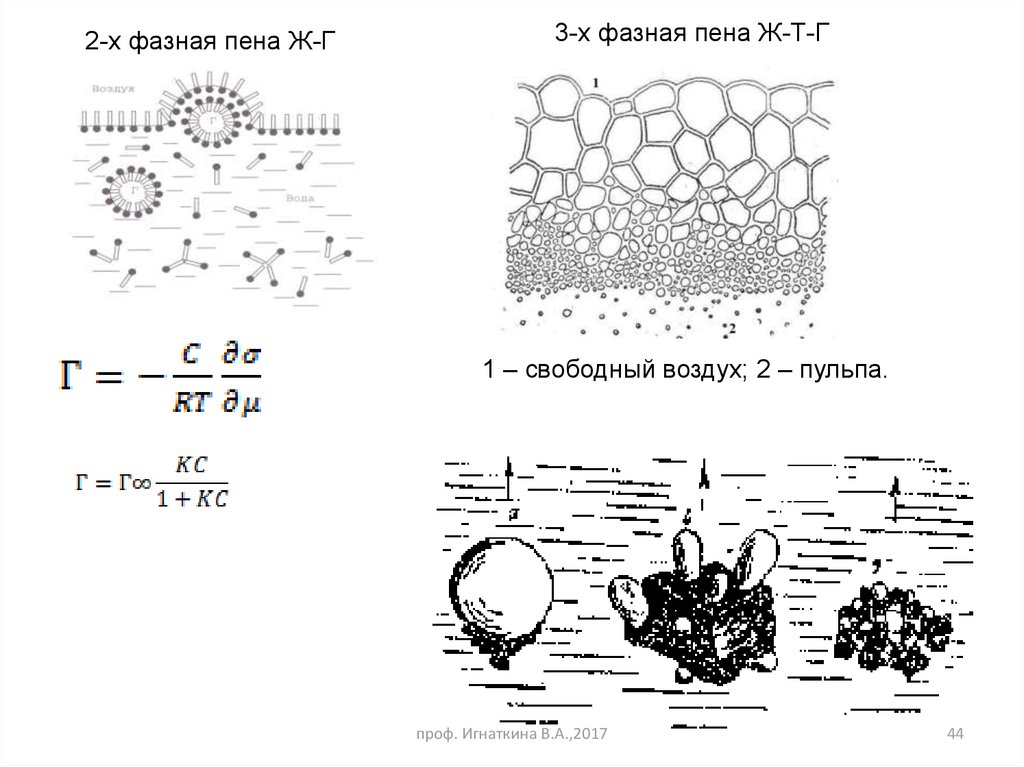
2-х фазная пена Ж-Г3-х фазная пена Ж-Т-Г
1 – свободный воздух; 2 – пульпа.
проф. Игнаткина В.А.,2017
44
45.
Строение пенного слояа–пленочноструктурная
пена
б-агрегатная
пена
проф. Игнаткина В.А.,2017
в–пленочная
пена (по В.И.
Классену)[7]
45
46.
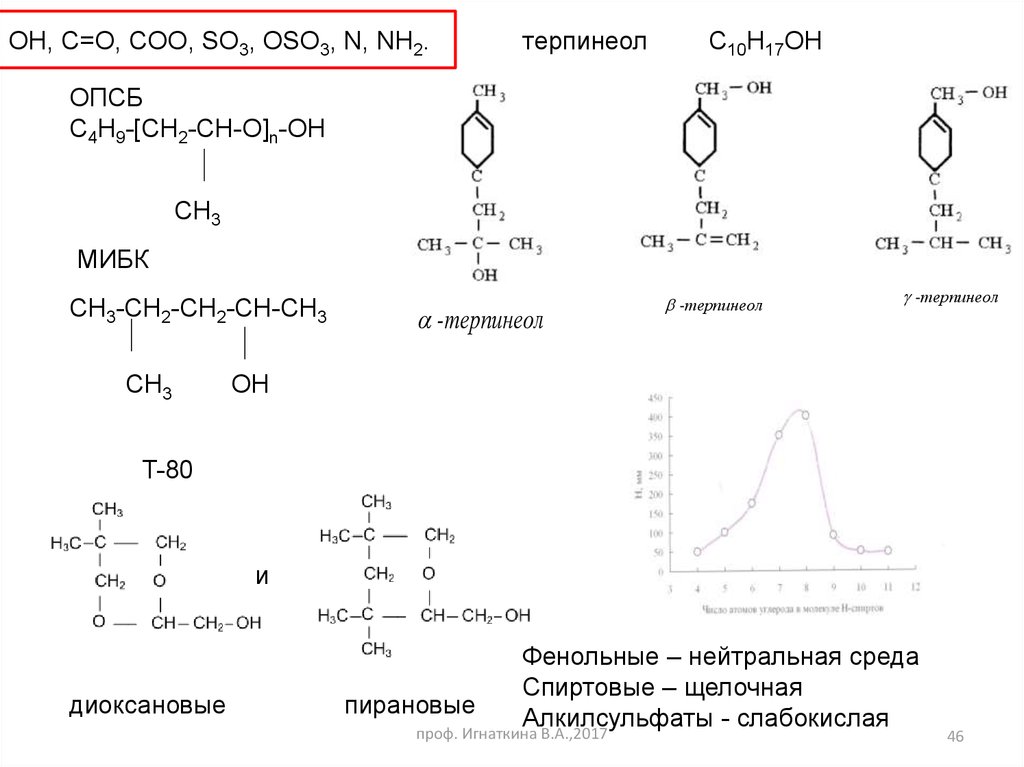
OH, C=O, COO, SO3, OSO3, N, NH2.терпинеол
С10H17OH
ОПСБ
С4Н9-[CH2-CH-O]n-OH
CH3
МИБК
CH3-CH2-CH2-CH-CH3
CH3
-терпинеол
-терпинеол
-терпинеол
OH
T-80
и
диоксановые
Фенольные – нейтральная среда
Спиртовые – щелочная
пирановые
Алкилсульфаты - слабокислая
проф. Игнаткина В.А.,2017
46
47.
В упрощенном виде скорость флотации может бытьопределена как (уравнение Белоглазова):
ln 1 / (1 – ε ) = k t.
Величина ln 1/(1–ε) называется
коэффициентом удельной скорости
флотации.
1 – постоянная скорость
2 – уменьшение скорости флотации к концу флотации
3 –увеличении скорости к концу флотации
4 – экстремальная, может быть следствием изменения
концентрации реагентов в пульпе
проф. Игнаткина В.А.,2017
47
48. Способы насыщения воздухом
• Специальными устройствами(механические, пневмомеханические,
пневматические флотомашины)
• Перепад давлений (напорная)
• Разрежение (вакуумная)
• Электролиз (электрофлотация)
проф. Игнаткина В.А.,2017
48
49. Классификация флотационных машин
• механические,• пневмомеханические
• пневматические
• напорные флотаторы
• электрофлотаторы
проф. Игнаткина В.А.,2017
49
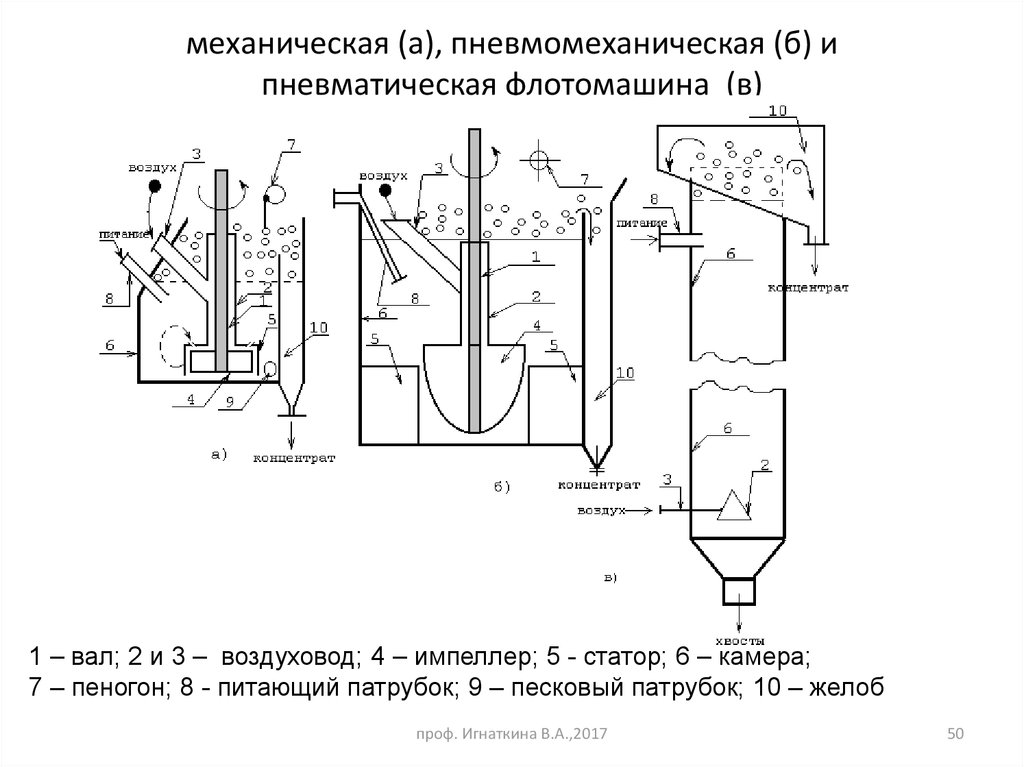
50. механическая (а), пневмомеханическая (б) и пневматическая флотомашина (в)
1 – вал; 2 и 3 – воздуховод; 4 – импеллер; 5 - статор; 6 – камера;7 – пеногон; 8 - питающий патрубок; 9 – песковый патрубок; 10 – желоб
проф. Игнаткина В.А.,2017
50
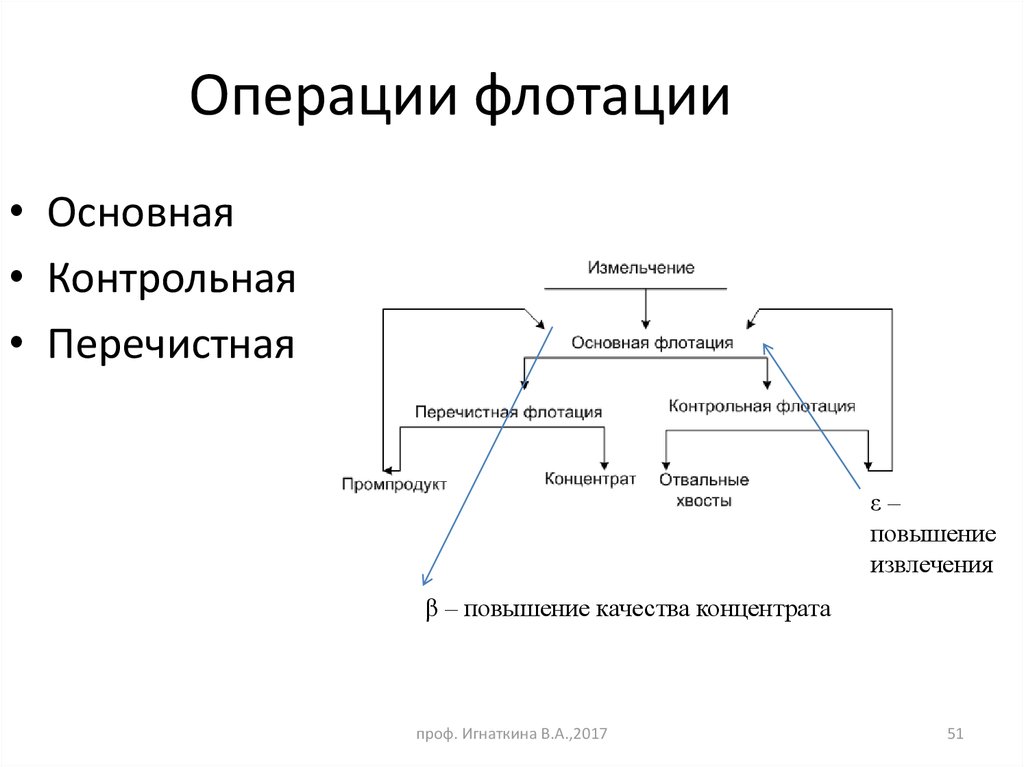
51. Операции флотации
• Основная• Контрольная
• Перечистная
ε–
повышение
извлечения
β – повышение качества концентрата
проф. Игнаткина В.А.,2017
51
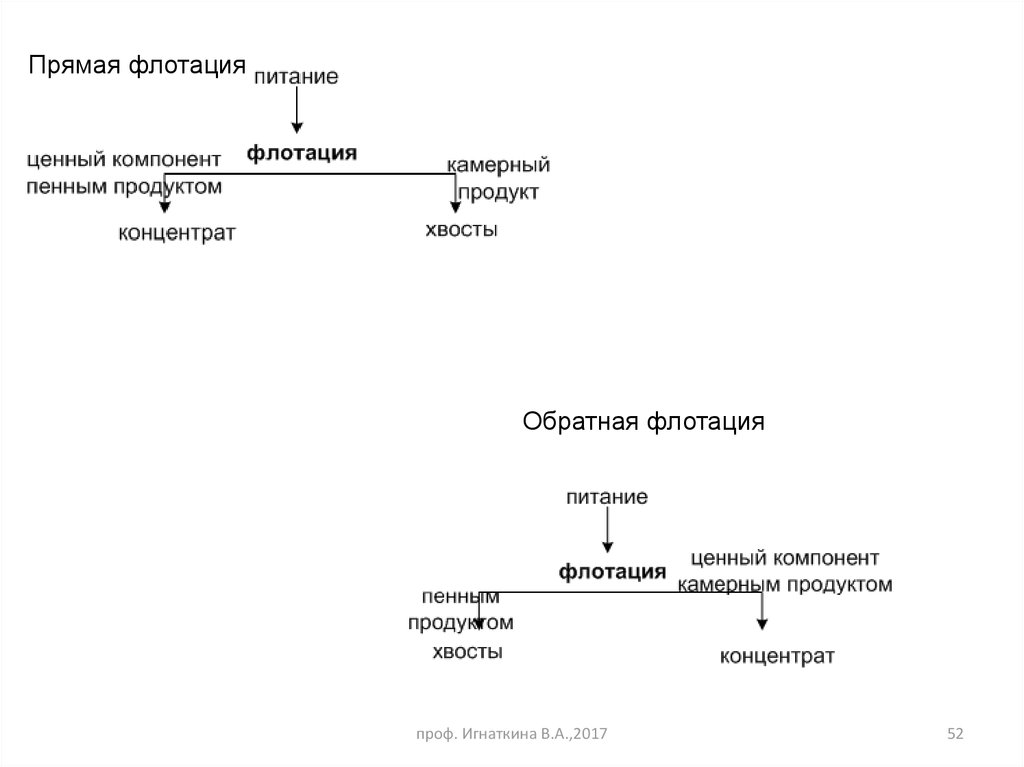
52.
Прямая флотацияОбратная флотация
проф. Игнаткина В.А.,2017
52
53.
Прямая селективная флотацияРуда
Флотация 1-го минерала
Концентрат 1
Хвосты
Флотация 2-го минерала
Концентрат 2
Хвосты
Флотация 3-го минерала
Концентрат 3
проф. Игнаткина В.А.,2017
Хвосты
53
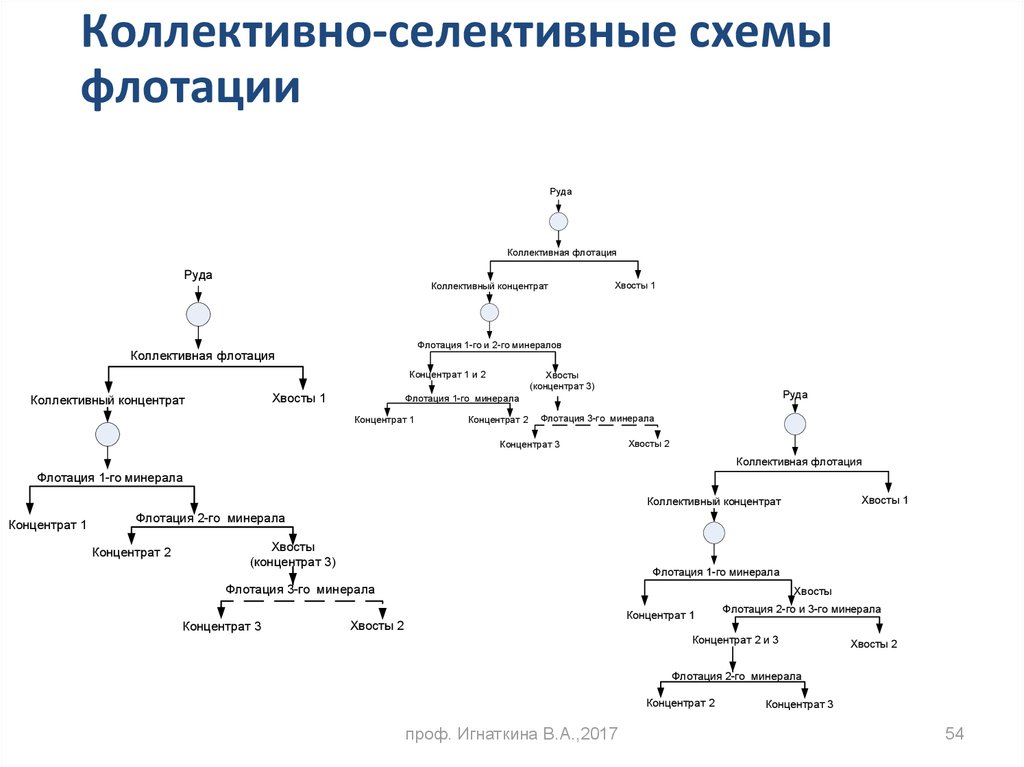
54.
Коллективно-селективные схемыфлотации
Руда
Коллективная флотация
Руда
Коллективный концентрат
Флотация 1-го и 2-го минералов
Коллективная флотация
Концентрат 1 и 2
Хвосты 1
Коллективный концентрат
Хвосты 1
Хвосты
(концентрат 3)
Руда
Флотация 1-го минерала
Концентрат 1
Концентрат 2
Флотация 3-го минерала
Концентрат 3
Хвосты 2
Коллективная флотация
Флотация 1-го минерала
Хвосты 1
Коллективный концентрат
Концентрат 1
Флотация 2-го минерала
Концентрат 2
Хвосты
(концентрат 3)
Флотация 1-го минерала
Флотация 3-го минерала
Концентрат 3
Хвосты
Концентрат 1
Хвосты 2
Флотация 2-го и 3-го минерала
Концентрат 2 и 3
Хвосты 2
Флотация 2-го минерала
Концентрат 2
проф. Игнаткина В.А.,2017
Концентрат 3
54
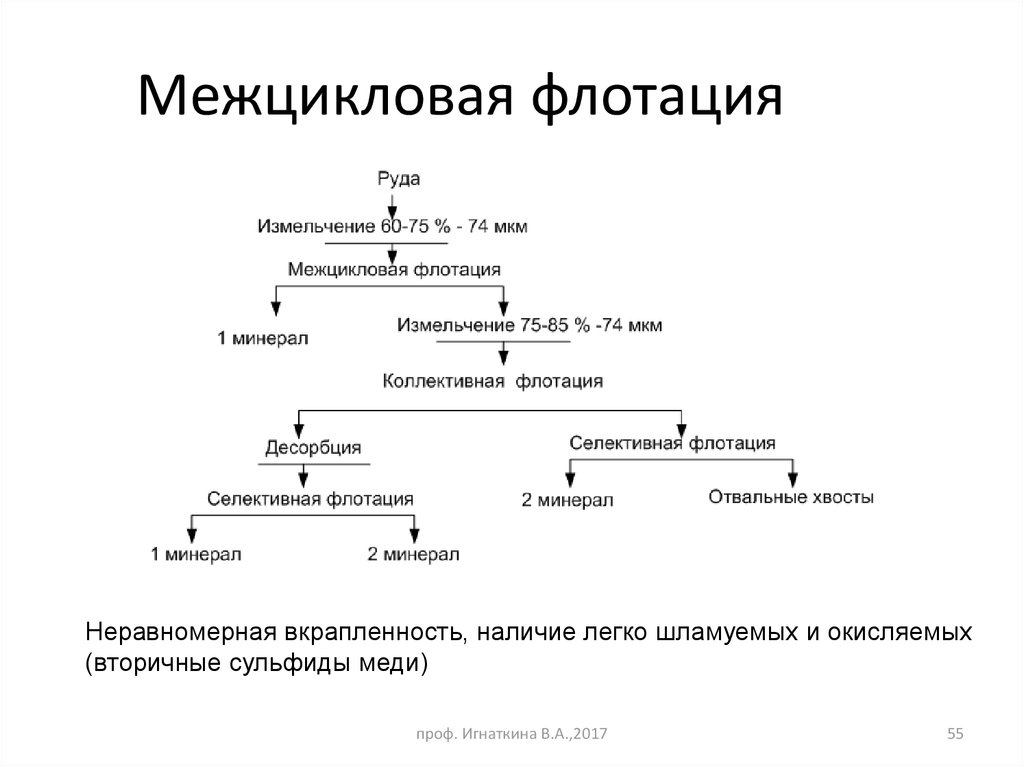
55. Межцикловая флотация
Неравномерная вкрапленность, наличие легко шламуемых и окисляемых(вторичные сульфиды меди)
проф. Игнаткина В.А.,2017
55
56. Типизация руд, минералов М.А. Эйгелеса по флотационным группам
1.2.
3.
4.
5.
6.
7.
Типизация руд, минералов
М.А. Эйгелеса по флотационным
группам
Природногидрофобные – графит, угли, самородная сера, тальк
(Mg3Si4O10(OH)2)
Руды сульфидных минералов тяжелых цветных металлов и самородные
металлы – галенит PbS, сульфиды меди Cu2S, CuS, сфалерит ZnS, золото,
серебро, платиноиды, самородная медь и др.
Смешанные и окисленные руды тяжелых цветных металлов – азурит
Cu3(СО3)2(ОН)2, малахит Cu2CO3(OH)2, церуссит PbCO3 и др.
Несульфидные руды с полярными солеобразными минералами с
щелочноземельными катионами (Ca, Ba, Sr) – кальцит CaCO3, шеелит CaWO4,
повелит CaMoO4 , апатит Са5[PO4]3(F, Cl, ОН), флюорит CaF2, барит BaSO4и др.
Руды, содержащие оксидные минералы черных металлов (железо,
марганец, хром) и цветных редких металлов (касситерит SnO2, ильменит
FeTiO3, рутил TiO2и др.)
Руды, содержащие силикаты и алюмосиликаты (берилл Al2[Be3(Si6O18)],
сподумен LiAl(Si2O6), породные минералы)
Руды, содержащие растворимые соли (галит NaCl, сильвин KCl)
проф. Игнаткина В.А.,2017
56
57. Сульфидные руды
• Сульфидныеминералы - основной
источник меди и
других тяжелых
цветных металлов
• Сопутствующие –
благородные металлы
(Аu, Ag, МПГ), редкие
металлы и
редкоземельные
элементы
проф. Игнаткина В.А.,2017
57
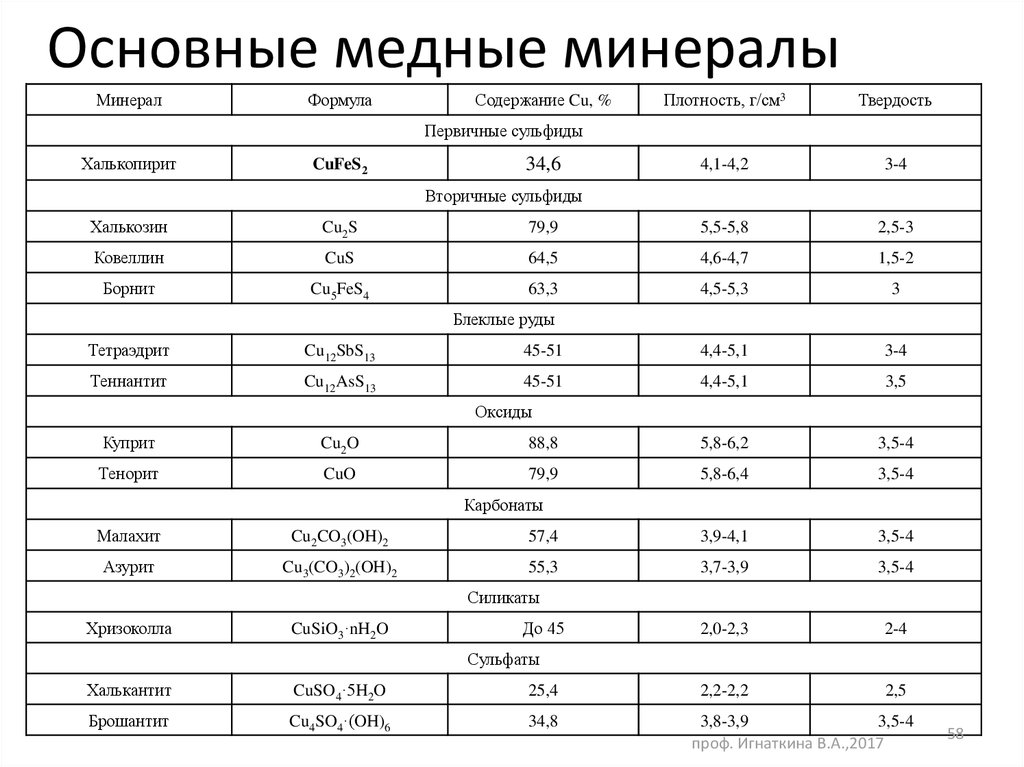
58. Основные медные минералы
МинералФормула
Содержание Cu, %
Плотность, г/см3
Твердость
4,1-4,2
3-4
Первичные сульфиды
Халькопирит
CuFeS2
34,6
Вторичные сульфиды
Халькозин
Cu2S
79,9
5,5-5,8
2,5-3
Ковеллин
CuS
64,5
4,6-4,7
1,5-2
Борнит
Cu5FeS4
63,3
4,5-5,3
3
Блеклые руды
Тетраэдрит
Cu12SbS13
45-51
4,4-5,1
3-4
Теннантит
Cu12AsS13
45-51
4,4-5,1
3,5
Оксиды
Куприт
Cu2O
88,8
5,8-6,2
3,5-4
Тенорит
CuO
79,9
5,8-6,4
3,5-4
Карбонаты
Малахит
Cu2CO3(OH)2
57,4
3,9-4,1
3,5-4
Азурит
Cu3(CO3)2(OH)2
55,3
3,7-3,9
3,5-4
2,0-2,3
2-4
2,2-2,2
2,5
Силикаты
Хризоколла
CuSiO3·nH2O
До 45
Сульфаты
Халькантит
CuSO4·5H2O
25,4
Брошантит
Cu4SO4·(OH)6
34,8
3,8-3,9
3,5-4
проф. Игнаткина В.А.,2017
58
59.
Требования к медным концентратамГОСТ Р 52998-2008 - Концентрат медный. Технические условия.
Дата введения 2010-01-01
Марка
Массовая доля, %
меди, не менее
примесей, не более
цинка
свинца
КМ0
40,0
2,0
2,0
КМ1
35,0
2,0
2,5
КМ2
30,0
3,0
4,0
КМ3
25,0
5,0
4,5
КМ4
23,0
6,0
4,5
КМ5
20,0
7,0
4,5
КМ6
18,0 (12,0)
8,0
4,5
As≤0,6 (1,2 %); Mo≤0,12 (0,18 %); влажность≤7 %
проф. Игнаткина В.А.,2017
59
60.
Раздельная флотация песков и шламовМедистые песчаники
проф. Игнаткина В.А.,2017
60
61.
Медно-порфировые рудыпроф. Игнаткина В.А.,2017
61
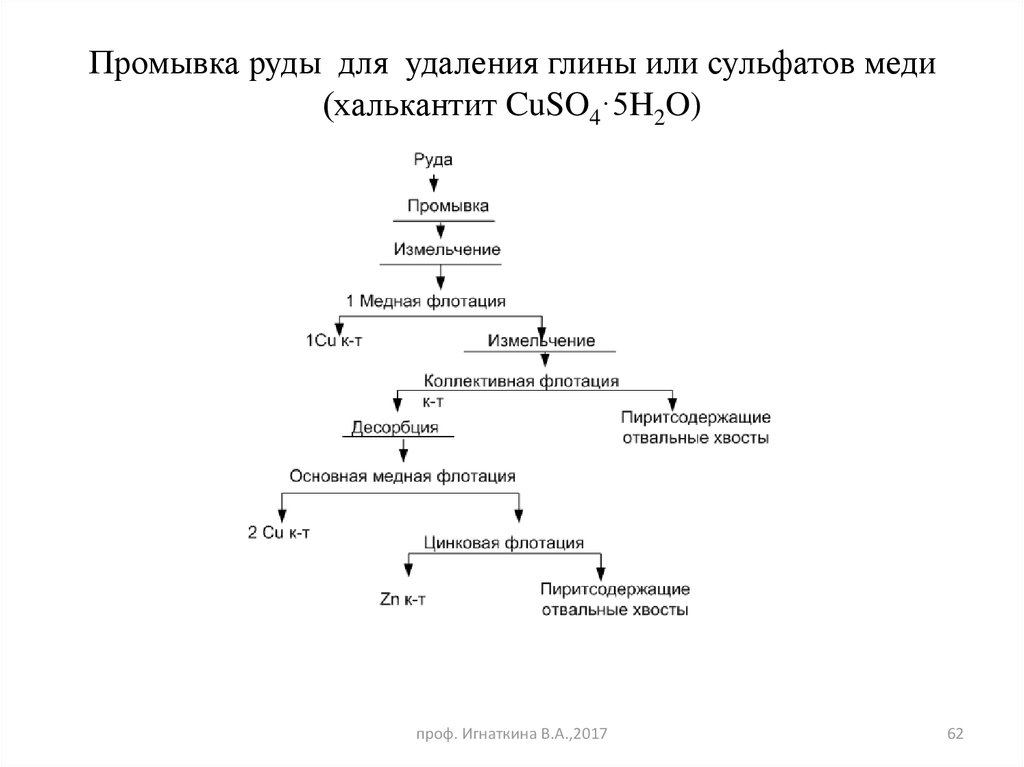
62.
Промывка руды для удаления глины или сульфатов меди(халькантит CuSO4·5H2O)
проф. Игнаткина В.А.,2017
62
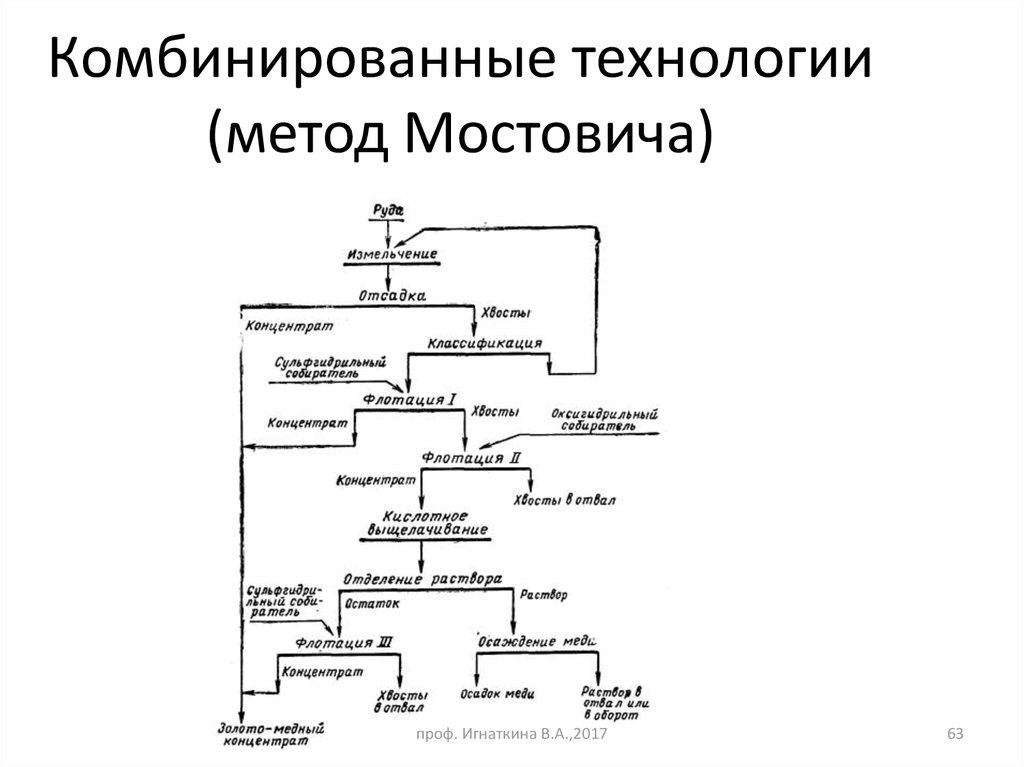
63. Комбинированные технологии (метод Мостовича)
проф. Игнаткина В.А.,201763
64. Полярные несульфиды
• Оксиды (Fe2O3, FeTiO3, MnO2, лопарит(Na,Ce,Ca,Sr,Th)(Ti,Nb,Fe)O3
• Солеобразующие (CaF2, CaCO3, Ca5(PO4)3F …)
• Силикаты и кварц (цирконий ZrSiO4 , сподумен
LiAl(Si2O6), лепидолит KLi1.5Al1.5(Si3AlO10)(F,OH)2,
SiO2)
проф. Игнаткина В.А.,2017
64
65. Реагентные режимы несульфидных руд
• Регуляторы среды (кислоты (серная H2SO4,плавиковая HF), щелочи (сода Na2CO3))
• Модификаторы (кислоты, кремнефтористый
натрий Na2SiF6, щавелевая кислота H2C2O4,
КМЦ, крахмал, сернистый Na2S натрий…)
• Оксигидрильные собиратели (карбоновые
кислоты R-COOH и их мыла R-COONa (олеат,
таловые масла, СЖК), алкилсульфаты ROSO3, алкилфосфаты, Аспарал Ф R –( COO,
NH, OSO3)
проф. Игнаткина В.А.,2017
C1865
66.
-CaCO3|ТВ+2RCOO-→-Ca(RCOO)2+ 2CO=3проф. Игнаткина В.А.,2017
66
67. Особенности использования производных карбоновых кислот
• Мицелообразование – растворимостьолеиновой кислоты 20 мг/л (7,1·10-5 моль/л)
и рКа = 4,7
Олеат натрия 309 мг/л (1,1·10-3 моль/л) при
50 0С
• Температура флотации не менее 16 0С
• Повышенное пенообразование
проф. Игнаткина В.А.,2017
67
68.
проф. Игнаткина В.А.,201768
69. Плавиковая кислота HF
активирует• полевые шпаты
• Берилл Al2Be3(Si6O18)
депрессирует
• Кварц SiO2
• Сподумен LiAl(Si2O6)
проф. Игнаткина В.А.,2017
69
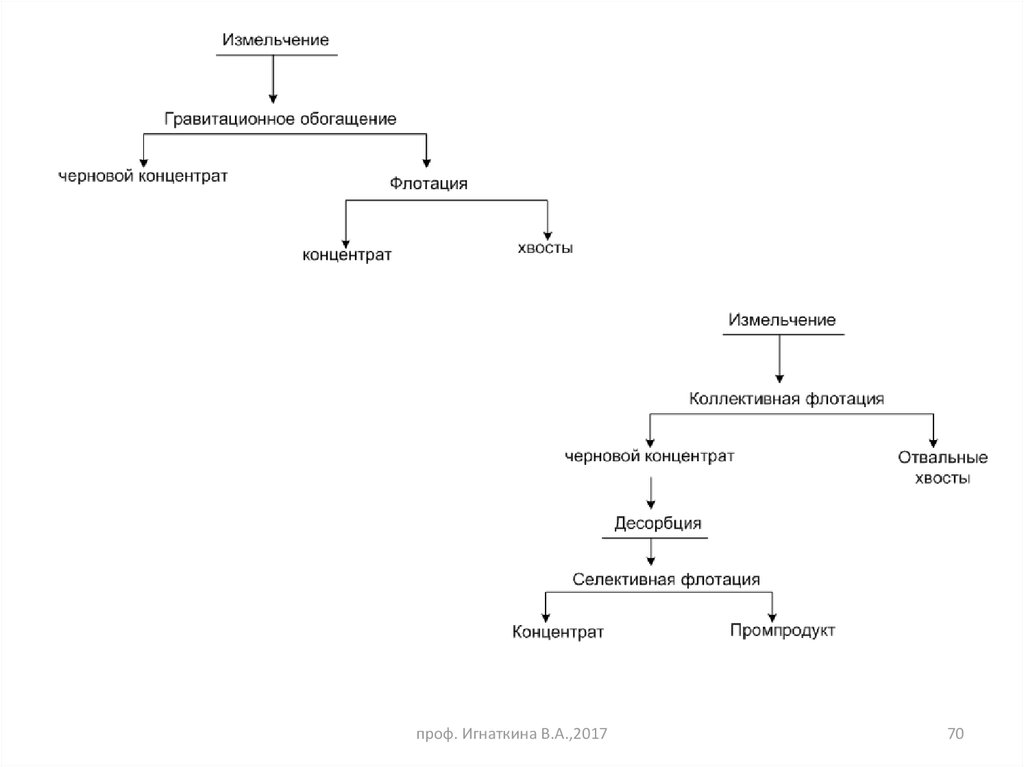
70.
проф. Игнаткина В.А.,201770
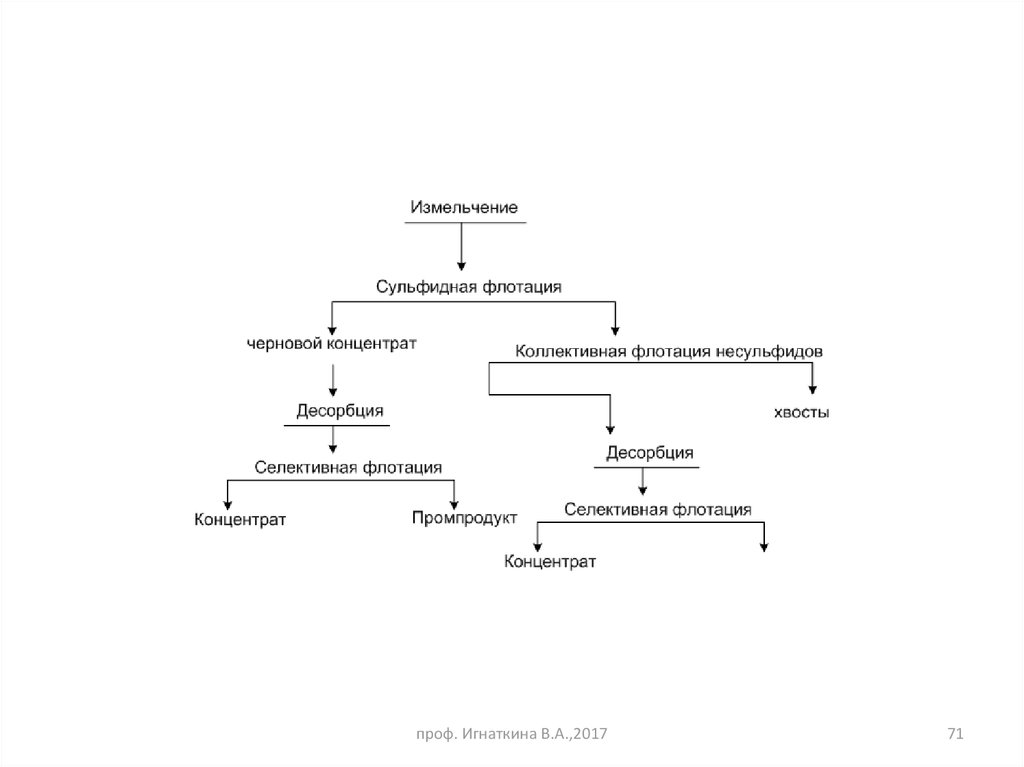
71.
проф. Игнаткина В.А.,201771
72. Высокотемпературные воздействия
• Обжиг для разрушения кальцита,• Восстановительная сульфидизация,
• Декрипитация – растрескивание минералов
при их нагревании и быстром охлаждении.
проф. Игнаткина В.А.,2017
72
73. Десорбция с применением пропарки
сульфидыкальциевые
• Высокотемпературная в
• Метод Петрова – с
щелочной среде
жидким стеклом Na2SiO3
(разделение Cu-Mo
(2,5-4 %) при температуре
коллективного
70-85 0С)
концентрата) –
окислительные условия
• Высокотемпературная в
среде сернистого натрия
(разделение Cu-Mo
коллективного
концентрата) –
восстановительные
проф. Игнаткина В.А.,2017
73
условия
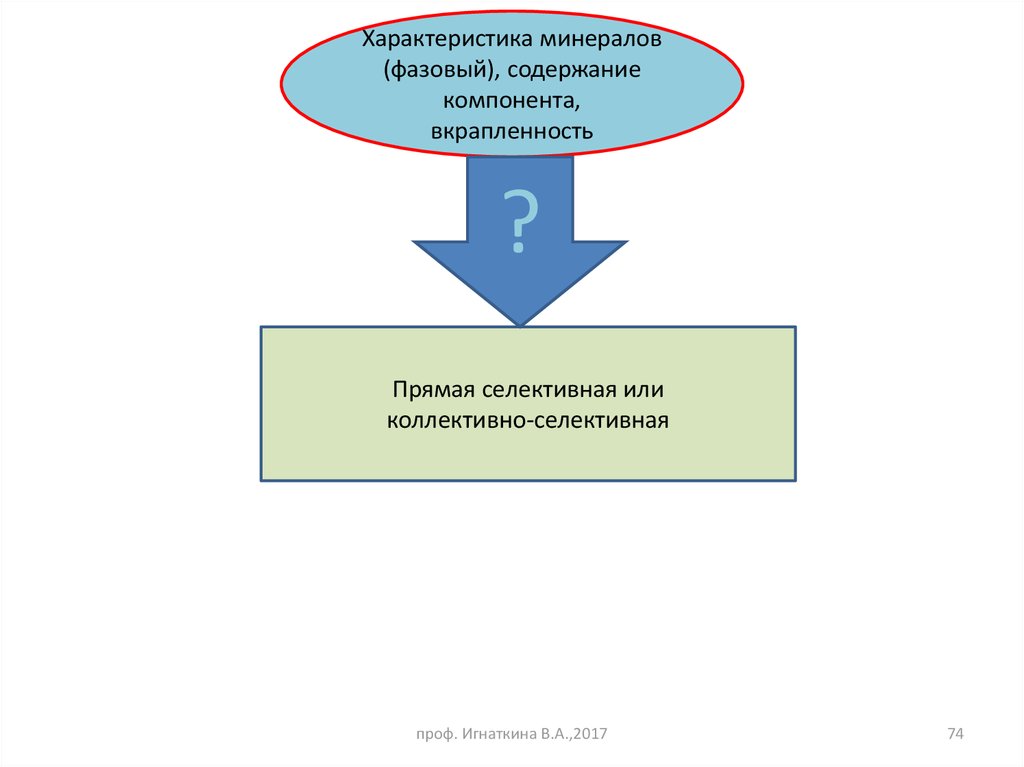
74.
Характеристика минералов(фазовый), содержание
компонента,
вкрапленность
?
Прямая селективная или
коллективно-селективная
проф. Игнаткина В.А.,2017
74
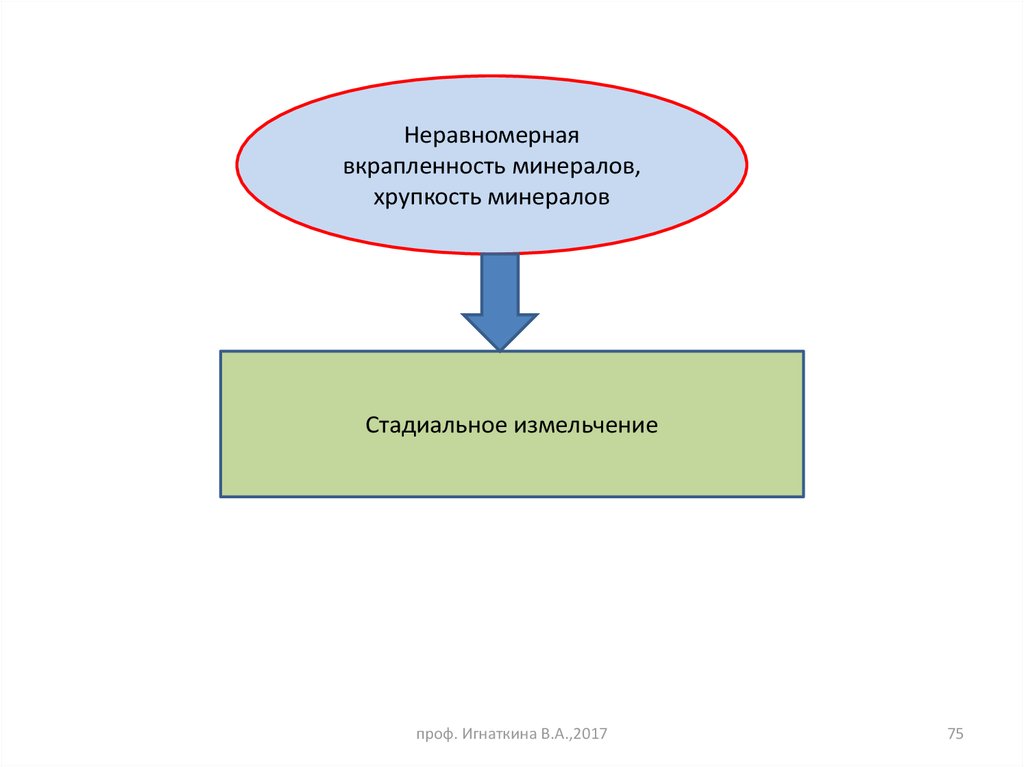
75.
Неравномернаявкрапленность минералов,
хрупкость минералов
Стадиальное измельчение
проф. Игнаткина В.А.,2017
75
76.
Неравномерноегранулометрическое
распределение минералов
Комбинирование с другими обогатительными
процессами (гравитация, магнитная сепарация….)
проф. Игнаткина В.А.,2017
76
77. Флотация
Железные руды• Получение
суперконцентратов
угли
• Флотация шламов
(селективная флокуляция)
проф. Игнаткина В.А.,2017
77













































 Промышленность
Промышленность








