Похожие презентации:
Начала коллоидной химии
1. Л-8. Начала коллоидной химии
1. Предмет, задачи, понятия коллоидной химии1.1. Объект, предмет коллоидной химии
1.2. Гетерогенные системы - III
2. Устойчивость дисперсных систем
2.1. Двойной электрический слой
2.2. Электрооптические явления
3. Биологическая роль коллоидов
Литература
1. Мушкамбаров, Н.Н. Физическая и коллоидная химия: учебник для
медицинских вузов (с задачами и решениями). – М.: ООО
"Медицинское информационное агентство", 2008. – 295 с.
2. Семиохин, И.А. Физическая химия: учебник. — М.: МГУ, 2001. — 272 с.
3. Родин, В.В. Основы физической, коллоидной и биологической
химии: курс лекций / Ставропольский ГАУ. – Ставрополь: Агрус, 2009. –
124 с.
4. Евстратова, К.И. Физическая и коллоидная химия: учебник для фарм.
вузов и факультетов /К.И. Евстратова, Н.А. Купина, Е.Е. Малахова. – М.:
В. шк., 1990. — 487 с.
2. 1. Предмет, задачи, понятия физической химии
1.1. Коллоидная химия изучает различные свойствадисперсных систем в зависимости от их
химического состава, строения и внешних условий.
Объект коллоидной химии – вещества в макро- и
микро- диспергированных состояниях.
Предмет коллоидной химии – дисперсные системы,
физико-химические явления и процессы в них.
Задачи коллоидной химии:
– обосновать причины физико-химических явлений и
процессов; выявить роль среды в их проявлении;
-выбор способов их описания;
-разработка методов их исследования;
-разработка рекомендаций по управлению ими.
3. 1. Предмет, задачи, понятия коллоидной химии
1.2. Гетерогенные системы - IIIРазнообразные системы, различные и по
природе фаз, и по размерам частиц, и по агрегатному
состоянию фаз обладают общими свойствами:
– гетерогенностью;
– термодинамической неустойчивостью.
Фаза — это совокупность гомогенных частей
системы, имеющих одинаковые химические, физические и термодинамические характеристики во всех
своих точках.
Фаза может быть непрерывной, а может быть
дисперсной, т. е. состоять из отдельных фрагментов
или частиц.
Примеры дисперсных фаз — льдинки; капельки масла в
воде; пузырьки воздуха в воде при нагревании; частицы
измельчённого угля; пыль в воздухе.
4. 1. Предмет, задачи, понятия коллоидной химии
1.2. Гетерогенные системы - IIIПо степени раздробленности (дисперсности)
системы делятся на следующие классы:
- грубодисперсные, размер частиц - более 10-5 м;
- тонкодисперсные (микро-гетерогенные) с размером
частиц от 10-5 до 10-7 м;
- коллоидно-дисперсные (ультра-микро-гетерогенные)
с частицами размером от 10-7 до 10-9м.
Один компонент дисперсной системы играет
роль дисперсионной среды, а другой – роль дисперсной фазы.
В этом случае все дисперсные системы можно
классифицировать по агрегатным состояниям фаз.
Центральное место в коллоидной химии занимают ультрамикро-гетерогенные системы со свободными частицами.
Это - так называемые коллоидные системы.
5. 1. Предмет, задачи, понятия коллоидной химии
1.2. Гетерогенные системы - III1. ДИСПЕРСНАЯ СИСТЕМА (ДИСПЕРСИЯ) - гетерогенная
система из двух или большего числа фаз, из которых
одна (дисперсионная среда) непрерывна, а другая
(дисперсная фаза) диспергирована (распределена) в ней
в виде отдельных частиц (твёрдых, жидких или газообразных). При размере частиц 10-5 см и меньше система
называется коллоидной.
2. КОЛЛОИДНОЕ СОСТОЯНИЕ ВЕЩЕСТВА - высокодисперсное (сильно раздробленное) состояние, в котором
отдельные частицы являются не молекулами, а
агрегатами, состоящими из множества молекул. Размер
частиц должен отвечать размерам 10-5-10-7 см. Для
существования таких систем требуется введение
стабилизаторов.
6. 1. Предмет, задачи, понятия коллоидной химии
1.2. Гетерогенные системы - III3. ЗОЛЬ – дисперсная система, в которой размер
частиц отвечает коллоидной степени дисперсности, т.е. лежит
в пределах от 10-5 до 10-7 см.
Золи с газообразной дисперсионной средой называют
аэрозолями, с жидкой - лиозолями. В зависимости от природы
дисперсионной среды лиозоли делятся на гидрозоли, алкозоли, этеро-золи и бензо-золи, у которых дисперсионной
средой являются соответственно вода, спирт, эфир, бензол.
Физико-химическая система – часть материального
мира, ограниченная реально существующей или
воображаемой поверхностью раздела и составляющая
предмет исследования.
7. 1. Предмет, задачи, понятия коллоидной химии
1.2. Гетерогенные системы - IIIЛИОЗОЛЬ - дисперсная система, в которой
твёрдые частицы с размером 10-5-10-7 см распределены
в жидкой непрерывной среде.
ГИДРОЗОЛЬ - свободнодисперсная коллоидная
система, в которой твёрдые частицы с размером 10-5-107см распределены в водной среде.
ОРГАНОДИСПЕРСИИ, ОРГАНОЗОЛИ дисперсные системы, в которых дисперсионная
среда - органическая жидкость.
Органозоль - дисперсная система, в которой
твёрдые частицы коллоидного размера распределены
в органической жидкости.
8. 1. Предмет, задачи, понятия коллоидной химии
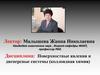
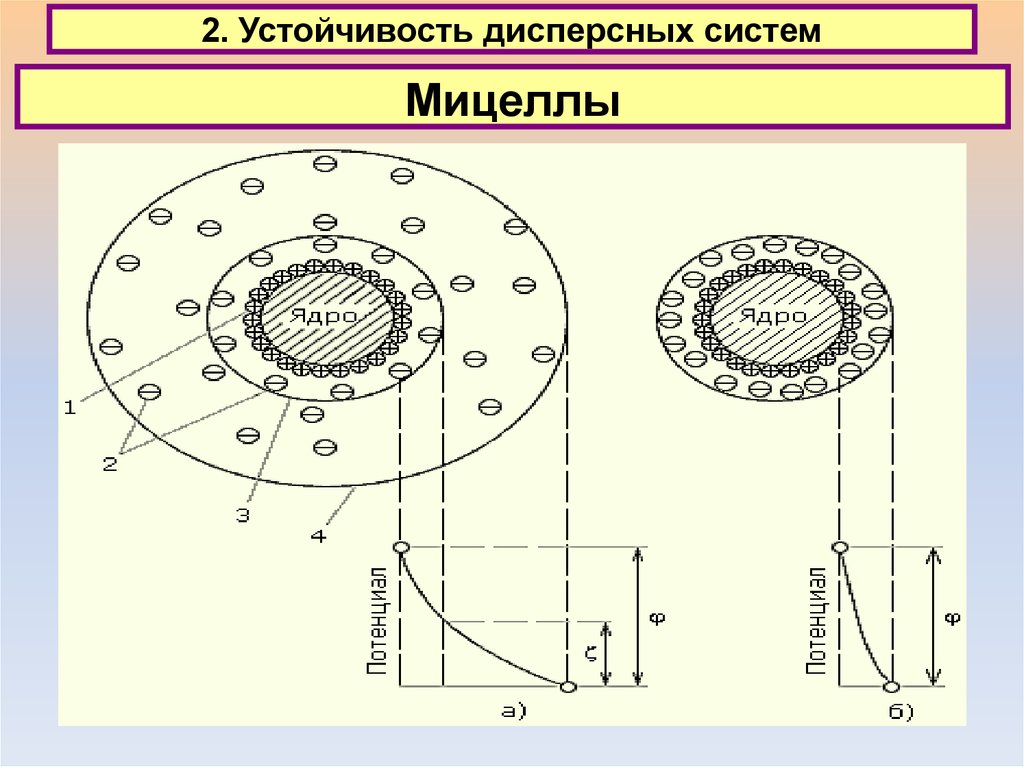
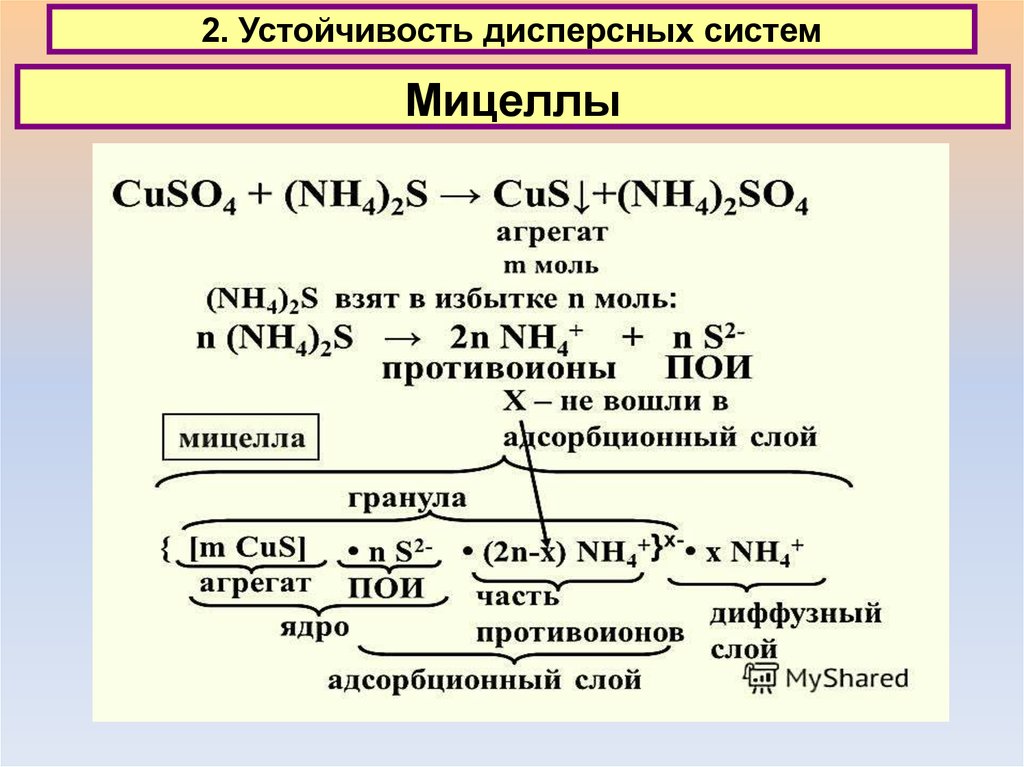
1.2. Гетерогенные системы - IIIМИЦЕЛЛА - коллоидно-химический комплекс,
состоящий из частицы и двойного ионного слоя.
В растворах поверхностно-активных веществ это агрегат из длинноцепочечных дифильных молекул
или ионов ПАВ, образующийся самопроизвольно при
определённой концентрации, зависящей от природы
полярной группы и, особенно, от длины цепи молекул.
В водных растворах ассоциация части молекул
(ионов) происходит в результате сцепления цепей, в
неводных (неполярных) средах - за счёт полярных
(функциональных) групп.
9. 1.2. Гетерогенные системы - III
Классификация дисперсных систем по агрегатнымсостояниям фаз
10. 1.2. Гетерогенные системы - III
Примеры свободнодисперсных систем11. 1.2. Гетерогенные системы - III
Примеры связнодисперсных систем12. 2. Устойчивость дисперсных систем
Коллоидные системы необычайно лабильны, т.е.неустойчивы. Для многих из них достаточно прибавления
ничтожного количества электролита, чтобы вызвать
выпадение осадка. Причина столь лёгкого изменения
состояния коллоидных систем связана с непостоянством
степени их дисперсности.
Различают два вида устойчивости любой
раздробленной системы – кинетическую и агрегативную.
Одно из самых резких и характерных отличий
коллоидной системы и от истинного раствора, и от
грубодисперсных систем в том, что в ней степень
дисперсности является чрезвычайно непостоянной
величиной и может изменяться в зависимости от самых
разнообразных причин.
13. 2. Устойчивость дисперсных систем
14. 2. Устойчивость дисперсных систем
Во многих случаях устойчивость такихсистем связана с наличием слоя стабилизатора
на поверхности коллоидных частиц.
Необходимым условием создания
устойчивых коллоидных систем является
присутствие третьего компонента стабилизатора.
Стабилизаторы - электролиты или другие
вещества не электролитной природы - ВМС или
ПАВ.
15. 2. Устойчивость дисперсных систем
Структурно-механические свойстваадсорбционных слоев в значительной мере
определяют поведение коллоидных систем.
Эти слои могут быть образованы или изменены
небольшими количествами каких-либо растворенных
веществ, поэтому создаётся возможность
регулирования ряда свойств коллоидных систем в
различных практических приложениях.
Коллоидные системы с частицами
диспергированного вещества, способных свободно
перемещаться в жидкой дисперсионной среде
совместно с адсорбированными на их поверхности
молекулами или ионами третьего компонента
(стабилизатора), называют лиозолями, а сами частицы,
обладающие сложным строением – мицеллами.
16. 2. Устойчивость дисперсных систем
Лио-золи по ФрейндлихуЛиофобные системы -- частицы дисперсной
фазы которых не взаимодействуют с дисперсионной
средой, не сольватируются и не растворяются в ней.
Лиофильные системы -- частицы дисперсной
фазы которых интенсивно взаимодействуют с
дисперсионной средой.
Лио-золи по Ребиндеру
Дисперсные много-или двухфазные системы он разделил
на два класса, исходя из величины удельной межфазовой
энергии (поверхностного натяжения).
17. 2. Устойчивость дисперсных систем
Лиофобные системы - золи драгоценныхметаллов, золи металлоидов (серы, селена, теллура),
дисперсии полимеров в воде (например, полистирола,
фторолона), золи сульфидов мышьяка, сурьмы,
кадмия, ртути, золи гидроксидов железа, алюминия, …
Эти системы характеризуются кинетической
устойчивостью и агрегативной неустойчивостью и
требуют стабилизации.
18. 2. Устойчивость дисперсных систем
Лиофильные коллоидные системы – поФрейндлиху – растворы, образующиеся при
растворении природных или синтетических ВМС:
растворы белков, крахмала, пектинов, камедей,
эфиров целлюлозы и разнообразных смол, как
природных так и синтетических.
Лиофильные системы считались двух- или
многофазными, термодинамически неустойчивыми,
неподчиняющимися правилу фаз Гиббса.
Достоверно установлено, что растворы ВМС – это
истинные растворы, т.е. однофазные системы,
гомогенные,
термо-динамически
устойчивые
и
подчиняющиеся правилу фаз Гиббса.
19. 2. Устойчивость дисперсных систем
Лиофобные системы – по Ребиндеру – дисперсныесистемы с достаточно высоким межфазовым натяжением
(s12), большим некоторого граничного значения sm: s12 > sm .
У них большая межфазовая свободная энергия,
поэтому граница раздела фаз выражена резко:
система является агрегативно неустойчивой и требует
введения стабилизатора.
Дисперсность таких систем является произвольной.
Лиофильные системы – по Ребиндеру – это
двухфазные коллоидные системы с низкой, хотя и
положительной межфазовой свободной энергией, меньшей
или равной граничному значению, s12 ≤ sm .
Это системы с очень малой межфазовой энергией,
они термо-динамически устойчивы и образуются
самопроизвольно.
Дисперсность их вполне определена и находится в
коллоидной области.
20. 2. Устойчивость дисперсных систем
Лиофильные системы1) так называемые критические эмульсии,
образующиеся в результате снижения поверхностного
натяжения при нагревании до температуры, близкой к
температуре неограниченного смешения, или в результате
прибавления очень больших количеств ПАВ;
2) ассоциативные коллоидные системы, образуемые
в водной среде веществами типа мыл, некоторых
красителей и дубителей, а в неводной среде некоторыми
ПАВ. Такие вещества в разбавленных растворах находятся в
молекулярном состоянии, при увеличении концентрации
происходит агрегация молекул с образованием частиц
коллоидного размера, т.е. образуются мицеллы.
21. 2. Устойчивость дисперсных систем
Мицеллы22. 2. Устойчивость дисперсных систем
Мицеллы23. 2. Устойчивость дисперсных систем
Мицеллы24. 2. Устойчивость дисперсных систем
Мицеллы25. 2. Устойчивость дисперсных систем
Мицеллы26. 2. Устойчивость дисперсных систем
Факторы и параметры устойчивостиКонцентрацию ПАВ, при которой в его растворе
возникает большое количество мицелл, находящихся в
термодинамическом равновесии с молекулами (ионами), и
резко изменяется ряд свойств раствора, называют
критической концентрацией мицеллообразования (ККМ).
Мицеллами ПАВ называют агрегат из длинноцепочечных дифильных молекул или ионов, образующихся
самопроизвольно в их растворах выше ККМ, зависящей от
природы полярной группы (групп) и особенно от длины
цепи молекулы.
В водных растворах ассоциация части молекул
(ионов) происходит в результате сцепления цепей, в
неводных (неполярных) средах – за счёт сцепления
полярных групп.
27. 2. Устойчивость дисперсных систем
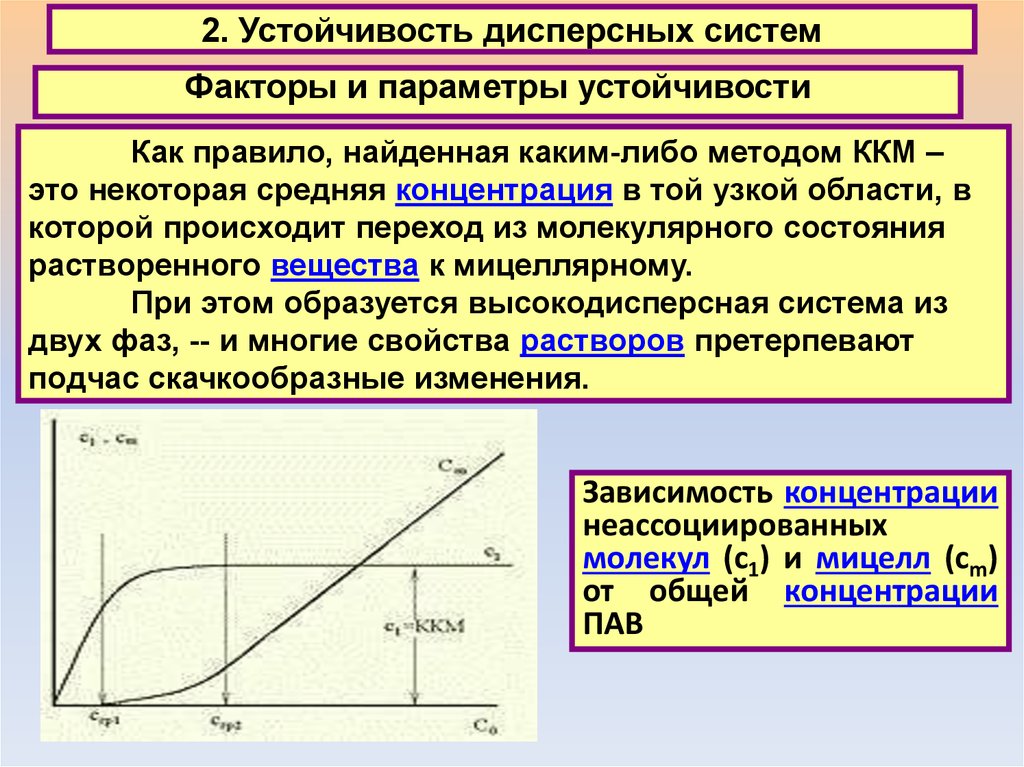
Факторы и параметры устойчивостиКак правило, найденная каким-либо методом ККМ –
это некоторая средняя концентрация в той узкой области, в
которой происходит переход из молекулярного состояния
растворенного вещества к мицеллярному.
При этом образуется высокодисперсная система из
двух фаз, -- и многие свойства растворов претерпевают
подчас скачкообразные изменения.
Зависимость концентрации
неассоциированных
молекул (с1) и мицелл (сm)
от общей концентрации
ПАВ
28. 2. Устойчивость дисперсных систем
Факторы и параметры устойчивостиКонцентрацию ПАВ, при которой в его растворе
возникает большое количество мицелл, находящихся в
термодинамическом равновесии с молекулами (ионами), и
резко изменяется ряд свойств раствора, называют
критической концентрацией мицеллообразования (ККМ).
Мицеллами ПАВ называют агрегат из длинноцепочечных дифильных молекул или ионов, образующихся
самопроизвольно в их растворах выше ККМ, зависящей от
природы полярной группы (групп) и особенно от длины
цепи молекулы.
В водных растворах ассоциация части молекул
(ионов) происходит в результате сцепления цепей, в
неводных (неполярных) средах – за счёт сцепления
полярных групп.
29. 2. Устойчивость дисперсных систем
Факторы и параметры устойчивости1.
2.
3.
4.
5.
6.
7.
8.
Агрегативная
Седиментационная
Изо-электрическая точка
Лиофильность, лиофобность
Потенциалы течения
Мембранный потенциал
Био-потенциал
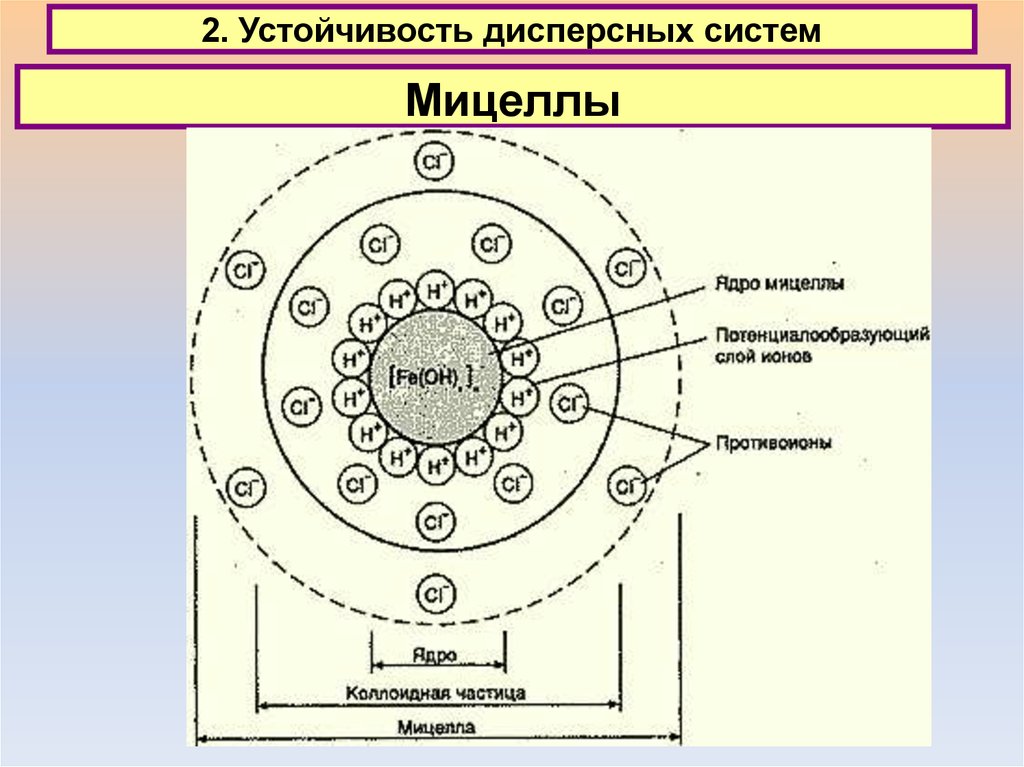
Дзета-потенциал
Тот факт, что дисперсные системы классифицируются по
величине свободной поверхностной энергии, показывает,
что коллоидные явления тесно связаны со свойствами
поверхности раздела фаз.
























 Химия
Химия