Похожие презентации:
Периодический закон. Периодическая система элементов. (Лекция 2)
1. Лекция №2
2.
3.
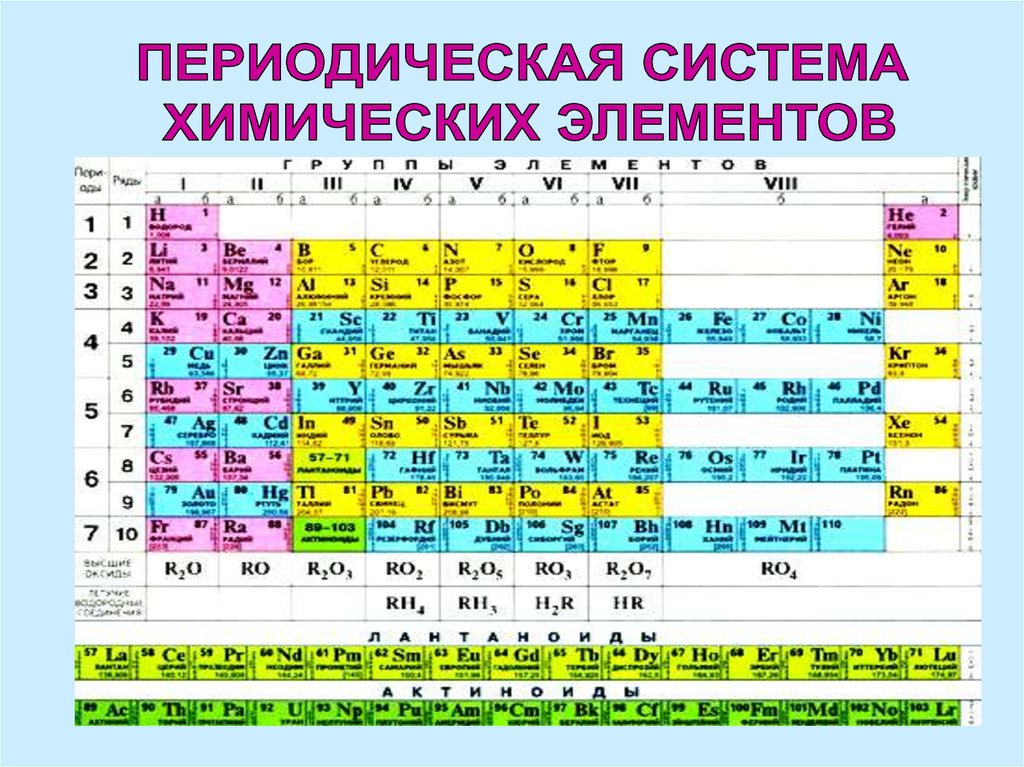
1869 г.Периодическая система
элементов - графическое
изображение периодического
закона.
Состоит из 10 горизонтальных
рядов
и 8 вертикальных групп.
4. Периоды - ряды элементов, в пределах которых свойства изменяются последовательно. По горизонтали семь периодов (1-7). Периоды 1, 2, 3 состоят из
Периоды - ряды элементов, впределах которых свойства изменяются
последовательно.
По горизонтали семь периодов (1-7).
Периоды 1, 2, 3 состоят из одного ряда
элементов - малые, остальные
периоды - большие.
2 и 3 периоды типические
5.
В 6 периоде находятсялантаноиды,
в 7 периоде – актиноиды,
их помещают вне общей
таблицы
и не относят к какой-либо
группе.
6.
Группасостоит из двух подгрупп:
главной
(содержит типические элементы и сходные с
ними по химическим свойствам элементы
больших периодов)
и побочной
(содержит только металлы – элементы
больших периодов).
8 группа содержит 3 побочные
подгруппы: железа, кобальта и никеля.
7. СТРОЕНИЕ АТОМА. Модели атома
ДемокритСвойства вещества
определяются
характеристиками образующих
его атомов.
8. СТРОЕНИЕ АТОМА. Модели атома
ТомсонАтом – положительно
заряженное тело
с заключенными внутри него е.
9. СТРОЕНИЕ АТОМА. Модели атома
1911 г. Э. Резерфорд, Н. БорПланетарная модель атома.
е – частица.
10. СТРОЕНИЕ АТОМА. Модели атома
Современная модель атома.Развитие планетарной модели.
Атом – ядро и окружающее его
электронное облако.
Ядро атома: р (+), n (0).
Окружено e (-).
11. Современная модель атома
Но:е движется не по определенным
траекториям, а характеризуется
плотностью вероятности
нахождения частицы в данной
точке пространства в данный
момент времени.
12. Современная модель атома
Орбиталь - пространствовблизи ядра, в котором
достаточно велика вероятность
нахождения е.
На одной орбитали может
находиться не более 2 е.
13. Современная модель атома
Орбитали изображаютквадратиком
(квантовая ячейка).
Стрелки обозначают, что на
орбитали находится е.
14. Современная модель атома
Изотопы– атомы с одним количеством р,
но разным количеством n;
разными физическими и одними
химическими свойствами
(Н – с 1 n – дейтерий,
с 2 n – тритий).
15. Состояние е в атоме. 4 квантовых числа
1. Главное квантовое число nопределяет число энергетических
уровней
n = N периода
если атом в невозбужденном состоянии
16. 4 квантовых числа
2. Орбитальное квантовое числоL
показывает форму орбиталей
17. Орбитальное квантовое число
s-орбиталь имеет сферическуюформу,
р-орбиталь - форму гантели,
d-орбиталь – форму цветка,
f-орбиталь – еще более сложную
форму
L от 0 до n-1
18. 4 квантовых числа
3. Магнитное квантовое числоm
Определяет расположение
орбитали в пространстве
m от -L до +L
(включая 0)
19. Магнитное квантовое число
L = 0, то m = 0,s-орбитали имеют 1 положение
в пространстве,
L = 1, m = -1, 0, +1,
р-орбитали – 3 положения,
20. Магнитное квантовое число
L = 2, m = -2, -1, 0, +1, +2,d-орбитали – 5 положений,
L = 3, m = -3, -2, -1, 0, +1, +2,
+3,
f-орбитали – 7.
21. 4 квантовых числа
4. Спиновое квантовое число sхарактеризует два возможных
направления вращения
электронов вокруг собственной
оси
S = +1/2 и -1/2
22. Распределение электронов
Принцип минимума энергииэлектрон в первую очередь
располагается в пределах
электронной подоболочки с
наименьшей энергией.
23. Распределение электронов
Первое правилоКлечковского:
Заполнение электронных
орбиталей идет от меньшего
значения суммы (n + L) к
большему.
24. Распределение электронов
Второе правилоКлечковского:
При одинаковой сумме (n + L)
заполнение идет от меньшего
n к большему.
25. Распределение электронов
Принцип ПаулиЧисло электронов
на энергетическом уровне N равно:
N = 2n2,
где n - главное квантовое число
26. Распределение электронов
Правило ХундаЕсли только возможно, электроны
в атомах стремятся оставаться
неспаренными
27.
Строение электронной оболочкиизображается электронной
формулой:
Энергетические уровни
обозначаются цифрами 1, 2, 3, 4,..
подуровни - буквами s, р, d, f,..
электроны - индексами над ними 2p6
28. современная формулировка периодического закона
Строение и свойства элементови их соединений находятся в
периодической зависимости
от заряда ядра атомов
29. современная формулировка периодического закона
и определяются периодическиповторяющимися
однотипными электронными
конфигурациями их атомов
30. Закономерности
1. Число энергетических уровнейв атоме = номеру периода.
31. Закономерности
2. Общее число е в атоме =порядковому номеру элемента
в Периодической системе.
32. Закономерности
3. У элементов главных подгруппчисло e на внешнем энергетическом
уровне = номеру группы
Периодической системы
(валентные e).
33. Закономерности
4. У элементов побочных подгрупп IIIVII групп, элементов побочнойподгруппы железа VIII группы
общее число e на s-подуровне
внешнего энергетического уровня
атома и d-подуровне предпоследнего
уровня = номеру группы (все они валентные e).
34. Закономерности
5. У элементов побочных подгруппI и II групп d-подуровень
предпоследнего энергетического
уровня завершен (d10), а на внешнем
энергетическом уровне
число e = номеру группы.
35. Периодические свойства атома
количество электронов навнешней электронной
оболочке
36. Периодические свойства атома
атомный и ионный радиусыпо периоду заряд ядра ↑, атомный радиус ↓
(например, от лития к фтору);
по главным и третьей побочной подгруппам
сверху вниз число электронных оболочек
↑, атомный радиус ↑ (например, от лития к
францию)
37. Периодические свойства атома
энергия ионизацииколичество энергии,
необходимой для отрыва e от атома
(по периоду ↑, по группе ↓)
38. Периодические свойства атома
сродство к электронуколичество энергии,
выделяющейся при присоединении
дополнительного e к атому
(по периоду ↑, по группе ↓)
39. Периодические свойства атома
восстановительная активностьспособность атома
отдавать e другому атому
(вдоль по периоду ↓,
вниз по группе ↑)
40. Периодические свойства атома
окислительная активностьспособностью атома
присоединять e от другого атома
(вдоль по периоду ↑,
вниз по группе ↓)
41. Периодические свойства атома
электроотрицательностьспособность атома в соединении
притягивать к себе e
(в периоде ↑, в группе ↓)
42. Периодические свойства атома
степень окисленияусловный заряд атома в соединении,
вычисленный исходя из
предположения, что оно состоит
только из ионов.
Выражается арабскими цифрами со знаками
«+», «-», «0» над символом элемента
43. Правила определения степени окисления
В простых веществах (N2 , Cl2, …)степень окисления атомов равна 0.
Щелочные металлы (Na, K, …)
имеют степень окисления +1,
щелочноземельные (Са, Ва, …) +2.
44. Правила определения степени окисления
Водород в соединениях снеметаллами (Н2О, Н2S) имеет
степень окисления +1,
а с металлами
(в гидридах - CaH2 , NaH) -1.
45. Правила определения степени окисления
Фтор имеет степень окисления -1.Кислород проявляет степень
окисления -2.
Искл. OF2, его степень окисления
+2.
46. Правила определения степени окисления
Алгебраическая сумма степенейокисления всех атомов,
входящих в состав молекулы,
всегда равна нулю,
а в сложном ионе – заряду.
47. Периодические свойства атома
Валентностьчисло химических связей, которыми
данный атом соединен с другими.
Число связей = числу его
неспаренных e.
48. Валентность и степень окисления
Степень окисления атома не всегдасовпадает с числом образуемых
им связей, т.е. не равна
валентности данного элемента.
Например, СО – валентности = III,
а степени окисления +2 и -2















































 Химия
Химия








