Похожие презентации:
Строение атома. Периодический закон и периодическая система элементов
1. Строение атома. Периодический закон и Периодическая система элементов Д.И.Менделеева
Быть может, эти электроныМиры, где пять материков,Искусства, званья, войны, троны
И память сорока веков.
Еще, быть может, каждый атомВселенная, где сто планет;
Там всё, что здесь, в объёме сжатом,
Но также то, чего здесь нет.
В. Брюсов «Мир электрона»
2.
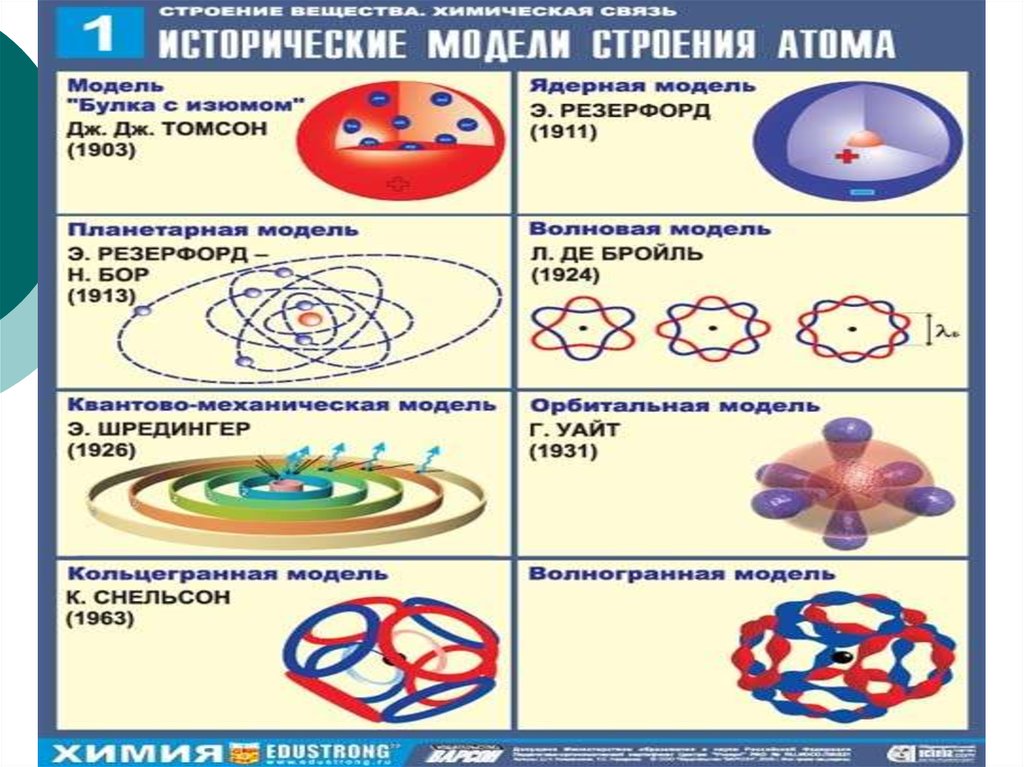
3. Современная модель строения атома
В основе современной теории строения атомалежат работы:
Дж. Томсона (который в 1897 г. открыл
электрон, а в 1904 г. предложил модель
строения атома, согласно которой атом – это
заряженная сфера с вкрапленными электронами
(модель «кекс с изюмом»)),
Э. Резерфорда (который в 1910 г. открыл ядро и
предложил ядерную планетарную модель атома),
Однако, планетарная модель строения атома противоречит классической электродинамике, т.к. электрон, вращающийся вокруг ядра, должен непрерывно излучать
энергию, в результате чего он за очень короткий промежуток времени (с) упадет на ядро, и атом прекратит свое существование.
Недостатки модели Резерфорда были устранены Н. Бором, который, дополнив ее новыми постулатами, представил динамическую модель строения атома водорода.
Н. Бора (который в 1910 г. предложил
динамическую модель строения атома водорода),
В основу своей теории Н. Бор положил
следующие постулаты:
4.
1) В изолированном атоме существуюторбиты, двигаясь по которым, электрон
не излучает энергию. Такие орбиты
называются стационарными
характеризуются энергией находящегося
на них электрона Еn, где n – номер
орбиты.
2) Излучение происходит только при
перемещении электрона с одной
стационарной орбиты на другую.
5.
М. Планка (который в 1900 г. высказалпредложение, что вещества поглощают и
пропускают энергию дискретными пропорциями,
названными им квантами),
А. Эйнштейна (который в 1905 г предсказал, что
любое излучение представляет собой поток
квантов энергии, назваными им фотонами),
Луи де Бройля (который в 1924 г. выдвинул
предложение, что электрон характеризуется
также корпускулярно-волновым дуализмом),
Вернера Гейзенберга (который в 1927 г.
постулировал принцип неопределенности),
Эрвина Шредингера (который в 1926 г. вывел
математическое описание поведения электрона в
атоме) и многих других. Работы этих ученых
заложили основу квантовой механики,
изучающей движение и взаимодействие
микрочастиц.
6. Современная модель строения атома базируется на четырех положениях:
1. В центре атома находится положительнозаряженное ядро, занимающее ничтожную часть
пространства внутри атома (например, радиус
атома водорода сост. 0,046 нм, а радиус протона
или ядра атома водорода составляет 6,5.10-7 нм).
2. Положительный заряд и почти вся масса атома
сосредоточены в ядре атома.
3. Ядра атомов состоят из протонов и нейтронов
(общее название нуклоны). Число протонов в
ядре равно порядковому номеру элемента, а
сумма чисел протонов (p) и нейтронов (n)
соответствует его массовому числу.
4. Вокруг ядра по орбиталям вращаются
электроны. Число электронов в невозбужденном
(основном) сост. равно заряду ядра.
7.
Различные виды атомов имеют общееназвание – нуклиды.
Нуклиды с одинаковым зарядом,
различными массовыми числами и
числом нейтронов в ядре называется
изотопами.
Нуклиды с одинаковыми массовыми
числами, но различными зарядами
ядра и числа нейтронов в ядре
называются изобарами (40Ar, 40K,
40Ca).
Нуклиды с одинаковым числом
нейтронов, но различным зарядом и
массовым числом называется
изотонами (нуклиды 157N и 146C,
имеющие по 8 нейтронов).
8. Корпускулярно-волновой дуализм
В соответствии с представлениями квантовой механики,электрон обладает двойственной природой, т.е. корпускулярноволновым дуализмом: с одной стороны электрон – это частица, которая имеет массу,
заряд и скорость движения; а с другой стороны электрон проявляет волновые свойства, такие как
способность к дифракции, интерференции и особенности движения.
Длина волны определяется в соответствии с соотношением
Де Бройля:
λ = h / (m υ)
λ – длина волны в см (м);
h – постоянная Планка
m – масса частицы в г (кг);
υ – скорость частицы в см/с (м/с).
Гипотеза де Бройля получила экспериментальное
подтверждение для малых частиц (электронов, нейтронов).
9.
Согласно принципу неопределенности В.Гейзенберга невозможно одновременно с
одинаково большой точностью указать
положение частицы и ее импульс, поэтому в
квантово-механической модели атома используют
вероятностный подход для характеристики
положения электрона.
Вероятность нахождения электрона в
определенной области пространства описывается
квадратом волновой функции Ψ2 (пси), которая
характеризует амплитуду волны, как функцию
координат электрона. Электрон может находиться в
любой части околоядерного пространства, однако
вероятность его нахождения в разных частях этого
пространства неодинакова.
10. Уравнение Шредингера
Исходя из утверждения о наличии у электрона волновых свойств, австрийский физик Э. Шредингер предположил, что состояниеэлектрона в атоме должно описываться известным в физике уравнением стоячей электромагнитной волны. (Стоячей волной
называется электромагнитная волна, расположенная в одной плоскости).
Подставив в уравнение стоячей волны значения
по де Бройлю , Э. Шредингер получил новое
уравнение, связывающее энергию электрона с
пространственными координатами и волновой
функцией (ψ).
11.
Уравнение Шредингера представляет собойдифференциальное уравнение в частных
производных:
где: ð2- дифференциальный оператор,
представляющий собой сумму вторых
частных производных по соответствующим
координатам, m - масса покоя электрона, E полная энергия электрона, U= e2/r потенциальная энергия электрона.
12.
Так как потенциальная функцияэлектрона в атоме водорода имеет
вид
где e — заряд электрона (и протона),
r — радиус-вектор, то уравнение
Шрёдингера запишется следующим
образом:
Здесь ψ — волновая функция
электрона в системе отсчёта протона,
m — масса электрона,
13.
постоянная Планка:h = 6.62·10-34 Дж·с.
ћ = h/2π = 1.05·10-34 Дж·с
E — полная энергия электрона,
оператор Лапласа:
14. Орбиталь
Пространство вокругядра, в котором
вероятность нахождения
электрона достаточно
велика, называется
орбиталью.
Вероятность нахождения
электрона внутри данной
области пространства
составляет не менее 95 %.
15. Квантовые числа
Главное квантовое число (n)определяет энергию и размеры
электронных орбиталей, удаленность
уровня от ядра. Принимает целые
значения (n = 1, 2, 3... до + ) и
соответствует номеру периода.
Число n показывает, сколько подуровней
имеет каждый уровень, и какой
энергетический уровень является
внешним. Чем больше n, тем выше
энергия. Оболочки (уровни) имеют
буквенные обозначения
n=1 2 3 4 5 6 7
K L M N O PQ
16. Физический смысл n
Определяет Энергию электронана уровне
Е=-13,6 z2/n2, где n- глав. кв.
число,
Z – заряд ядра.
Е – энергия электрона на эн.
Уровне, эВ.
17. Орбитальное квантовое число
Орбитальное (побочное или азимутальное ( ))квантовое число определяет форму атомной орбитали и
характеризует энергетические подуровни.
Величина принимает целочисленные значения от 0 до
(n – 1) и может обозначаться буквами.
Подуровень
s рd fg
Орбитальное квантовое число = 0 1 2 3 4
Каждому значению соответствует орбиталь особой
формы, например s-орбиталь имеет сферическую форму,
р-орбиталь – гантель.
В одной и той же оболочке энергия подуровней
возрастает в ряду Es < Ep < Ed < Ef < Eg. В первой
оболочке (n = 1) может быть одна s-; во второй (n = 2)
две s- и р-, в третьей (n = 3) s-, р- и d-, в четвертой (n
= 4) s-, р-, d- и f- подоболочки и т. д.
18.
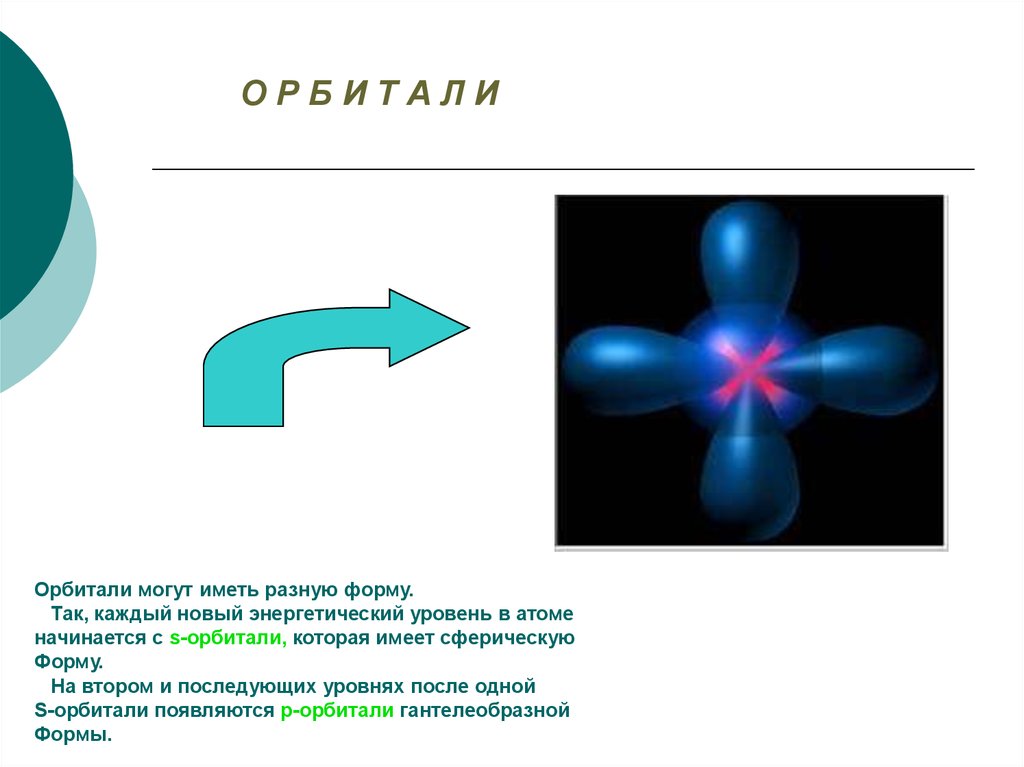
ОРБИТАЛИОрбитали могут иметь разную форму.
Так, каждый новый энергетический уровень в атоме
начинается с s-орбитали, которая имеет сферическую
Форму.
На втором и последующих уровнях после одной
S-орбитали появляются p-орбитали гантелеобразной
Формы.
19. Магнитное квантовое число
Магнитное квантовое число (m ) характеризуеториентацию орбиталей в пространстве относительно
внешнего магнитного или электрического поля и их
максимального количества для подуровней. В отсутствие
внешнего магнитного поля все орбитали одного подуровня
имеют одинаковое значение энергии.
Величина m принимает целочисленные значения от – до
+ , включая ноль, и меняется скачкообразно. Это означает,
что для каждой формы орбитали существует (2 + 1),
энергетически равноценных ориентации в пространстве.
Так при = 0 m = 0 – это s-подуровень, имеющий одну
орбиталь шарообразной формы;
при = 1 m = -1; 0; +1 – это p- -подуровень, имеющий три
оболочки гантелеобразной формы (рис. 1);
при = 2 m = -2; -1; 0; +1; +2 – это d подуровень -пять
орбиталей сложной конфигурации,
а при = 3 m = -3; -2; -1; 0; +1; +2; +3 это f- подуровень
семь орбиталей сложной конфигурации.
20.
21. Спиновое квантовое число
Спиновое квантовое число (ms)характеризует механический момент движения
электронов и имеет два значения +1/2 и –1/2,
соответствующие противоположным
направлениям вращения. Электроны с разными
спинами обычно обозначаются противоположно
направленными стрелками ↑ ↓.
Каждая электронная орбиталь в атоме (или
атомная орбиталь (АО)) характеризуется
тремя квантовыми числами: n, и m .
Общие число АО равно n2. Условно атомную
орбиталь обозначают в виде клеточки.
Состояние электрона в атоме полностью
характеризуется четырьмя квантовыми числами
n, , m , и ms.
22. Строение многоэлектронных атомов
Запись распределения электронов в атоме по уровням,подуровням и орбиталям получила название электронной
конфигурации элемента.
При составлении электронных конфигураций
многоэлектронных атомов учитывают: принцип
минимальной (наименьшей) энергии, принцип
Паули, правила Гунда (Хунда) и Клечковского.
Принцип минимальной энергии: электроны в
невозбужденном атоме распределяются по орбиталям
таким образом, чтобы суммарная энергия атома была
минимальной (n + ). Первыми заполняются орбитали с
минимальными уровнями энергии.
23.
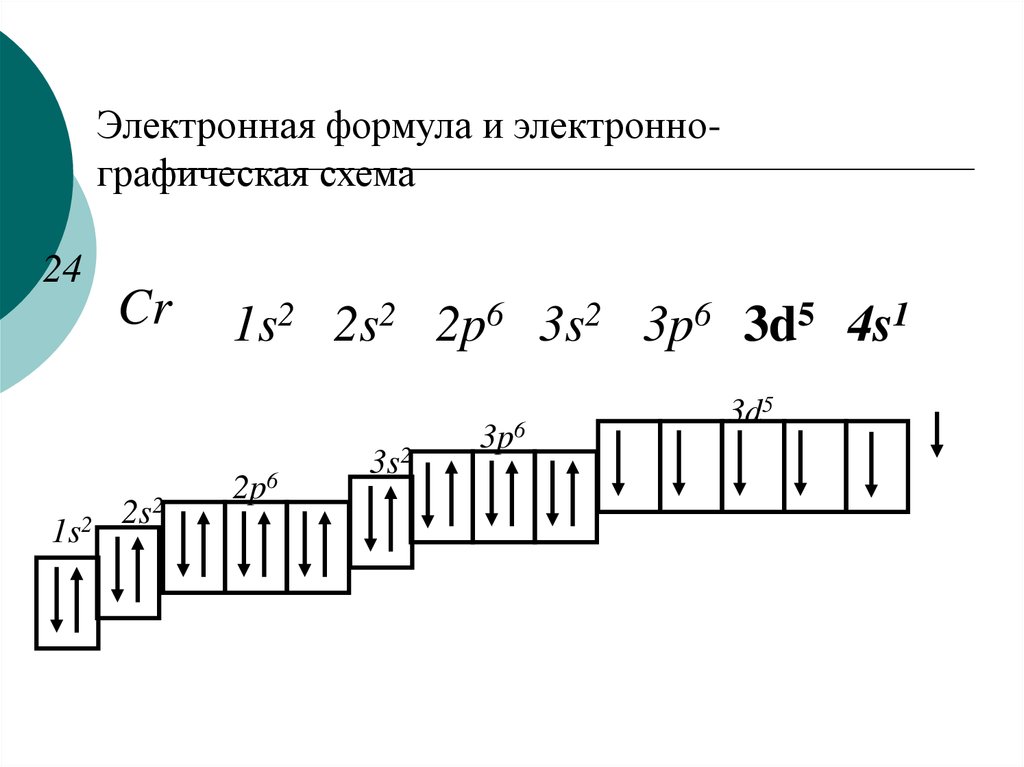
Электронная формула и электроннографическая схема24
1s2
Cr
2s2
1s2 2s2 2p6 3s2 3p6 3d5 4s1
2p6
3s2
3p6
3d5
24.
Правило В. Клечковского. Увеличение энергиии соответственно заполнение орбиталей
происходит в порядке возрастания суммы
квантовых чисел n + , а при равной сумме n +
в порядке возрастания n.
Соответственно этому правилу подуровни
выстраиваются в следующий ряд:
1s < 2s < 2p < 3s < 3p < 4s 3d < 4p < 5s 4d <
5p < 6s 5d 4f < 6p < 7s и т. д.
Исключение составляют d- и f-элементы с
полностью и наполовину заполненными
подуровнями, у которых наблюдается так
называемый «провал электронов», например Cu,
Ag, Cr, Mo, Pd, Pt.
25.
Принцип Паули (1925): на однойатомной орбитали не может быть более
двух электронов, причем они должны
иметь противоположные
(антипараллельные) спины. По-другому
можно сказать: в атоме не может
быть двух электронов, обладающих
одинаковым набором 4 квантовых
чисел n, , m , и ms. Поэтому
допускается заполнение и не
допускается заполнение и .
26. Правило Гунда (Хунда):
Правило Гунда (Хунда):заполнение электронами
подуровня происходит т.о.,
чтобы суммарный спин был
максимален, т.е при наличии
нескольких пустых или
наполовину заполненных АО
данного подуровня электроны
занимают максимально возможное
число АО.
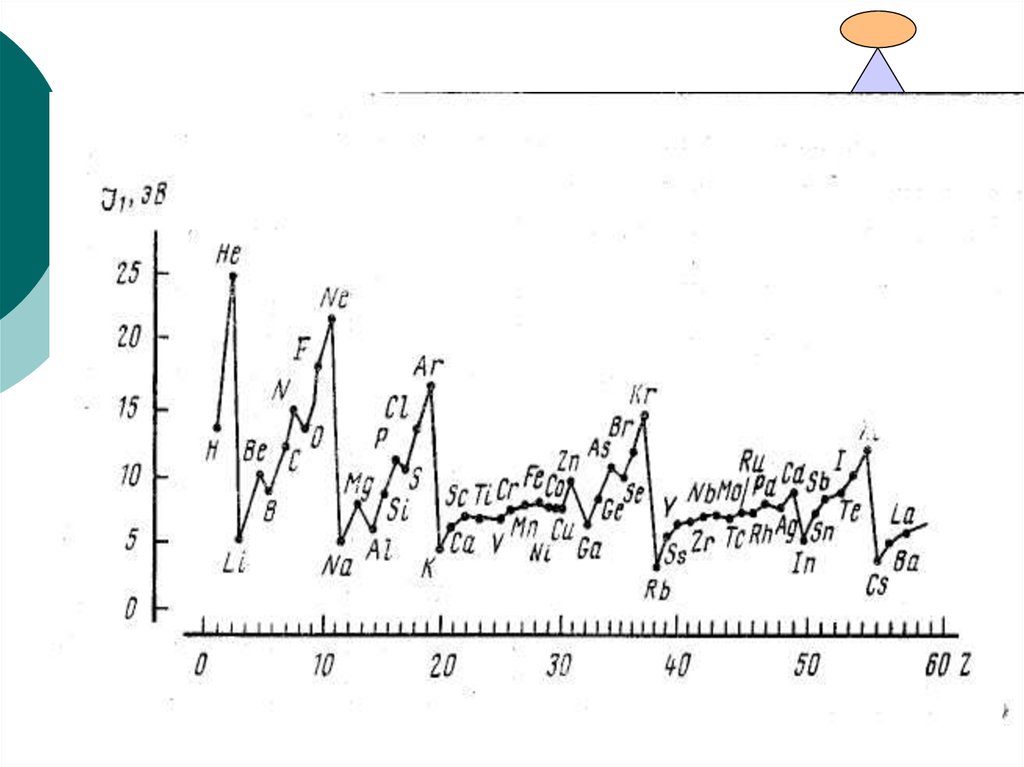
27. Периодические свойства атомов элементов
Энергия ионизации (J), или, первыйионизационный потенциал (J1)
представляет собой наименьшую энергию,
необходимую для удаления электрона от
свободного атома в его низшем
энергетическом (основном) состоянии на
бесконечность. Э + J = Э+ + е Энергию ионизации выражают в
килоджоулях на моль (кДж/моль),
либо в электронвольтах (эВ/моль).
1 эВ= 96.32 кДж/моль
28. J2, J3, J4,
(для многоэлектронного атомасуществуют также понятия
второго, третьего и т. д.
ионизационных потенциалов, - Это
энергия удаления электрона от его
свободных невозбуждённых
катионов с зарядами +1, +2 и т. д.
Эти ионизационные потенциалы,
как правило, менее важны для
характеристики химического
элемента.),
29.
30.
Энергия ионизации характеризуетвосстановительную способность
элемента. Чем ниже энергия ионизации,
тем выше восстановительная
способность элемента. Энергия ионизации
определяется электронным строением элементов и ее изменение
имеет периодический характер
.
Энергия ионизации возрастает по периоду.
В группе энергия ионизации уменьшается с
увеличением порядкового номера элемента, что
обусловлено увеличением размеров атомов. Наименьшие
значения энергии ионизации имеют щелочные элементы,
что объясняется эффектом экранирования.
Он заключается в уменьшении воздействия на внешние электроны
положительного заряда ядра из-за наличия между ними других электронов.
Эффект экранирования противоположен эффекту проникновения электрона во
внутренние области атома.
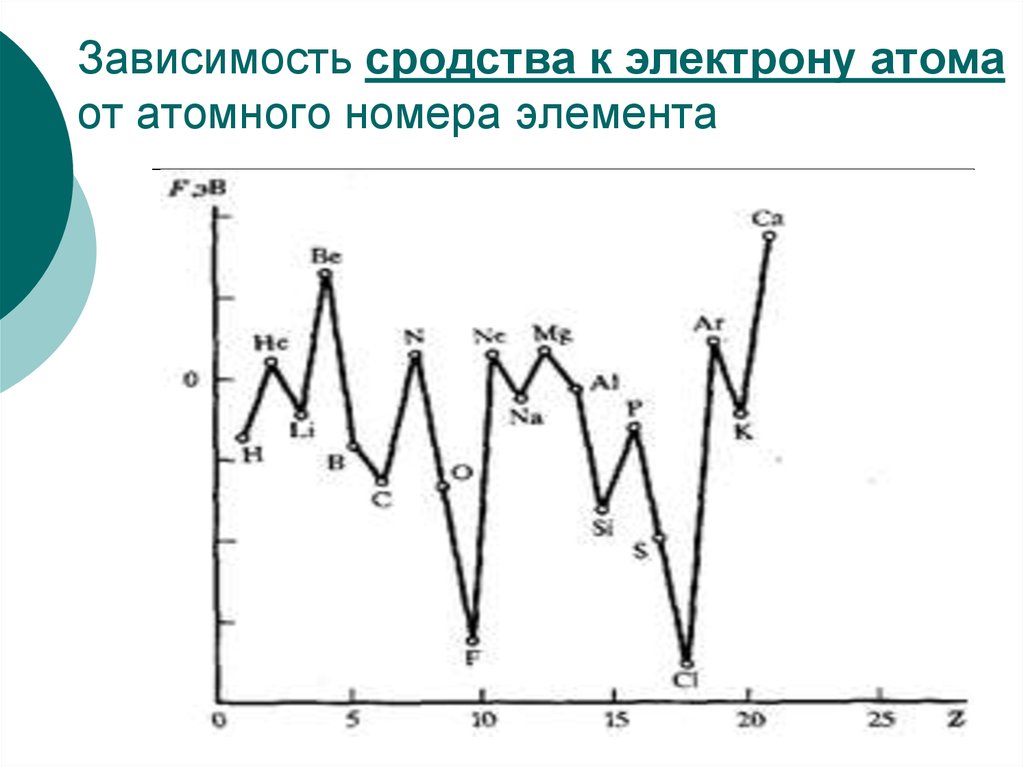
31. Сродство к электрону
Сродство к электрону – этоэнергетический эффект присоединения
моля электронов к молю нейтральных
атомов. Например: Э + е- = Э- +Ее.
Количественно сродство к электрону Е евыражается в кДж/моль или эВ и зависит
от положения элемента в периодической
системе. Наибольшие значения сродства
к электрону имеют галогены, кислород,
сера, наименьшие и даже отрицательные
значения ее – элементы с электронной
конфигурацией s2 (He, Be, Mg, Zn), c
полностью или наполовину
заполненными p-подуровнями (Ne, Ar, Kr,
N, P, As).
32. Зависимость сродства к электрону атома от атомного номера элемента
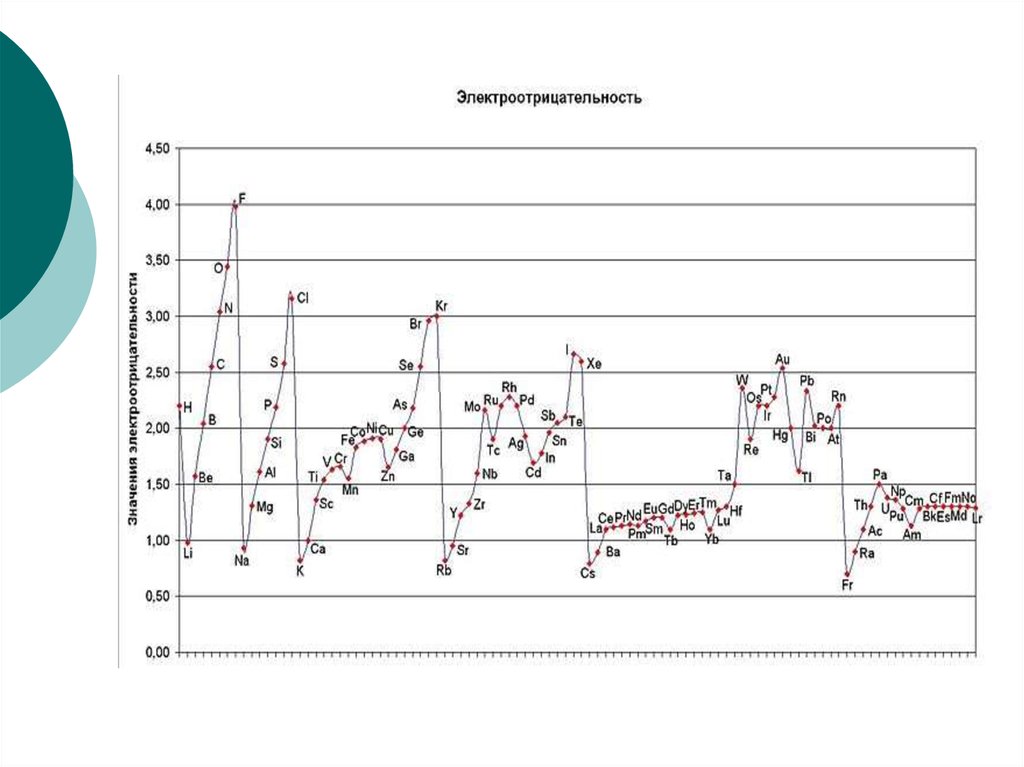
33. Электроотрицательность
Электроотрицательность (ЭО) – этохарактеристика способности атомов в
соединениях притягивать к себе электроны.
Имеется несколько шкал ЭО. Согласно P.
Малликену (США) ЭО равна полусумме энергии
ионизации и энергии сродства к электрону.
Относительная ЭО (ОЭО) по Л. Полингу
(США) – это разность энергии диссоциации
соединения А-В и образующих его молекул
А-А и В-В. За единицу в ней принята
ЭО лития.
ОЭО (F)=4. Величина ЭО возрастает по
периоду и несколько убывает в
группах с возрастанием номера
периода
34.
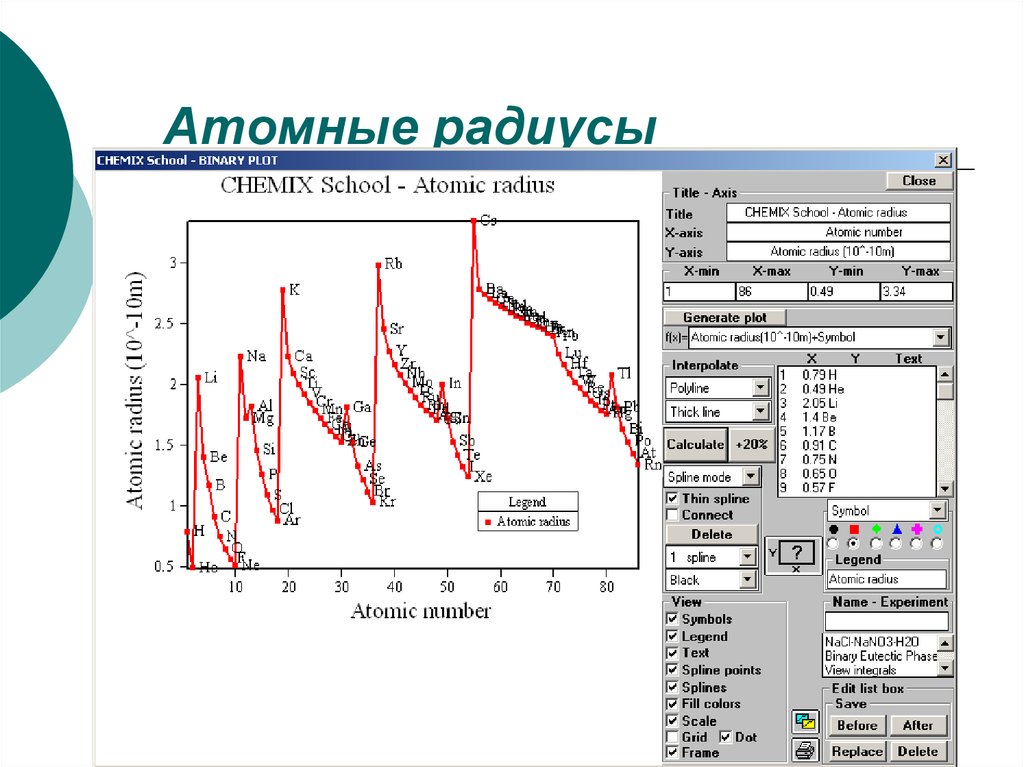
35. Атомные радиусы
Атомные радиусы элементов не имеютстрого определенных границ из-за
корпускулярно-волнового характера
электронов. Поэтому абсолютное
значение радиуса атома определить
невозможно. Можно условно принять за
радиус атома теоретически рассчитанное
значение расстояния от ядра до
наиболее удаленного от него максимума
электронной плотности (орбитальный
радиус атома) или половину расстояния
между центрами 2-х смежных атомов в
кристаллах (эффективные радиусы
атомов).
36. Эффективные атомные и ионные радиусы
R(F-)=0,113 нм,а расстояние Na-F 0,231 нм, отсюда
R(Na+)= 0,231 - 0,113 нм=0,118нм.
Для одного и того же элемента эфф.
радиусы (ков., ион.,мет.)не
совпадают между собой.
37. Орбитальный радиус атома
Для любого атома может быть толькоодин орб. радиус в нормальном
состоянии и много в возбужденных.
Орб. радиусы ближе к истинному
размеру атома, чем эффективные.
R(F-)=0,04 нм,
R(Na+)=0,019 нм.
38. Периодичность изменение атомных радиусов
Наблюдается периодичность изменение атомныхрадиусов (эффект. и орбит.), особенно у s- и pэлементов. У d- и f-элементов кривая изменения
радиусов атомов по периоду имеет более плавный
характер.
В одной и той же группе с увеличением номера
периода атомные радиусы, как правило, возрастают в
связи с увеличением числа электронных оболочек.
Однако увеличение заряда ядра в периодах при этом
производит к уменьшению ат. радиусов, поэтому
увеличение атомных радиусов с увеличением номера
периода относительно невелико, а в некоторых
случаях, например у p-элементов III группы значение
орбитального радиуса у Al больше, чем у Ga.
Уменьшение ат. рад. с увеличением ат. массы носит
название лантаноидного (актиноидного) сжатия.
39. Атомные радиусы
40. Диагональная аналогия
При переходе по периоду слева направорадиусы атомов и ионов уменьшаются
настолько, насколько они увеличиваются
при переходе сверху вниз по группе., т.е
радиусы атомов элементов,
расположенных по диагонали (Li и Mg,
Be и Al)т близки, это положение было
отмечено Менделеевыми называется
диагональной аналогией:
Li - Be
Ве - В
Mg
Al
41. Вторичная периодичность
Изменение свойств энергии ионизации,атомных радиусов в подгруппах элементов
имеют немонотонный характер
Н-р в ряду С-Si-Ge-Sn-Pb имеются
внутренние минимумы и максимумы.
Немонотонность изменения свойств
элементов в подгруппе называется
вторичной периодичностью.
Открыта русским физико-химиком Е.В.
Бироном в 1915 г, доказана С.А.
Щукаревым
42. Физ. смысл периодического закона
В свете учения о строении атомов:Свойства простых веществ, а также
формы и свойства их соединений
находятся в периодической
зависимости от заряда ядра атомов
элементов.
Физ. смысл периодического закона
заключается в периодическом изменении
свойств атомов элементов в результате
периодически возобновляющихся
сходных электронных оболочек атома
при последовательном возрастании
значений главного квантового числа
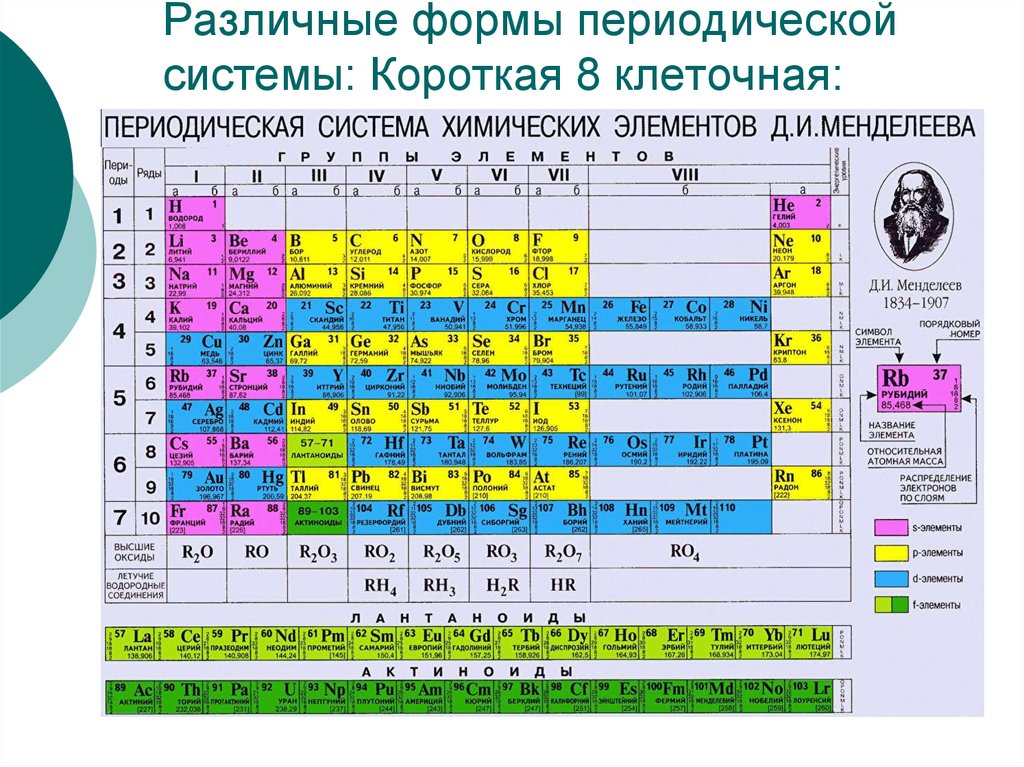
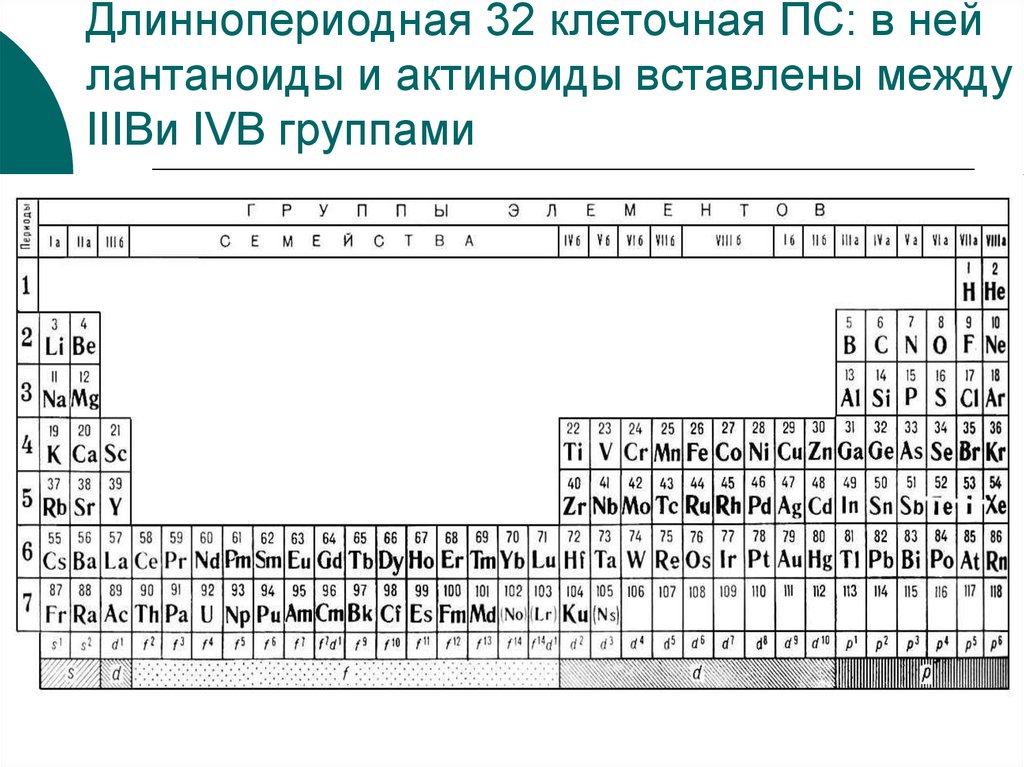
43. Периодическая система Д.И. Менделеева
Период –это горизонтальный рядэлементов, начинающийся щел. Ме и
заканчив. Благ. Газом. (малые, большие,
незавершенный).
Типическими элементами Д.И. Менделее
называл элементы II и III периодов
Ряды элементов (четные, нечетные),
семейства, триады
В периодах наблюдается горизонтальная
аналогия (в семействах, триадах)
44.
Группа элементоввертикальные столбцы, в кот.входят сходные по свойствам
элементы.
Главные подгруппы состоят из
элементов и больших и малых
периодов, побочные только из
эл. больших периодов
В подгруппах наблюдается
групповая
(вертикальная)аналогия.






































 Химия
Химия








