Похожие презентации:
Гидролиз солей
1. ГИДРОЛИЗ СОЛЕЙ
«Вода, у тебя нет ни цвета, ни вкуса, ни запаха,тебя невозможно описать, тобой
наслаждаются,
не ведая, что ты такое.
Нельзя сказать,
что необходимо для жизни: ты сама жизнь. »
(А. де Сент-Экзюпери. Планета людей)
2. Гидролиз – это реакция обменного разложения веществ водой.
ГидролизГидролиз – это реакция обменного разложения
веществ водой.
Частицы растворенного вещества в воде
окружены гидратной оболочкой. В некоторых
случаях это приводит к химическому
взаимодействию с образованием новых
веществ, к реакции гидролиза.
hydro – вода, lysis - распад
3.
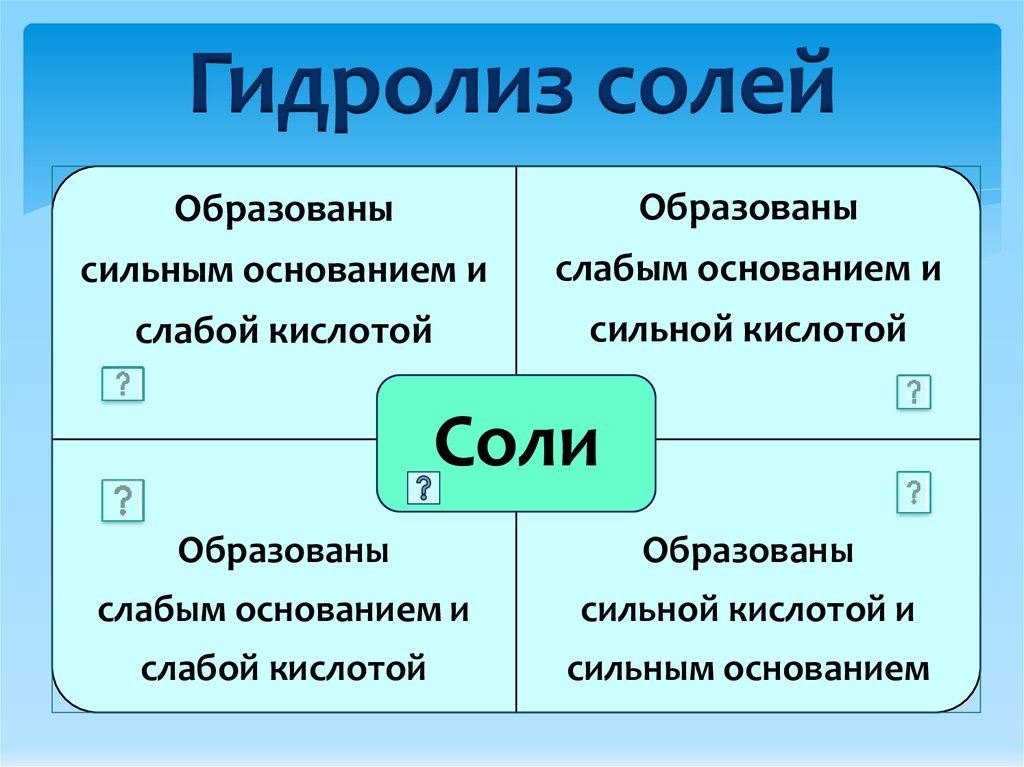
Гидролиз солейОбразованы
Образованы
сильным основанием и
слабым основанием и
слабой кислотой
сильной кислотой
Соли
Образованы
Образованы
слабым основанием и
сильной кислотой и
слабой кислотой
сильным основанием
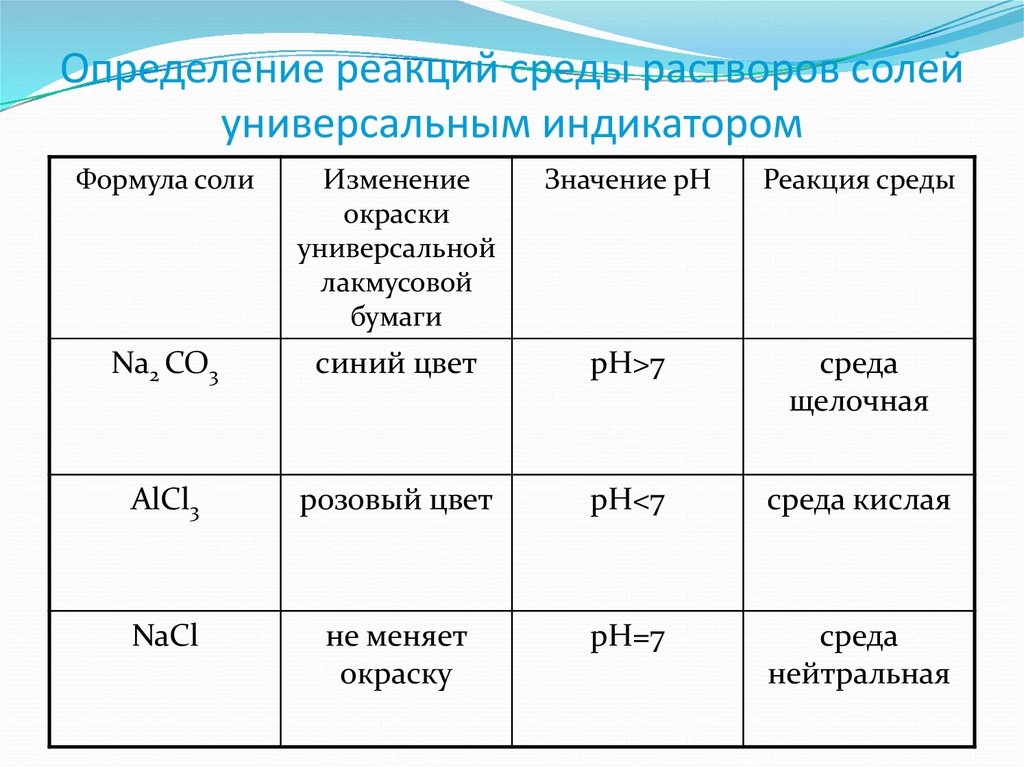
4. Определение реакций среды растворов солей универсальным индикатором
Формула солиИзменение
окраски
универсальной
лакмусовой
бумаги
Значение рН
Реакция среды
Na2 CO3
синий цвет
pH>7
среда
щелочная
AlCl3
розовый цвет
pH<7
среда кислая
NaCl
не меняет
окраску
pH=7
среда
нейтральная
5. Алгоритм составления уравнений гидролиза солей
1. Записать уравнение диссоциации соли;2. Выбрать слабый ион;
3. Записать его взаимодействие с водой;
4. Определить среду раствора;
5. Составить молекулярное и полное
ионное уравнения.
6. Гидролиз солей, образованных слабым основанием и слабой кислотой:
Al2 (CO3)3 ↔ 2Al3+ + 3CO32─H2O ↔ OH─ + H+
Al3+ + HOH ↔ (AlOH)2+ + H +
CO32─ + HOH ↔ HCO3 ─ + OH ─
Реакция среды зависит от силы
образовавшегося слабого электролита.
7. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой:
3Na2CO3 + 2AlCl3 → Al2(CO3)3 + 6NaClAl2(CO3)3 + 3HOH → 2Al(OH)3 + 3CO2 ↑
3Na2CO3 + 2AlCl3 + 3H2O → 2Al(OH)3 +3CO2↑+ 6NaCl
Например, соли, которые нельзя получить
реакцией обмена между водными растворами
двух солей (в ТР – разлагаются в водной среде)
Al2(CO3)3
Реакция протекает полно, необратимо.
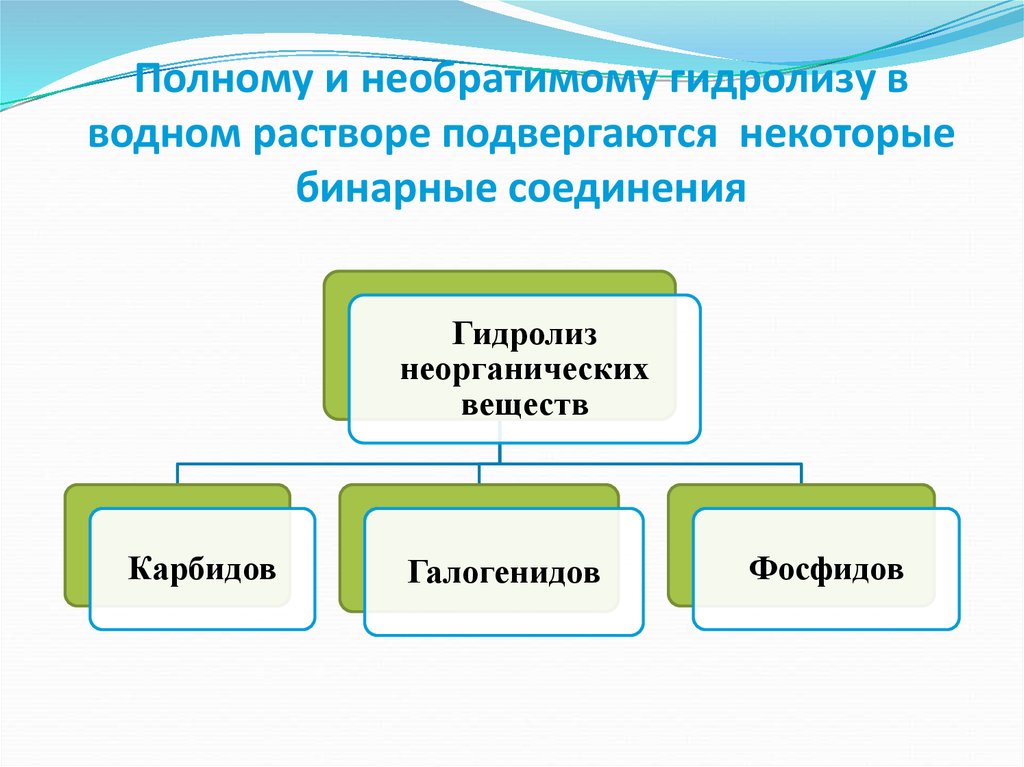
8. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения
Гидролизнеорганических
веществ
Карбидов
Галогенидов
Фосфидов
9. Гидролиз бинарных соединений
Гидролиз фосфидов:Са3P2 + 6H2O = 3Са(OH)2 + 2PH3↑
фосфид
кальция
фосфин
Гидролиз карбидов:
CaC2 + 2H2O = Ca(OH)2 + C2 H2↑
Карбид
кальция
ацетилен
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑
Карбид
алюминия
Гидролиз галогенидов:
метан
SiCl4 + 3H2O = H2SiO4↓ + 4HСl
хлорид
кремния (+4)
кремниевая
кислота
10. Факторы, влияющие на условия протекания гидролиза
1. Химическая природа соли2. Температура
3. Концентрация соли
4. Концентрация ионов (катионов
H+ и гидроксид-анионов ОH-)
11.
12. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье)
Усилить гидролиз соли можно следующимиспособами:
Добавить воды (уменьшить концентрацию раствора;
Нагреть раствор;
Связать один из продуктов гидролиза в
труднорастворимое соединение или удалить один из
продуктов в газовую фазу.
13. Тест
1.Гидролизу по катиону и аниону подвергается соль : А) K2S, Б) KCl,В)(NH4)2CO3 , Г) NH4Cl
2.Установите соответствие между формулой соли и окраской лакмуса:
А) фиолетовая
1)Na3PO4
Б) красная
2)KCl
В) синяя
3)Cu(NO3)2
3.Установите соответствие между названием соли и способ ее к гидролизу:
А) хлорид калия
1)гидролиз по катиону
Б) нитрат цинка
2)гидролиз по аниону
В) фосфат натрия
3)гидролиз по катиону и аниону
Г) нитрит натрия
4)гидролизу не подвергается
4.Установите соответствие между названием соли и средой ее водного
раствора:
А) Zn(NO3)2
1)кислая
Б) K2CO3
2)щелочная
В) NaNO3
3)нейтральная
Г) Li S
14. Ответы к тесту.
1. 1-32. А-2
Б-3
В-1
3. А-4
Б-1
В-2
Г-2
4. А-1
Б-2
В-3
Г-2
15. Гидролиз
Роль гидролиза:В
природе:
преобразование
земной
коры;
обеспечение слабощелочной среды морской воды.
В народном хозяйстве: выработка из непищевого
сырья ценных продуктов (бумага, мыло, спирт,
глюкоза,
белковые
дрожжи);
очистка
промышленных
стоков
и
питьевой
воды;
подготовка тканей к окрашиванию; известкование
почв; порча производственного оборудования;
В повседневной жизни: стирка; мытье посуды;
умывание с мылом; процессы пищеварения.
16. Синквейн
1. Назовите самое главное словосегодняшнего урока (существительное).
2. Опишите его (прилагательные).
3. Назовите действие или состав
существительного (глаголы или
существительные).
4. Сформулируйте свое отношение к теме.
5. Приведите слова, с которыми ассоциируется
у вас понятие «гидролиз».













 Химия
Химия








