Похожие презентации:
Электрическая проводимость растворов
1. Электрическая проводимость растворов
Физическая и коллоидная химия2.
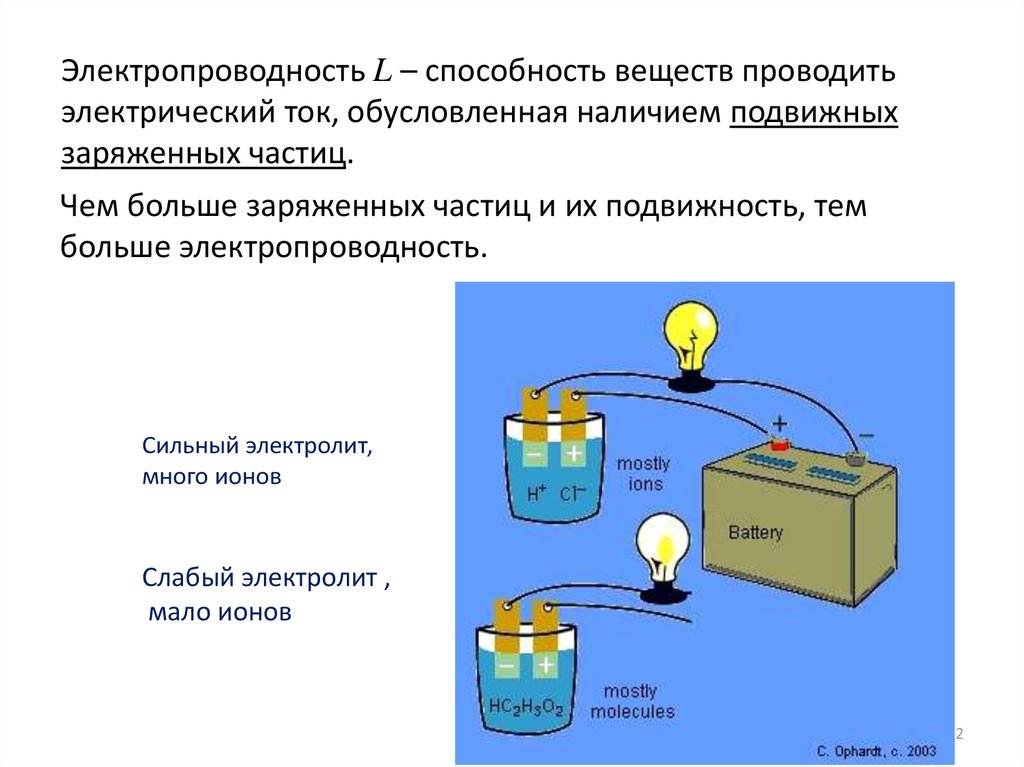
Электропроводность L – способность веществ проводитьэлектрический ток, обусловленная наличием подвижных
заряженных частиц.
Чем больше заряженных частиц и их подвижность, тем
больше электропроводность.
Сильный электролит,
много ионов
Слабый электролит ,
мало ионов
2
3.
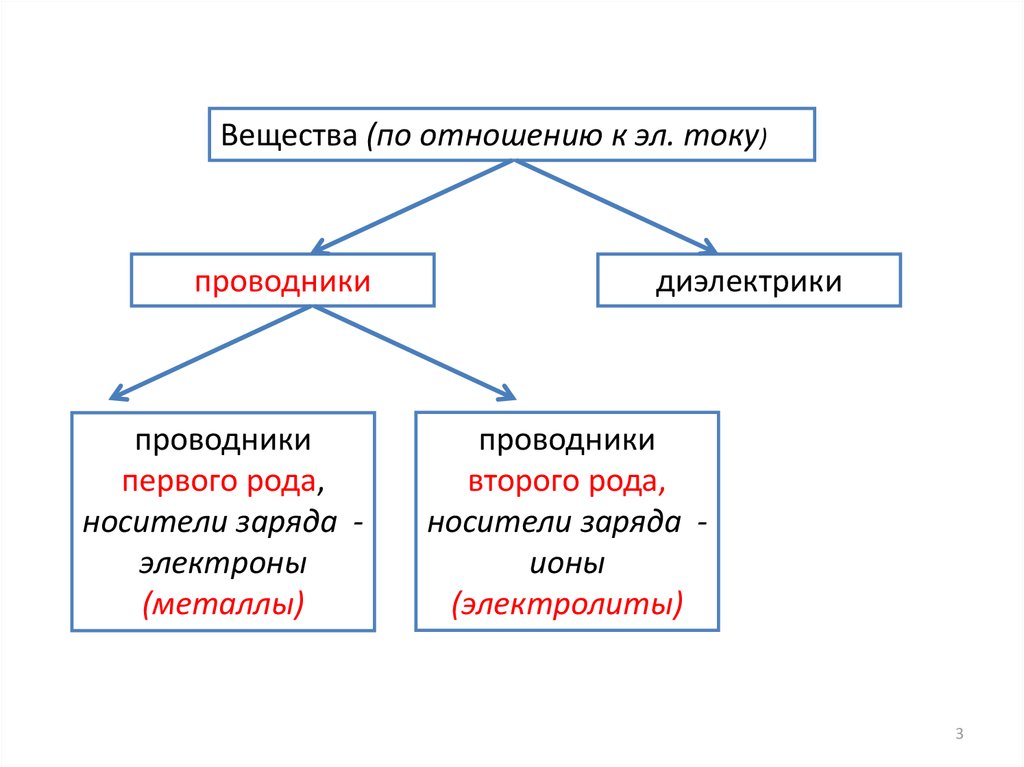
Вещества (по отношению к эл. току)проводники
проводники
первого рода,
носители заряда электроны
(металлы)
диэлектрики
проводники
второго рода,
носители заряда ионы
(электролиты)
3
4.
Растворы электролитов как проводникивторого рода. Удельная и молярная
электропроводности раствора.
Растворы электролитов — проводники второго рода,
носителями электричества в них служат анионы и катионы.
Электропроводность
зависит от
• природы
электролита
природы
растворителя,
С,
Т
4
5.
Электропроводность – величина , обратная сопротивлениюR – сопротивление [Ом]
1
L
R
L – электропроводность [Ом–1] или [См] (Сименс)
1 Ом–1 = 1 См
(полная)
электропроводность
системы
удельная
электропроводность
1
ρ– удельное сопротивление [Ом∙м]
χ – удельная электропроводность
СИ [Ом–1 ∙ м–1] или [См ∙ м–1]
Внесистемные единицы
[Ом–1 ∙ см–1], или [См ∙ см–1]
5
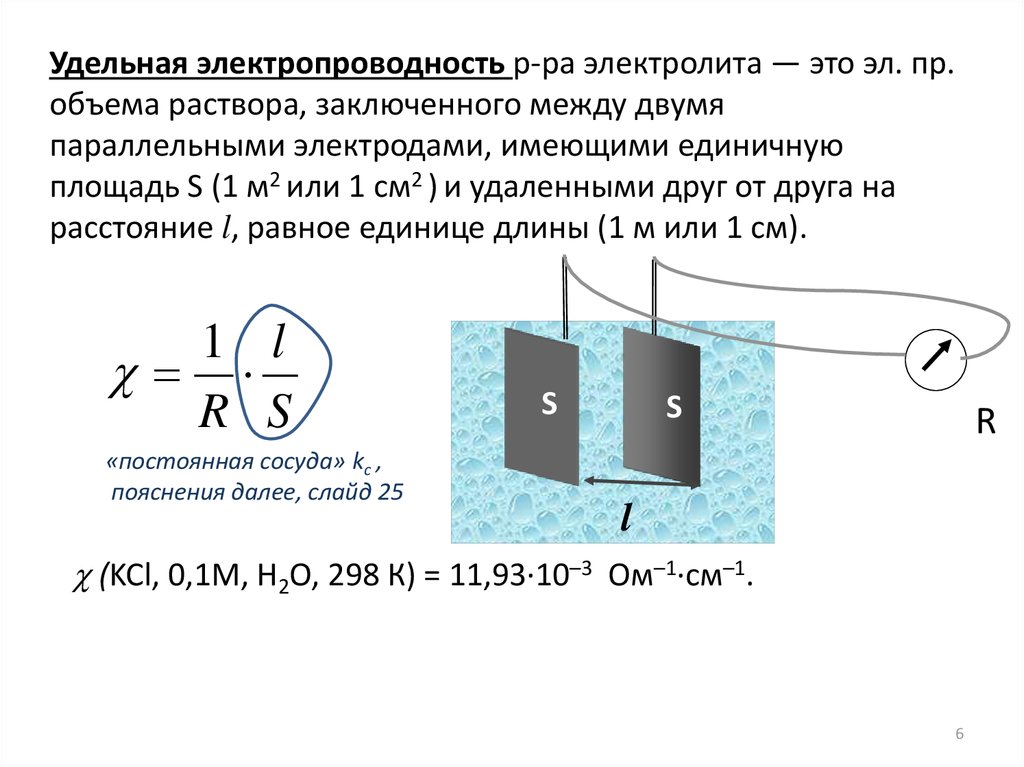
6.
Удельная электропроводность р-ра электролита — это эл. пр.объема раствора, заключенного между двумя
параллельными электродами, имеющими единичную
площадь S (1 м2 или 1 см2 ) и удаленными друг от друга на
расстояние l, равное единице длины (1 м или 1 см).
1 l
R S
«постоянная сосуда» kс ,
пояснения далее, слайд 25
S
S
R
l
(KCl, 0,1М, Н2О, 298 К) = 11,93∙10–3 Ом–1∙см–1.
6
7.
В зависимости от С в этом объеме может содержатьсяразличное количество растворенного вещества
Разное число носителей заряда –
трудно сравнивать вещества по χ :
(KCl, 0,1М) и ( НCl, 0,3М)
Молярная электропроводность – эл. пр. такого объема
раствора, который содержит 1 моль растворенного
вещества, при условии, что раствор заключен между двумя
параллельными электродами, удаленными друг от друга на
расстояние, равное единице длины.
C
7
8.
Вид формулы зависит от размерности χ и Сχ
См∙м–1
См∙см–1
С
моль/м3
моль/л
уравнение
размерность λ
Ом–1∙м2∙моль–1
C
Cм∙м2∙моль–1
1000
C
или
Ом–1∙см2∙моль–1
или
Cм∙cм2∙моль–1
Указывать формульную единицу (единичный заряд)
(1/2 MgCl2 , 0,1 М) = 98,1 Ом–1∙см2∙моль–1
8
9.
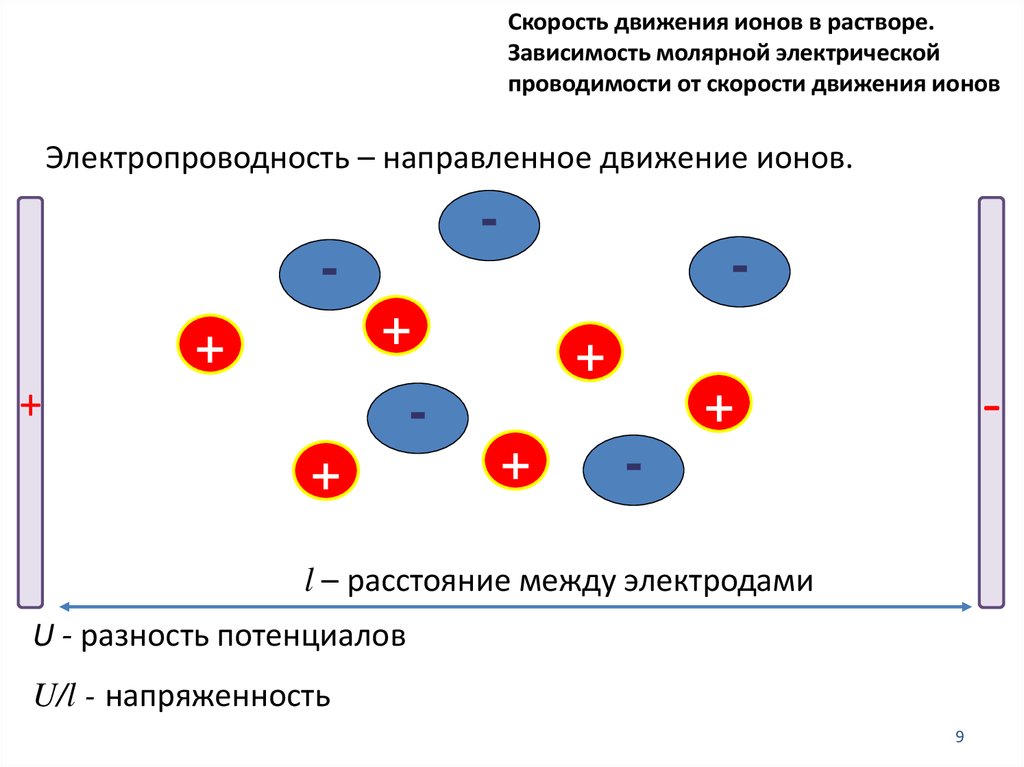
Скорость движения ионов в растворе.Зависимость молярной электрической
проводимости от скорости движения ионов
Электропроводность – направленное движение ионов.
-
-
-
+
+
+
+
+
-
+
+
-
l – расстояние между электродами
U - разность потенциалов
U/l - напряженность
9
10.
Вклад иона (катиона или аниона) в общую электропроводностьраствора зависит от скорости его движения.
Скорость движения иона
м/с
Если U/l = 1 В/м, то «абсолютная скорость» u м2В–1с–1
Абсолютные скорости движения катиона
uK и аниона u А
F = 96 500 Кл/моль (количество электричества, переносимое 1
моль частиц единичного заряда)
К = F∙ uК
А =F∙ uА
– молярная электропроводность при бесконечном
разбавлении (постоянная величина для каждого иона),
«подвижность»
10
11.
Молярная электропроводность ионовпри бесконечном разбавлении в водных растворах (25 °С)
Катион
H+
Na+
K+
Ag+
NH4+
1/2 Ca2+
1/2 Ba2+
1/2 Zn2+
1/2 Cu2+
К (См см2 моль–1)
349,8
50,1
73,5
61,9
73,5
59,5
63,6
54
56,6
1/2 SO32–
CH3COO–
1/2 SO42–
1/2 CrO42–
А , (См см2 моль–1)
198,3
76,4
78,1
76,8
71,5
72,0
40,9
80,0
85,0
1/3 Fe3+
1/3 Al3+
68,0
63,6
1/2 CO32–
HCOO–
69,3
54,6
Анион
OH–
Cl–
Br–
I–
NO3–
С2H5COO–
37,2
11
12.
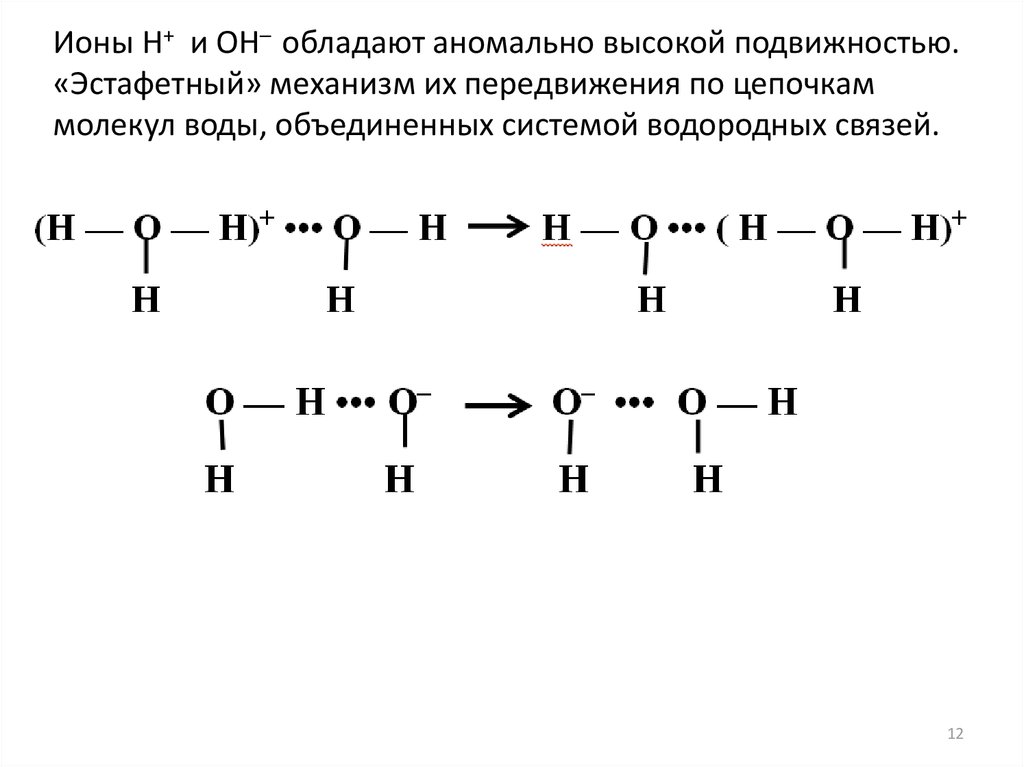
Ионы Н+ и ОН– обладают аномально высокой подвижностью.«Эстафетный» механизм их передвижения по цепочкам
молекул воды, объединенных системой водородных связей.
12
13.
закон КольраушаЭлектропроводность раствора складывается из
подвижности катионов и анионов.
K A
Можно получить раствора расчетным путем,
используя справочные значения ионов.
Например:
(ВаSO4) = 2 (1/2 Ba+2) + 2 (1/2 SO4–2) =
= 2∙63,6 + 2∙80,0 = 287,2 (См см2моль–1).
13
14.
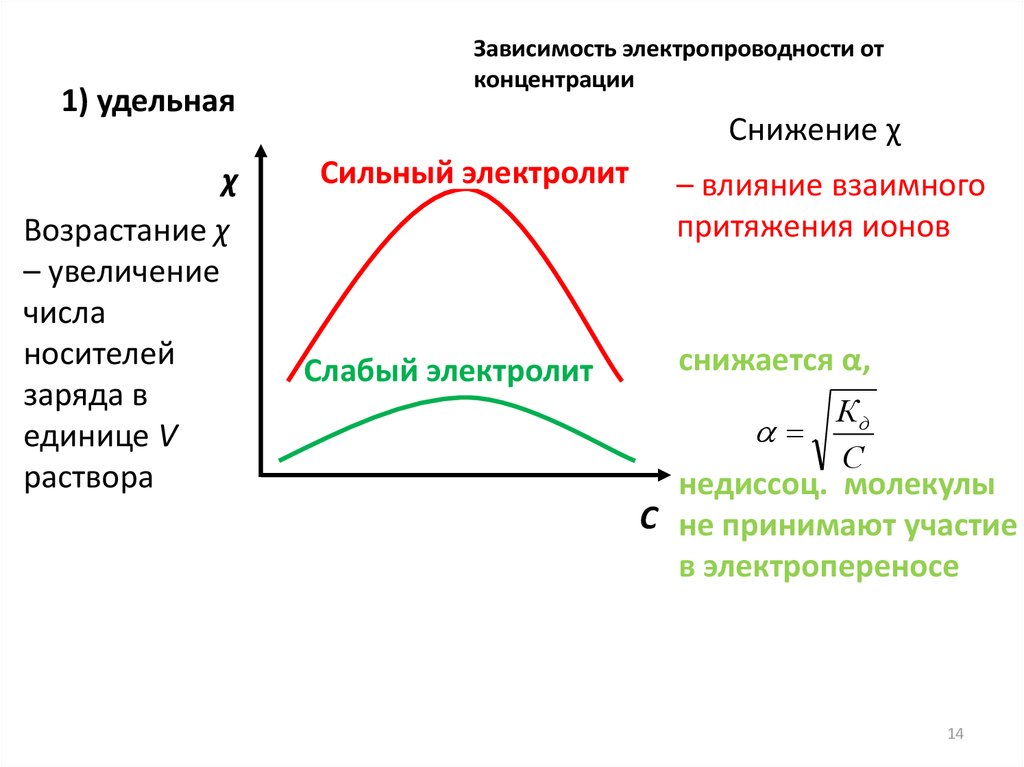
1) удельнаяχ
Возрастание χ
– увеличение
числа
носителей
заряда в
единице V
раствора
Зависимость электропроводности от
концентрации
Снижение χ
Сильный электролит
Слабый электролит
– влияние взаимного
притяжения ионов
снижается α,
Кд
С
недиссоц. молекулы
С не принимают участие
в электропереносе
14
15.
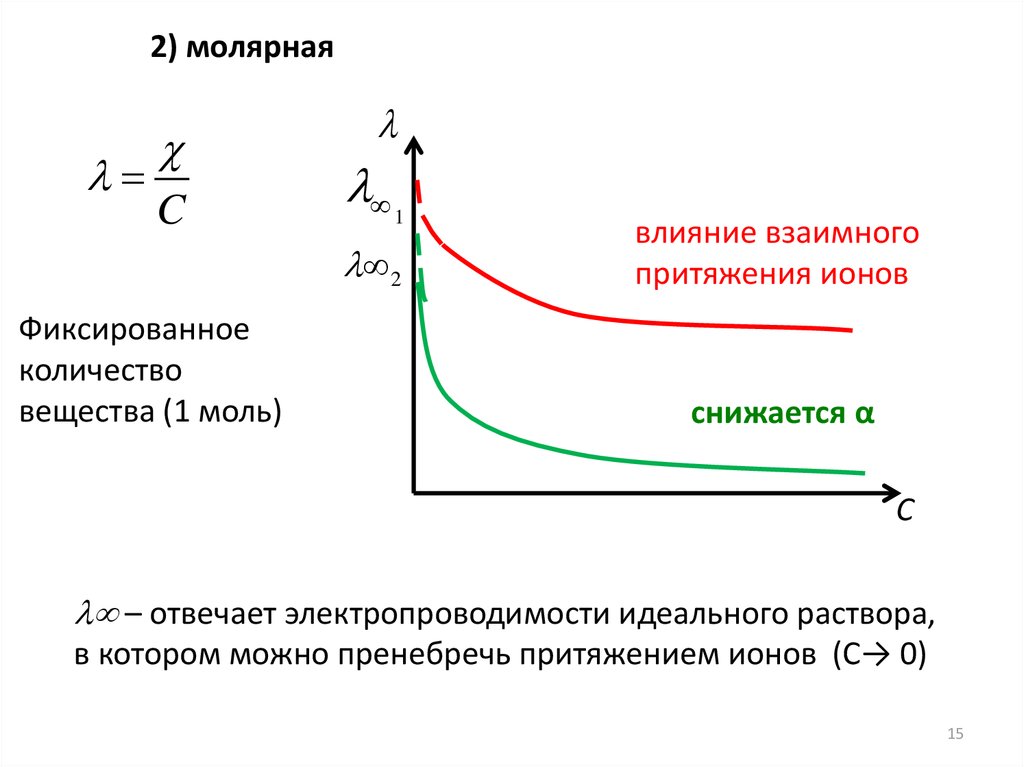
2) молярнаяC
1
2
Фиксированное
количество
вещества (1 моль)
влияние взаимного
притяжения ионов
снижается α
С
– отвечает электропроводимости идеального раствора,
в котором можно пренебречь притяжением ионов (С→ 0)
15
16.
Как определить ?• прямое измерение невозможно (нельзя приготовить
«бесконечно разбавленный раствор»),
• из графической зависимости от С (при С → 0) сложно
экстраполировать к оси ординат (не прямая линия).
Экстраполяция упрощается, если зависимость будет иметь
линейный характер.
16
17.
Растворы сильных электролитов.
h C
1
2
h C
«закон квадратного корня»
(эмпирический)
λ
λ∞
C
объясняется на основании электростатической теории
сильных электролитов Дебая − Гюккеля − Онзагера
17
18.
В теории сильных электролитов (Д- Г - О) учитываются дваосновных эффекта взаимодействия между ионами,
вызывающие торможение:
электрофоретический
релаксационный
эффект
эффект
При наложении эл. поля
ион и ионная атмосфера
движутся в
противоположные стороны
Некоторый избыток
противоположных ионов позади
центрального иона (нарушенная
симметрия ионной атмосферы).
18
19.
Дополнительный материалУравнение, полученное Дебаем, Гюккелем и Онзагером
является теоретическим обоснованием эмпирического
«закона квадратного корня»
bЭ bP C
bЭ
8,85 10 4
T
1
1
2
bP
2
8,20 10 5
Т 2
3
Для водных растворов при 298 К = 8,94 Па∙с , = 78,3
уравнение принимает вид:
4
60,4 10 0,23 C
h C
1
1
2
2
19
20.
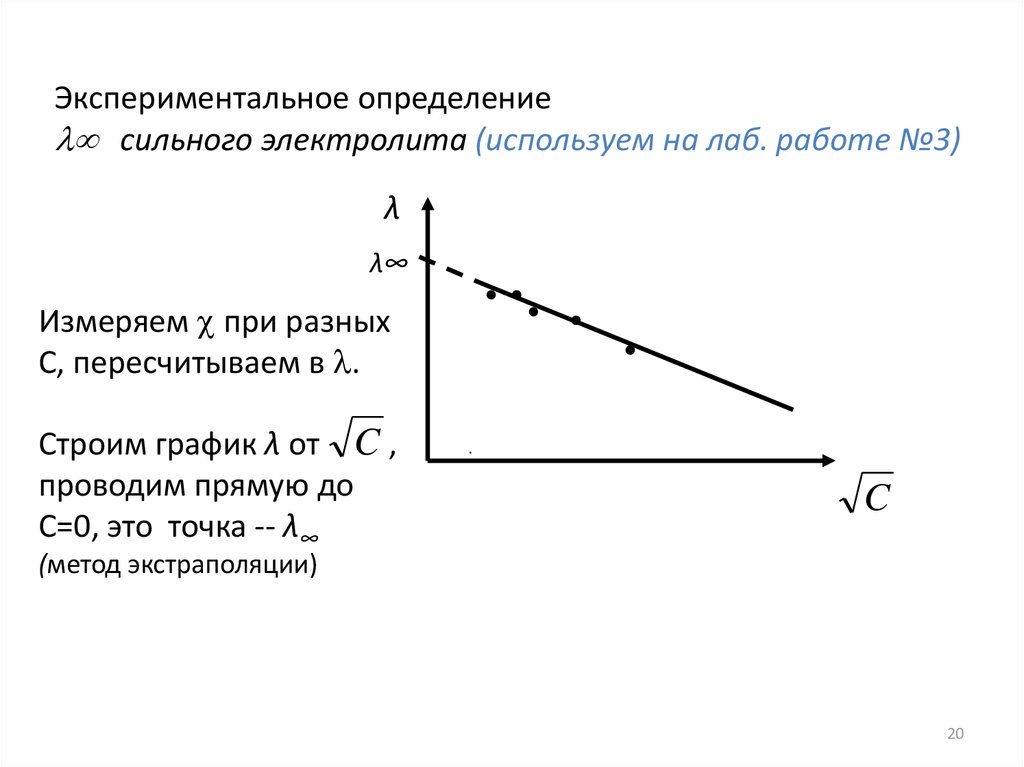
Экспериментальное определениесильного электролита (используем на лаб. работе №3)
λ
λ∞
Измеряем при разных
С, пересчитываем в .
Строим график λ от C ,
проводим прямую до
С=0, это точка -- λ∞
C
(метод экстраполяции)
20
21.
Растворы слабых электролитовконцентрация ионов невелика,
расстояния между ними большие,
поэтому можно считать, что электростатические взаимодействия
отсутствуют.
Влияние концентрации на связано с диссоциацией
Степень диссоциации:
Кд
С
(З-н разбавления Оствальда)
Кд
С
1
2
21
22.
1Кд 2
С
1
1
lg lg lg K д lg C
2
2
1
lg A lg C
2
Уравнение прямой
y A bx
Определение Кд
слабого электролита
(используем в лаб.
работе №4)
lgλ
A
1
А lg lg K д
2
lgС
А – из графика,
λ∞ по справочным данным
К А
22
23.
Примерχ 0,135 М раствора пропионовой кислоты равна 4,79∙10–4
См∙см–1 Вычислите молярную электрическую
проводимость, степень диссоциации, концентрацию ионов
водорода, pH и константу электролитической диссоциации.
Решение :
1000
C
4,79 10–4 1000
3,35 См∙см2∙моль–1.
0,135
С 2 Н 5СОО Н 37,2 349,8 387 См∙см2∙моль–1.
3,35
0,0098
387
СН СС 2 Н 5СООН 0,0098 0,135 0,00132 1,32 10-3 моль / л
рН lg СН lg( 1,32 10-3 ) 2,88
Kд С 2 0,135 0,00982 1,14 10 5
23
24.
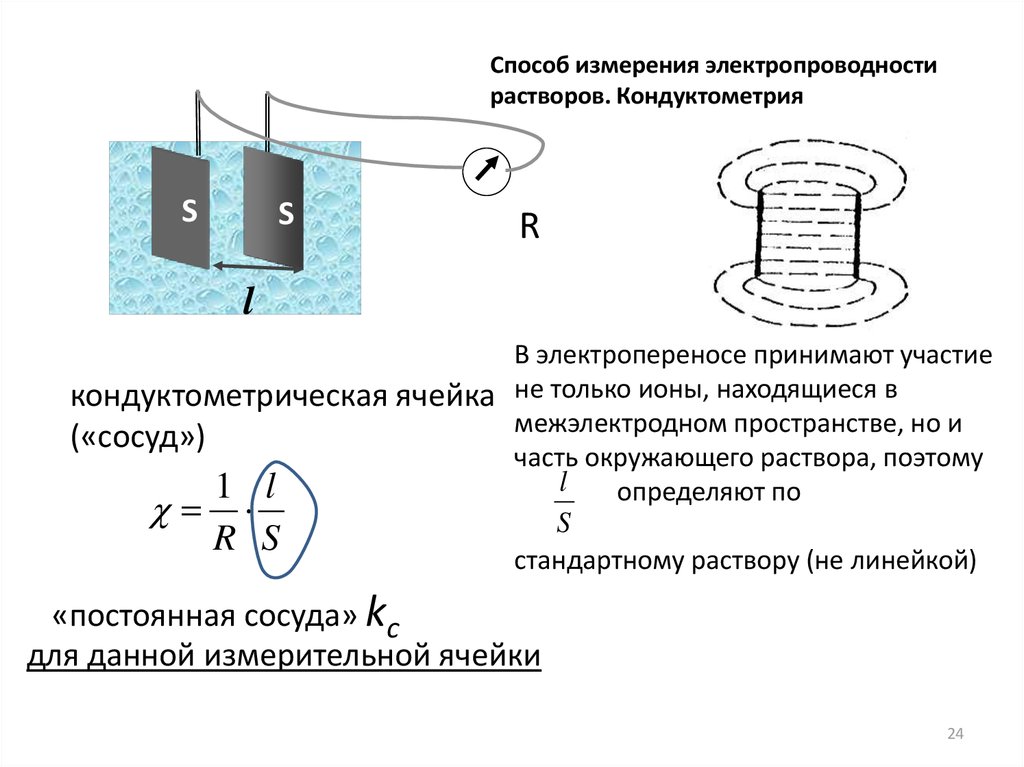
Способ измерения электропроводностирастворов. Кондуктометрия
S
S
R
l
В электропереносе принимают участие
кондуктометрическая ячейка не только ионы, находящиеся в
межэлектродном пространстве, но и
(«сосуд»)
часть окружающего раствора, поэтому
l
1 l
определяют по
S
R S
стандартному раствору (не линейкой)
«постоянная сосуда» kс
для данной измерительной ячейки
24
25.
Определение kс и настройка кондуктометрапо стандартному раствору КСl
KCl
Стандартный раствор KCl
1 l 1
kC
RKCl S R KCl
KCl . - справочная величина
R KCl - измеряют
«постоянная сосуда»
kC KCl . R KCl
Затем измеряют R изучаемого раствора (старые приборы)
и вычисляют
р ра
1
kC
R р ра
25
26.
В современных кондуктометрах надисплее прибора высвечивается значение
уже с учетом kC (настраивают заранее)
26
27.
Дополнительный материалвнутриклеточная жидкость χ= 1 – 3∙10–5 См∙см-1
жидкие среды организма (кровь, лимфа, желчь, моча,
спинно-мозговая жидкость) χ = 0,6 – 2,0 См∙см–1
особо чистая вода = 4,4 10–8 См∙см–1,
лабораторная дистиллированная вода 10–6 См∙см–1.
27
28.
! Если измеряемая χ ≈10–4 –10–6 См∙см–1 – учитывать вклад χ воды.Пример
χ насыщенного раствора AgBr равна 0,397∙10-6 См∙см-1 .
χ воды, взятой для растворения равна 0,300∙10-6 См∙см-1.
Считать соль полностью диссоциированной, а подвижности ионов —
равными подвижности при бесконечном разбавлении:
Br–= 78,1 См∙см2∙моль–1, Ag+= 61,9 См∙см2∙моль–1.
Найти концентрацию ионов Ag+ иПР
Решение : 78,1 61,9 140 См∙см2∙моль–1.
Ag
Br-
С
1000
C
( нас воды) 1000
C
( нас воды) 1000
(0,397 10-6 0,300 10-6 ) 1000
6,977 10 7 моль / л
140
ПР СAg 6,36 10-13
2
28
29.
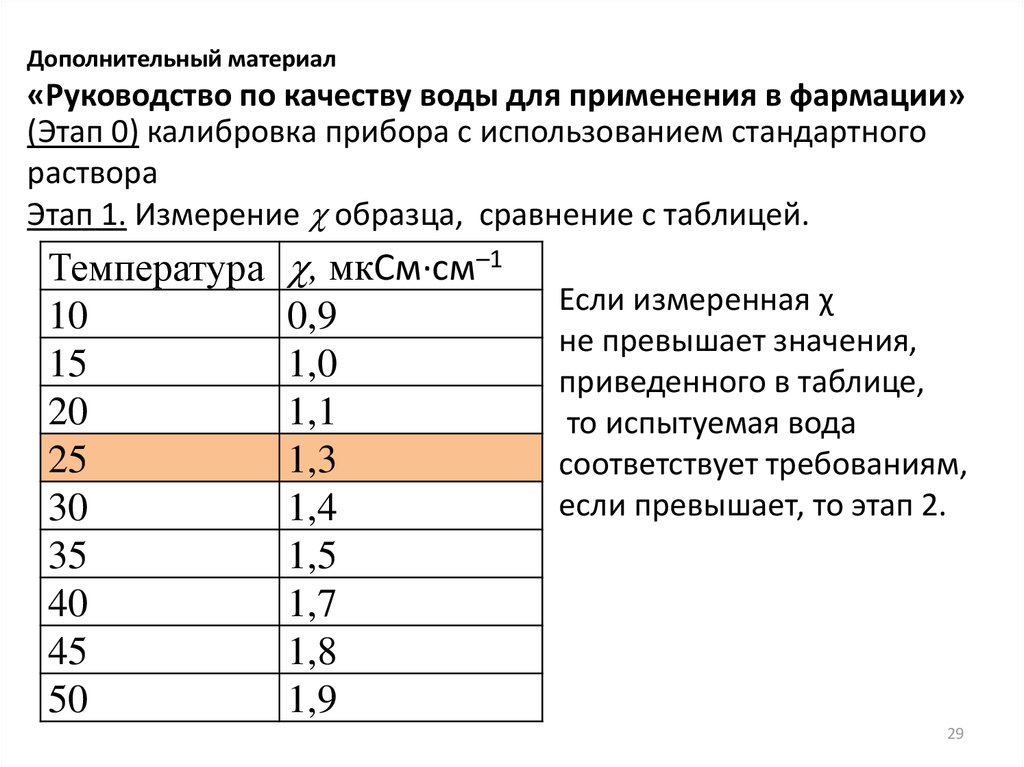
Дополнительный материал«Руководство по качеству воды для применения в фармации»
(Этап 0) калибровка прибора с использованием стандартного
раствора
Этап 1. Измерение образца, сравнение с таблицей.
Температура
10
15
20
25
30
35
40
45
50
, мкСм∙см–1
0,9
1,0
1,1
1,3
1,4
1,5
1,7
1,8
1,9
Если измеренная χ
не превышает значения,
приведенного в таблице,
то испытуемая вода
соответствует требованиям,
если превышает, то этап 2.
29
30.
Этап 2.Термостатируют образец при 25 С и наблюдают изменение χ
при поглощении СО2 воздуха.
Если изменения в значении χ, обусловленные поглощением
СО2 , не будут превышать 0,1 мкСм∙см–1 в течение 5 мин,
записывают значение χ.
Вода выдерживает испытание, если значение χ не
превышает 2,1 мкСм∙см–1. Если превышает – этап 3.
30
31.
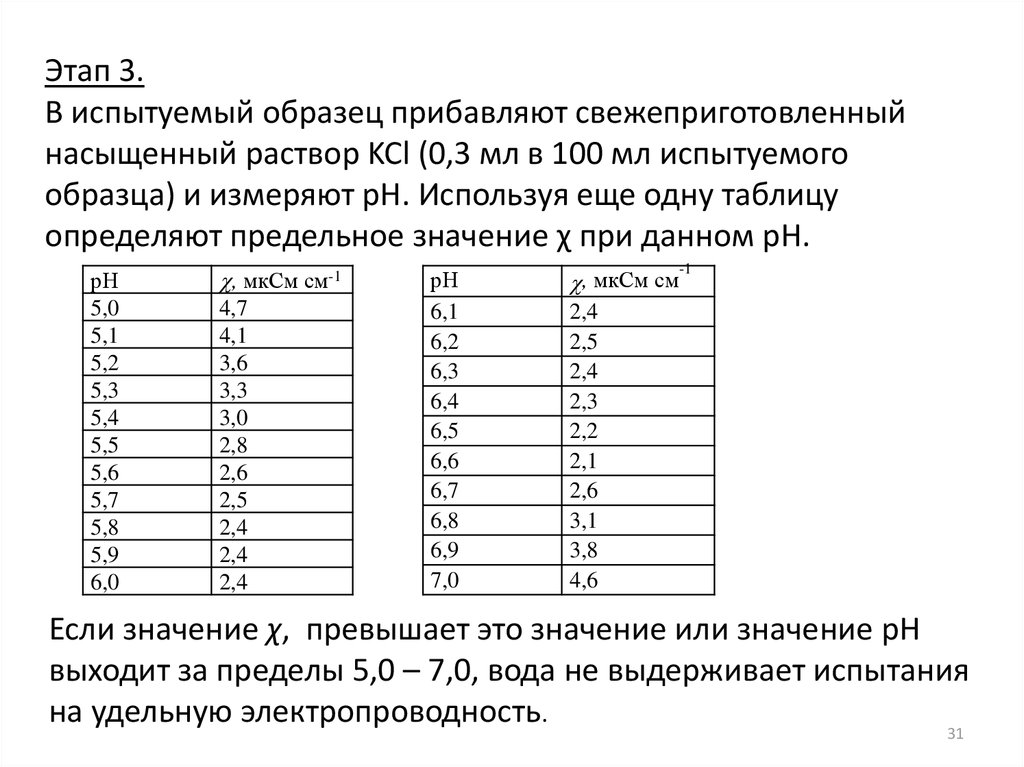
Этап 3.В испытуемый образец прибавляют свежеприготовленный
насыщенный раствор KCl (0,3 мл в 100 мл испытуемого
образца) и измеряют pH. Используя еще одну таблицу
определяют предельное значение χ при данном pH.
рН
5,0
5,1
5,2
5,3
5,4
5,5
5,6
5,7
5,8
5,9
6,0
, мкСм см-1
4,7
4,1
3,6
3,3
3,0
2,8
2,6
2,5
2,4
2,4
2,4
рН
6,1
6,2
6,3
6,4
6,5
6,6
6,7
6,8
6,9
7,0
-1
, мкСм см
2,4
2,5
2,4
2,3
2,2
2,1
2,6
3,1
3,8
4,6
Если значение χ, превышает это значение или значение pH
выходит за пределы 5,0 – 7,0, вода не выдерживает испытания
на удельную электропроводность.
31
32.
Зависимость электрической проводимостиразбавленных растворов от температуры
С повышением Т :
разрушение сольватных оболочек
(↓ r гидратированных ионов, ↓η)
z Ae
Скорость движения иона ( u A
) возрастает.
Электропроводность возрастает.6 rA
Т 298[Т (Т 298 )]
Т 298[Т (Т 298 )]
где α – температурный коэффициент
электропроводности.
для сильных кислот α = 0,0164 ;
для сильных оснований α = 0,0190 ;
для солей α = 0,0220.
32
33.
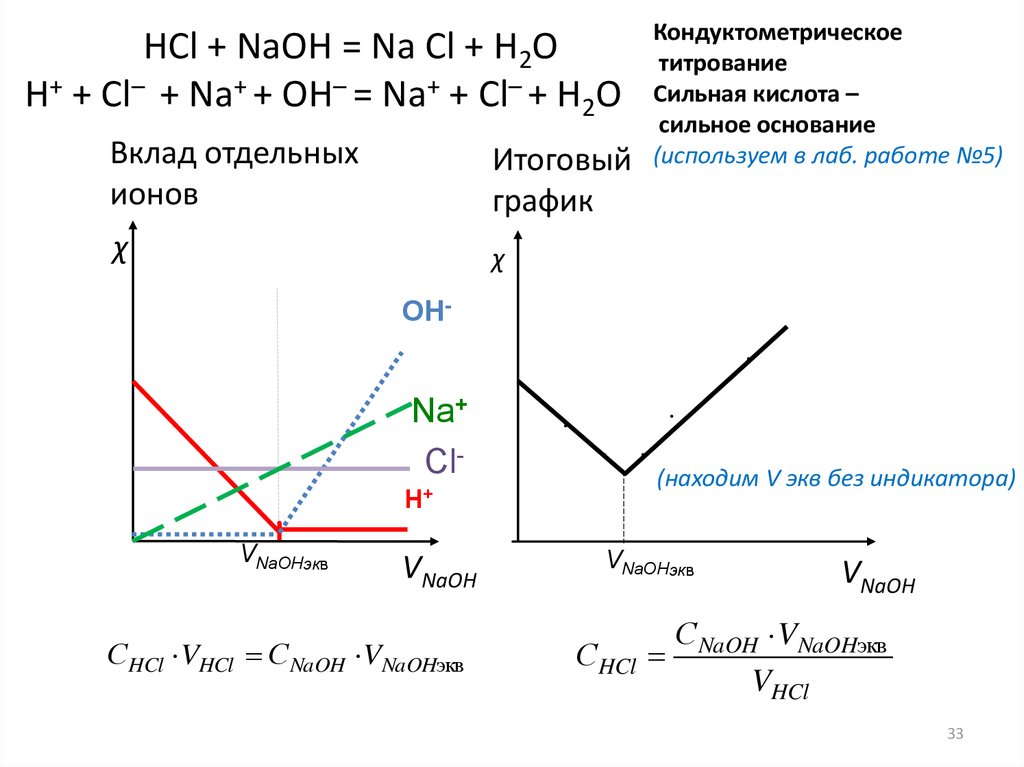
Кондуктометрическоетитрование
Сильная кислота –
сильное основание
(используем в лаб. работе №5)
HCl + NaOH = Na Cl + H2O
H+ + Cl– + Na+ + OH– = Na+ + Cl– + H2O
Вклад отдельных
ионов
Итоговый
график
χ
χ
OH
Na+
ClН+
VNaOHэкв
VNaOH
СHCl VHCl С NaOH VNaOHэкв
(находим V экв без индикатора)
VNaOHэкв
СHCl
VNaOH
С NaOH VNaOHэкв
VHCl
33





















 Химия
Химия








