Похожие презентации:
Химия элементов VIIA группы
1. Химия элементов VIIA группы
2. Что читать?
• Ахметов Н.С. «Общая и неорганическаяхимия».
• Карапетьянц М.Х., Дракин С.И. «Общая и
неорганическая химия».
• Глинка Н.Л. «Общая химия»
• Коттон Ф., Уилкинсон Дж. «Основы
неорганической химии»
• Гринвуд Н., Эршно А. «Химия элементов»
3.
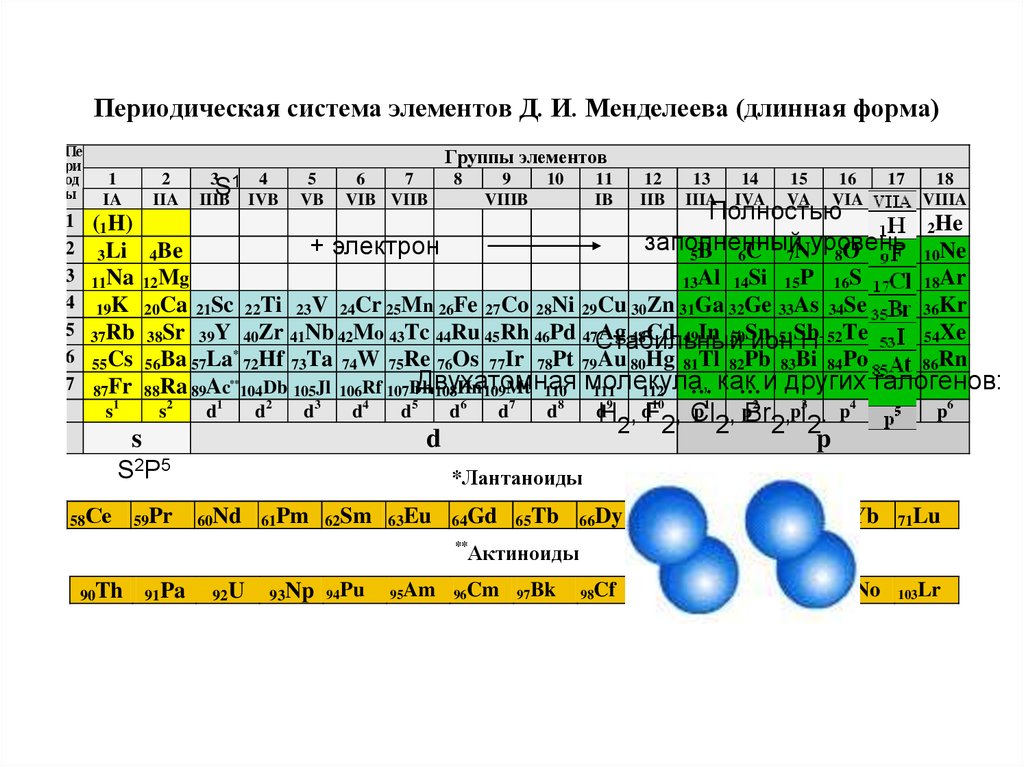
Периодическая система элементов Д. И. Менделеева (длинная форма)Пе
ри
од
ы
1
2
3
4
5
6
7
Группы элементов
1
IA
2
IIA
s1
s2
3 1 4
S
IIIB IVB
5
VB
6
7
VIB VIIB
8
9
VIIIB
10
d7
d8
11
IB
12
IIB
13
14
IIIA IVA
15
VA
16
17
18
VIA VIIA VIIIA
Полностью
(1H)
1H 2He
заполненный
уровень
+ электрон
3Li 4Be
5B
6C
7N
8O
9F 10Ne
11Na 12Mg
13Al 14Si 15P 16S 17Cl 18Ar
19K 20Ca 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31Ga 32Ge 33As 34Se 35Br 36Kr
Ag 48Cd 49In 50Sn
37Rb 38Sr 39Y 40Zr 41Nb 42Mo 43Tc 44Ru 45Rh 46Pd 47Стабильный
51Sb
ион
Н- 52Te 53I 54Xe
*
55Cs 56Ba 57La 72Hf 73Ta 74W 75Re 76Os 77Ir 78Pt 79Au 80Hg 81Tl 82Pb 83Bi 84Po 85At 86Rn
**
Двухатомная
… как
… и других галогенов:
87Fr 88Ra 89Ac 104Db 105Jl 106Rf 107Bh
108Hn 109Mt 110 молекула,
111
112
d1
d2
d3
d4
s
S2Р5
58Сe
59Pr
d5
d6
9
dH
d
2
dF10 , Cl
p1 , pBr
pI3 .
,
,
2 2
2
2 2
p
p4
p5
p6
*Лантаноиды
60Nd
61Pm
62Sm
63Eu
64Gd
65Tb
66Dy
67Ho
68Er
69Tm 70Yb
71Lu
98Cf
99Es
100Fm
101Md 192No
103Lr
Актиноиды
**
90Th
91Pa
92U
93Np 94Pu
95Am
96Cm
97Bk
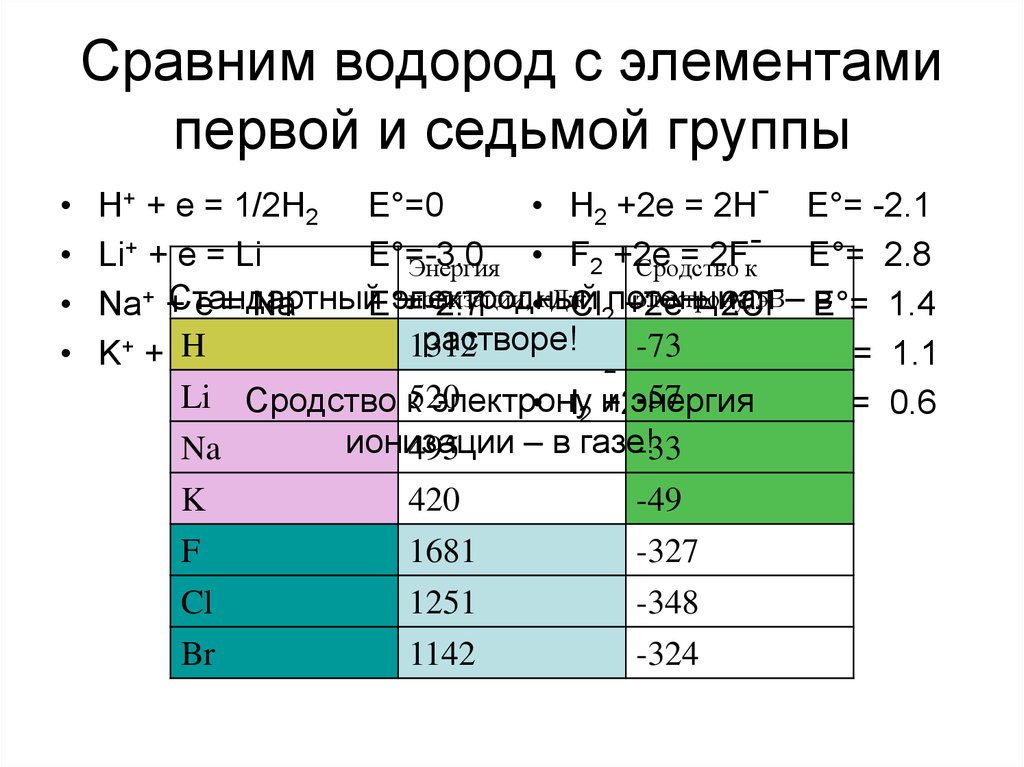
4. Сравним водород с элементами первой и седьмой группы
H+ + e = 1/2H2 E°=0
• H2 +2e = 2H- E°= -2.1
- E°= 2.8
Li+ + e = Li
E°=-3.0
F
+2e
=
2F
2 Сродство к
Энергия
ионизации,•кДж
электрону,
Стандартный
электродный
в
Na+ +
e = Na
E°=-2.7
Cl2потенциал
+2e
= 2ClэВ- – E°=
1.4
растворе!
1312
-73 = 2Br- E°= 1.1
K+ + eH= K
E°=-2.9
• Br2 +2e
Li Сродство к520
-57= 2Iэлектрону
и энергия
• I2 +2e
E°= 0.6
ионизации
– в газе!
Na
495
-33
K
420
-49
F
1681
-327
Cl
1251
-348
Br
1142
-324
5. Распространение водорода ат.%
Во вселенной
H – 88.6%
He – 11.3%
Остальное – 0,1%
На Земле
O – 54.2%
Si – 15.8%
H – 17.0%
6. Степени окисления водорода
Окислительно-восстановительные свойства1S1
+ электронКак окислители,
Только
окислители!
- электрон
Только
восстановители
так
и восстановители
H2 +2HCl
2 Na+=Mg
2 NaH
(комнатная
Т)
+1
=
MgCl
+
H
-1
2
2
LiAlH4 + 4 H2O = Li[Al(OH)4] +2 H2
0
NaH
O22NaOH
= H2O+ H2
2H2O +2H
2Na
2 +=
H2
LiAlH4
H2O
HF
NH4+
ПРИМЕРЫ
ПРИМЕР
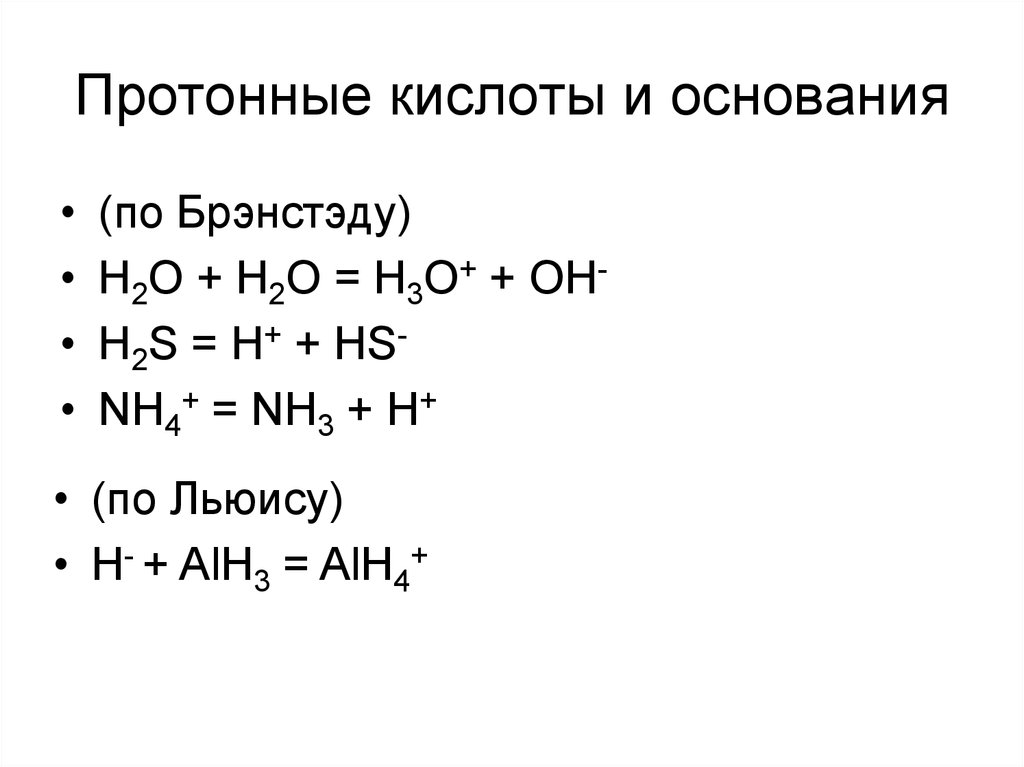
7. Протонные кислоты и основания
(по Брэнстэду)
H2O + H2O = H3O+ + OHH2S = H+ + HSNH4+ = NH3 + H+
• (по Льюису)
• H- + AlH3 = AlH4+
8. Получение водорода
Лабораторные способы:Основаны на ОВР
1. CaH2 + 2 H2O = Ca(OH)2 + H2
2. Электролиз
. 2 H2O → 2H2 + O2
Дорогой способ, но его используют в промышленности как
попутный при получении хлора и щелочи.
2 H2O + 2 NaCl → 2NaOH + Cl2 + H2
Катод
Zn + H2SO4 → ZnSO4 + H2
15% р-р
Анод
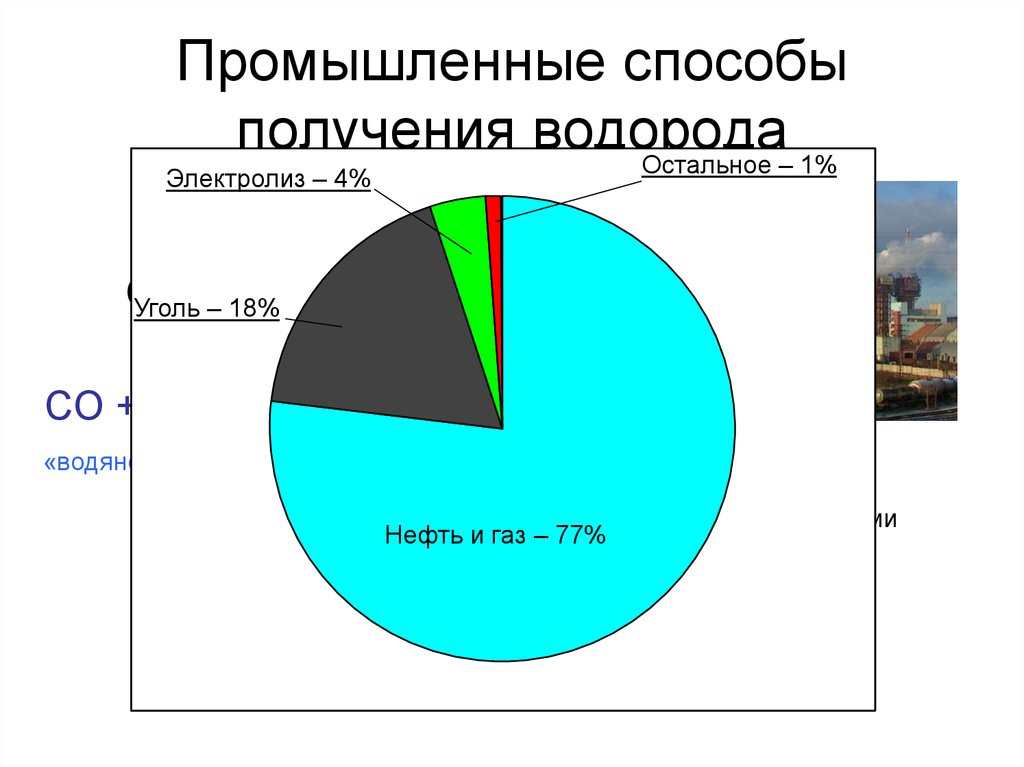
9. Промышленные способы получения водорода
Остальное – 1%Электролиз – 4%
750 °C
CH4 + H2O →
CO + 3H2
Ni
1000 °С
C
+ H2O → CO + H2
(кокс)
Уголь
– 18%
400 °С
CO + H2O → CO2 + H2
«водяной газ»
Fe, Cu
Нефть и газ – 77%
Поглощают растворами
щелочей
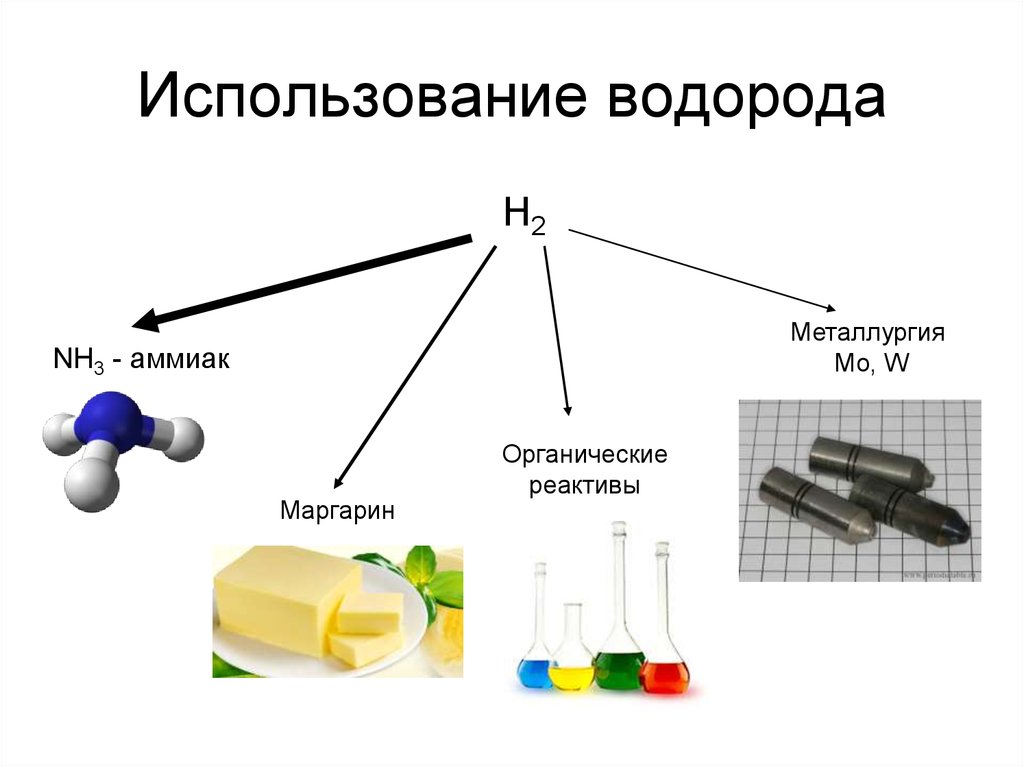
10. Использование водорода
H2Металлургия
Mo, W
NH3 - аммиак
Маргарин
Органические
реактивы
11. Водородная энергетика
аккумулирование, транспортировка• Водородная энергетика — направление выработки
средство
для аккумулирования,
транспортировки
и
и потребления
энергии человечеством,
основанное
потребления
энергии
людьми средства для
на использовании
водорода
в качестве
аккумулирования, транспортировки и потребления
энергии людьми, транспортной инфраструктурой и
различными
направлениями.
Город. Сжигаем
нефть и производственными
газ
Где-то там, далеко…
Водород выбран как наиболее распространенный
элемент на поверхности земли Аи получаем
в космосе,
теплота
его где-то там…
Теперь
сжигаем водород
сгорания
водорода наиболее высока, а продуктом
сгорания в кислороде является вода (которая вновь
вводится в оборот водородной энергетики).
Много букв!!!
12. Галогены
• αλς – морская соль• γεν – рождать
• Солероды
• F, Cl, Br, I, At
nS2nP5
13. Распространение в природе
РаспространениеМинералыв природе
F
Cl
Br
I
At
0.063
0.017
0.0002
4.10-5
-
13 место
20
46
60
CaF2
флюорит
Na3[AlF6]
криолит
Ca5(PO4)3F
фторапатит
Во всех водах
Радиоактивные
руды
NaCl
галит
KCl
силвит
KNACl2
сильвинит
В окружающих и нефтяных
водах
14. Происхождение названий элементов и первооткрыватели
FCl
Разрушительный
Текучий
Br
I
Зловонный
At
Неустойчивый
Фиолетовый
Желто-зеленый
1886
1774
1826
АНРИ МУАССАН
КАРЛ ШЕЕЛЕ
АНТУАН БАЛАР
1811
Берна́рд Куртуа́
Предсказан
Д.И. Менделеевым
Обнаружен физиками
США, 1940
15. Физические свойства
FCl
Br
I
At
Температуры кипения и плавления (°С)
-220
-101
-7
117
244
-188
-34
60
184
309
плавится при p(I2)≥1
расч.
Газ
Газ
Жидкость
Твердое
Тв.
Стандартные электродные потенциалы, В
2,8
1,4
Самый
Сильные окислители
Сильный
Окислитель
1,1
0,6
Окислители
0,5
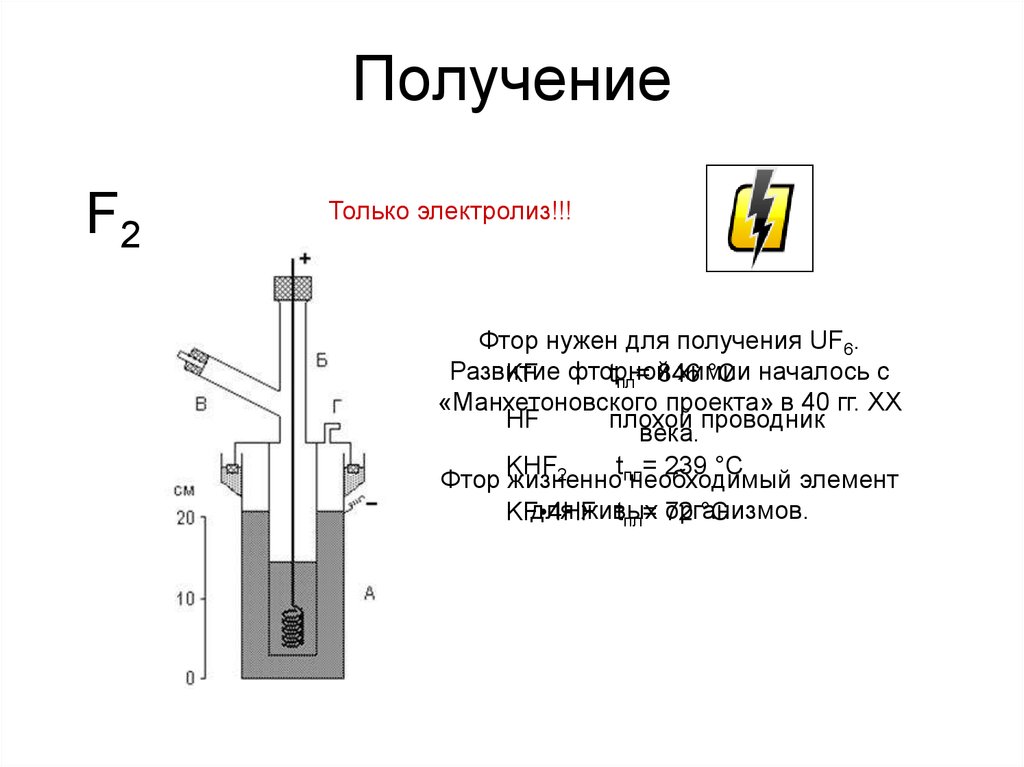
16. Получение
F2Только электролиз!!!
Фтор нужен для получения UF6.
Развитие
химии
KF фторной
tпл= 846
°С началось с
«Манхетоновского проекта» в 40 гг. XX
HF
плохой проводник
века.
KHF2
tпл= 239 °С
Фтор жизненно
необходимый элемент
для живых
организмов.
KF•4HF
tпл= 72
°С
17.
«Все есть яд, все есть лекарство –всему цена мера.»
Абу Али Хусейн ибн Абдаллах ибн Си́на
«Авиценна»
18. Получение
Cl2Все тот же электролиз.
Промышленный способ.
Электролиз водных растворов: 2 H2O + 2 NaCl → 2NaOH + Cl2 + H2
Окисление хлорид-ионов
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
MnO2 + 4HCl
→ Cl2 + MnCl2 + 2H2O
19. Получение
Br2Электролиз.
I2
Промышленный способ.
Окисление галогенид-ионов
2KMnO4 + 16HBr → 5Br2 + 2MnBr2 + 2KBr + 8H2O
MnO2 + 4HI
→ I2 + MnI2 + 2H2O
Cl2 + 2HBr → 2HCl + Br2
Br2 + 2HI → 2HBr + I2
Промышленный способы
20. Получение галогеноводородов
Реакция замещенияCaF2 + H2SO4 → 2HF + CaSO4
2NaCl + H2SO4 → 2HCl + Na2SO4
Реакции с серной кислотой неприемлемы в случае брома и иода
2NaBr + 3H2SO4 → Br2 + SO2 + 2NaHSO4 + H2O
8NaI + 9H2SO4 → 4I2 + H2S + 8 NaHSO4 + 4H2O
Реакция замещения с кислотой не окислителем
NaBr + H3PO4 → HBr + NaH2PO4
NaI + H3PO4 → HI + NaH2PO4
21. Галогеноводороды
При с.у. безцветные газы, хорошо растворимые в воде.Растворы в воде – сильные кислоты (кроме HF).
Кислоты взаимодействуют с активными
металлами с образованием солей и водорода:
Zn + 2HCl = ZnCl2 + H2
Фтороводород и плавиковая кислота отличаются от аналогов:
Фтороводород кипит при 19 ºС за счет образования водородных связей:
HF + HF = H2F2 = H+ + HF2Плавиковая кислота реагирует со стеклом:
SiO2 + 6HF = 2H+ + SiF62- + 2H2O
22. Взаимодействие галогенов с водой
Зависимость от температуры:Фтор – уникальный окислитель, очень сильный:
Г2 + H2O ↔ H+ + Г- + НГО (низкие t)
2F2 + 2H2O = 4HF + O2
+ = 2NaF
2F22++3H
2NaOH(р-р)
+ OF2 + H2O t)
3Г
2O ↔ H + 5Г + НГО3 (высокие
Для остальных галогенов равновесие сильно зависящее от рН:
Г2 + H2O ↔ H+ + Г- + НГО
Cl
HClO
Br
HBrO
I HIO
ГО
pK- c
20
4 ºС
10
8 ºС
013
ºС
ГО
Kc3-
-4
70
10ºС
-8
50
10ºС
-13
20
10ºС
Ca(OH)2 + Cl2 = CaCl(ClO) + H2O (хлорная известь)
CaCl(ClO) + H2O + CO2 = CaCO3 + Cl2 + H2O
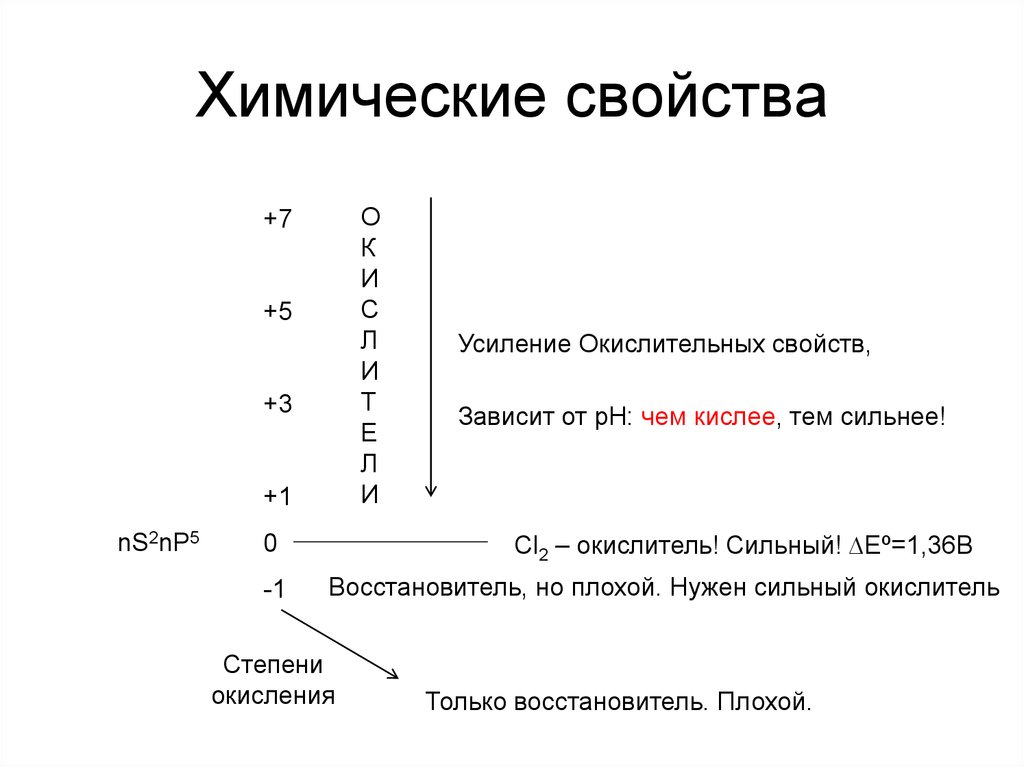
23. Химические свойства
ОК
И
С
Л
И
Т
Е
Л
И
+7
+5
+3
+1
nS2nP5
Зависит от рН: чем кислее, тем сильнее!
Cl2 – окислитель! Сильный! ∆Eº=1,36В
0
-1
Усиление Окислительных свойств,
Восстановитель, но плохой. Нужен сильный окислитель
Степени
окисления
Только восстановитель. Плохой.
24. Химические свойства
Примеры:2KClO3 = 2KСl + 3O2 (нагрев. В присутствии MnO2)
4KClO3 = KCl + 3KClO4 (нагрев.)
NaClO3 ϟ = NaClO4 (электролиз)
KBrO3 + O3 = KBrO4
NaIO3 + Cl2 + 4NaOH = Na3H2IO6↓ + 2NaCl + H2O
HClO4 – сильная кислота.
ClO4- - не окислитель при низких температурах (кинетика)
8Al + 3KClO4 = 3 KCl + 4Al2O3 – в двигателях системы Спейс Шатл.

















 Химия
Химия