Похожие презентации:
Геометрия молекул
1. Геометрия молекул
к.х.н., доц. Губанов Александр Иридиевич2. Что читать?
Чупахин А. П. Общая химия. Химическая связь и строение вещества.Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия.
Ахметов Н. С. Общая и неорганическая химия.
Глинка Н.Л. Общая химия.
3. Геометрия
• Геометрическое (пространственное) строение –это взаимное расположение атомов в
многоатомной частице, характеризуемое
длинами и валентными углами – углами между
отрезками, соединяющими центры трех
ближайших атомов, один из которых – общий
(иначе – угол между двумя связями).
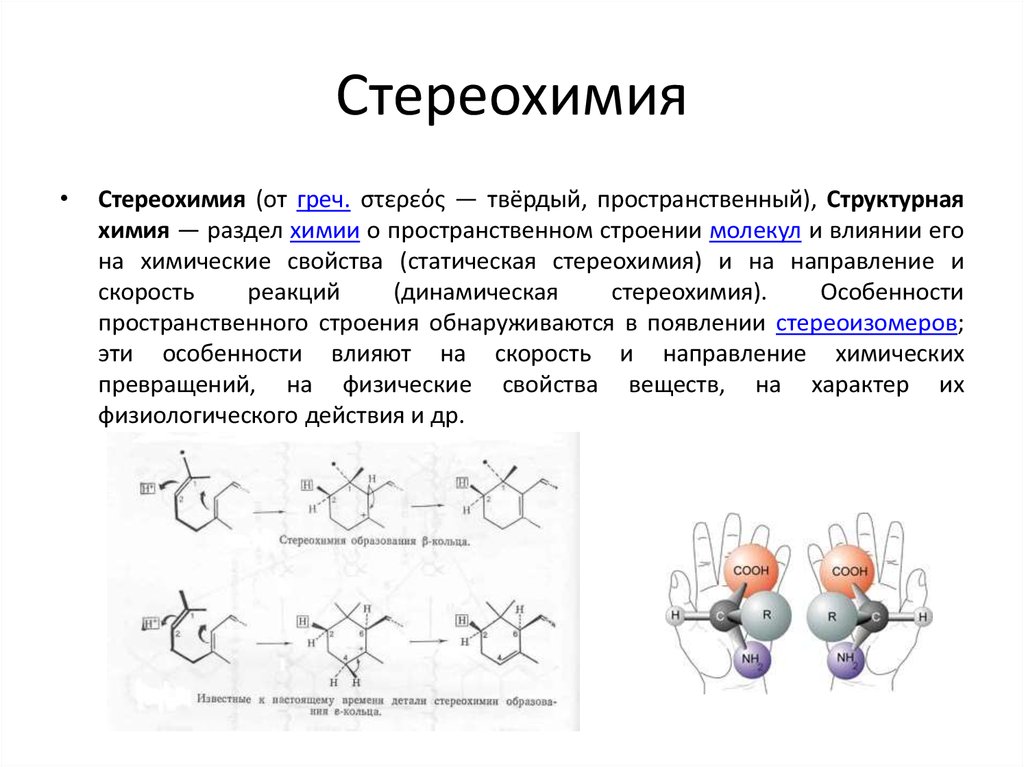
4. Стереохимия
Стереохимия (от греч. στερεός — твёрдый, пространственный), Структурная
химия — раздел химии о пространственном строении молекул и влиянии его
на химические свойства (статическая стереохимия) и на направление и
скорость
реакций
(динамическая
стереохимия).
Особенности
пространственного строения обнаруживаются в появлении стереоизомеров;
эти особенности влияют на скорость и направление химических
превращений, на физические свойства веществ, на характер их
физиологического действия и др.
5. Перхлорат калия
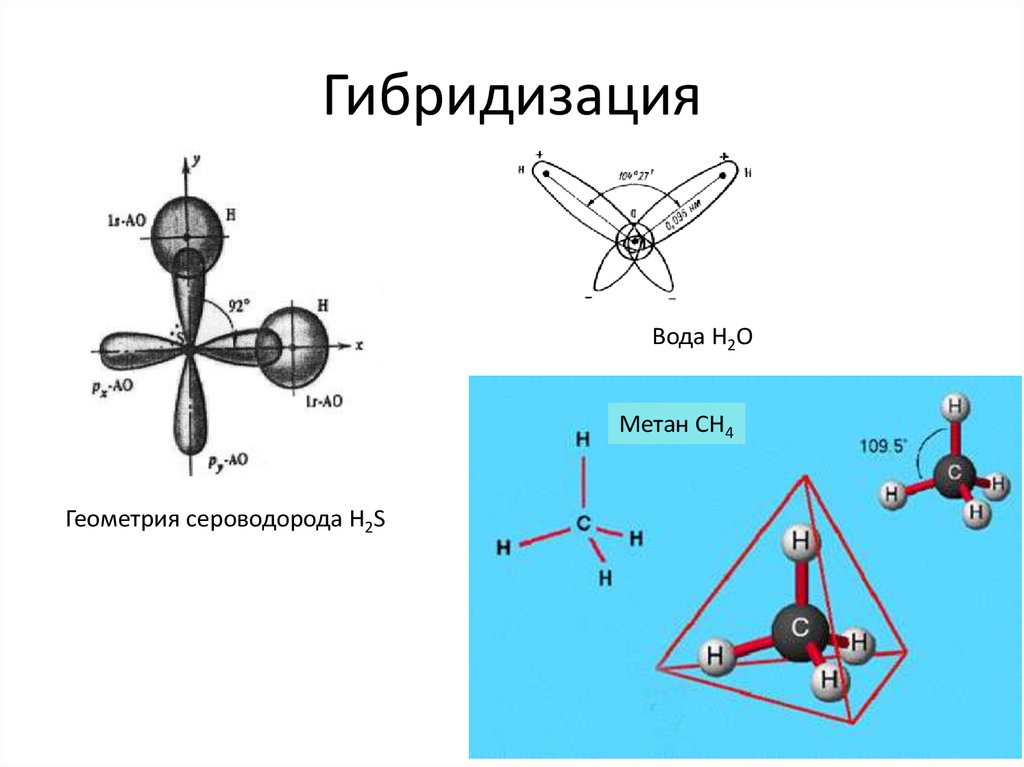
6. Гибридизация
Вода H2OМетан СН4
Геометрия сероводорода H2S
7. Гибридизация
• Гибридизацией атомных орбиталей (ГАО)называют «перемешивание» близких по
энергии АО.
• Причина в образовании максимально
возможного числа ковалентных связей и
минимизации отталкивания между
отрицательно заряженными электронными
парами (как образующими связи –
связывающими, так и не поделенными).
• Энергетически выгодно!
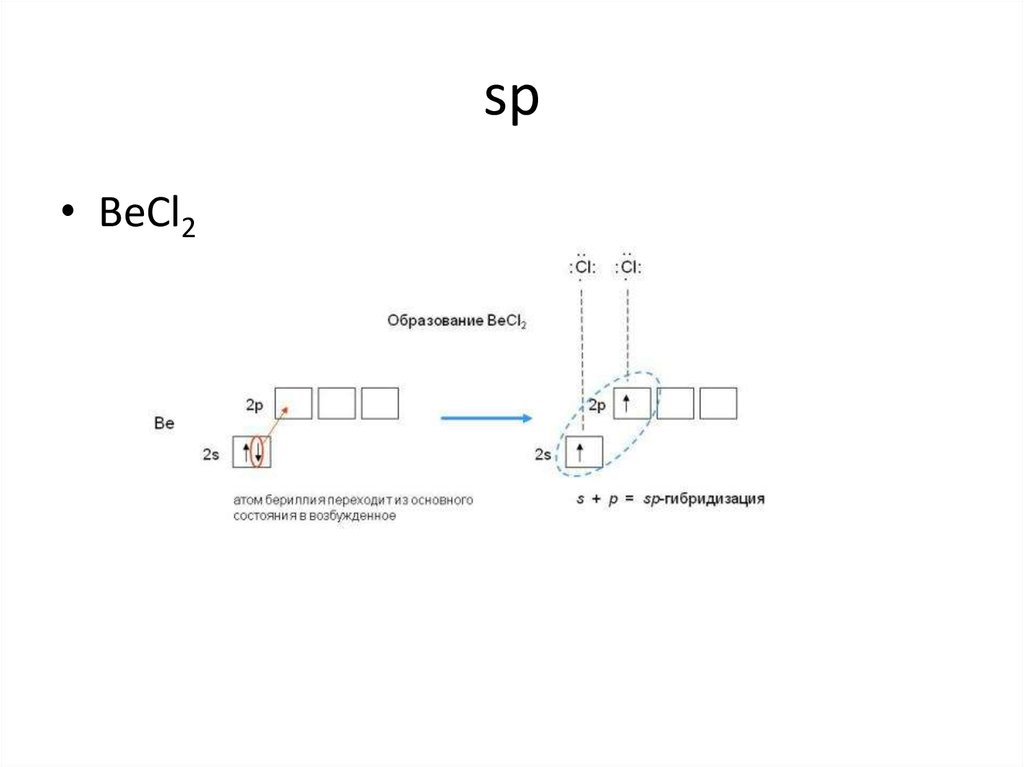
8. sp
• BeCl29. sp
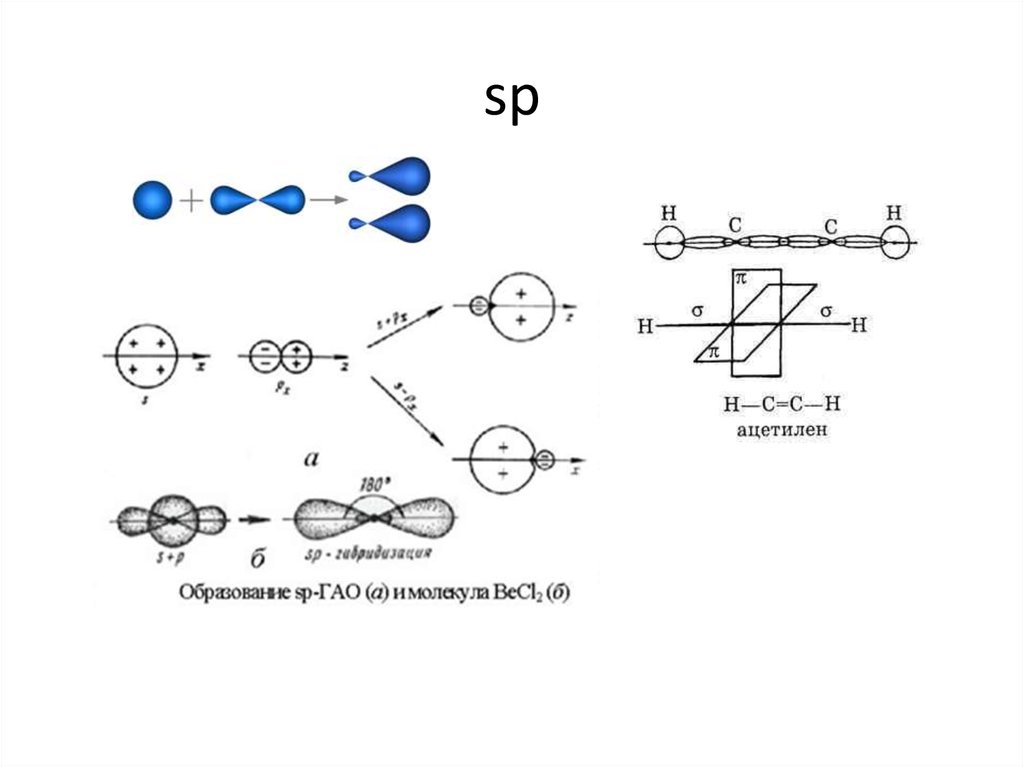
10. sp
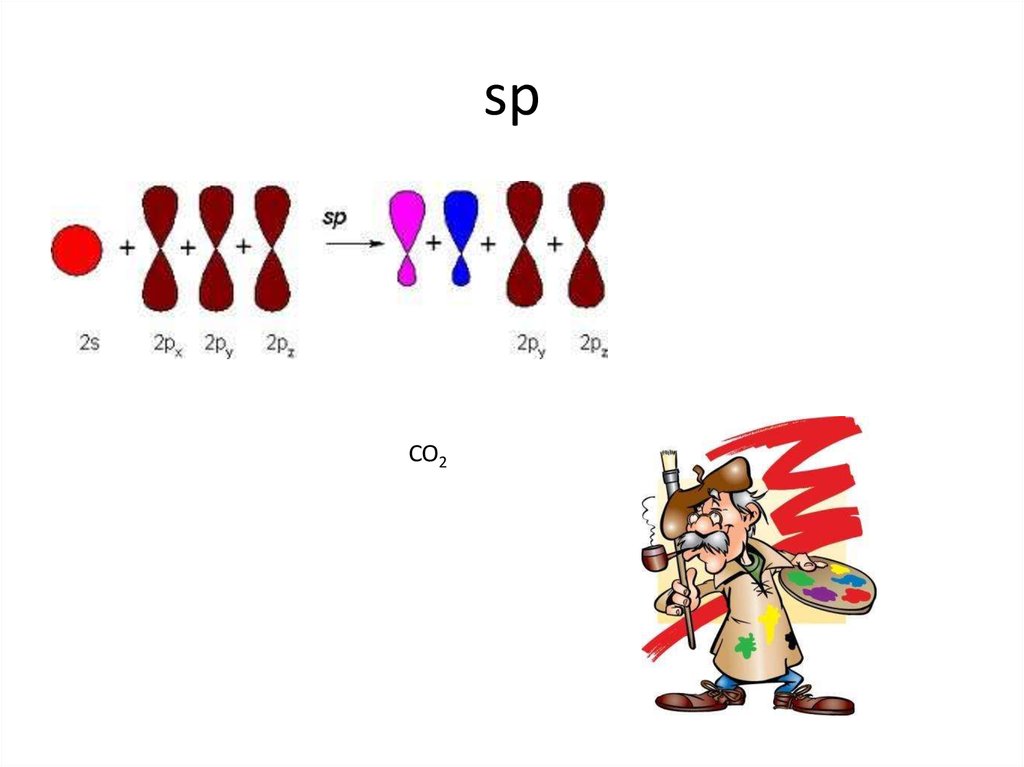
CO211. sp2
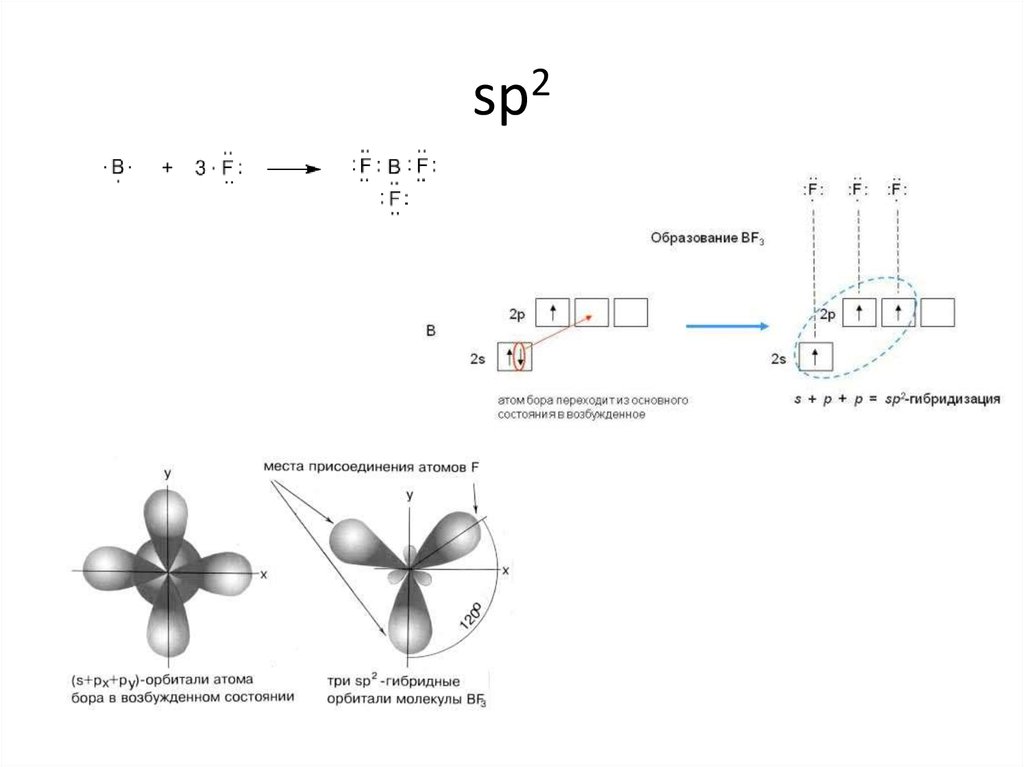
12. sp2
13. sp2
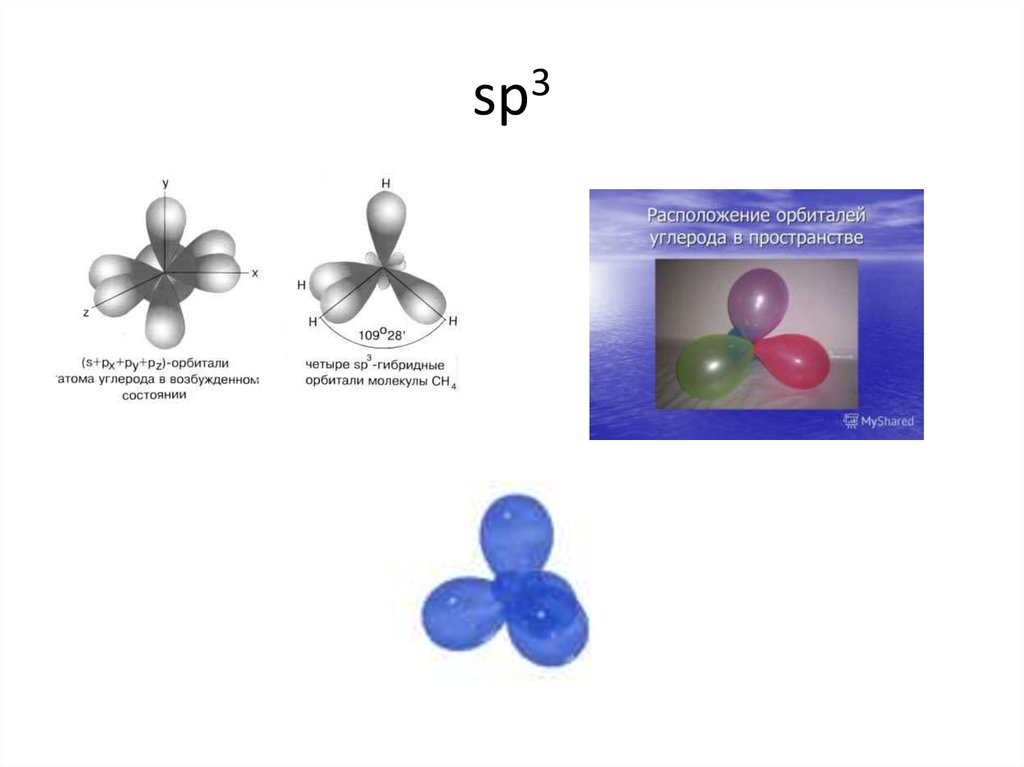
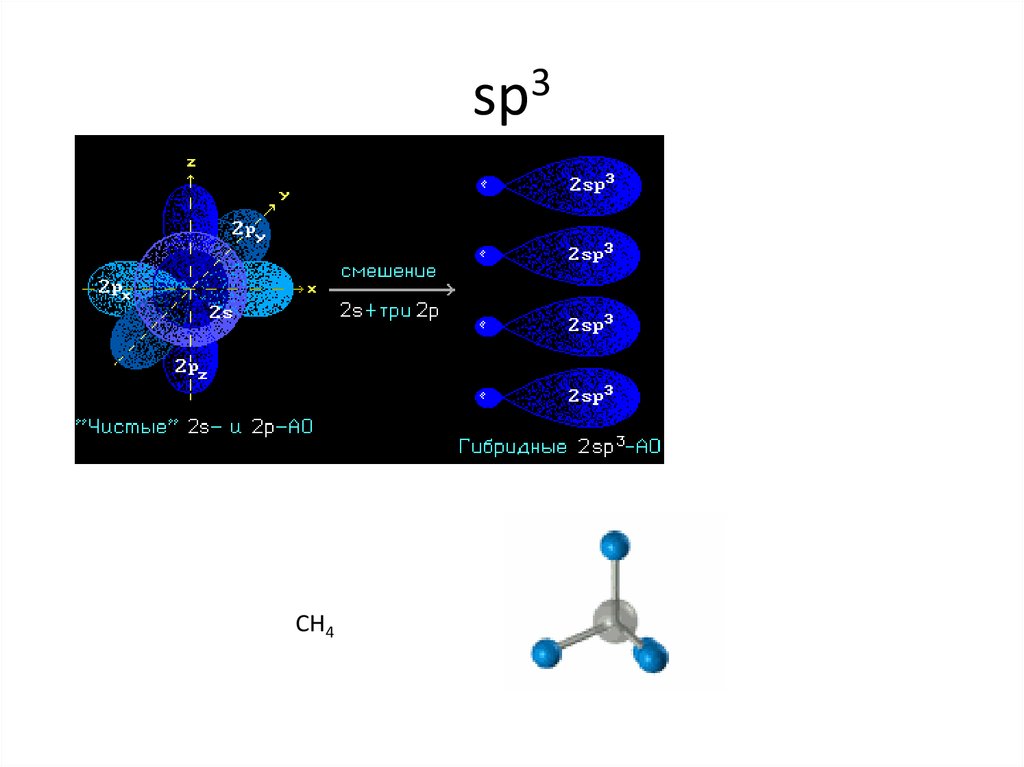
14. sp3
15. sp3
CH416. sp3
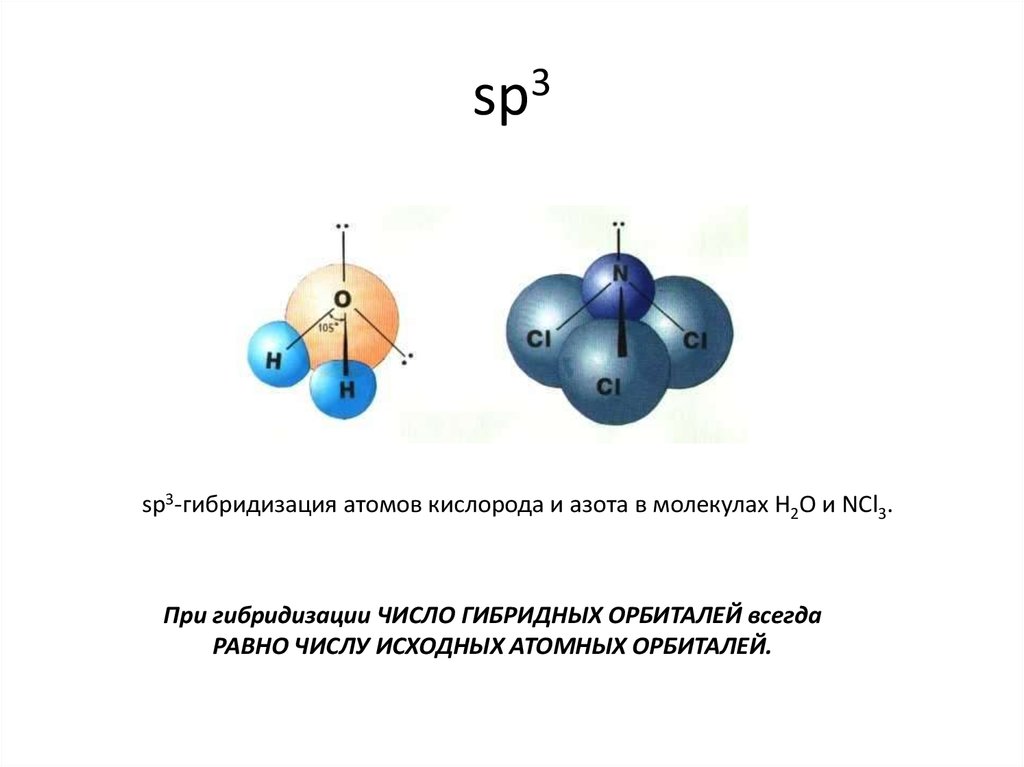
sp3-гибридизация атомов кислорода и азота в молекулах H2O и NCl3.При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда
РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
17. dsp2
Тип гибридизации dsp2 и плоскоквадратная форма комплекса реализуютсяпри образовании устойчивого диамагнитного комплекса
тетрацианоникколат(II)-иона [Ni(CN)4]2- (КЧ = 4):
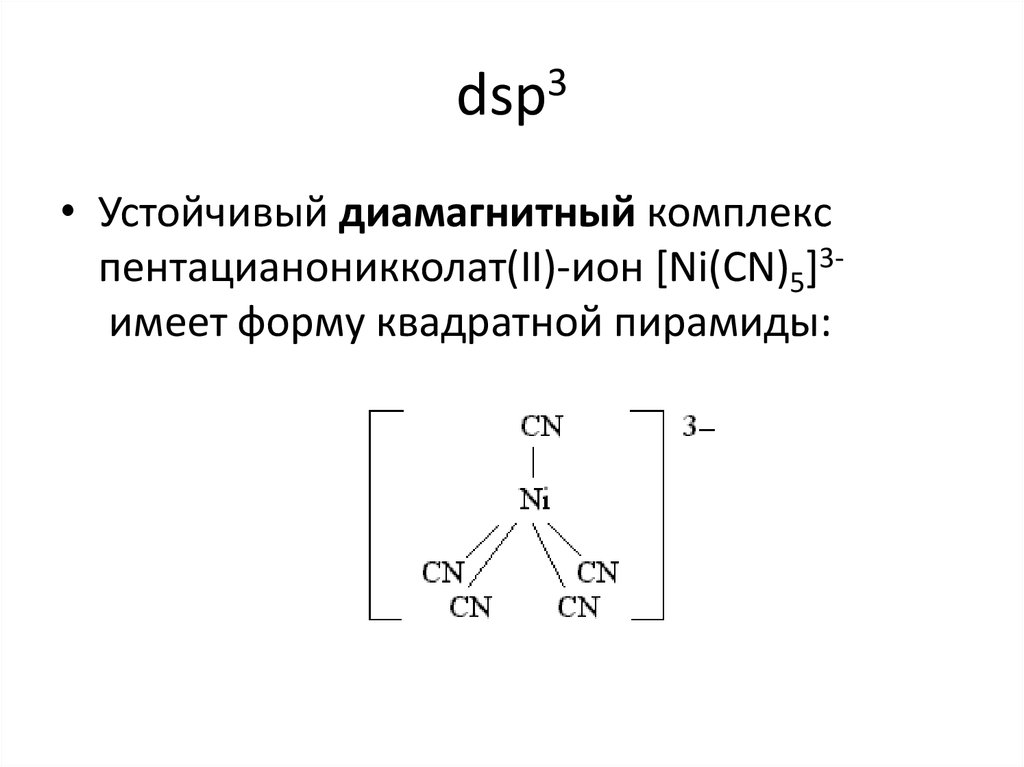
18. dsp3
• Устойчивый диамагнитный комплекспентацианоникколат(II)-ион [Ni(CN)5]3имеет форму квадратной пирамиды:
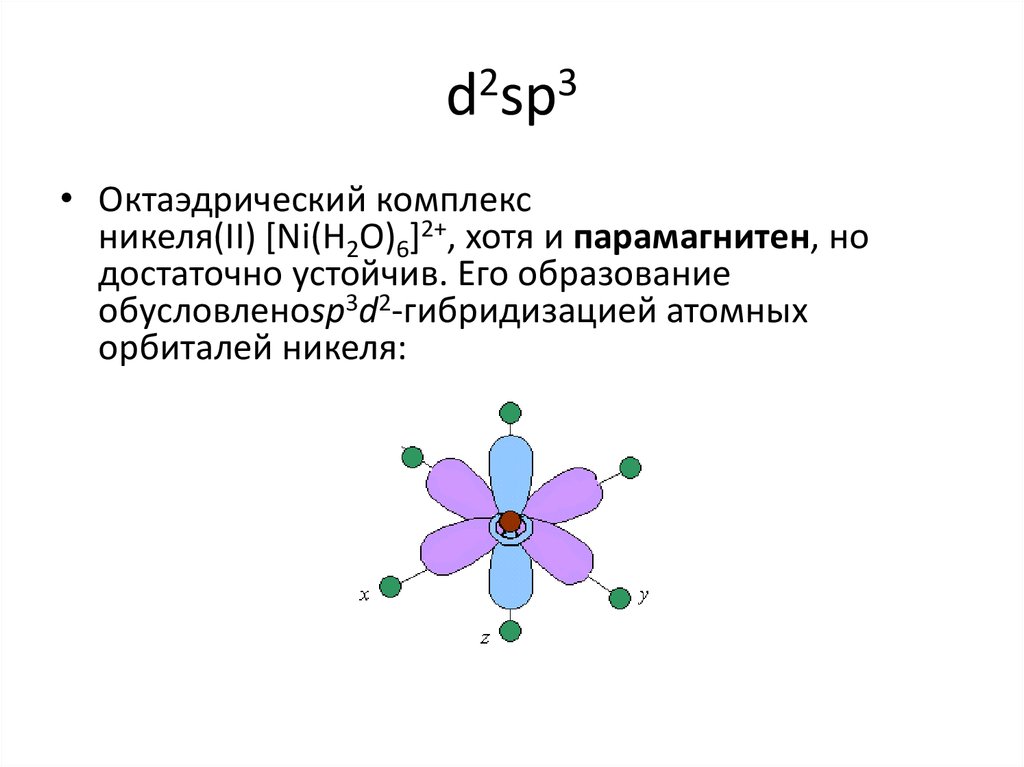
19. d2sp3
• Октаэдрический комплексникеля(II) [Ni(H2O)6]2+, хотя и парамагнитен, но
достаточно устойчив. Его образование
обусловленоsp3d2-гибридизацией атомных
орбиталей никеля:
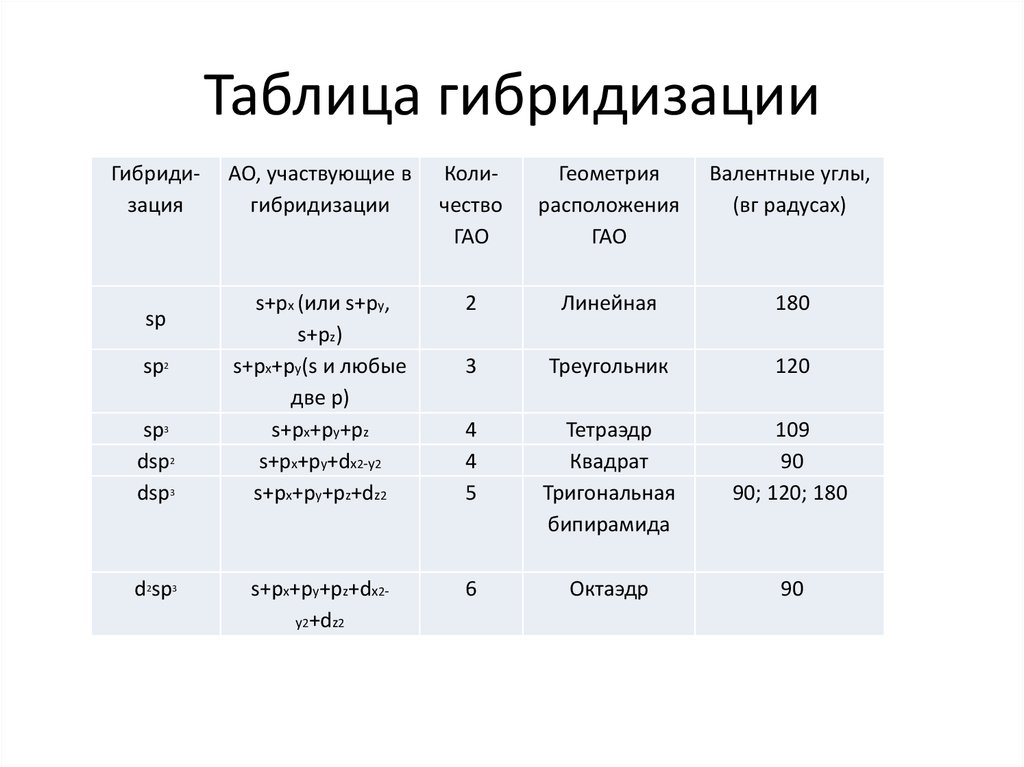
20. Таблица гибридизации
Гибридизацияsp
sp2
sp3
dsp2
dsp3
d2sp3
АО, участвующие в
гибридизации
Количество
ГАО
Геометрия
расположения
ГАО
Валентные углы,
(вг радусах)
s+px (или s+py,
s+pz)
s+px+ру(s и любые
две р)
s+px+ру+рz
s+px+ру+dx2-y2
s+px+ру+рz+dz2
2
Линейная
180
3
Треугольник
120
4
4
5
Тетраэдр
Квадрат
Тригональная
бипирамида
109
90
90; 120; 180
s+px+ру+рz+dx2y2+dz2
6
Октаэдр
90
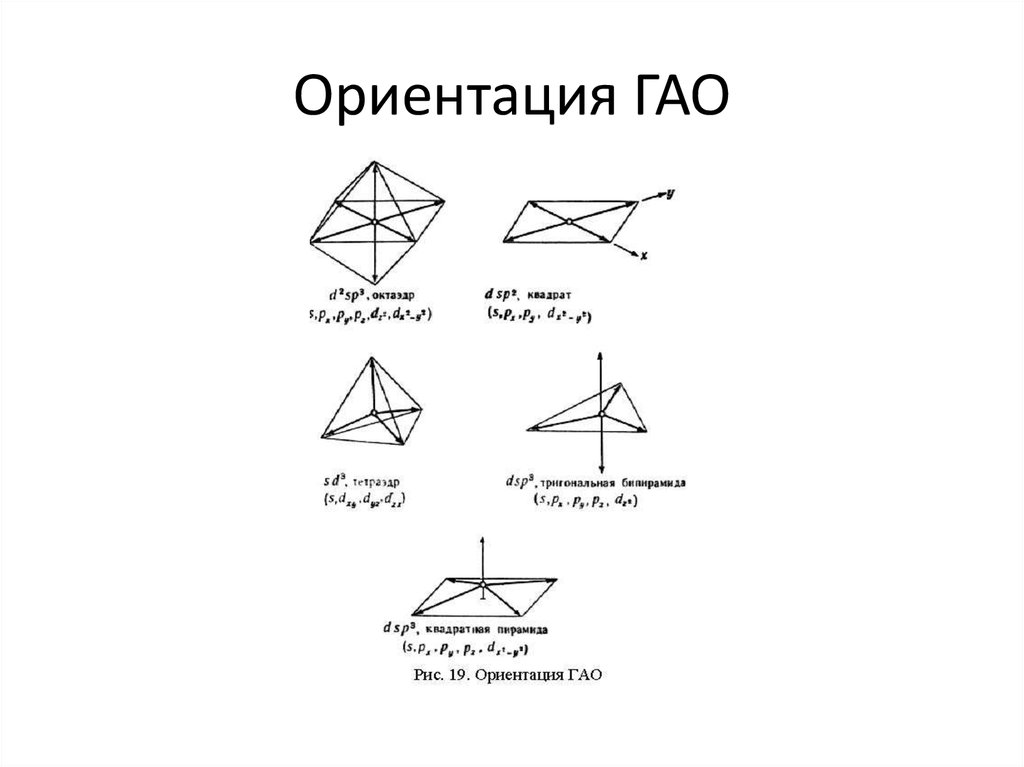
21. Ориентация ГАО
22. Метод Гиллеспи (1953)
Роналд Джеймс Гиллеспиродился
21 августа 1924 года, Лондон
23. НП, СП
• НП-НП – очень не выгодное соседство (90о)• НП- СП – не выгодное соседство (90о)
• СП-СП – выгодное соседство (90о)
24.
25.
26. AB
27. AB2Ex
28. AB3Ex
29. AB4Ex
30. AB5Ex
31. AB6Ex
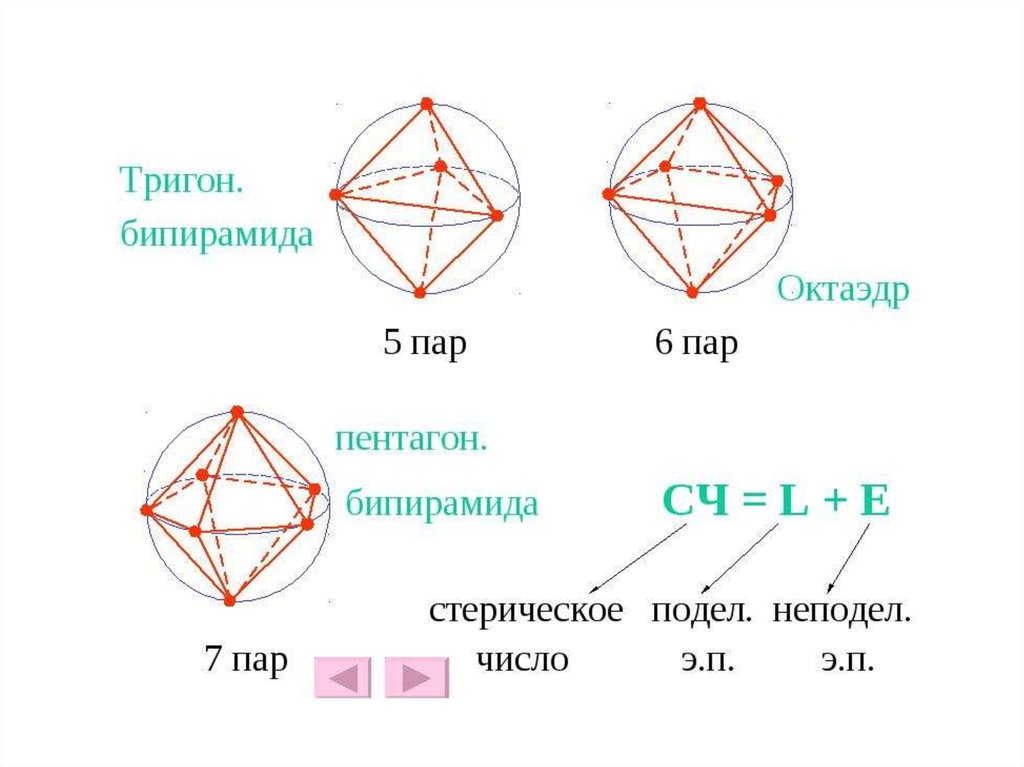
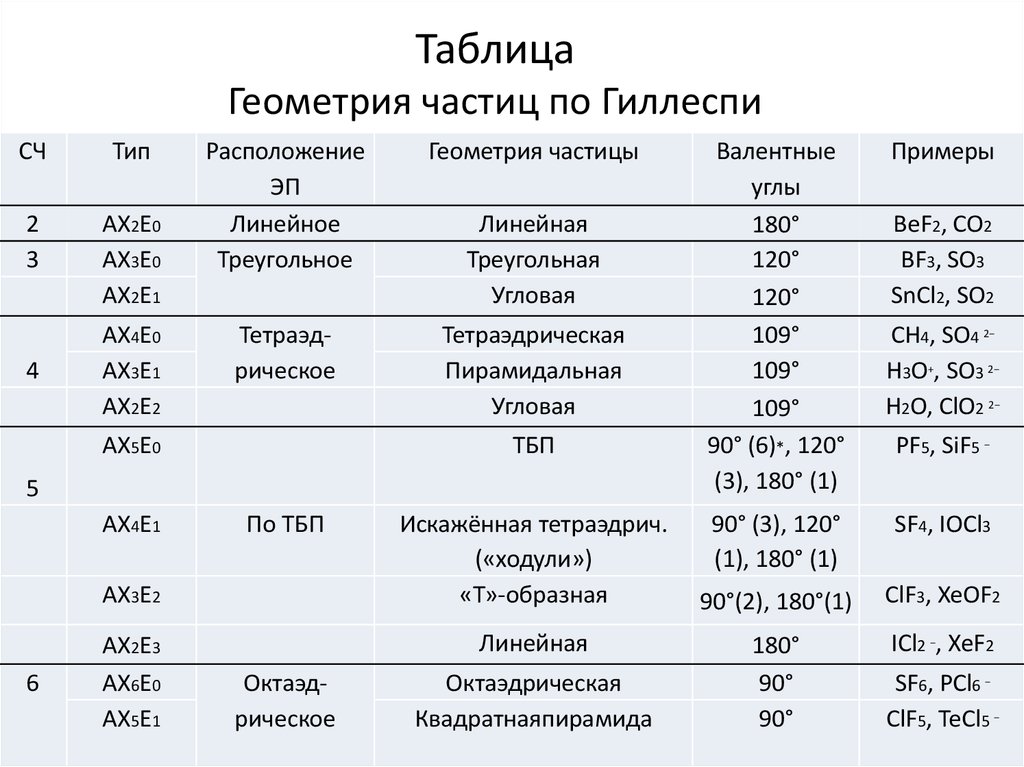
32. Таблица Геометрия частиц по Гиллеспи
СЧТип
2
3
АХ2Е0
АХ3Е0
АХ2Е1
4
АХ4Е0
АХ3Е1
АХ2Е2
Расположение
ЭП
Линейное
Треугольное
Геометрия частицы
Тетраэдрическое
Тетраэдрическая
Пирамидальная
Угловая
АХ5Е0
Линейная
Треугольная
Угловая
ТБП
5
АХ4Е1
По ТБП
АХ3Е2
6
АХ2Е3
АХ6Е0
АХ5Е1
Искажённая тетраэдрич.
(«ходули»)
«Т»-образная
Линейная
Октаэдрическое
Октаэдрическая
Квадратнаяпирамида
Валентные
углы
180°
120°
120°
109°
109°
109°
90° (6)*, 120°
(3), 180° (1)
Примеры
BeF2, CO2
BF3, SO3
SnCl2, SO2
CH4, SO4 2−
H3O+, SO3 2−
H2O, ClO2 2−
PF5, SiF5 −
90° (3), 120°
(1), 180° (1)
SF4, IOCl3
90°(2), 180°(1)
ClF3, XeOF2
180°
90°
90°
ICl2 −, XeF2
SF6, PCl6 −
ClF5, TeCl5 −
33.
34. Алгоритм
Алгоритм определения геометрии частицы по методу Гиллеспи (рассмотрим напримере SО2):
1. Исходя из электронных конфигураций атомов (S [Ne]3s23р4, О [He]2s22p4)
определить их ковалентность: 2, 4 или 6 для S и 2 для О.
2. Из значений ковалентностей построить структурную формулу, т. е. определить
строение частицы: число и расположение σ- и π- связей. О=S=О.
3. Определить число не поделенных пар центрального атома. Молекула типа АХ2Е1.
Вариант 1. Смотрим таблицу
Вариант 2. Таблицы нет.
Найти стерическое число (СЧ = 2+ 1 =3) и задаваемое им расположение ЭП: по
вершинам правильной фигуры расположить НП так, чтобы отталкивание НП-НП и
НП-СП было минимальным.

























 Химия
Химия








