Похожие презентации:
Характеристика химических элементов и химических реакций
1.
2. Характеристика элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
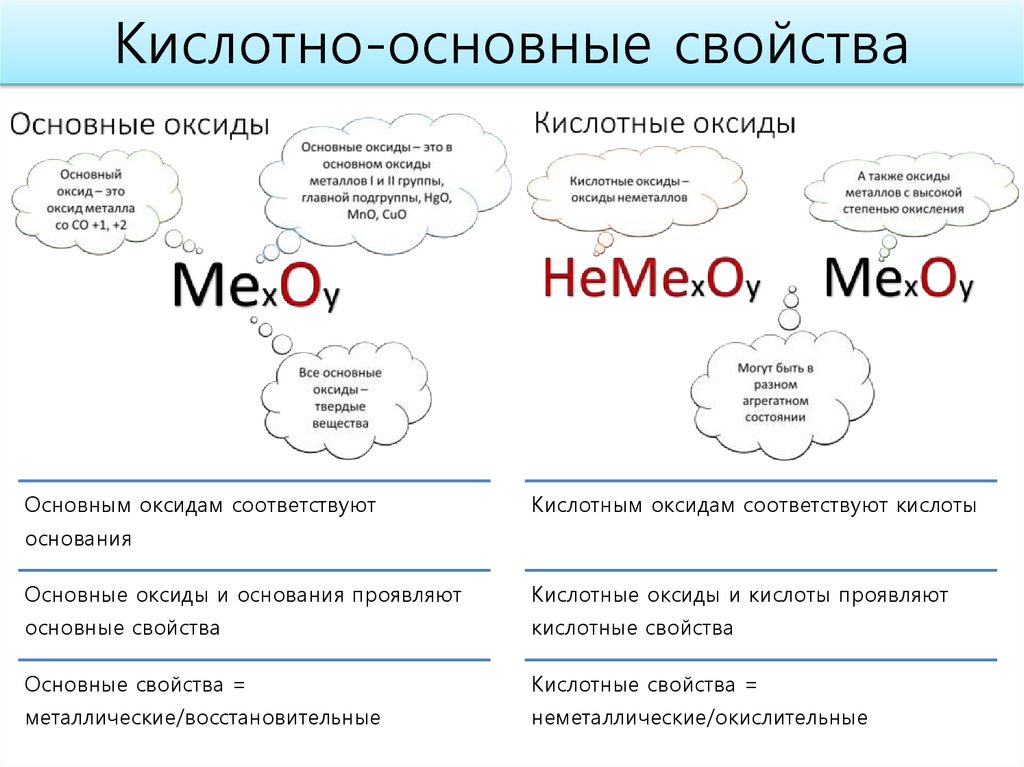
Число3. Кислотно-основные свойства
Основным оксидам соответствуютКислотным оксидам соответствуют кислоты
основания
Основные оксиды и основания проявляют
Кислотные оксиды и кислоты проявляют
основные свойства
кислотные свойства
Основные свойства =
Кислотные свойства =
металлические/восстановительные
неметаллические/окислительные
4.
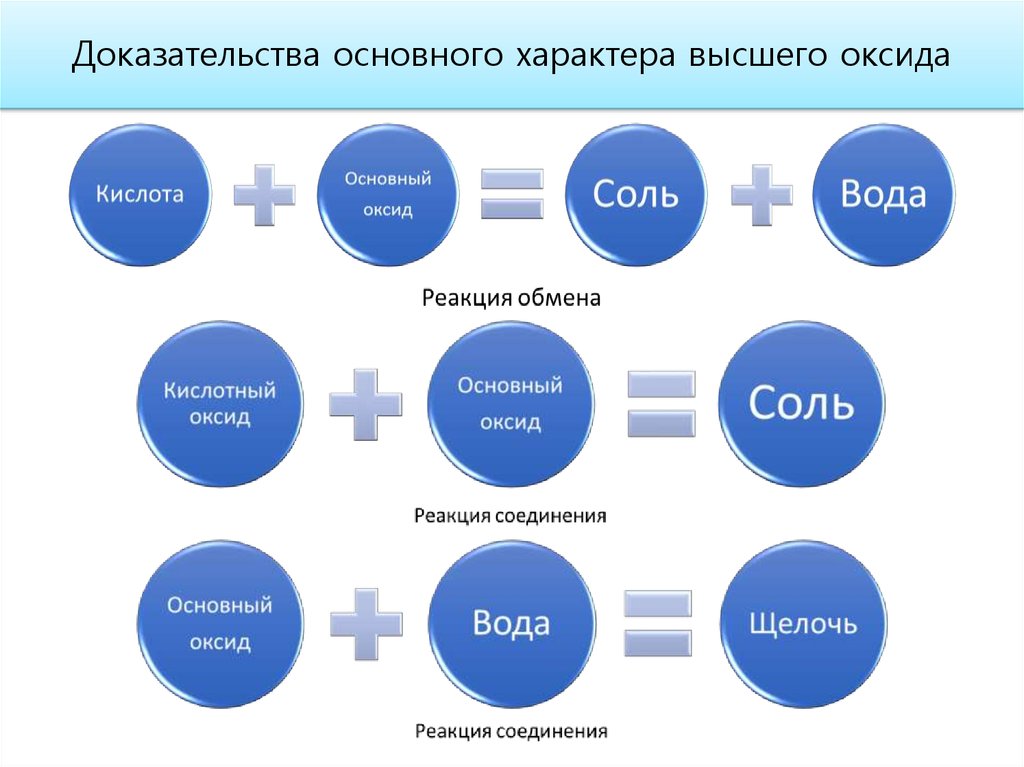
Доказательства основного характера высшего оксида5.
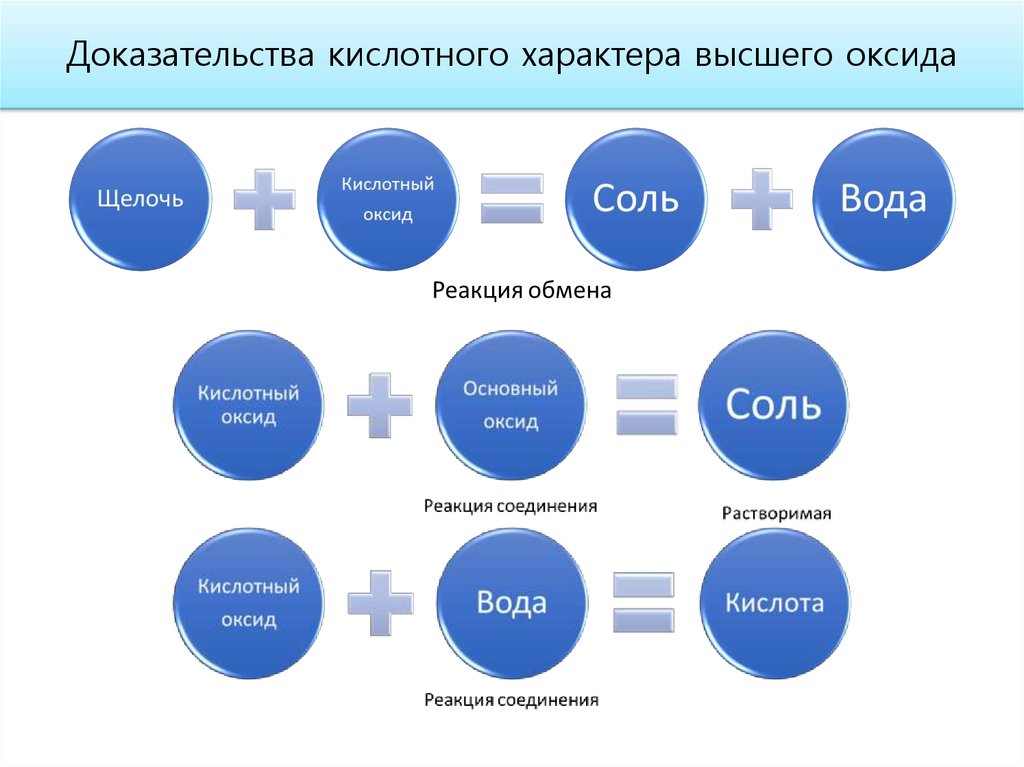
Доказательства кислотного характера высшего оксида6.
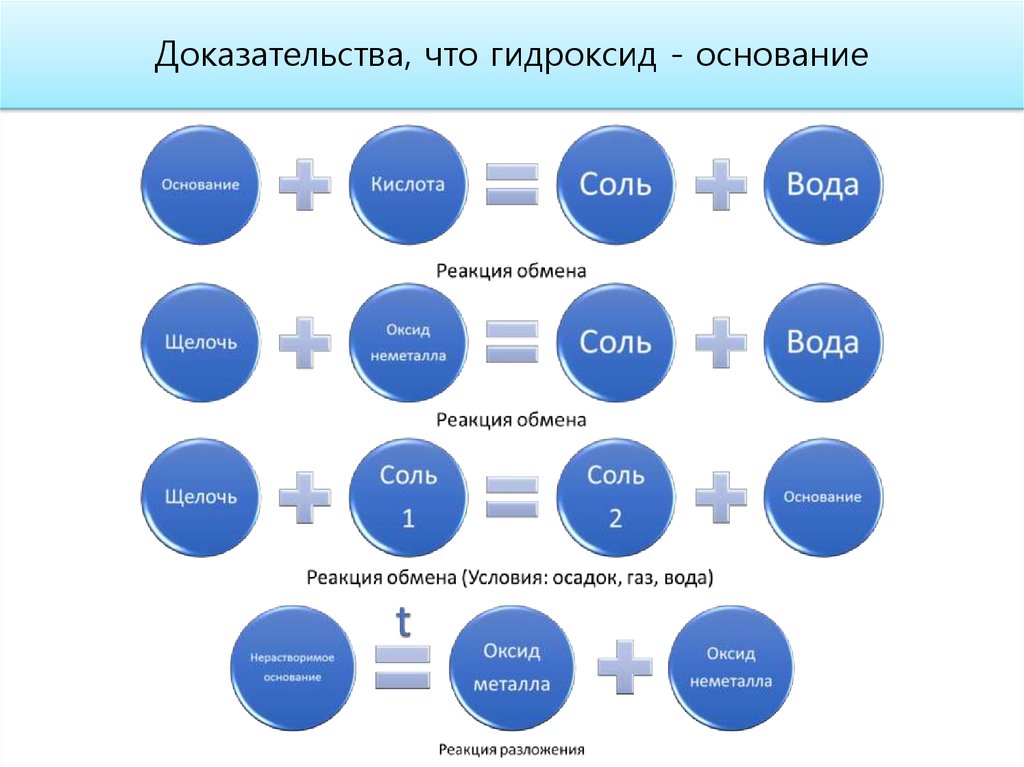
Доказательства, что гидроксид - основание7.
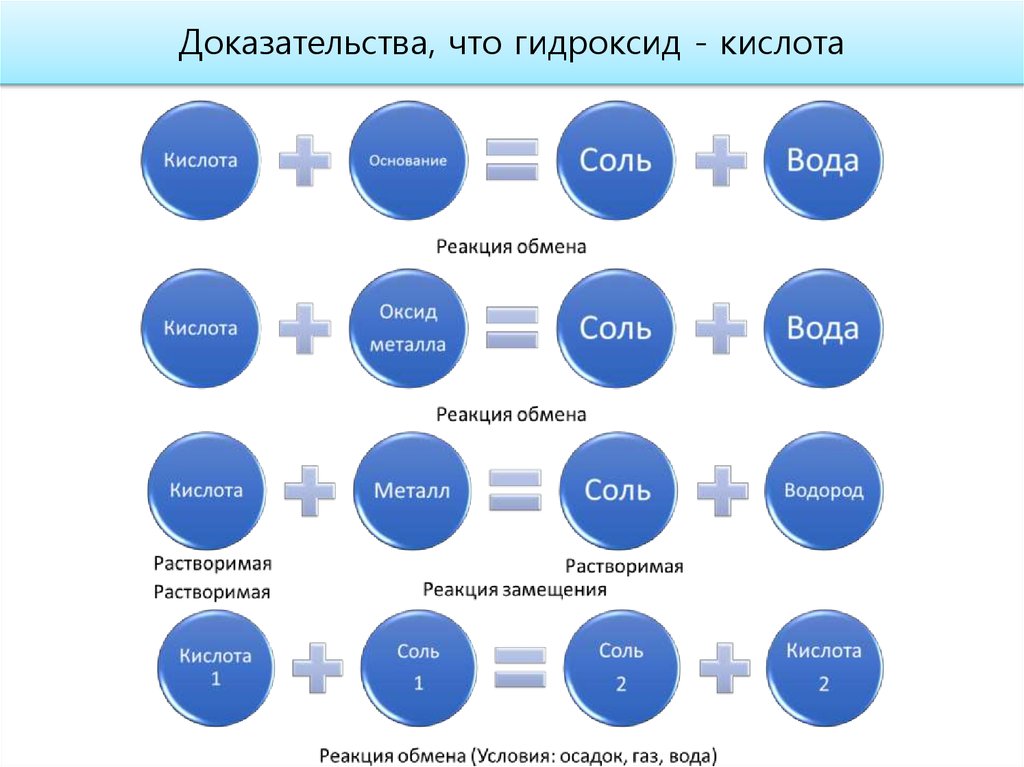
Доказательства, что гидроксид - кислота8. Эксперимент
Цель: получить гидроксид цинкаи проверить его кислотно-основные свойства
Оборудование:
ZnCl2, NaOH, HCl, две пробирки
Ход эксперимента:
Вывод: Полученный гидроксид цинка провзаимодействовал с кислотой (проявил
основные свойства) и с основанием (проявил кислотные свойства)
Амфотерные вещества : вещества, которые в зависимости от условий реакции
проявляют кислотные или основные свойства
(от греч. амфотеро – и тот, и другой)
Гидроксид цинка
Основание
Zn(ОН)2
Кислота
H2ZnO2
9.
Уравнения реакций, которые произошли во время экспериментаZnCL2+2NaOH=2NaCl+Zn(OH)2
Zn(OH)2+2HCl=ZnCl2+2H20
H2ZnO2+2NaOH=Na2ZnO2+2H2O
10.
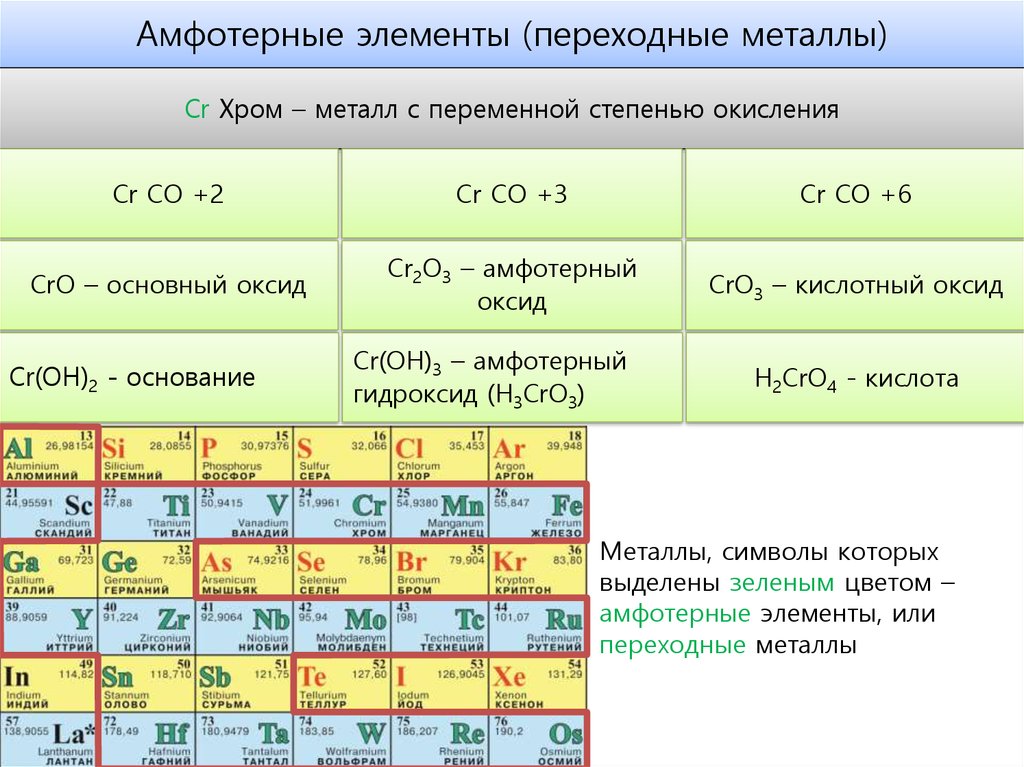
Амфотерные элементы (переходные металлы)Cr Хром – металл с переменной степенью окисления
Cr СО +2
Cr СО +3
Cr СО +6
CrO – основный оксид
Cr2O3 – амфотерный
оксид
CrO3 – кислотный оксид
Cr(OH)2 - основание
Cr(OH)3 – амфотерный
гидроксид (H3CrO3)
H2CrO4 - кислота
Металлы, символы которых
выделены зеленым цветом –
амфотерные элементы, или
переходные металлы




 Химия
Химия








