Похожие презентации:
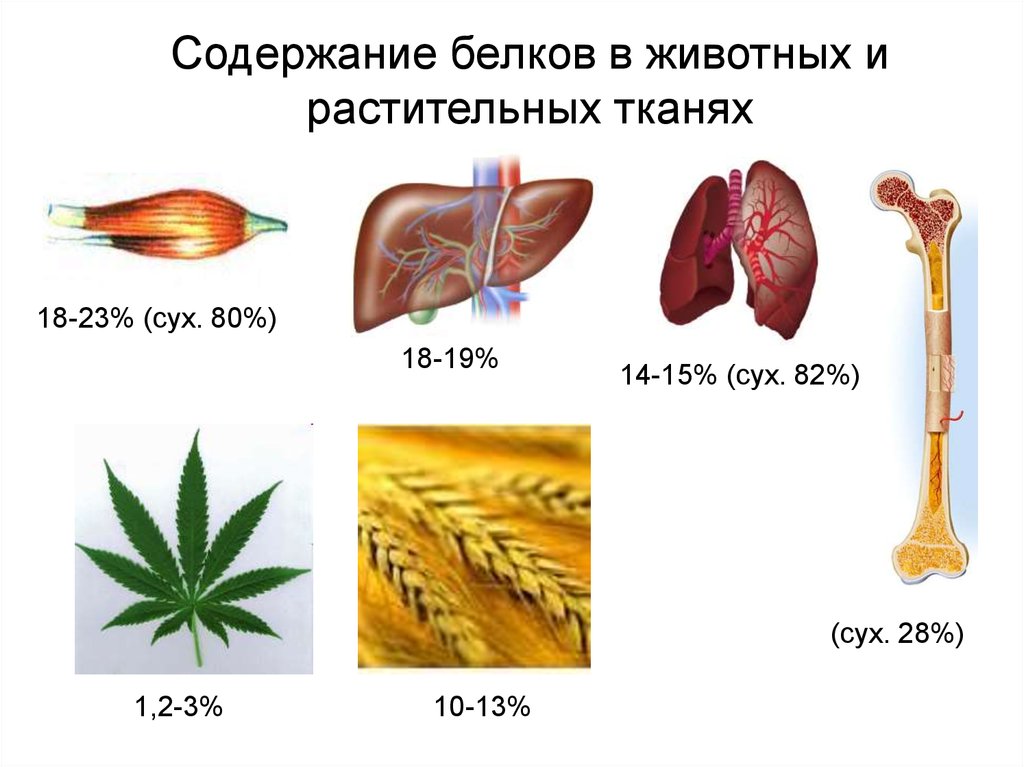
Содержание белков в животных и растительных тканях
1.
Содержание белков в животных ирастительных тканях
18-23% (сух. 80%)
18-19%
14-15% (сух. 82%)
(сух. 28%)
1,2-3%
10-13%
2.
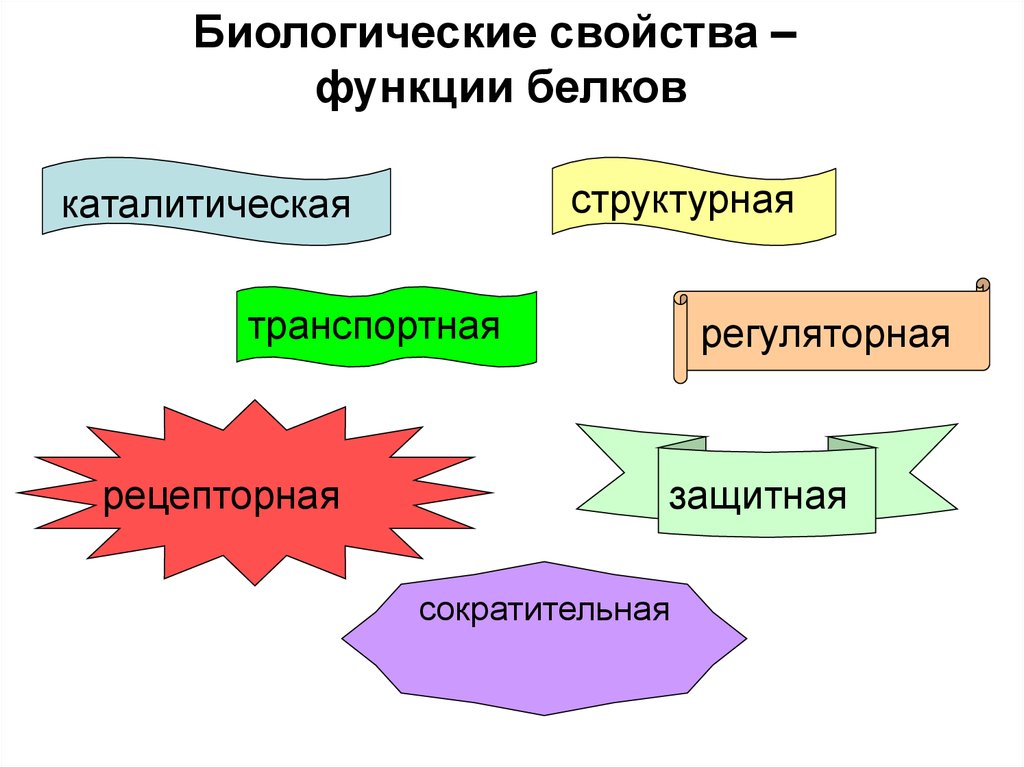
Биологические свойства –функции белков
структурная
каталитическая
транспортная
рецепторная
регуляторная
защитная
сократительная
3.
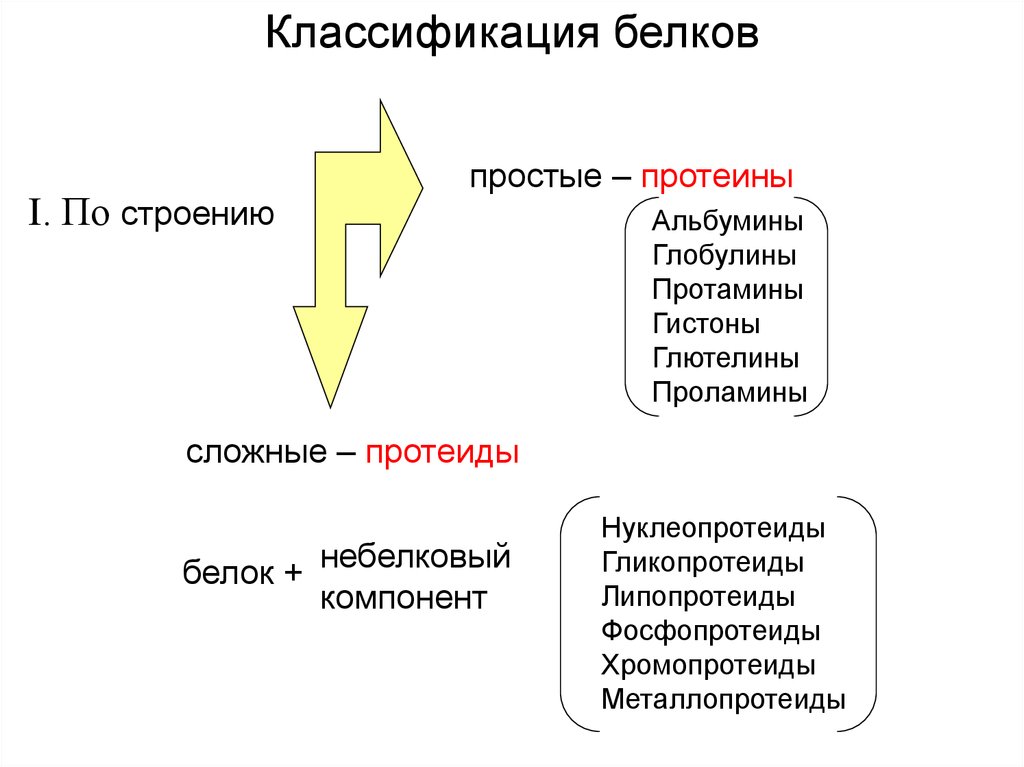
Классификация белковI. По строению
простые – протеины
Альбумины
Глобулины
Протамины
Гистоны
Глютелины
Проламины
сложные – протеиды
белок + небелковый
компонент
Нуклеопротеиды
Гликопротеиды
Липопротеиды
Фосфопротеиды
Хромопротеиды
Металлопротеиды
4.
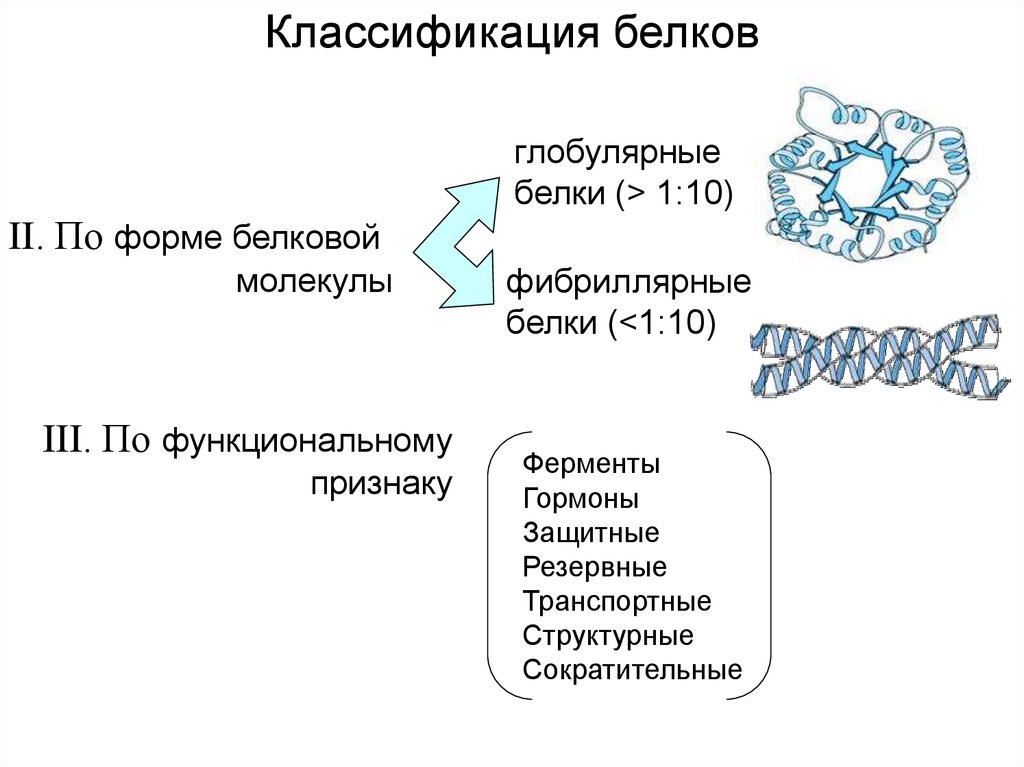
Классификация белковглобулярные
белки (> 1:10)
II. По форме белковой
молекулы
III. По функциональному
признаку
фибриллярные
белки (<1:10)
Ферменты
Гормоны
Защитные
Резервные
Транспортные
Структурные
Сократительные
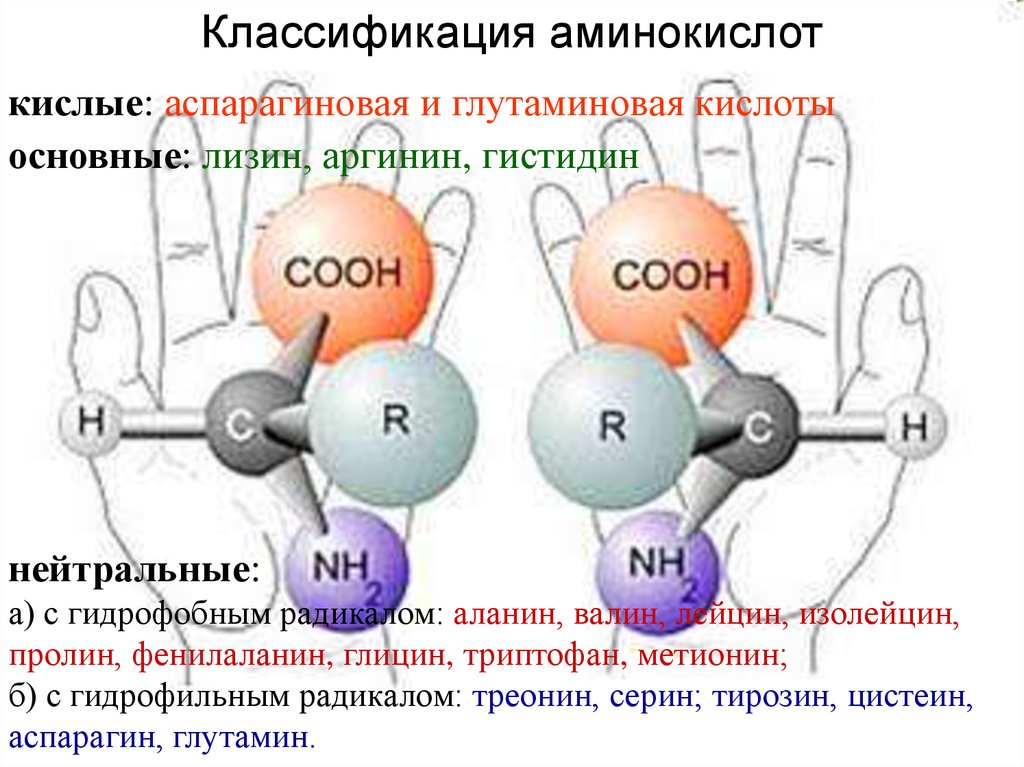
5. кислые: аспарагиновая и глутаминовая кислоты основные: лизин, аргинин, гистидин
Классификация аминокислоткислые: аспарагиновая и глутаминовая кислоты
основные: лизин, аргинин, гистидин
нейтральные:
а) с гидрофобным радикалом: аланин, валин, лейцин, изолейцин,
пролин, фенилаланин, глицин, триптофан, метионин;
б) с гидрофильным радикалом: треонин, серин; тирозин, цистеин,
аспарагин, глутамин.
6.
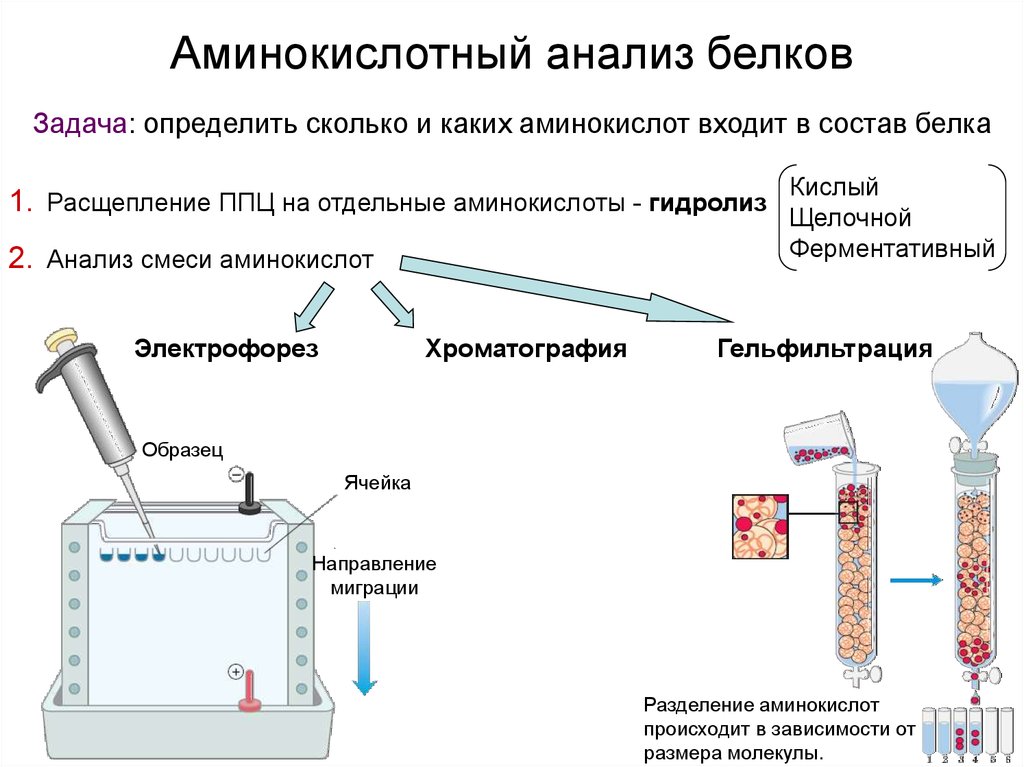
Аминокислотный анализ белковЗадача: определить сколько и каких аминокислот входит в состав белка
Кислый
1. Расщепление ППЦ на отдельные аминокислоты - гидролиз Щелочной
Ферментативный
2. Анализ смеси аминокислот
Электрофорез
Хроматография
Гельфильтрация
Образец
Ячейка
Направление
миграции
Разделение аминокислот
происходит в зависимости от
размера молекулы.
7.
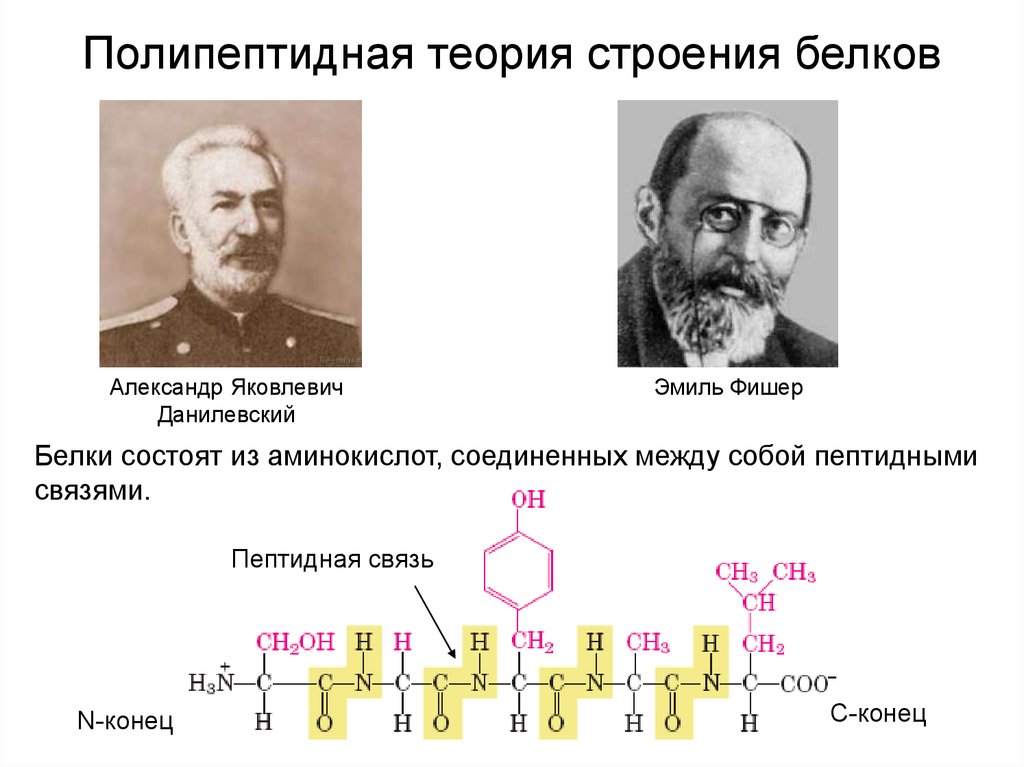
Полипептидная теория строения белковАлександр Яковлевич
Данилевский
Эмиль Фишер
Белки состоят из аминокислот, соединенных между собой пептидными
связями.
Пептидная связь
N-конец
С-конец
8.
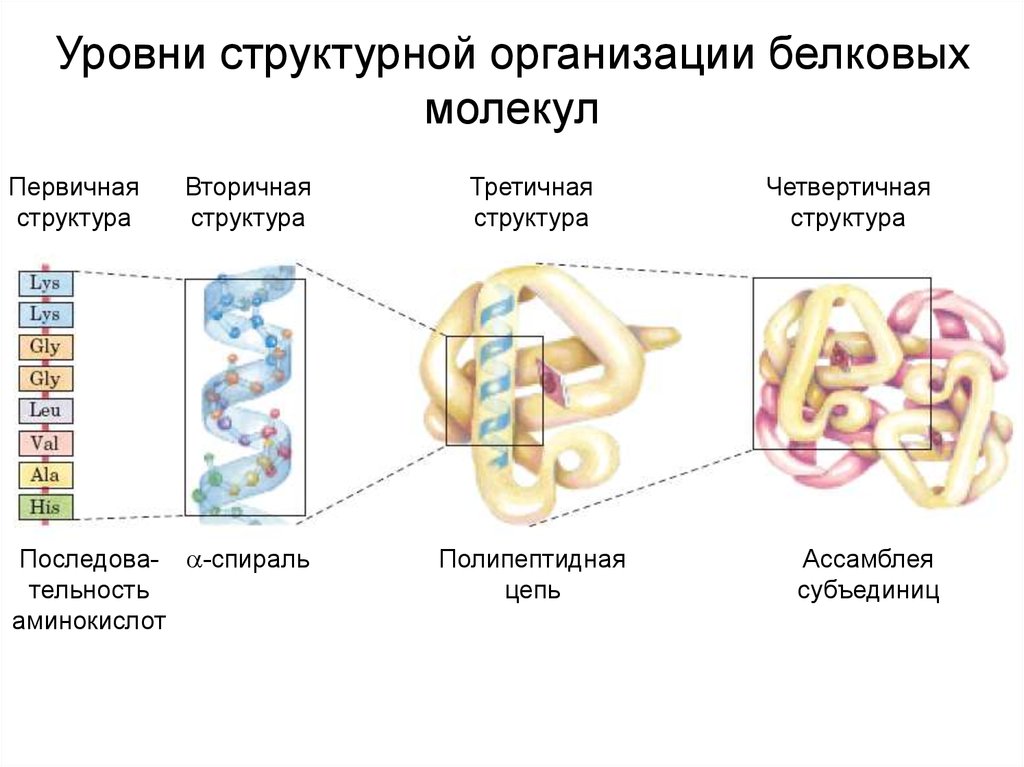
Уровни структурной организации белковыхмолекул
Первичная
структура
Вторичная
структура
Последова- -спираль
тельность
аминокислот
Третичная
структура
Полипептидная
цепь
Четвертичная
структура
Ассамблея
субъединиц
9.
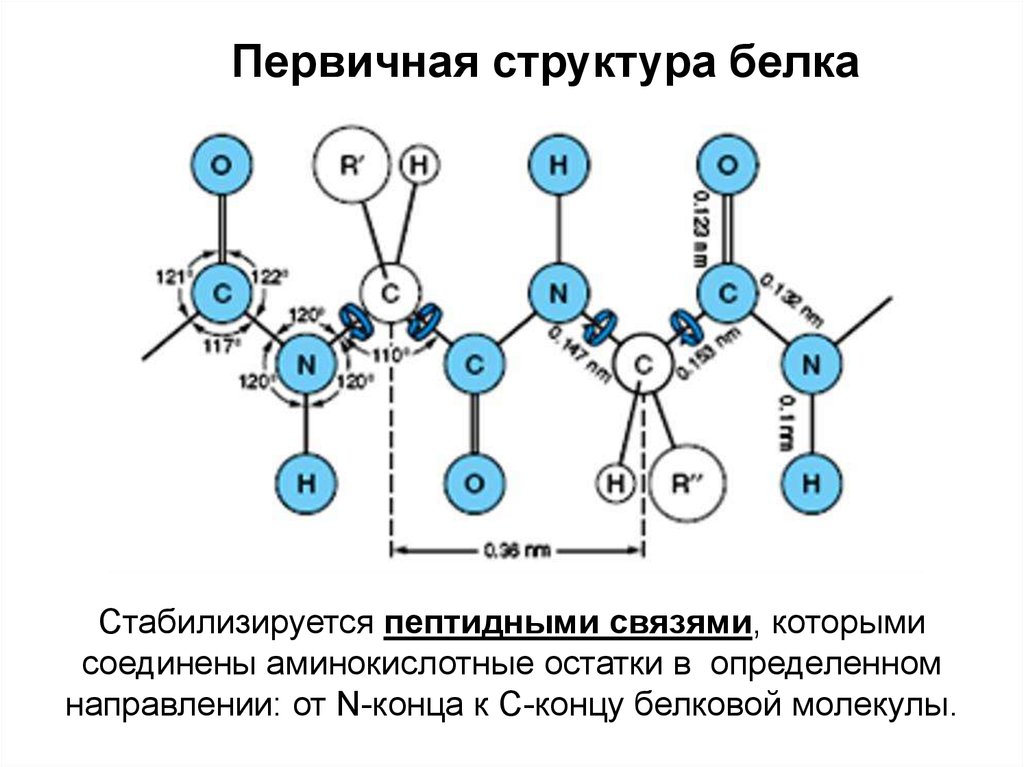
Первичная структура белкаСтабилизируется пептидными связями, которыми
соединены аминокислотные остатки в определенном
направлении: от N-конца к С-концу белковой молекулы.
10.
Методы определения аминокислотнойпоследовательности белка
1. Химическая модификация концевых аминокислот
N-концевая а/к – метод Сэнжера
С-концевая а/к – метод восстановления концевой СООН группы в спиртовую
2. Избирательный гидролиз полипептида
с С-конца – Карбоксипептидазный метод
с N-конца – Аминопептидазный метод
3. Метод Эдмана (фенилизотиоцианатный метод)
Секвенатор белков, работающий
на основе метода Эдмана.
11.
Аминокислотная последовательность инсулина быкаA цепь
Frederick Senger
Дисульфидные мостики
в молекуле инсулина
В цепь
12.
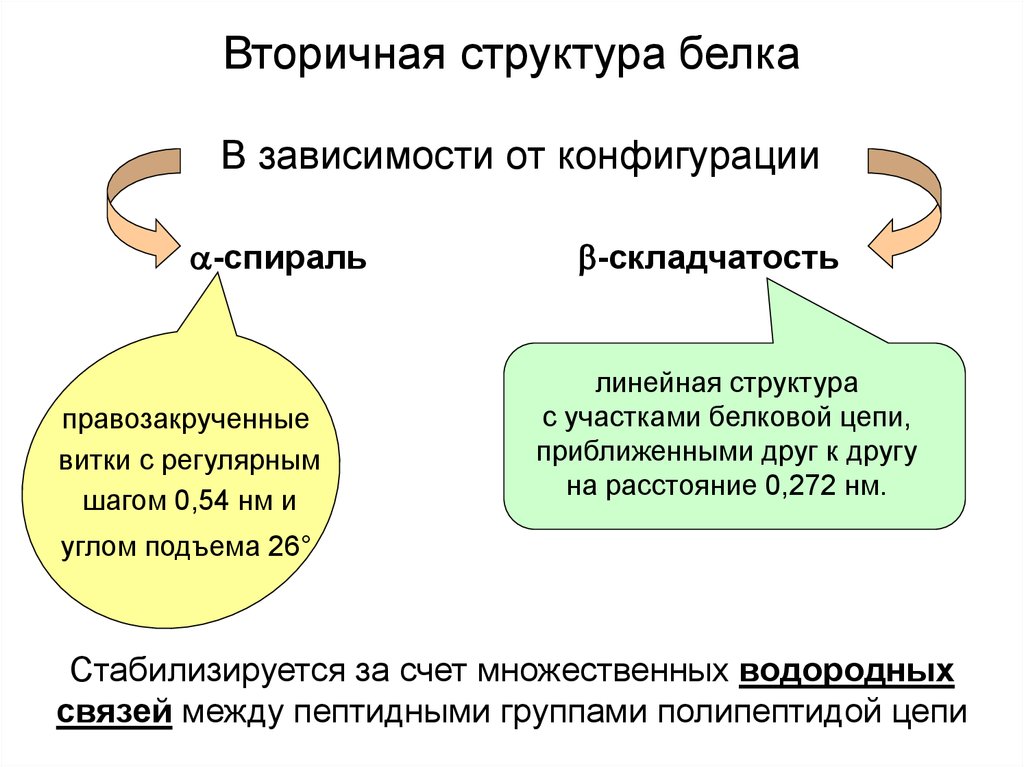
Вторичная структура белкаВ зависимости от конфигурации
-спираль
правозакрученные
витки с регулярным
шагом 0,54 нм и
-складчатость
линейная структура
с участками белковой цепи,
приближенными друг к другу
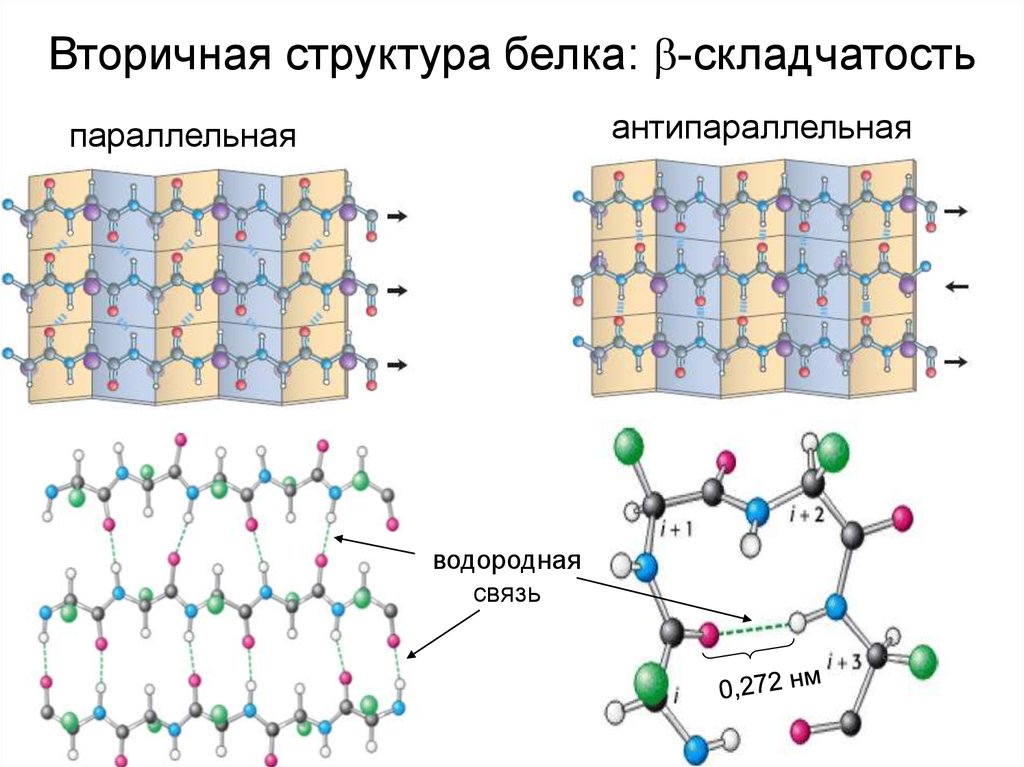
на расстояние 0,272 нм.
углом подъема 26°
Стабилизируется за счет множественных водородных
связей между пептидными группами полипептидой цепи
13.
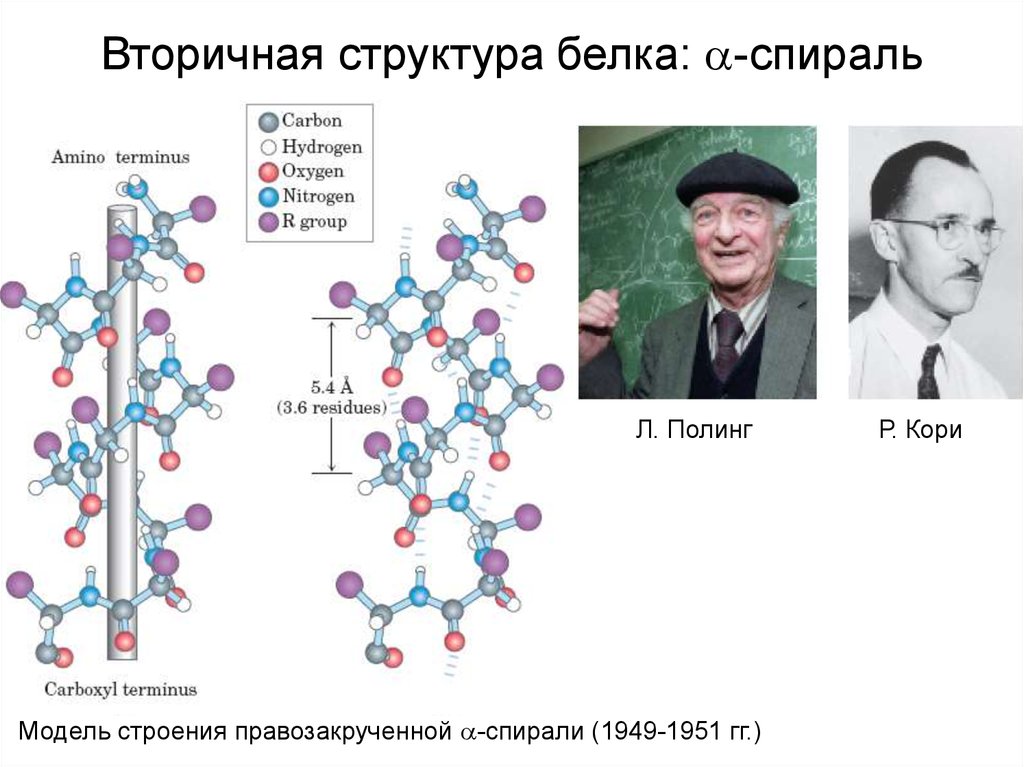
Вторичная структура белка: -спиральЛ. Полинг
Модель строения правозакрученной -спирали (1949-1951 гг.)
Р. Кори
14.
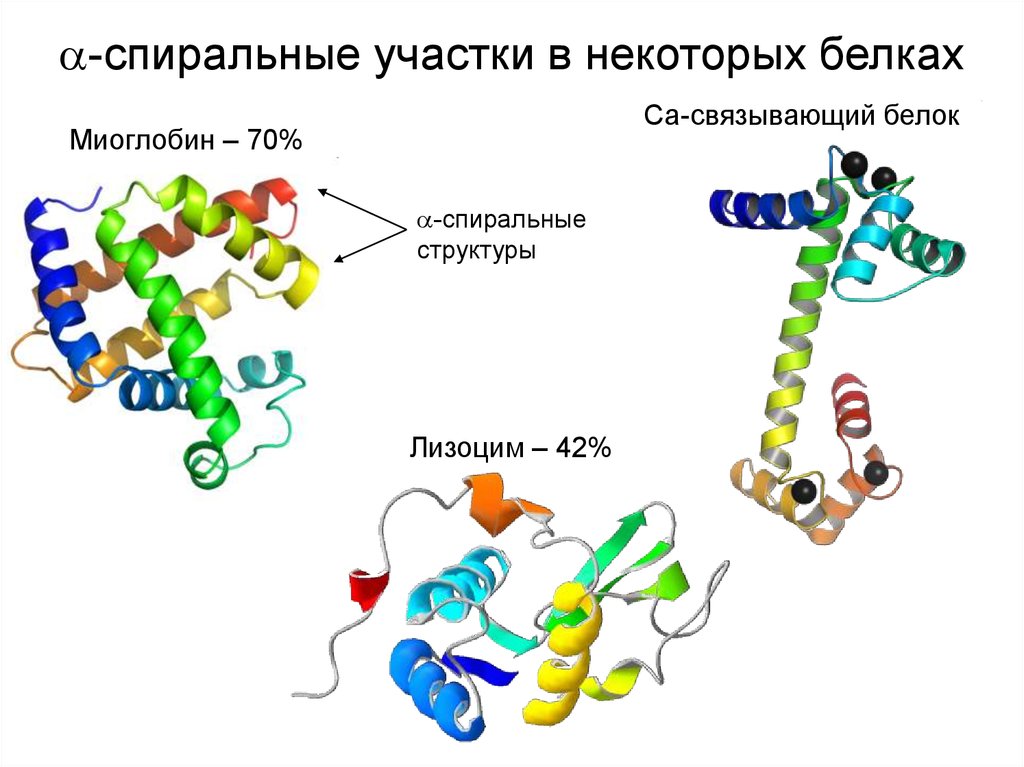
-спиральные участки в некоторых белкахCa-связывающий белок
Миоглобин – 70%
-спиральные
структуры
Лизоцим – 42%
15.
Вторичная структура белка: -складчатостьантипараллельная
параллельная
водородная
связь
16.
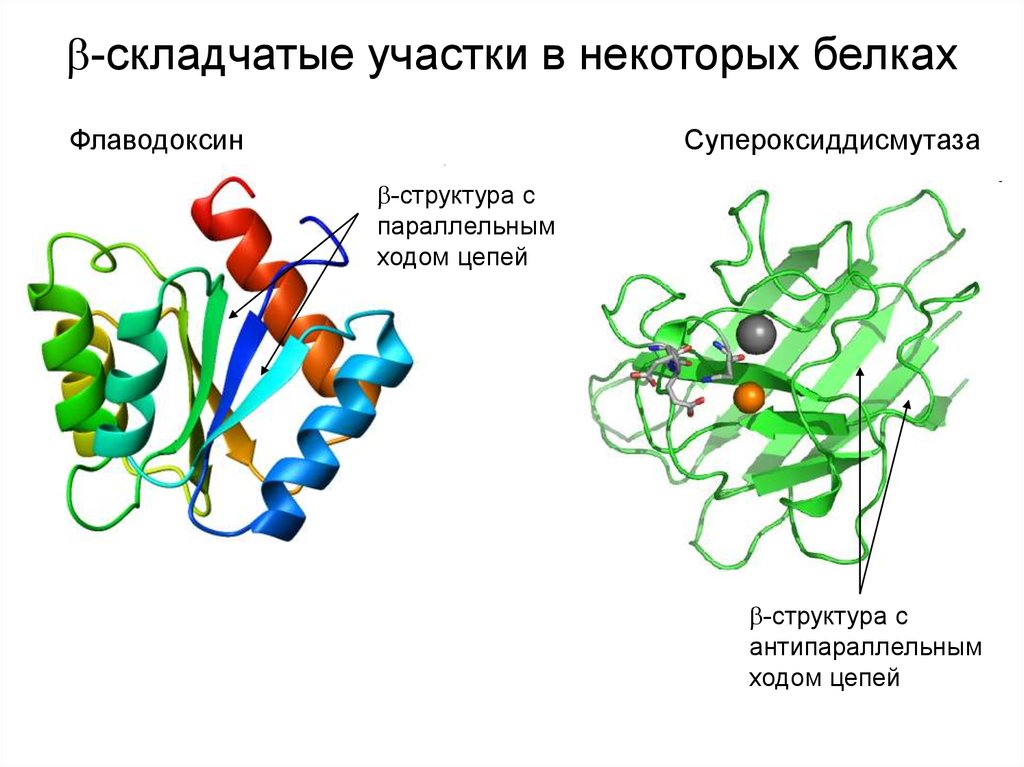
-складчатые участки в некоторых белкахФлаводоксин
Супероксиддисмутаза
-структура с
параллельным
ходом цепей
-структура с
антипараллельным
ходом цепей
17.
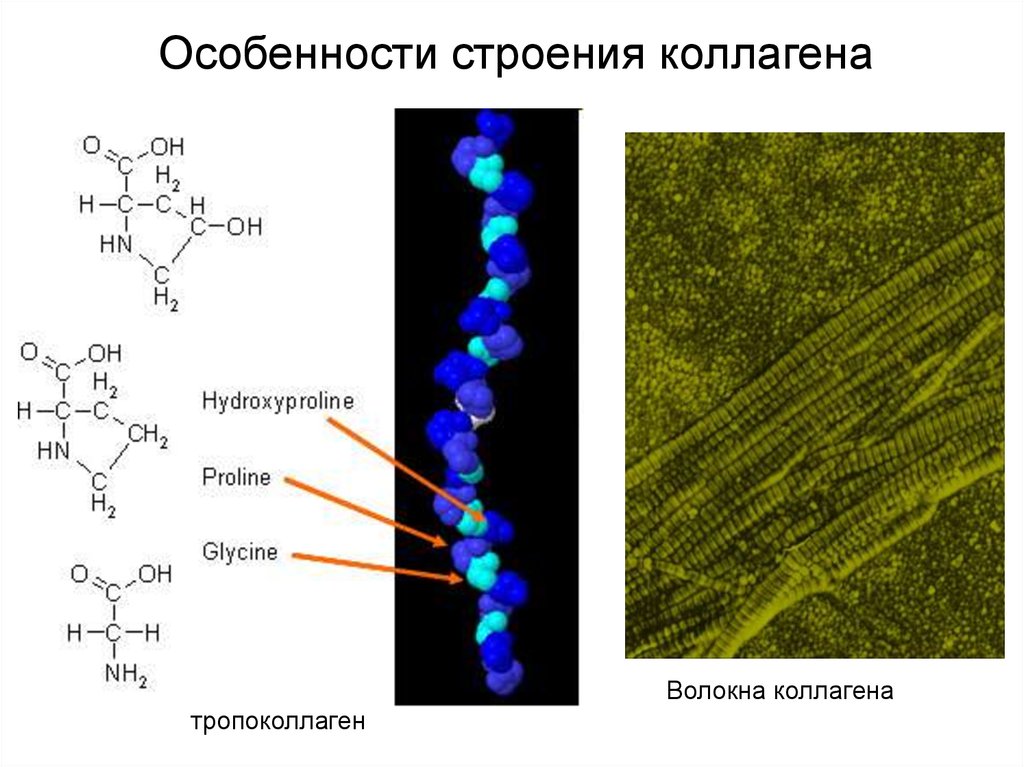
Особенности строения коллагенаВолокна коллагена
тропоколлаген
18.
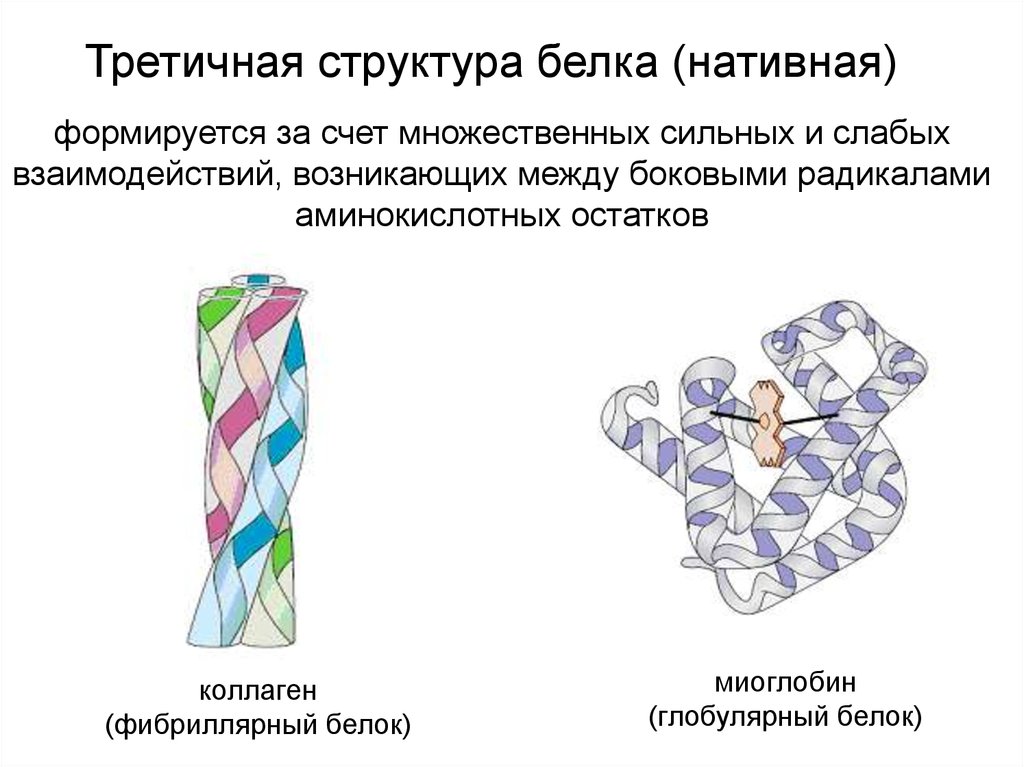
Третичная структура белка (нативная)формируется за счет множественных сильных и слабых
взаимодействий, возникающих между боковыми радикалами
аминокислотных остатков
коллаген
(фибриллярный белок)
миоглобин
(глобулярный белок)
19.
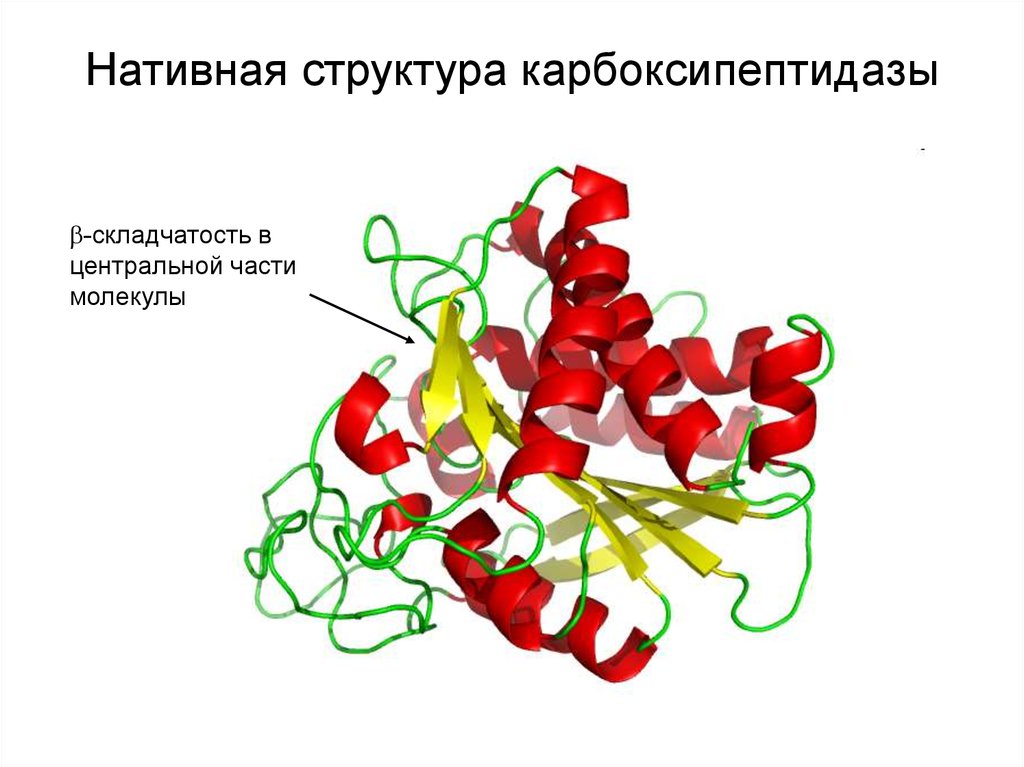
Нативная структура карбоксипептидазы-складчатость в
центральной части
молекулы
20.
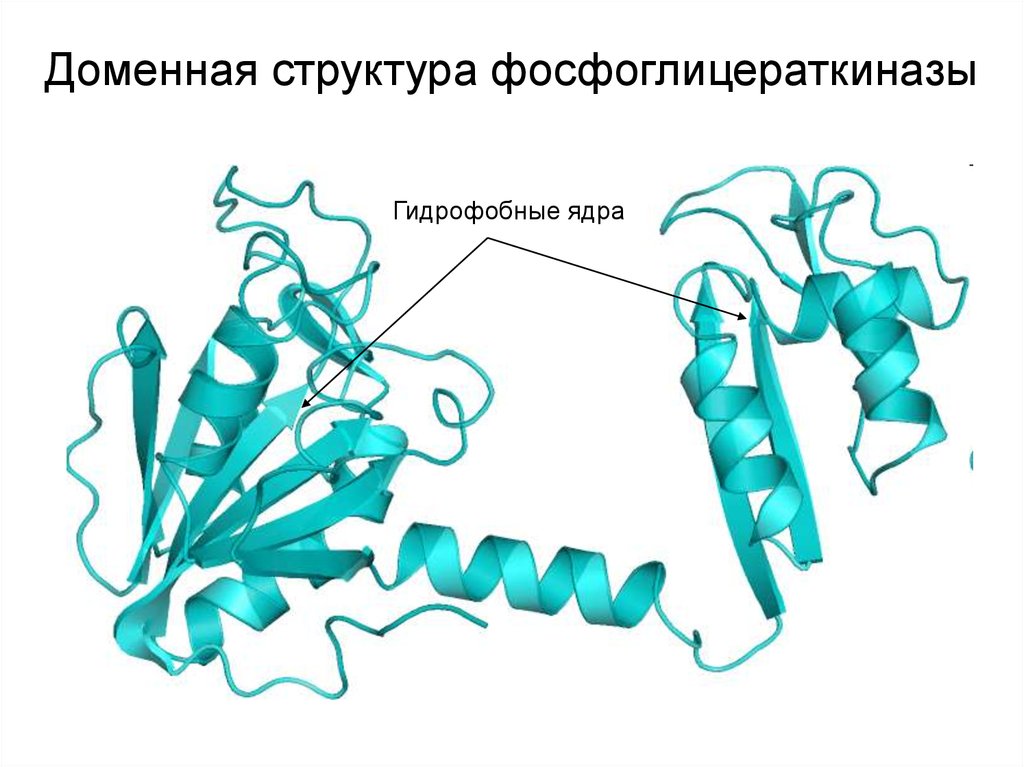
Доменная структура фосфоглицераткиназыГидрофобные ядра
21.
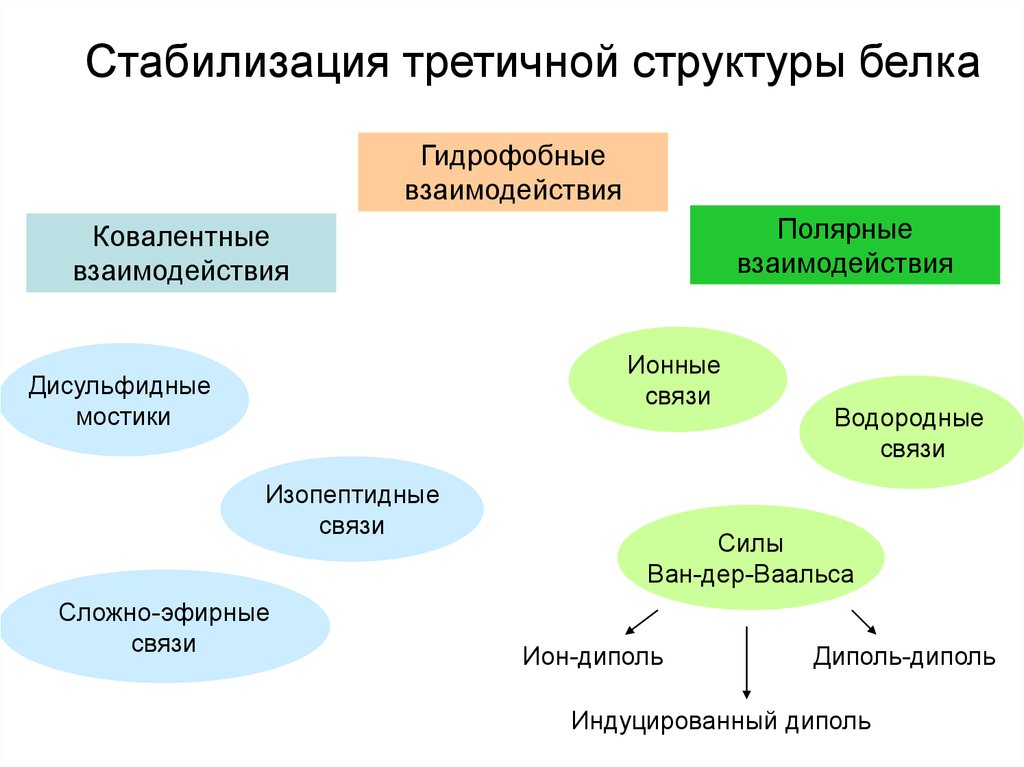
Стабилизация третичной структуры белкаГидрофобные
взаимодействия
Полярные
взаимодействия
Ковалентные
взаимодействия
Ионные
связи
Дисульфидные
мостики
Изопептидные
связи
Сложно-эфирные
связи
Водородные
связи
Силы
Ван-дер-Ваальса
Ион-диполь
Диполь-диполь
Индуцированный диполь
22.
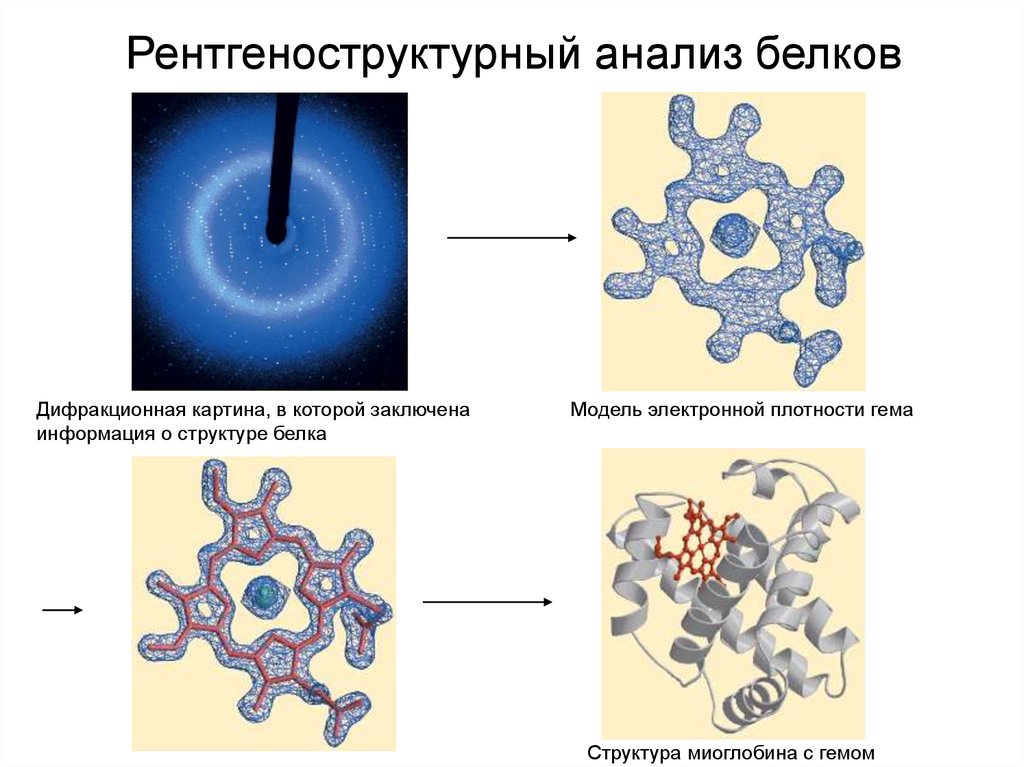
Рентгеноструктурный анализ белковДифракционная картина, в которой заключена
информация о структуре белка
Модель электронной плотности гема
Структура миоглобина с гемом
23.
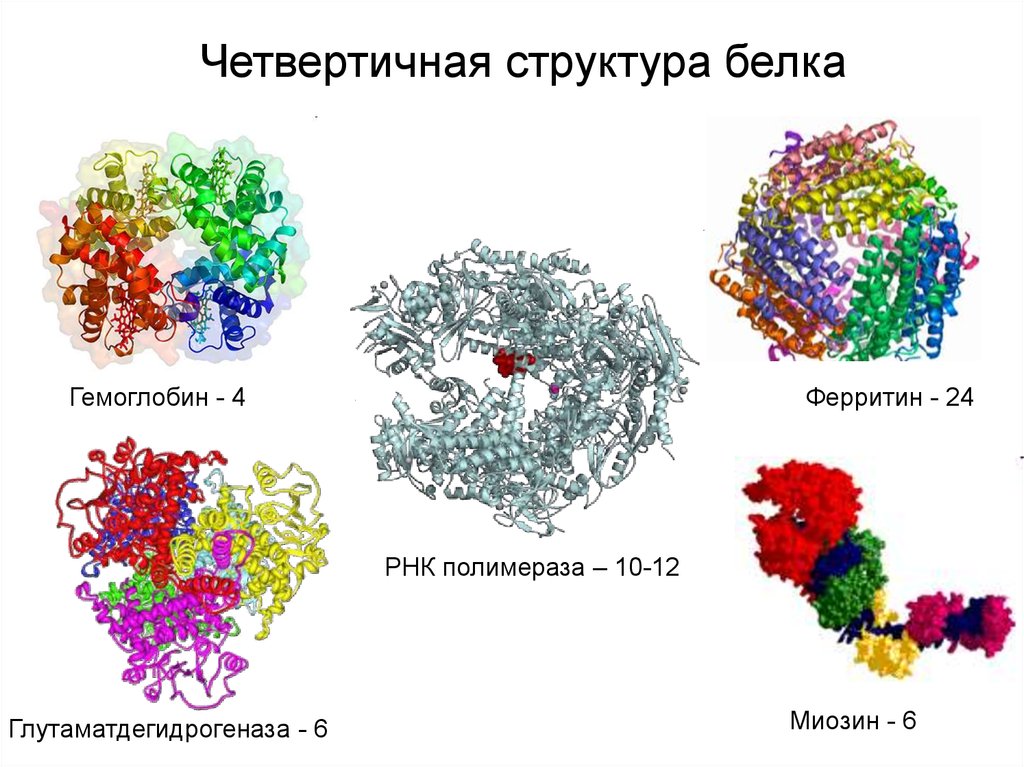
Четвертичная структура белкаГемоглобин - 4
Ферритин - 24
РНК полимераза – 10-12
Глутаматдегидрогеназа - 6
Миозин - 6
24.
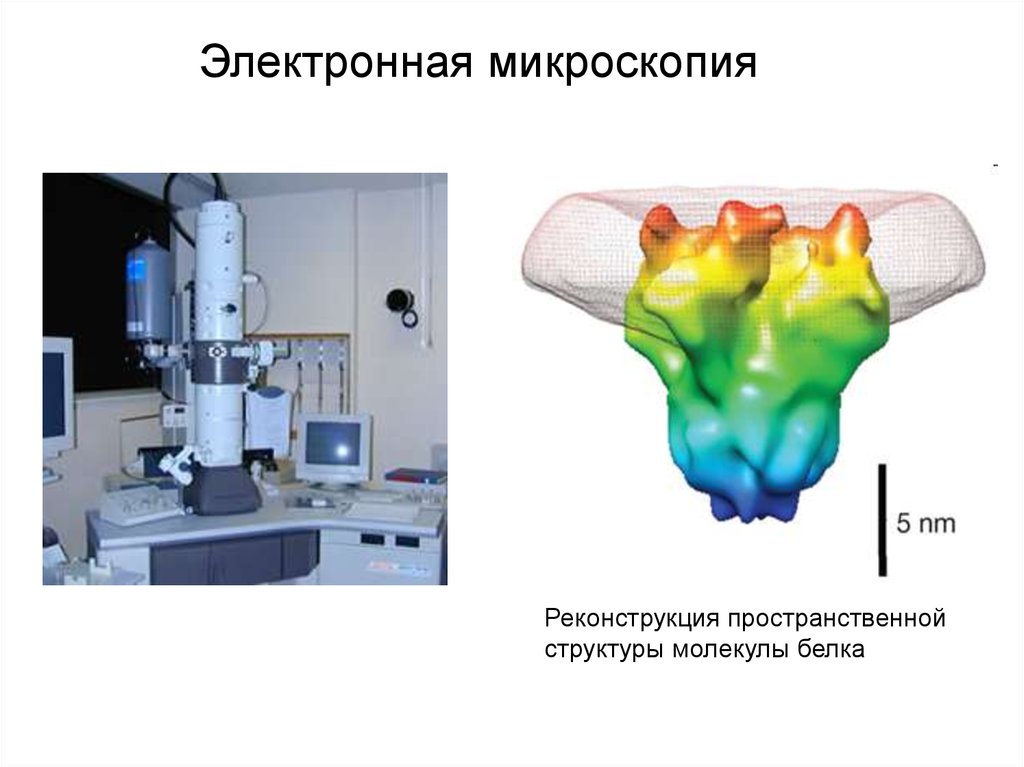
Электронная микроскопияРеконструкция пространственной
структуры молекулы белка
25.
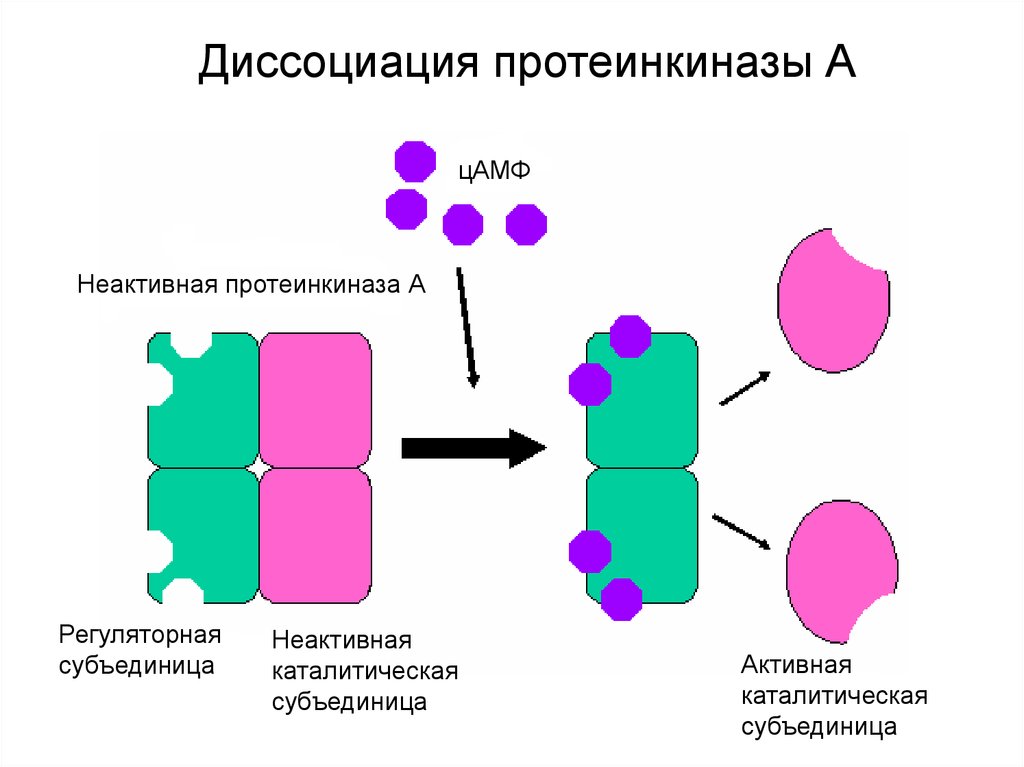
Диссоциация протеинкиназы АцАМФ
Неактивная протеинкиназа А
Регуляторная
субъединица
Неактивная
каталитическая
субъединица
Активная
каталитическая
субъединица
26.
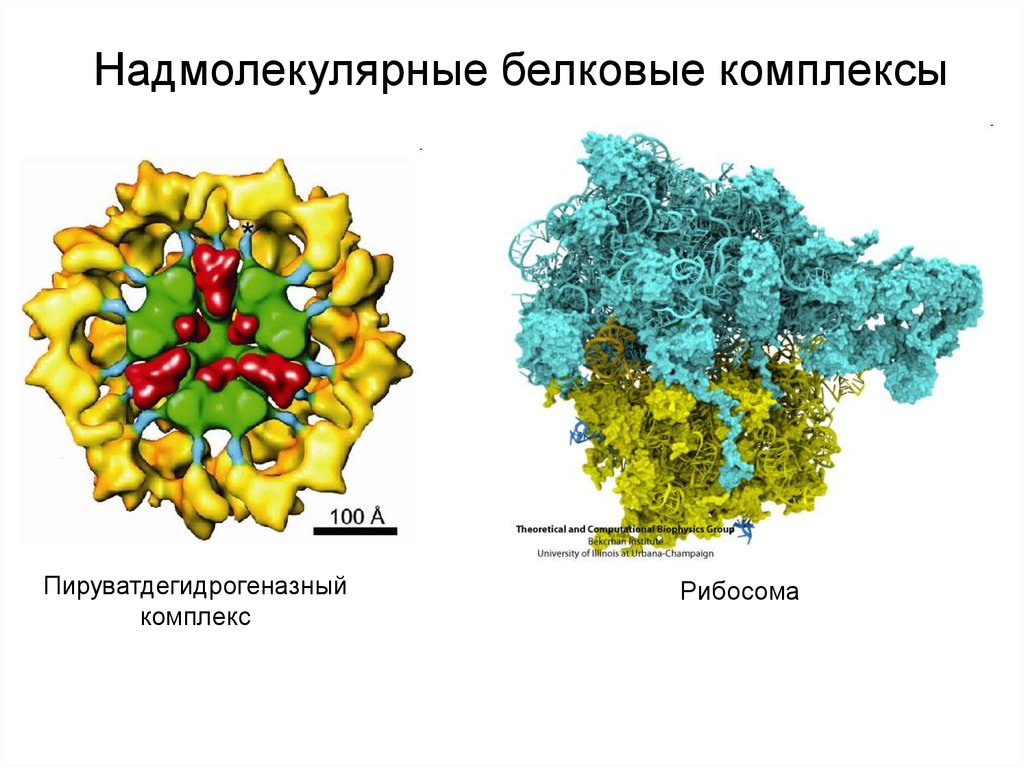
Надмолекулярные белковые комплексыПируватдегидрогеназный
комплекс
Рибосома
27.
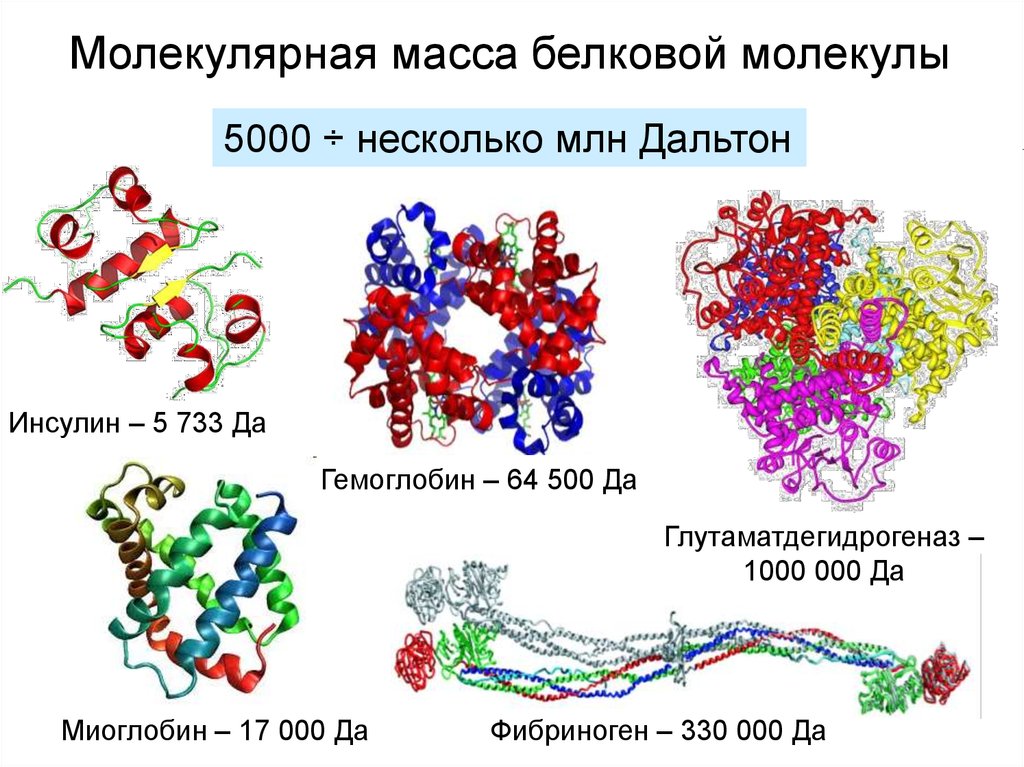
Молекулярная масса белковой молекулы5000 ÷ несколько млн Дальтон
Инсулин – 5 733 Да
Гемоглобин – 64 500 Да
Глутаматдегидрогеназ –
1000 000 Да
Миоглобин – 17 000 Да
Фибриноген – 330 000 Да
28.
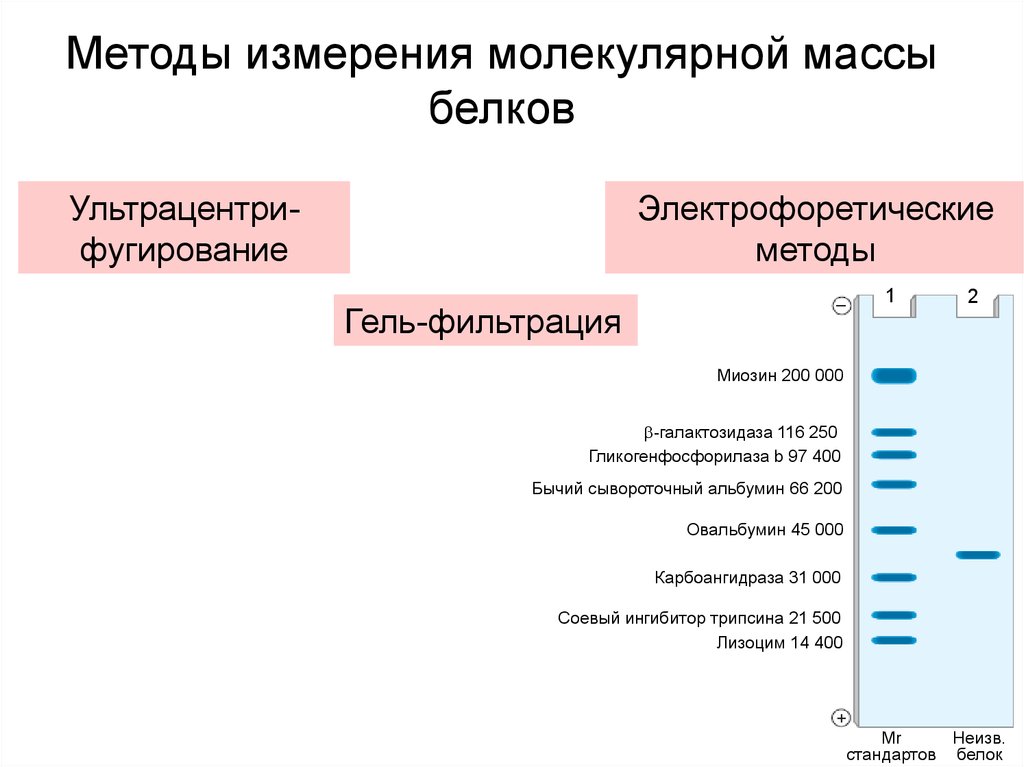
Методы измерения молекулярной массыбелков
Ультрацентрифугирование
Электрофоретические
методы
1
Гель-фильтрация
2
Миозин 200 000
-галактозидаза 116 250
Гликогенфосфорилаза b 97 400
Бычий сывороточный альбумин 66 200
Овальбумин 45 000
Карбоангидраза 31 000
Соевый ингибитор трипсина 21 500
Лизоцим 14 400
Mr
Неизв.
стандартов белок
29.
Растворимость белковI. Гидрофильные белки – растворимы в
воде и солевых растворах (гемоглобин,
миоглобин, амилаза, пепсин и др.)
II. Гидрофобные белки – растворимы в
аполярных растворителях (белки,
входящие в состав клеточных
мембран и др.)
III. Белки, не растворимые ни в воде, ни
в аполярных растворителях
(кератин, коллаген, фиброин и др.)
30.
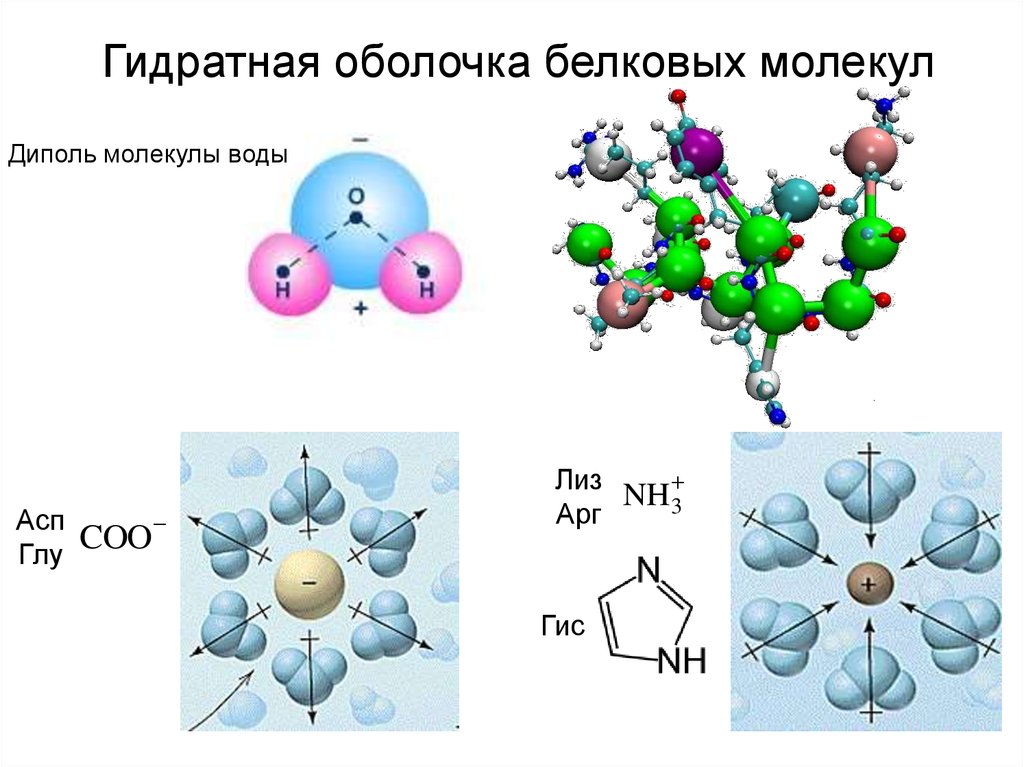
Гидратная оболочка белковых молекулДиполь молекулы воды
Асп
Глу
COO
Лиз
NH3
Арг
Гис
31.
Гидратная оболочка белковых молекул32.
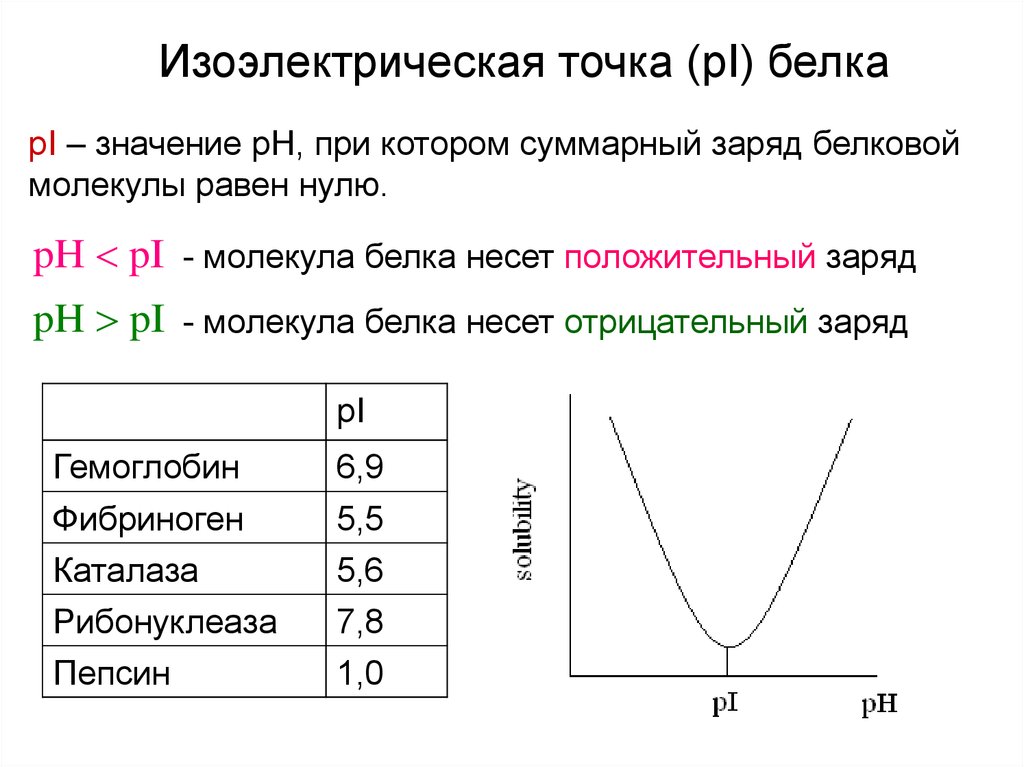
Изоэлектрическая точка (pI) белкаpI – значение pH, при котором суммарный заряд белковой
молекулы равен нулю.
pH pI - молекула белка несет положительный заряд
pH pI - молекула белка несет отрицательный заряд
pI
Гемоглобин
6,9
Фибриноген
Каталаза
Рибонуклеаза
5,5
5,6
7,8
Пепсин
1,0
33.
Свойства белковых растворов1. Растворы белков – коллоидные растворы (эффект Тиндаля)
Джон Тиндаль
(1820-1893)
Коллоидный раствор
рассеивает свет
Истинный раствор
пропускает свет
34.
Свойства белковых растворов2. Белки не проходят через полупроницаемые мембраны
Диализ
белки
Низкомолекулярные
вещества
Аппарат искусственная почка
(гемодиализный аппарат)
35.
Свойства белковых растворов3. Водные растворы белков опалесцируют
Величина показателя преломления ~ [белка] в растворе
36.
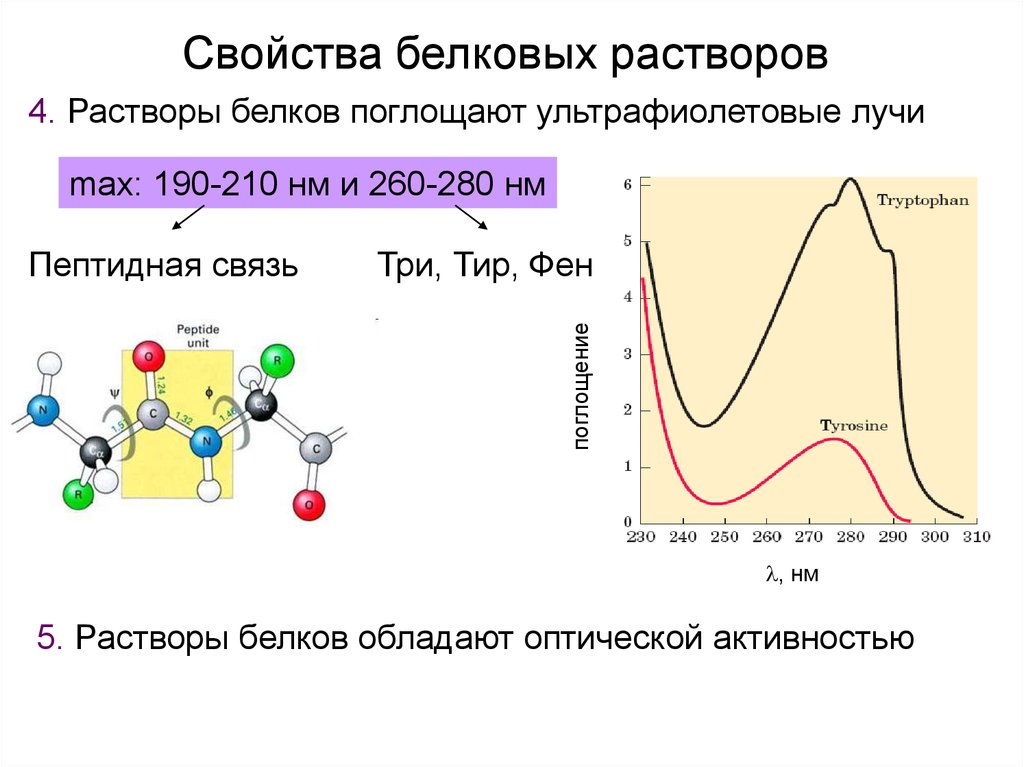
Свойства белковых растворов4. Растворы белков поглощают ультрафиолетовые лучи
max: 190-210 нм и 260-280 нм
Три, Тир, Фен
поглощение
Пептидная связь
, нм
5. Растворы белков обладают оптической активностью
37.
Осаждение белков из водных раствороввысаливание
денатурация
с сохранением
пространственной
структуры
1. Нейтральные соли сильных
кислот и оснований:
NaCl, KCl,
(NH 4 ) 2 SO 4 , Na 2SO 4
2. Малополярные
органические
растворители при низкой температуре:
этанол,
метанол,
ацетон.
с нарушением
пространственной
структуры
Высокая температура
Высокое давление
Радиация
Изменение pH среды
Органические аполярные
растворители
6. Соли тяжелые металлы
7. Встряхивание
1.
2.
3.
4.
5.
38.
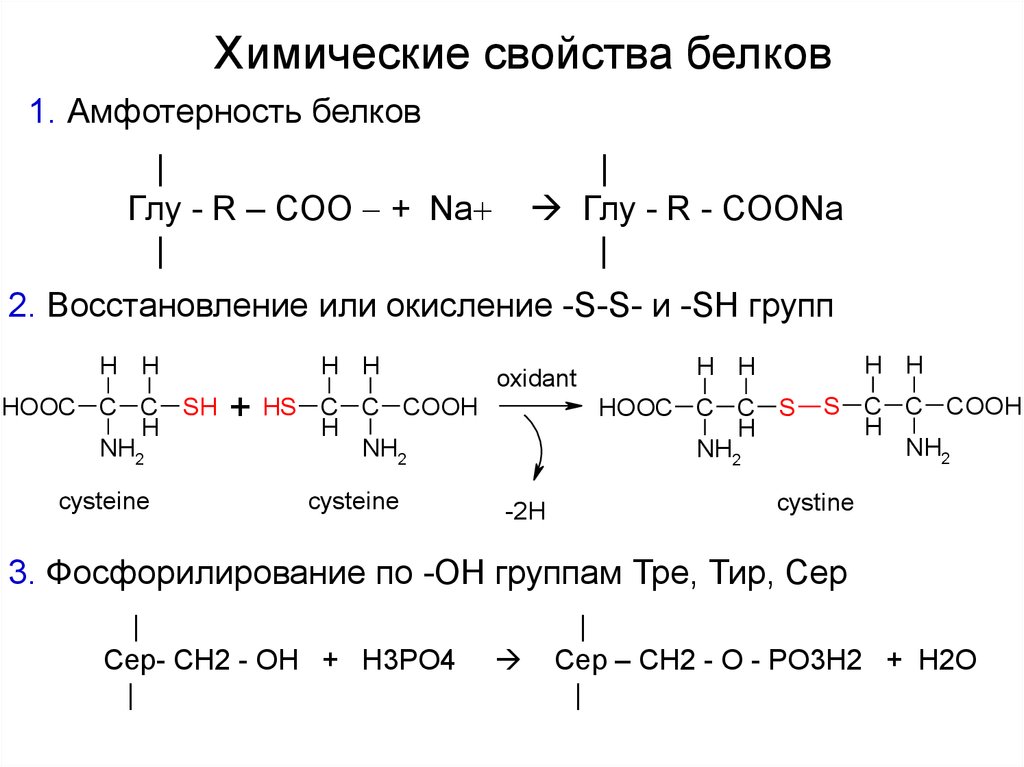
Химические свойства белков1. Амфотерность белков
|
Глу - R – COO + Na
|
|
Глу - R - CООNa
|
2. Восстановление или окисление -S-S- и -SH групп
H H
HOOC C C SH
H
NH2
cysteine
H H
+
oxidant
HS C C COOH
H
NH2
cysteine
H H
H H
HOOC C C S
H
NH2
-2H
S C C COOH
H
NH2
cystine
3. Фосфорилирование по -ОН группам Тре, Тир, Сер
|
Сер- CН2 - OH + H3PO4
|
|
Сер – СН2 - O - PO3H2 + H2O
|
39.
Химические свойства белков4. Гликозилирование
• О-гликозидные связи (-ОН группы Сер, Тре и Тир)
Сер CH2 OH C6 H12 O6
Сер CH2 O C6 H12 O6 H2 O
• N-гликозидные связи (амидные группы Асн)
Асн CH2 CONH2 C6 H12 O6
Асн CH2 CONH C6 H12 O6 H2 O
5. Метилирование
Лиз R NH3
( CH3 )
Лиз R NH CH3 H
S-аденозилметионин – источник метильных групп
40.
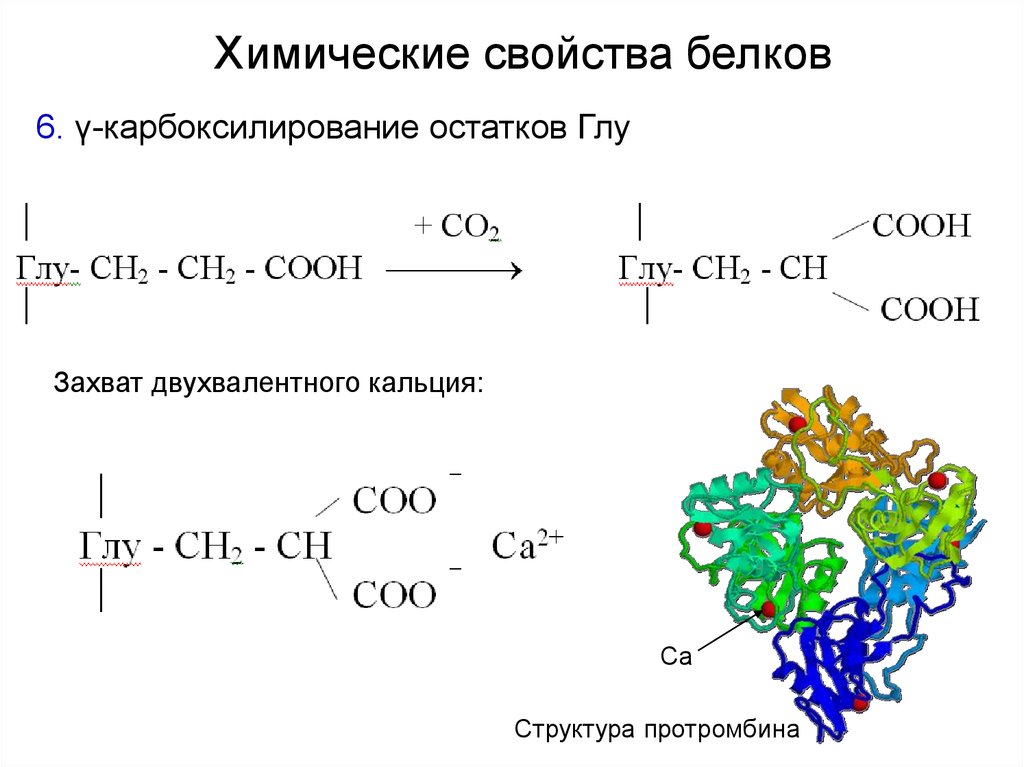
Химические свойства белков6. γ-карбоксилирование остатков Глу
Захват двухвалентного кальция:
Са
Структура протромбина
41.
Химические свойства белков7. Цветные реакции белков
• реакция Миллона на остатки Тир
• реакция Фолля на остатки Цис
• реакция Сакагучи на остатки Арг
• биуретовая р-я на наличие пептидной группировки
8. Гидролиз белков
• кислотный
• щелочной
• ферментативный
42.
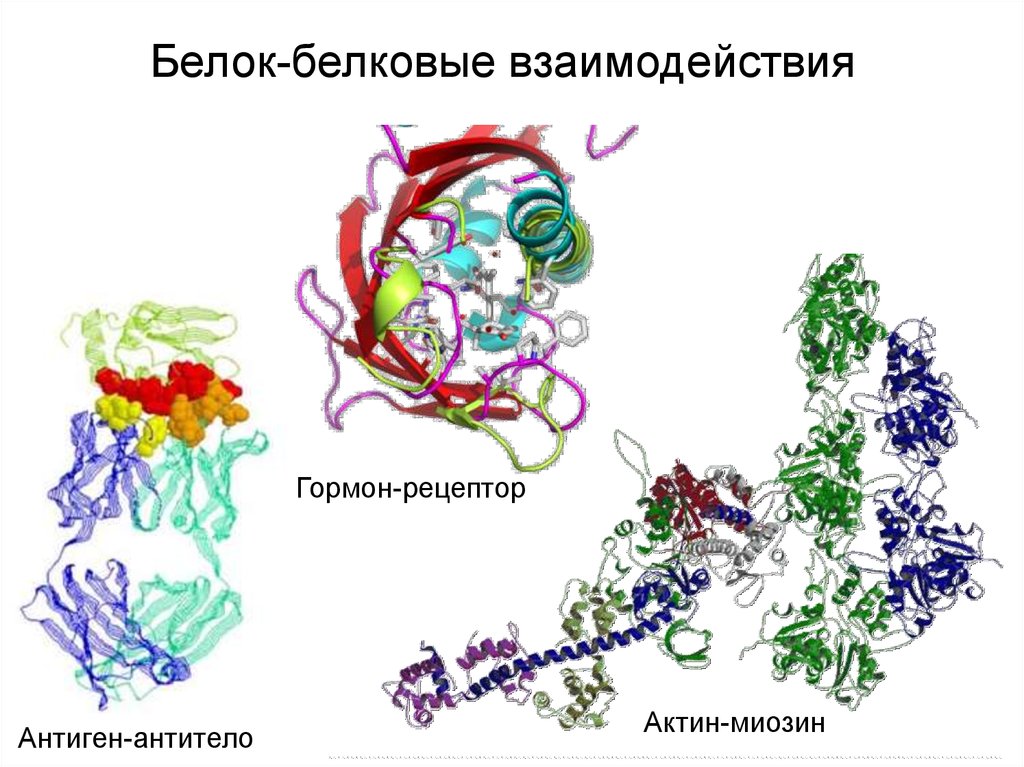
Белок-белковые взаимодействияГормон-рецептор
Антиген-антитело
Актин-миозин
43.
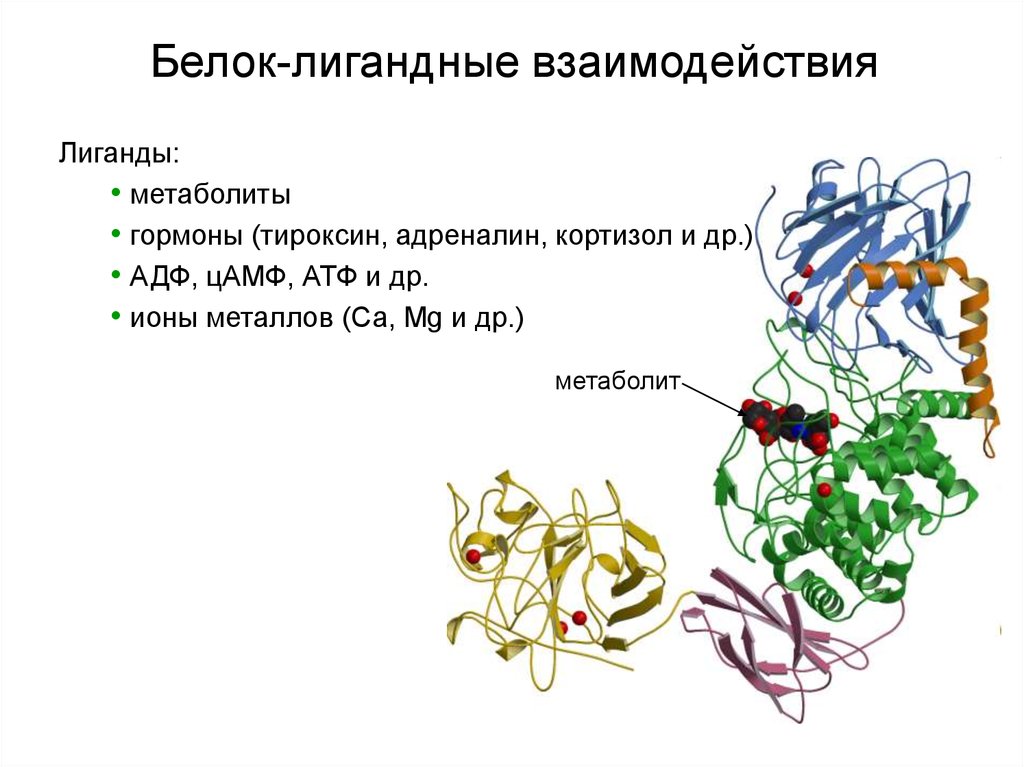
Белок-лигандные взаимодействияЛиганды:
• метаболиты
• гормоны (тироксин, адреналин, кортизол и др.)
• АДФ, цАМФ, АТФ и др.
• ионы металлов (Са, Mg и др.)
метаболит










 Биология
Биология








