Похожие презентации:
Коллекция учебных динамических слайдов по химии (8 класс)
1.
Коллекция учебныхдинамических слайдов
по химии 8 класс.
2008
aleksei.bazhenov@mail.ru
2.
13/09/17Содержание:
1. Химический элемент.
2. Тренировочный материал для изучения знаков
химических элементов.
3. Чтение химических формул.
4. Валентность.
5. Орбитально – планетарная модель строения
атома.
6. Строение электронной оболочки. (Часть 1)
7. Строение электронной оболочки. (Часть 2)
8. Ионы и ионная химическая связь.
Далее
Содержание
Назад
2
9. Ковалентная неполярная связь.
10. Ковалентная полярная связь.
3.
13/09/17Содержание:
11. Молярный объем газов.
12. Степень окисления.
13. Классификация неорганических веществ.
14. Кристаллические решетки.
15. Чистые вещества и смеси.
16. Уравнения химических реакций.
17. Составление уравнений химических реакций.
18. Прибор для определения электролитов.
19. Реакции ионного обмена.
Далее
Содержание
Назад
3
20. Условия протекания реакций ионного обмена.
Примечание.
4.
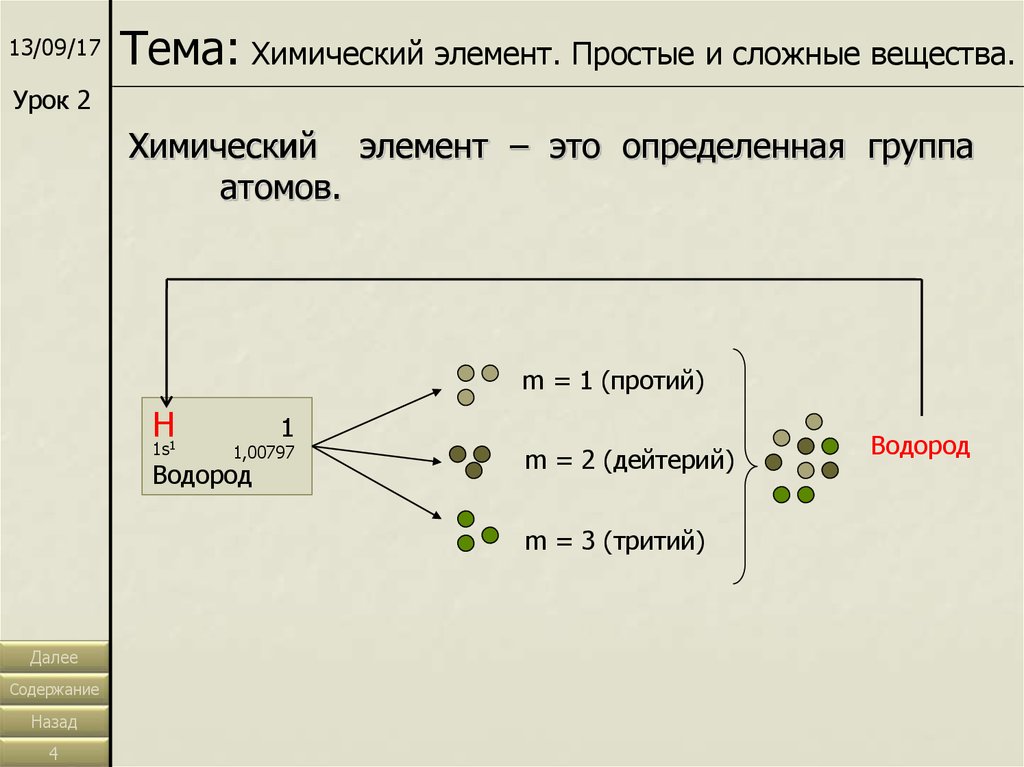
13/09/17Тема: Химический элемент. Простые и сложные вещества.
Урок 2
Химический элемент – это определенная группа
атомов.
m = 1 (протий)
Н
1s1
1
1,00797
Водород
m = 2 (дейтерий)
m = 3 (тритий)
Далее
Содержание
Назад
4
Водород
5.
13/09/17Урок 5-6
Тема:
Строение периодической
химических элементов.
системы.
Знаки
Сейчас
Тренировочный
на экране
материал
будутк
появляться
изучению знаков химических
знаки
химических
элементов.элементов. Четко
и правильно проговаривай
название
и
произношение
химического элемента.
Желаю тебе удачи!
Далее
Содержание
Назад
5
6.
13/09/17Урок 7
Тема: Химические формулы.
Чтение химических формул.
Примеры:
1. NH3 – молекула эн аш три состоит из одного атома азота и трех
атомов водорода.
2. Al(OH)3 – молекула алюминий о аш трижды состоит из одного
атома алюминия, трех атомов кислорода и трех атомов
водорода.
3. K3BO3 – молекула калий три бор о три состоит из трех атомов
калия, одного атома бора и трех атомов кислорода.
Далее
Содержание
Назад
6
C
(NH
P
Fe
BaCO
Na
H
O
O
SO
)
PO
KHCO
PbSiO
AlCl
CH
ZnMnO
Ca(OH)
AgNO
COOH
8
2 22
54 333442 4
318
3
7.
13/09/17Урок 11
Тема: Валентность.
Составление химических формул по валентности.
Правило нахождения валентности:
- У металла валентность ставится по номеру группы.
- У неметалла, стоящего на первом месте в формуле, ставится
высшая валентность.
- У неметалла, стоящего на втором месте в формуле, ставится
низшая валентность.
Пример:
Порядок действий:
10
2
6
1.
Находим
валентность
химических элементов.
V
I
VI
Далее
Содержание
Назад
7
II
Na
P O
O
S
2. Находим наименьшее общее
кратное.
3. Находим индексы.
:
:
==22
1
=5
1
3
8.
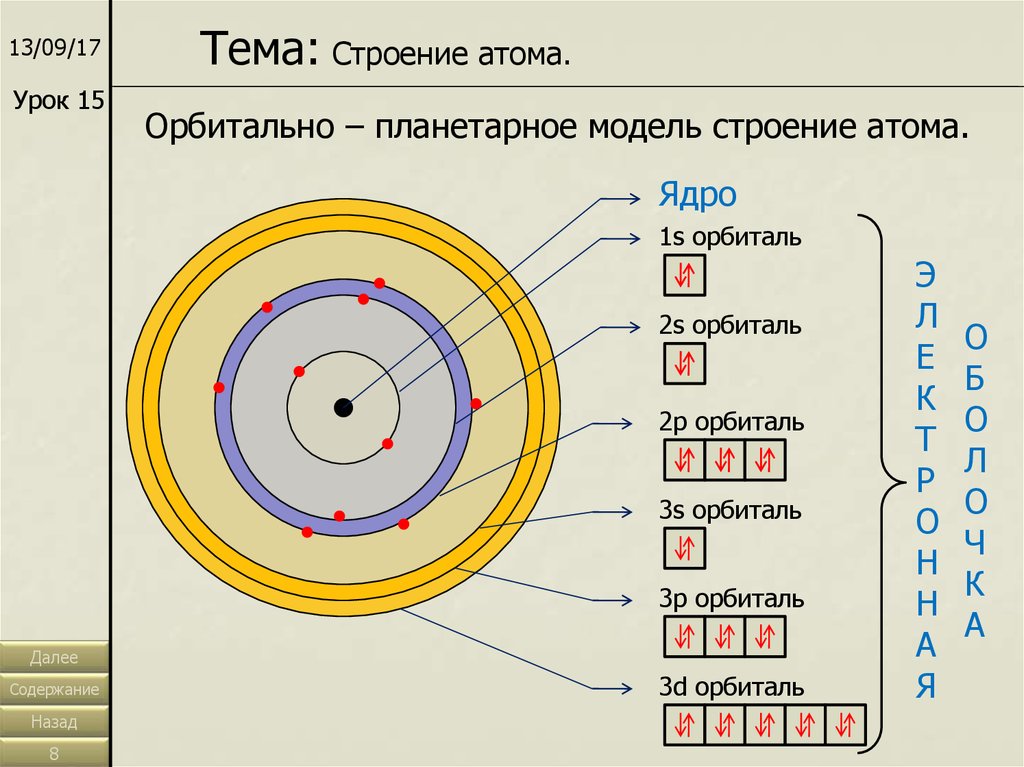
13/09/17Урок 15
Тема: Строение атома.
Орбитально – планетарное модель строение атома.
Ядро
1s орбиталь
2s орбиталь
2p орбиталь
3s орбиталь
3p орбиталь
Далее
Содержание
Назад
8
3d орбиталь
Э
Л
Е
К
Т
Р
О
Н
Н
А
Я
О
Б
О
Л
О
Ч
К
А
9.
13/09/17Тема: Строение электронных оболочек атомов.
Урок 17
Электронная оболочка – это совокупность
электронов, двигающихся вокруг ядра атома.
Электроны
в(N)совпадает
электронной
Номер
n
Число
Номер
– главное
электронов
группы
периода
квантовое
совпадает
число
на
суровне
числом
– определяет
рассчитывается
электронов
с оболочке
числом
число
на
располагаются
на
энергетических
энергетических
энергетических
по
последнем
формуле.
энергетическом
уровней
уровней
элемента.
. уровне.уровнях.
N = 2n2
Период
3
Группа
n = 1, N = 2 . 12 = 2
V
5
n = 2, N = 2 . 22 = 8
15
Общее число электронов
е=
Р
30,9748
Проверка
Фосфор
Далее
Содержание
Назад
9
15
10.
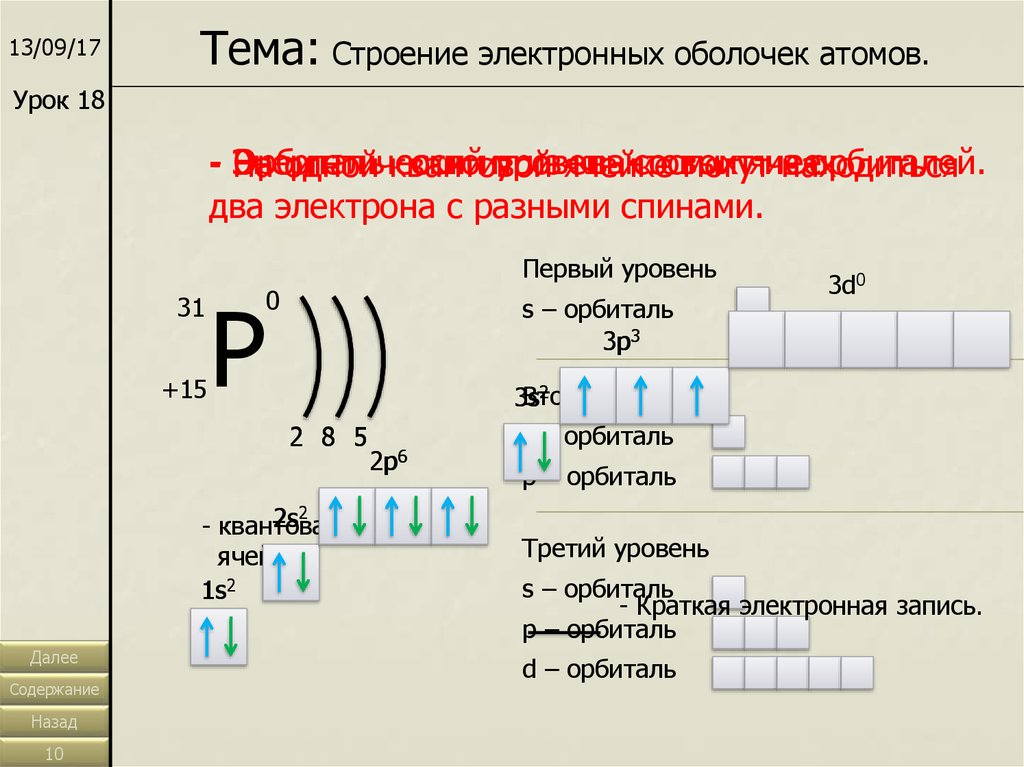
13/09/17Тема: Строение электронных оболочек атомов.
Урок 18
- Энергетический
Орбиталь
состоит
уровень
из ячейке
квантовых
состоит
ячеек.
из
орбиталей.
На
одной квантовой
могут
находиться
два электрона с разными спинами.
Первый уровень
31
+15
Р
0
s – орбиталь
3p3
2
Второй
уровень
3s
2 8 5
2s2
- квантовая
ячейка
1s2
Далее
Содержание
Назад
10
3d0
2p6
s – орбиталь
p – орбиталь
Третий уровень
s – орбиталь
- Краткая электронная запись.
p – орбиталь
d – орбиталь
11.
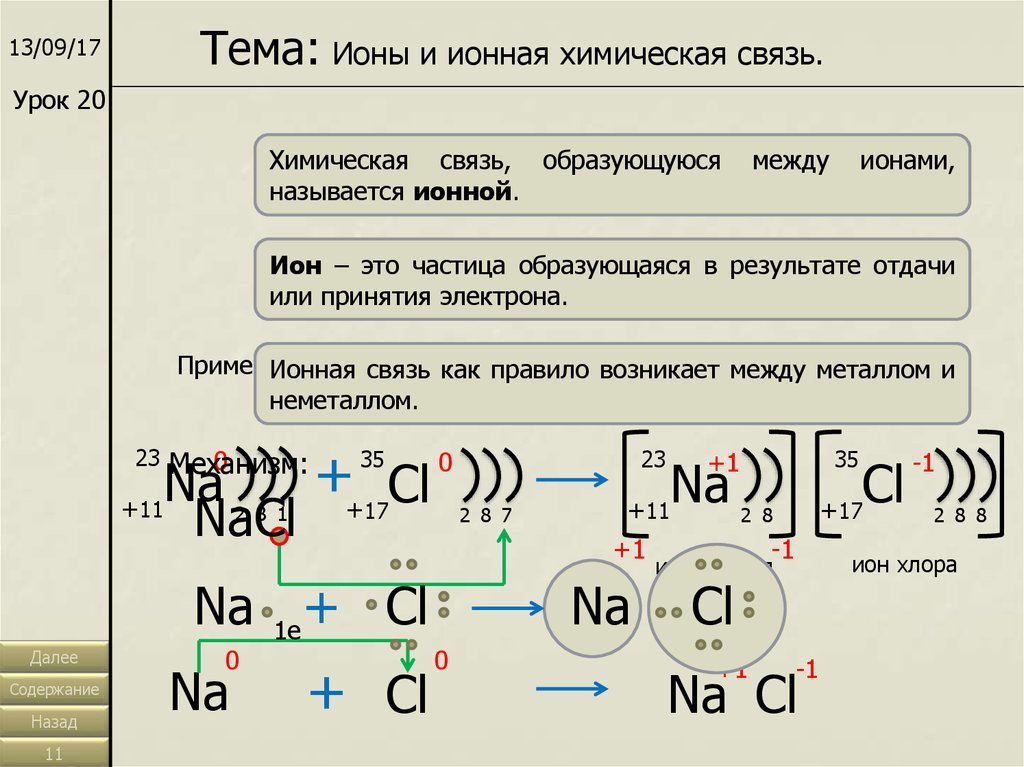
Тема: Ионы и ионная химическая связь.13/09/17
Урок 20
Химическая связь, образующуюся
называется ионной.
между
ионами,
Ион – это частица образующаяся в результате отдачи
или принятия электрона.
Пример:Ионная связь как правило возникает между металлом и
неметаллом.
NaCl – хлорид натрия (поваренная, пищевая соль)
+
Na
Cl
+11
+17
NaCl
23
0
Механизм:
35
2 8 1
Na 1e + Cl
Далее
Содержание
Назад
11
0
Na
+ Cl
23
0
2 8 7
Na
0
Na
+11
+1
35
+1
-1
2 8 8
ион хлора
ион натрия
Cl
+1
Cl
+17
2 8
-1
-1
Na Cl
12.
13/09/17Урок 21
Тема: Ковалентная связь между одинаковыми атомами
неметаллов.
Химическая
связь,
образования общих
ковалентной.
возникающая
в
электронных пар,
результате
называется
Связь возникающая между одинаковыми неметаллами
называется ковалентной неполярной.
Пример:
Н22
F
O
N
Далее
Содержание
Назад
12
Н + N
F
O
N
Н
F
O
00
00
НN
F
O F
НN
O
13.
13/09/17Тема: Ковалентная полярная химическая связь.
Урок 22
Химическая
связь,
образования общих
ковалентной.
возникающая
в
электронных пар,
результате
называется
Ряд неметаллов.
Связь возникающая между разными
называется ковалентной полярной.
неметаллами
F, O, N, Cl, Br, S, C, P, Si, H.
Пример:
Электроотрицательность
(ЭО) – это способность
ЭО уменьшается
атомов химического элемента притягивать
к себе
электроны.
NНН3О
NН
2
НCl
Элемент с большей
ЭО, при образовании
ковалентной
-δ δ
++δ
δ
полярной связи, приобретает частично отрицательный
+δ
+
δ
-δ
заряд (- δ).
Далее
Содержание
Назад
13
Н NО Н
++
Н
Элемент
с меньшей ЭО, при образовании ковалентной
+δ
+
Н
Cl
полярной связи, приобретает частично положительный
заряд (+ δ).
НН
+δ
14.
13/09/17Урок 31
Тема: Молярный объем газов.
Молярный объем V
(Vm) (л/моль).
N
m
M = Mr
Vm – буквенное обозначение молярного объема
Vm n измерения
n NA
M n
II. Задача.
л/моль – единицы
Молярный
это лобъем
занимаемый
Определитеобъем
массу –89,6
аммиака
(NH3) 1 молем любого газа
при нормальных условиях (22,4 л/моль).
Дано:
Решение:
V
V –) объем
(л)
V(NH
=
89,6л
3
1. n(NH3) - ?
n =
n – количество вещества (моль)
Vm
89,6 л о
Нормальные
условия
(н.у.)
m(NH3) = ?
n(NH3) = – Т = 0 С ; = 4 моль
22,4
Р =л/моль
760 мм рт. ст. (101,3 кПа)
M = Mr
2. M(NH3) - ?
Mr(NH=3) = Ar(N) + 3=. Ar(H) = 14 +=3 . 1 x= 17
M(NH3) = 17 г/моль
V
Далее
Содержание
Назад
14
3. m(NH3) = ?
Vm
n
m=M.n
Ответ: m(NH3) = 61 г
m(NH3) = 17 г/моль . 4 моль = 61 г
15.
13/09/17Тема: Степень окисления.
Урок 34
Степень окисления – это заряд приобретаемый элементом в
соединении, в результате полной отдачи или принятия
электрона.
Правила:
1. Степень окисления элемента в простом веществе равна 0.
H20 ; O20 ; F20 ; Cl20 ; Ca0.
2. Степень
H+1; О-2;окисления
Na+1 ; K+1 ;некоторых
Ca+2 ; Mg+2
элементов
; Ba+2 ; Alв+3соединении:
.
- H+1
- О-2
Пример:
2 . (+1)
+ Х + 3с. его
(-2)валентностью:
=0
- степень окисления металла
совпадает
+2
+3
Na+1 ; K+1 ; Ca+2 ; Mg+2 ;2Ba
+ Х; -Al6 =. 0
H2СO3
Далее
Содержание
Назад
15
Х =элементов
+4
+4
3. Сумма степеней окисления
в соединении, с учетом
коэффициентов, равна 0.
1. Составляем
2.
3.
Степень
Расставляем
окисления
и решаем
степени
элемента,
уравнение.
окисления
у Правило
которого
элементов,
3.покакоторые
ее не
можем определить ,пообозначим
правилу за
2. X
Х
H ; О
+1
-2
16.
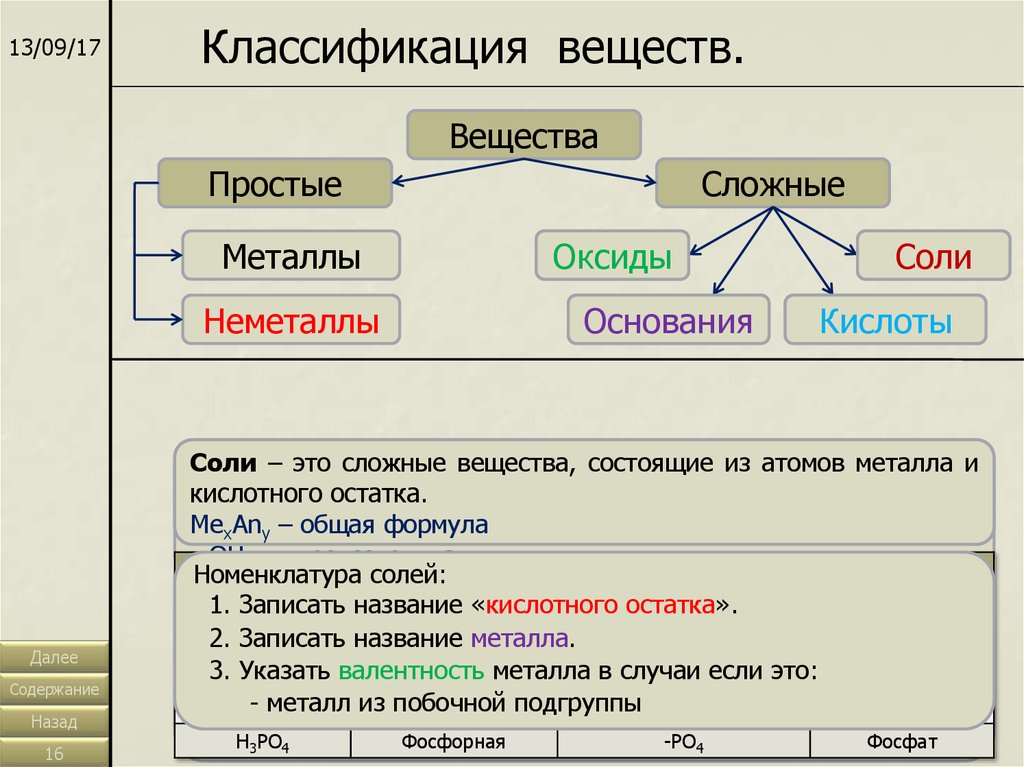
13/09/17Классификация веществ.
Вещества
Простые
Металлы
Неметаллы
Далее
Содержание
Назад
16
Сложные
Оксиды
Основания
Соли
Кислоты
Кислоты
Соли
– это–сложные
вещества,
вещества,
состоящие
состоящие
из атомов из
металла
и
Основания
–это
этосложные
сложные
вещества,
состоящие
из
атомов
Оксиды – это сложные вещества, состоящие из двух элементов,
водорода
кислотного
остатка.
кислотного остатка.
металла иигидроксогрупп.
один из которых кислород. ЭхОу – общая формула.
H
Me
–x –общая
формула
формула
Me(ОH)
общая
формула
xAn
xAn–y общая
- OH
- гидроксогруппа
Формула
Название
Кислотный остаток
Название
Номенклатура
оксидов:
Номенклатура
солей:
HCl
Соляная
-Cl
Хлорид
1.
Записать
название
«кислотного
остатка».
Номенклатура
1. Записать
оснований:
слово
«оксид».
HNO
Азотная
Нитрат
2. 1.
Записать
2.
Записать
название
слово
название
«гидроксид».
металла.
элемента. -NO3
3 Записать
3. 2.
Указать
Записать
3.4 Указать
валентность
название
валентность
металла.
элемента
в случаи
в случаи
если это:
H
Серная металла
-SO
Сульфат
2SO
4 если это:
3.
Указать
металл
- неметалл
из
валентность
побочной
металла в случаи
H2-CO
Угольная подгруппы
-CO3 если это: Карбонат
3
- металл
изФосфорная
из
побочной
побочной
подгруппы
подгруппы
H3PO-4 металл
-PO4
Фосфат
17.
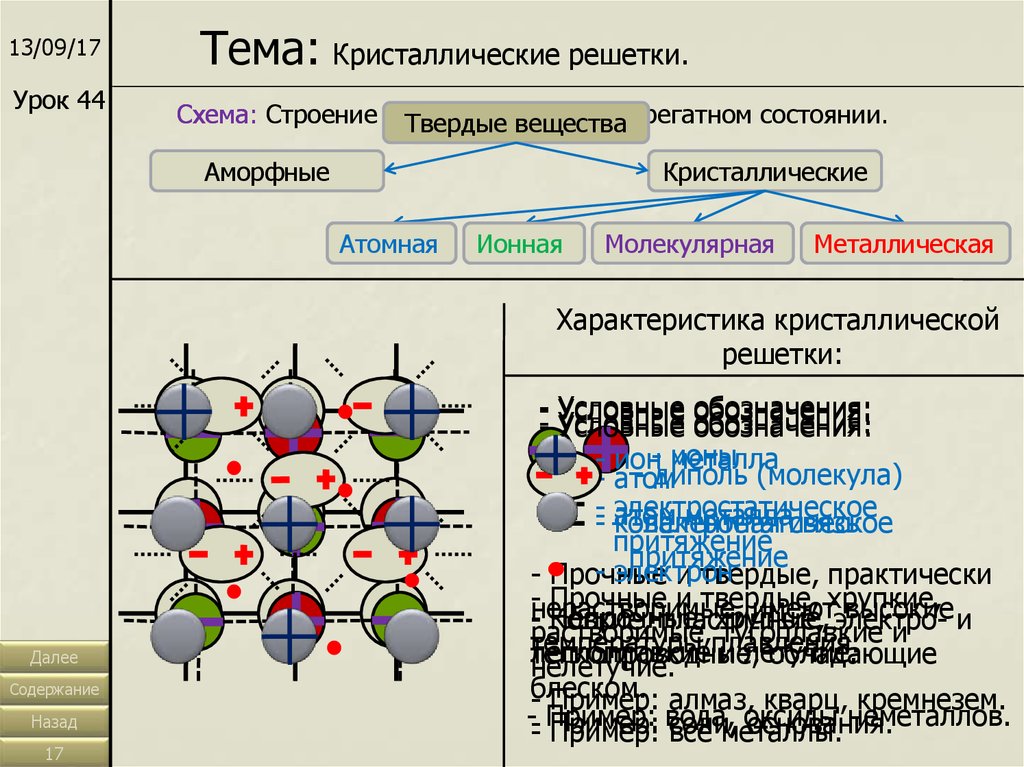
13/09/17Урок 44
Тема: Кристаллические решетки.
Схема: Строение веществ
в твердом
Твердые
веществаагрегатном состоянии.
Аморфные
Кристаллические
Атомная
Ионная
Молекулярная
Металлическая
Характеристика кристаллической
решетки:
Далее
Содержание
Назад
17
- Условные
обозначения:
- Условные обозначения:
- ион- ионы
металла
- диполь (молекула)
- атом
-- электростатическое
металласвязь
- -атом
ковалентная
электростатическое
притяжение
притяжение
- электрон
- Прочные
и твердые, практически
-нерастворимые,
Прочные и твердые,
хрупкие,
имеют
высокие и
Непрочные,
хрупкие, электро-растворимые,
Ковкие,
пластичные,
тугоплавкие и
температуры
плавления.
легкоплавкие и летучие.
теплопроводные,
обладающие
нелетучие.
блеском.
- Пример: алмаз, кварц, кремнезем.
-- Пример:
вода, оксиды
неметаллов.
основания.
- Пример:
Пример: соли,
все металлы.
18.
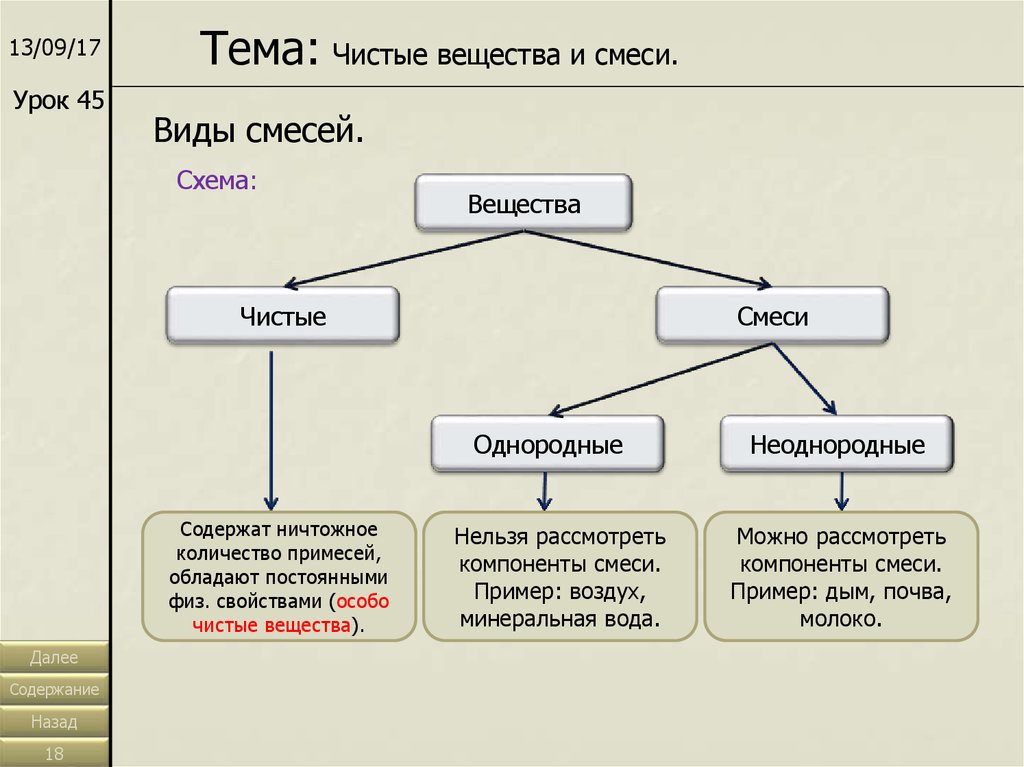
13/09/17Урок 45
Тема: Чистые вещества и смеси.
Виды смесей.
Схема:
Вещества
Чистые
Смеси
Однородные
Содержат ничтожное
количество примесей,
обладают постоянными
физ. свойствами (особо
чистые вещества).
Далее
Содержание
Назад
18
Нельзя рассмотреть
компоненты смеси.
Пример: воздух,
минеральная вода.
Неоднородные
Можно рассмотреть
компоненты смеси.
Пример: дым, почва,
молоко.
19.
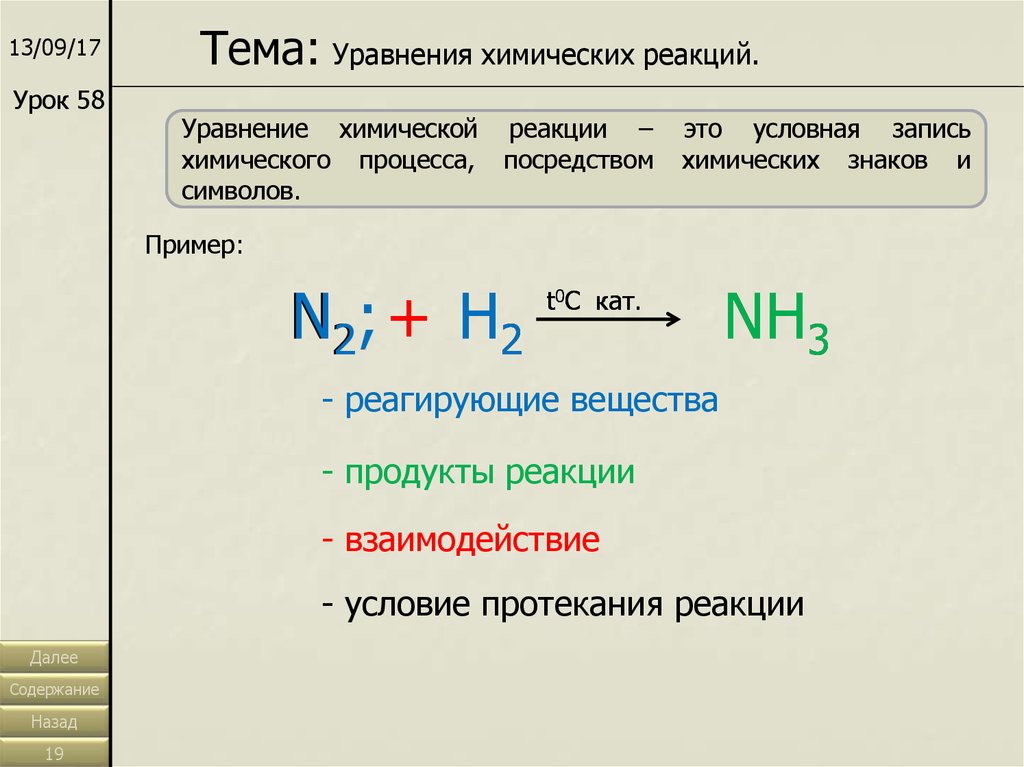
13/09/17Урок 58
Тема: Уравнения химических реакций.
Уравнение химической реакции –
химического процесса, посредством
символов.
это условная запись
химических знаков и
Пример:
N2 ; + H 2
t0C кат.
NH3
- реагирующие вещества
- продукты реакции
- взаимодействие
- условие протекания реакции
Далее
Содержание
Назад
19
20.
13/09/17СОСТАВЛЕНИЕ УРАВНЕНИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Пример: Составить уравнение реакции взаимодействия
фосфора и кислорода.
9. Определи:
1.
В левой есть
частили уравнения
еще не уравненные
запиши (не
формулы
соединенные)
веществ,
3. Определи: атомов, какого элемента в левой части
которые
2.
4.
5.
7.
атомы:
Соедини
Определи
Раздели
В правой
вступают
фигурной
Н.О.К.
Н.О.К.
частина
чисел
стрелкой
уравнения
число
в атомов
реакцию.
атомов
атомы
запиши
в этого
левой
каждого
(Формулы
формулы
элемента
и правой
соединенного
веществ
впростых
частях
левой
уравнения
6.
8.
Запиши полученный
Н.О.К.
больше.
в квадратике
(Вначале
коэффициент
под
уравнивают
стрелкой.
перед формулой.
число атомов,
газообразных
образующихся
и
уравнения.
элемента.
правой
а) Если
частях.
есть,
веществ
в результате
то вернись
состоят
реакции.
к пункту
из двух
3. атомов: Н2, О2, N2, Cl2
которых в левой части уравнения больше.)
и.т.д.)
б) Если нет, то ВСЁ.
4 :1= 4
4P
Далее
Содержание
Назад
20
4
4 : 4= 1
+ 5 O2 = 2 P2O5
Материал взят из презентации
Лебедева Сергея Николаевича
ГОУ школа-интернат V-VI вида. Костромской области.
10 : 2 = 5
10
10 : 5 = 2
21.
13/09/17Урок 72
Тема: Электролитическая диссоциация.
Электролиты – это вещества, водные растворы
которых проводят электрический ток
Проверка электропроводности раствора:
Электропроводность
раствора хлорида
натрия (NaCl)
Начать
Закончить
NaCl - электролит
Электропроводность
раствора сахара
Начать
Далее
Содержание
Назад
21
Закончить
сахар - неэлектролит
22.
13/09/17Тема:
Реакции ионного обмена.
РИО (реакции ионного обмена) – это реакции
протекающие между электролитами.
Пример: Взаимодействие хлорида бария с сульфатом натрия.
Порядок действий:
6. По
1.
2.
3.
4.
5.
Записать
Расставить
Составить
Сократить
таблице
уравнение
полное
сокращенное
одинаковые
коэффициенты.
растворимости,
ионное
реакции
ионы
ионное
уравнение
определить
вв молекулярном
левой
уравнение.
(растворимые
и правой
нерастворимые
виде.
частивещества
полного
вещества.
расписать
ионного
уравнения.
на
Обозначить
ионы.
их стрелкой вниз.
2+ - + 2Na
+ BaCl
Na+2SO442- BaSO4 + 2Na
Ba
2Cl
2 NaCl
2Cl
2
Ba2+ +
+ SO42- BaSO4
+
+
Далее
Содержание
Назад
22
+
+
23.
13/09/17Тема:
Условия протекания реакций ионного обмена.
I. Если
II.
Еслиобразуется
образуетсяосадок.
газ.
+CO 2- + 2H
+SO 2- 2Na
+SO 2- + H CO
NaBa
H
Na
2Na
2+
+
2+ 32
3
2
2
22Cl
3
4
44 + 2Na
BaCl
Na2SO4 BaSO
2Cl2 + 2Na
2 NaCl
4
2+
Ba2+ ++ CO3++ 2H +
BaSO+4
+ SO42-
+
+
H2 O
CO2
O + CO2
+ + H2+
+
III. Если образуется вода.
2+
+CO 2- MgCO + 22Na
+
Mg(NO
)
+
Na
NaNO
Mg
2NO
2Na
2NO
+
+
2+
23
2
2
3
3
3
2NaOH
H SO 2Na
Na SO + 2H O
2Na
2OH + 2H
2
4
2
4
2
2Mg2++
CO
MgCO3 + 2H O
+
+
+
3
+
+ 2OH + 2H +
+
+
2
Далее
OH-
+
++ H
H2O
+
Содержание
Назад
23
24.
13/09/17Коллекция учебных динамических слайдов по
химии 8 класс.
Если, разработанные мною слайды, пригодятся Вам в работе, я
буду очень рад. По ходу просмотра могли возникнуть вопросы или
замечания, которые стоит исправить, не поленитесь дайте знать.
Возможно у вас есть собственные, подобные разработки. Я могу
их обработать и разместить рядом с указанием вашего авторства.
Может быть в будущем получится отличная разработка, которая
поможет многим при подготовки к урокам. Надеюсь, что
заинтересовал Вас, пишите aleksei.bazhenov@mail.ru
С Уважением Баженов А.А.
Верьте в себя и у Вас все получится
Далее
Содержание
Назад
24
















 Химия
Химия








