Похожие презентации:
Химическая связь
1.
ХИМИЧЕСКАЯСВЯЗЬ
2.
ХИМИЧЕСКАЯ СВЯЗЬХимическая
связь
—
это
взаимодействие
атомов,
обусловленное
перекрыванием
их
электронных
облаков
и
сопровождающееся
уменьшением
полной энергии системы.
«Под химической связью следует понимать силу,
удерживающую атомы друг около друга в
молекулах, ионах или кристаллах»
3.
ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯСВЯЗЬ?
Ответ вытекает из следующего термодинамического принципа:
«минимуму энергии системы
соответствует максимум
устойчивости»
4.
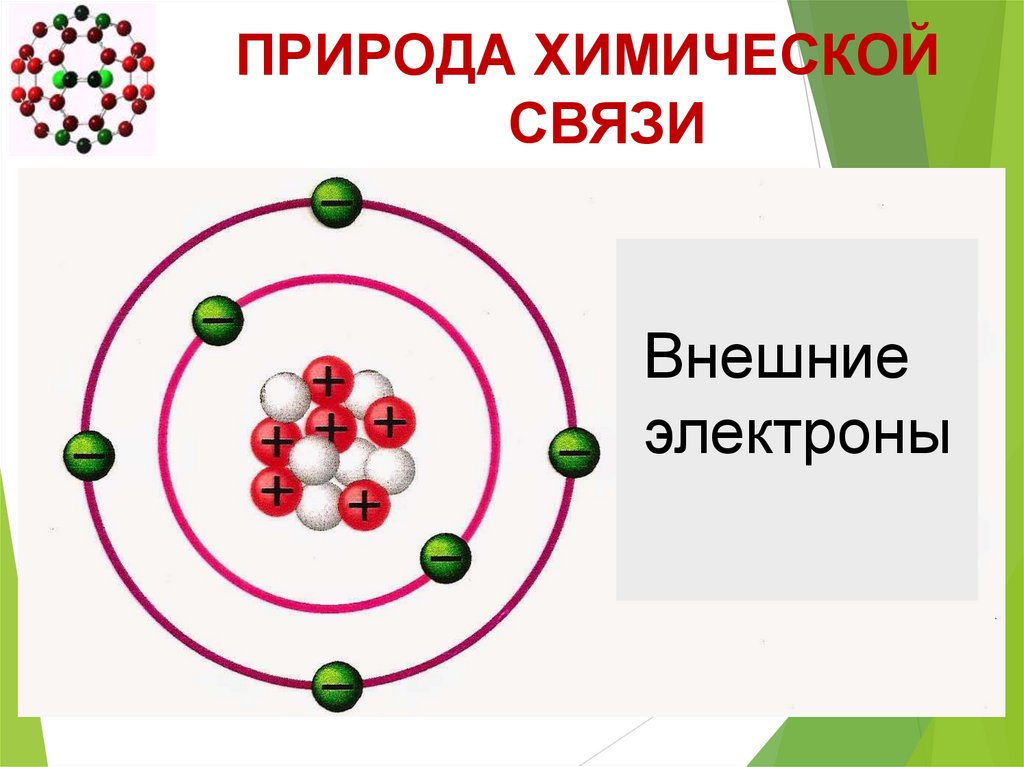
ПРИРОДА ХИМИЧЕСКОЙСВЯЗИ
Внешние
электроны
5.
ПРАВИЛО ОКТЕТА(Льюис, 1875-1946)
При образовании химической связи
атомы
стремятся
приобрести
устойчивую восьмиэлектронную (или
двухэлектронную) внешнюю оболочку,
соответствующую
строению
атома
ближайшего инертного газа (ns2np6).
6.
ОБРАЗОВАНИЕ ОКТЕТА12/10/23/ стом.
1. Обобществление электронов (ковалентная
связь)
··
..
..
Cl·
+ ·Cl
..
.. → ׃
3s23p5
3s23p5
▪▪
▪▪
▪▪
▪▪
׃Cl ׃Cl ׃
3s23p6
3s23p6
2. Перенос электрона (ионная связь)
+ .. –
..
Na· + ·Cl → ׃Na ׃Cl ׃
▪ ▪
2s22p63s1 3s23p5
▪ ▪
2s22p6 3s23р6
электронный октет
7.
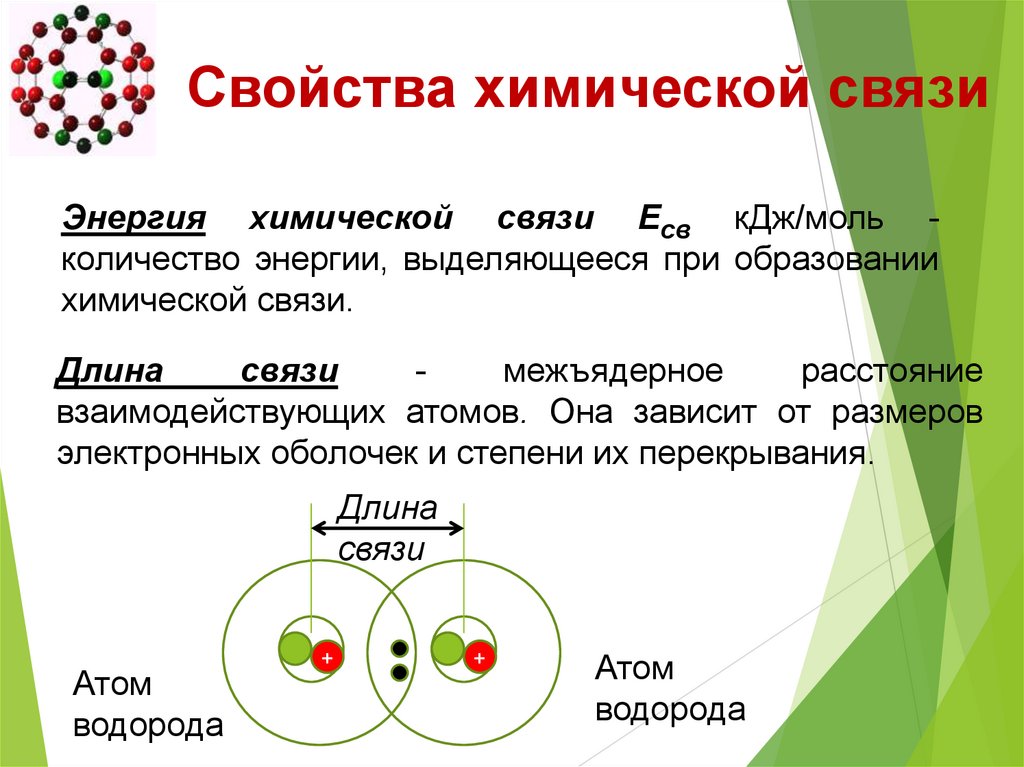
Свойства химической связиЭнергия химической связи Есв кДж/моль количество энергии, выделяющееся при образовании
химической связи.
Длина
связи
межъядерное
расстояние
взаимодействующих атомов. Она зависит от размеров
электронных оболочек и степени их перекрывания.
Длина
связи
Атом
водорода
+
+
Атом
водорода
8.
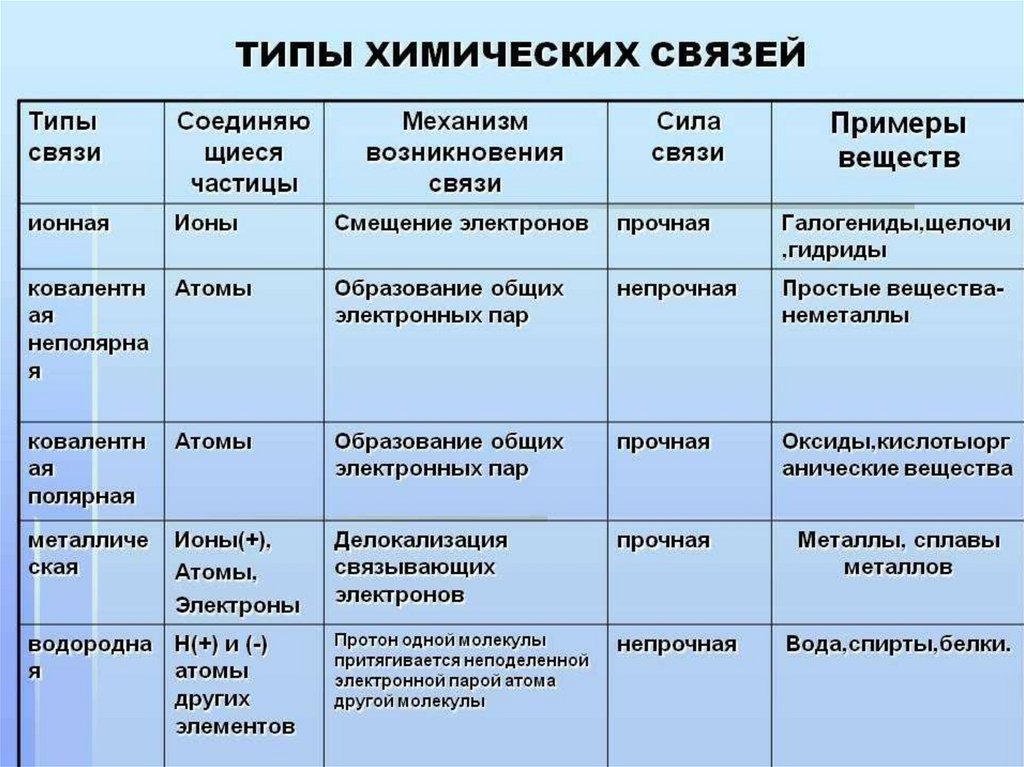
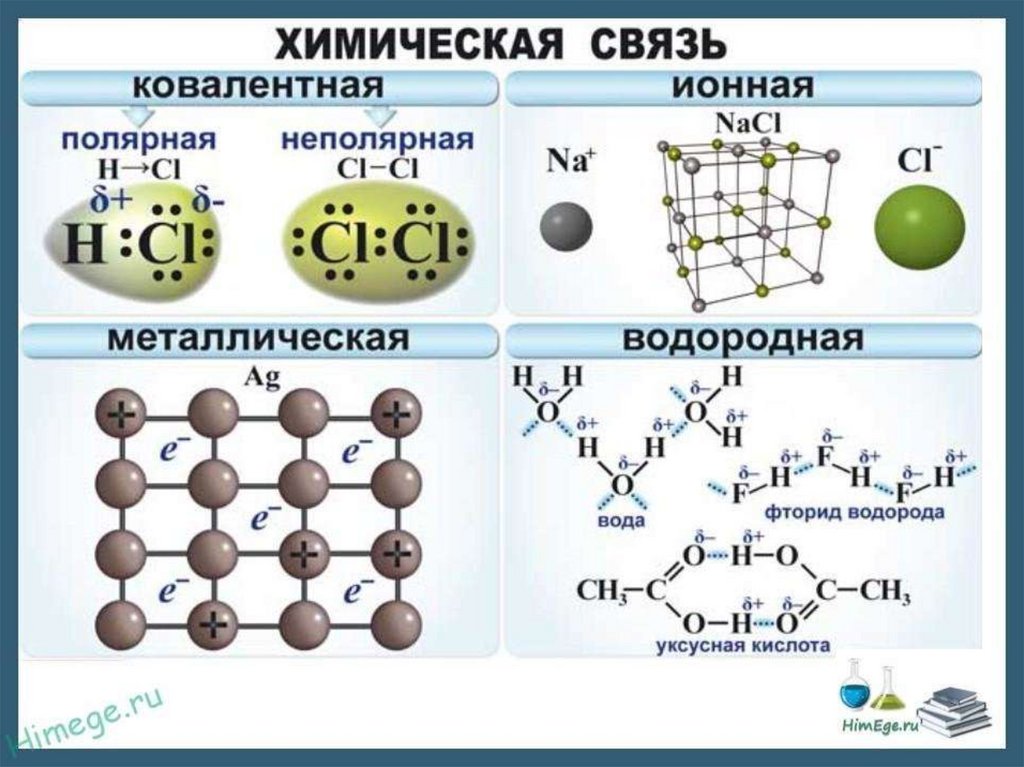
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИОСНОВНЫЕ ТИПЫ:
1. Ковалентная (полярная и неполярная)
2. Ионная
3. Металлическая.
КРОМЕ ТОГО, МЕЖДУ МОЛЕКУЛАМИ ВОЗНИКАЮТ:
1. Водородная химическая связь.
2. Ван-дер-Ваальса взаимодействия.
9.
10.
11.
Ионная связьВальтер Коссель (нем. Walther Kossel)
(4 января 1888 — 22 мая 1956)
В 1916 выдвинул гипотезу, которая
легла в основу теории ионной
химической связи и гетеровалентности
12.
ИОННАЯ СВЯЗЬИонная
химическая
связь
электростатическое
взаимодействие отрицательно и
положительно заряженных ионов в
химическом соединении.
+ -
NaCl
13.
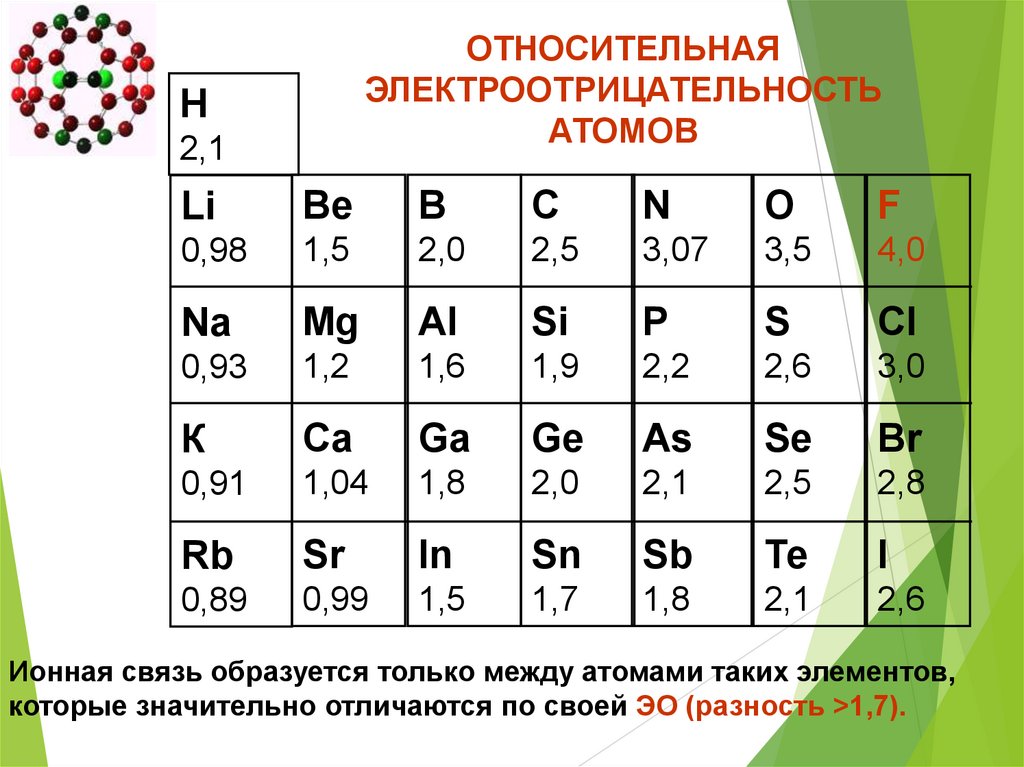
ОТНОСИТЕЛЬНАЯЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
АТОМОВ
Н
2,1
Li
Be
В
С
N
О
F
0,98
1,5
2,0
2,5
3,07
3,5
4,0
Na
Mg
Al
Si
P
S
Сl
0,93
1,2
1,6
1,9
2,2
2,6
3,0
К
Ca
Ga
Ge
As
Se
Br
0,91
1,04
1,8
2,0
2,1
2,5
2,8
Rb
Sr
In
Sn
Sb
Те
I
0,89
0,99
1,5
1,7
1,8
2,1
2,6
Ионная связь образуется только между атомами таких элементов,
которые значительно отличаются по своей ЭО (разность >1,7).
14.
1415.
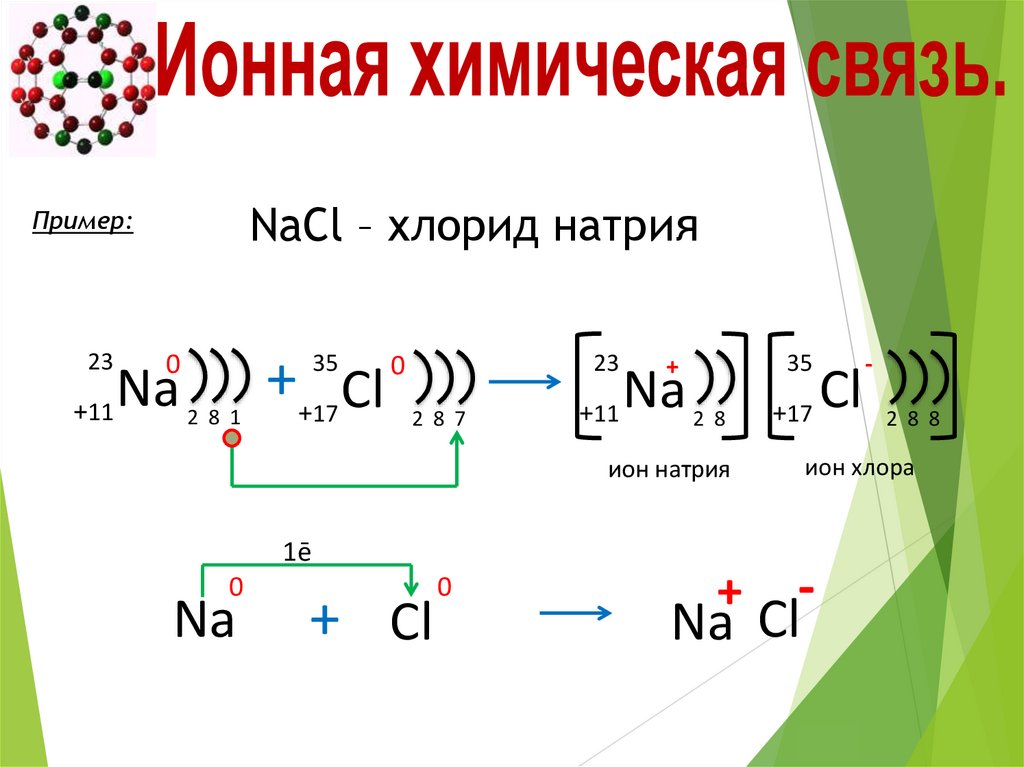
NaCl – хлорид натрияПример:
23
0
Na
+11
++17 Cl
35
2 8 1
23
0
2 8 7
+11
35
+
Na
2 8
ион натрия
1ē
0
Na
+ Cl
0
+17
2 8 8
ион хлора
Na Cl
+
Cl
-
16.
Ионная связьИонная связь — сильная химическая связь, возникающая
в результате электростатического притяжения катионов и
анионов. Возникает между атомами с большой разностью
электроотрицательностей
Na+Cl=NaCl
1.Образование ионов
Na – ē = Na+
Cl + ē = Cl2. Образование молекулы
Na+ + Cl- = NaCl
11Na (1s22s22p63s1) - ē = 11Na+ (1s22s22p6)
17Cl (1s22s22p63s23p5) + ē = 17Cl- (1s22s22p63s23p6)
17. Примеры соединений с ионым типом связи
CsF, КI, LiClК2S, Nа2S
Nа3N, Mg3N2
Nа2O, Li2O
18.
Ковалентная связьМетод валентных связей (метод ВС)
Гилберт Ньютон Льюис (англ. Gilbert Newton Lewis)
(23 октября 1875 — 23 марта 1946)
В 1916 Льюис высказал идею, что ковалентная
химическая связь образуется за счёт обобществления
пары электронов, то есть электронная плотность
распределяется между двумя атомами
19.
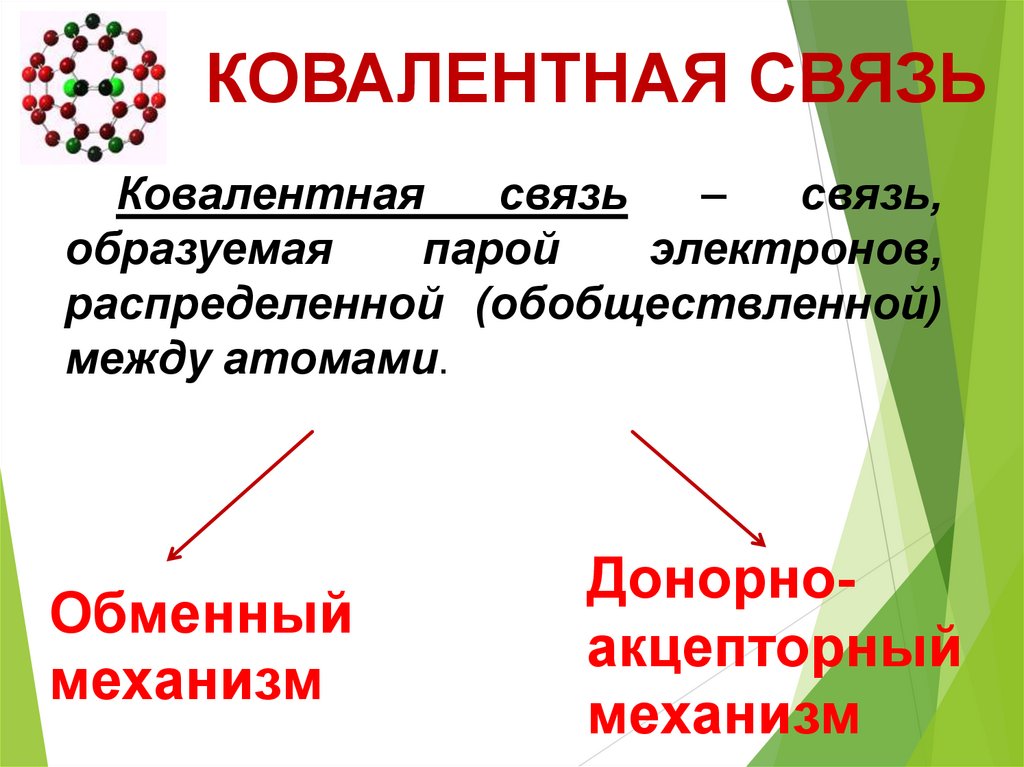
КОВАЛЕНТНАЯ СВЯЗЬКовалентная
связь
–
связь,
образуемая
парой
электронов,
распределенной (обобществленной)
между атомами.
Обменный
механизм
Донорноакцепторный
механизм
20.
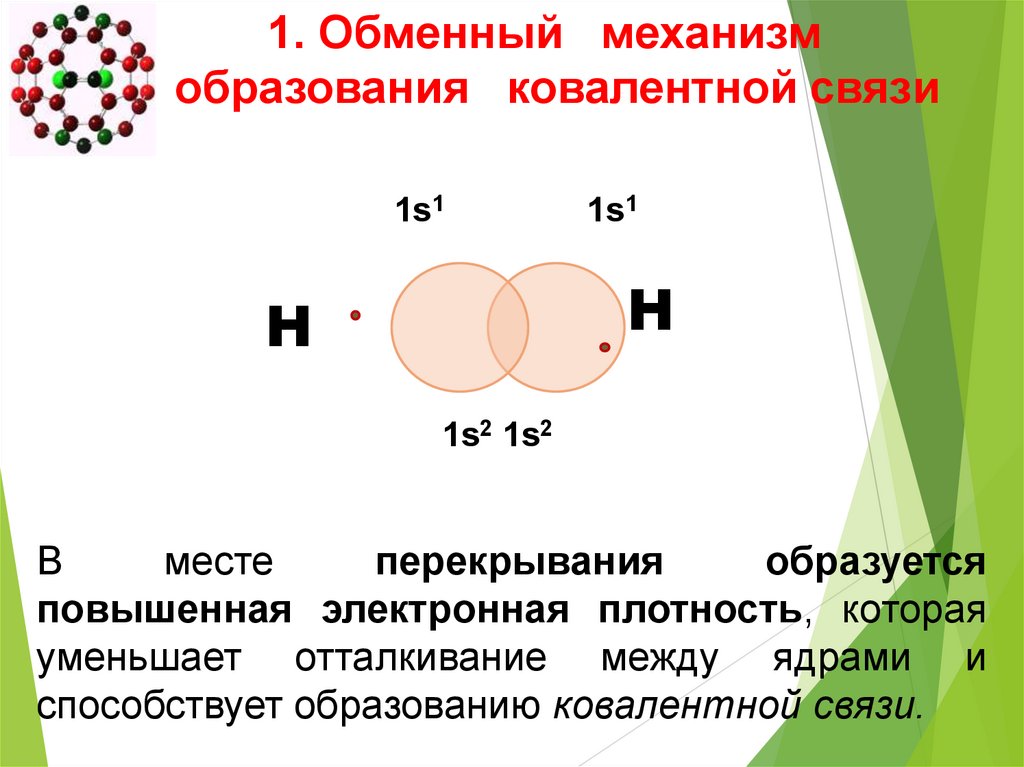
1. Обменный механизмобразования ковалентной связи
1s1
1s1
Н
Н
1s2 1s2
В
месте
перекрывания
образуется
повышенная электронная плотность, которая
уменьшает отталкивание между ядрами и
способствует образованию ковалентной связи.
21.
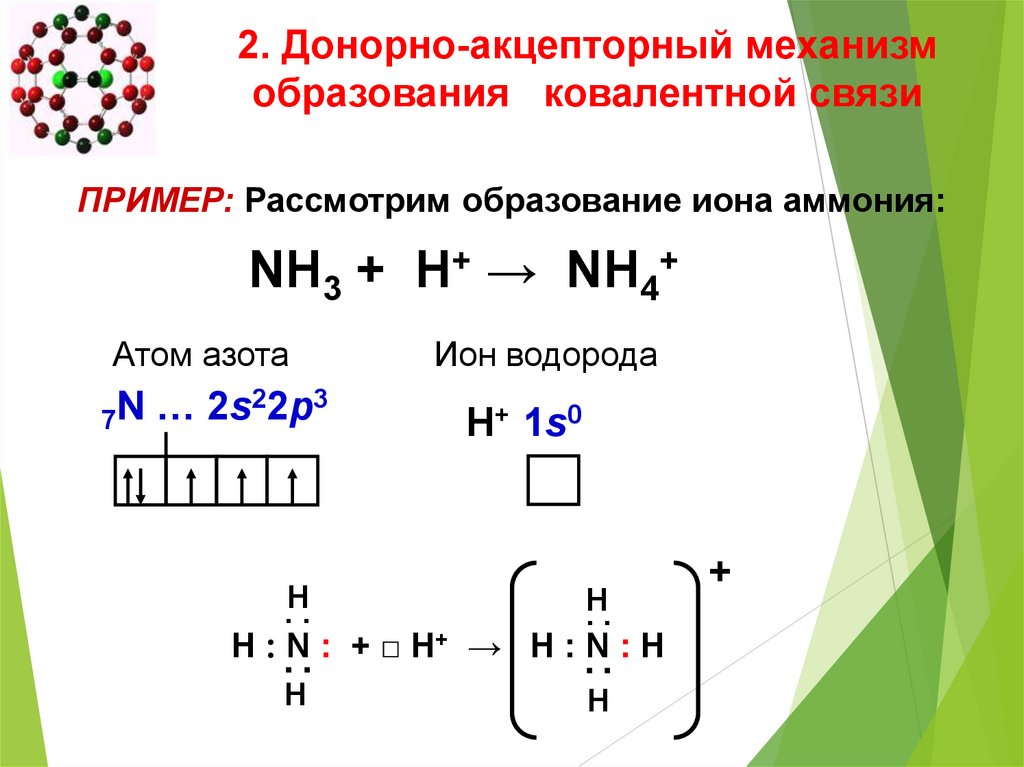
2. Донорно-акцепторный механизмобразования ковалентной связи
ПРИМЕР: Рассмотрим образование иона аммония:
NH3 + H+ → NH4+
Атом азота
22p3
N
…
2s
7
Ион водорода
H+ 1s0
.H.
H
..
▪ ▪
▪ ▪
H
H
H ׃N ׃+ □ H+ → H ׃N ׃H
+
22. Виды ковалентной связи
Если электронная плотность расположенасимметрично между атомами, ковалентная
связь называется неполярной.
Если электронная плотность смещена в
сторону одного из атомов, то ковалентная
связь называется полярной.
Полярность связи тем больше, чем больше
разность электроотрицательностей
атомов.
23.
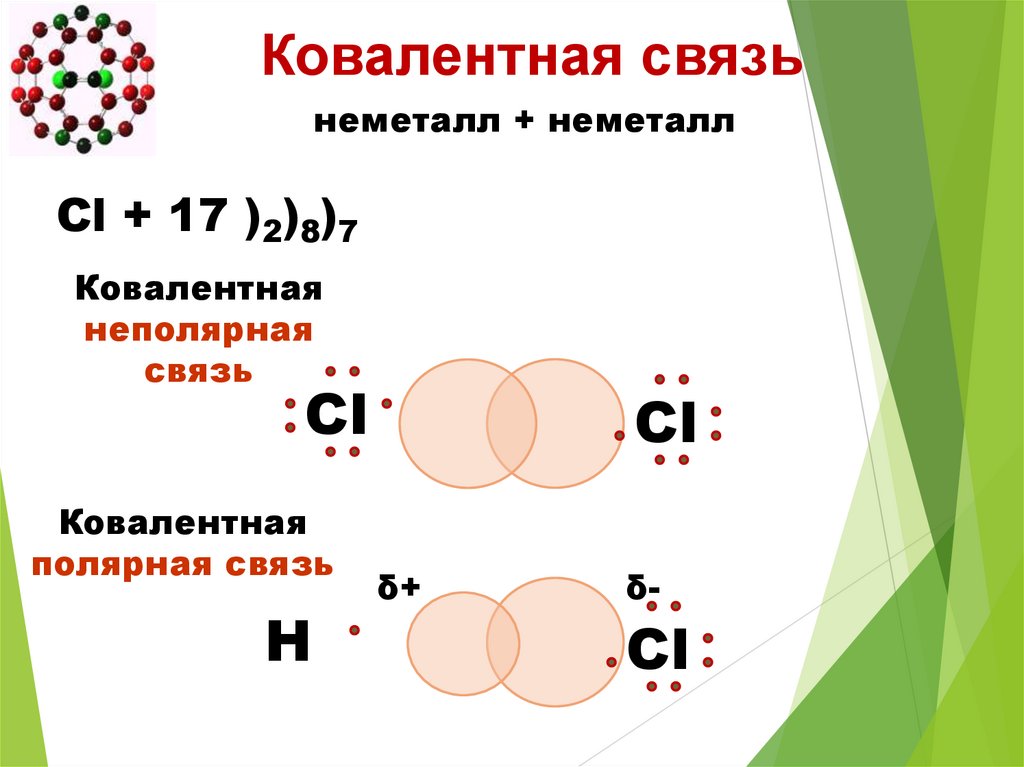
Ковалентная связьнеметалл + неметалл
Cl + 17 )2)8)7
Ковалентная
неполярная
связь
Сl
Ковалентная
полярная связь
Н
Сl
δ+
δ-
Сl
24.
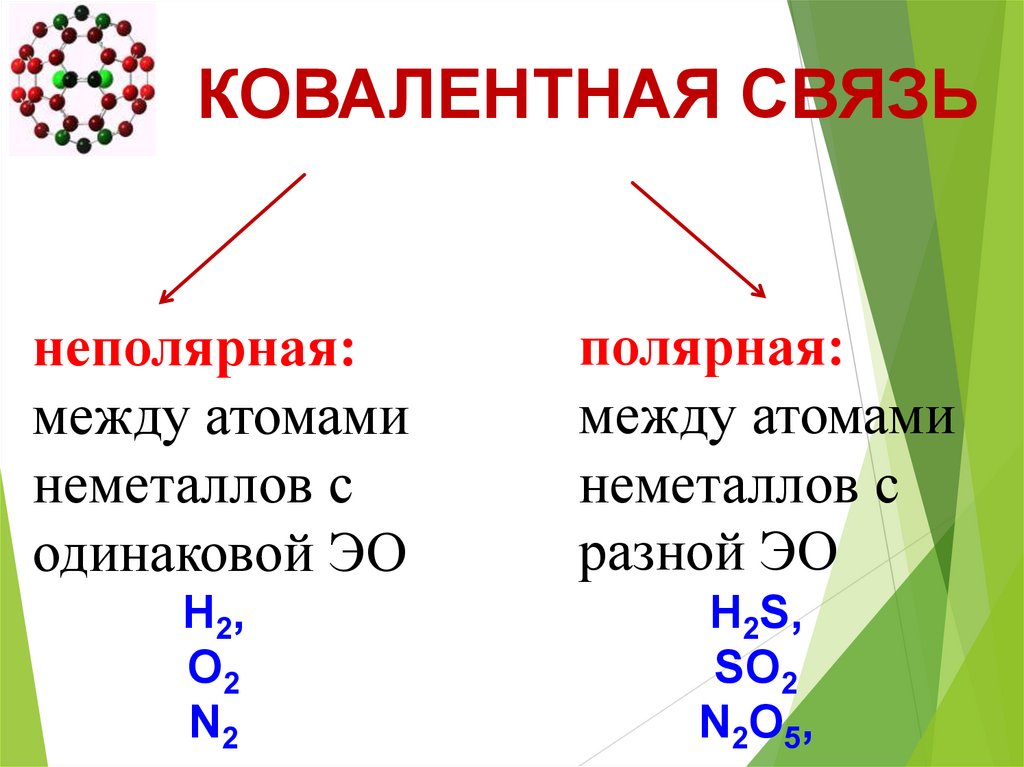
КОВАЛЕНТНАЯ СВЯЗЬнеполярная:
между атомами
неметаллов с
одинаковой ЭО
полярная:
между атомами
неметаллов с
разной ЭО
H 2,
O2
N2
H2S,
SO2
N 2O 5,
25.
26.
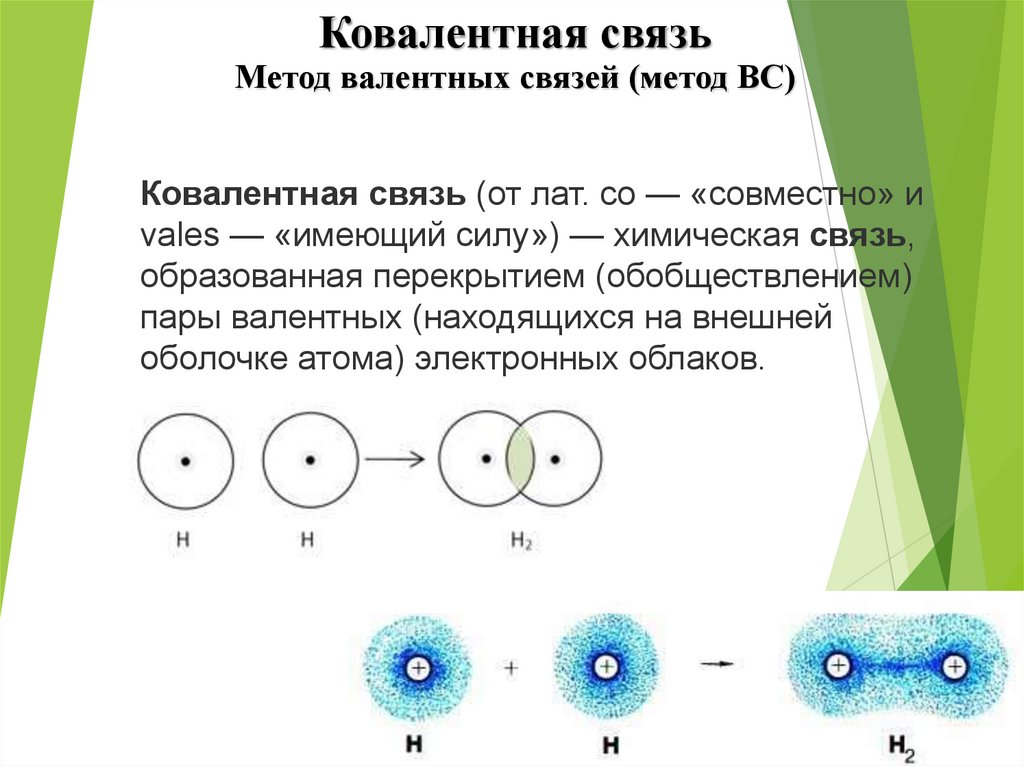
Ковалентная связьМетод валентных связей (метод ВС)
Ковалентная связь (от лат. co — «совместно» и
vales — «имеющий силу») — химическая связь,
образованная перекрытием (обобществлением)
пары валентных (находящихся на внешней
оболочке атома) электронных облаков.
27.
28.
29.
30.
31.
32.
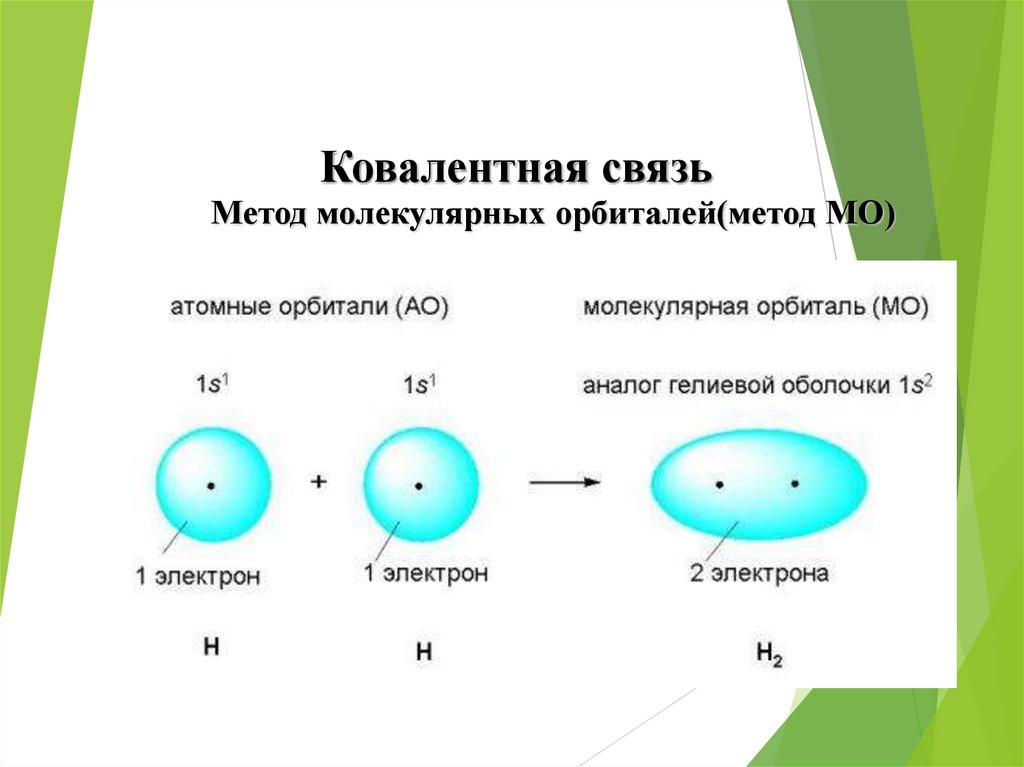
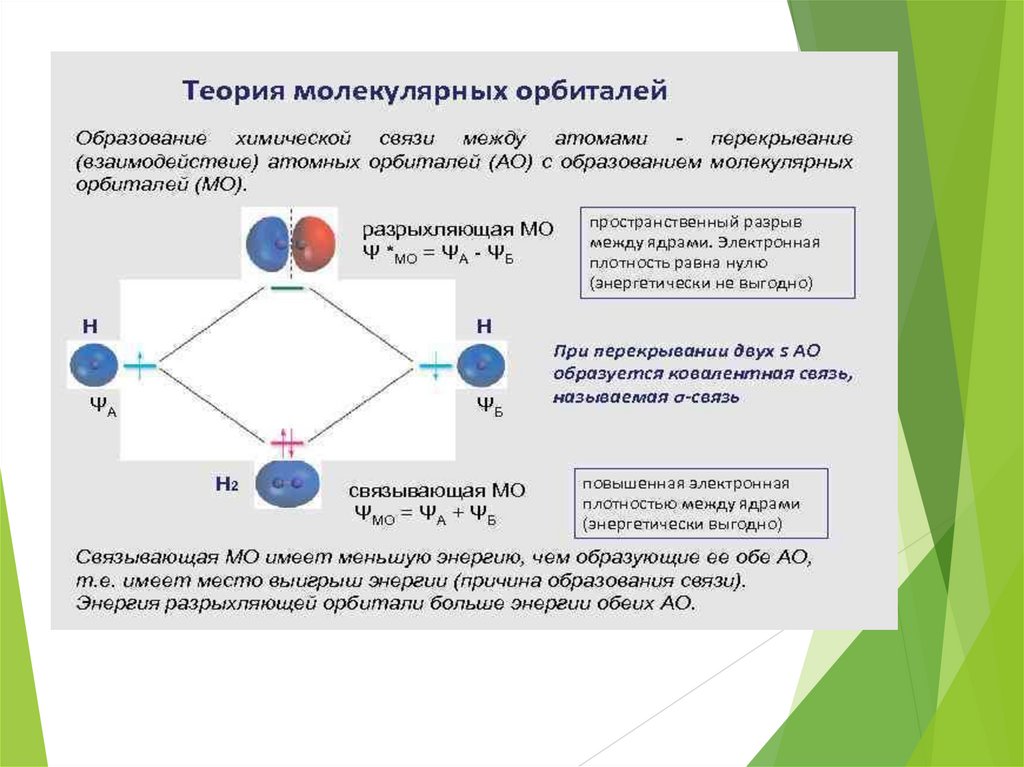
Ковалентная связьМетод молекулярных орбиталей(метод МО)
33.
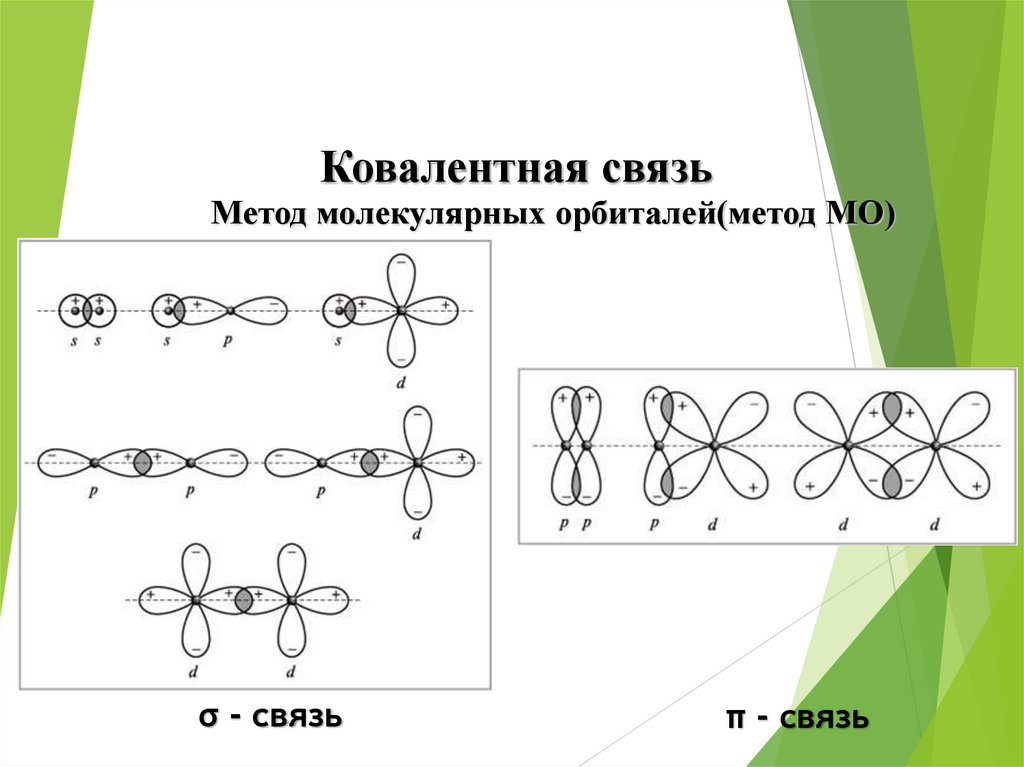
Ковалентная связьМетод молекулярных орбиталей(метод МО)
σ - связь
π - связь
34.
35.
36.
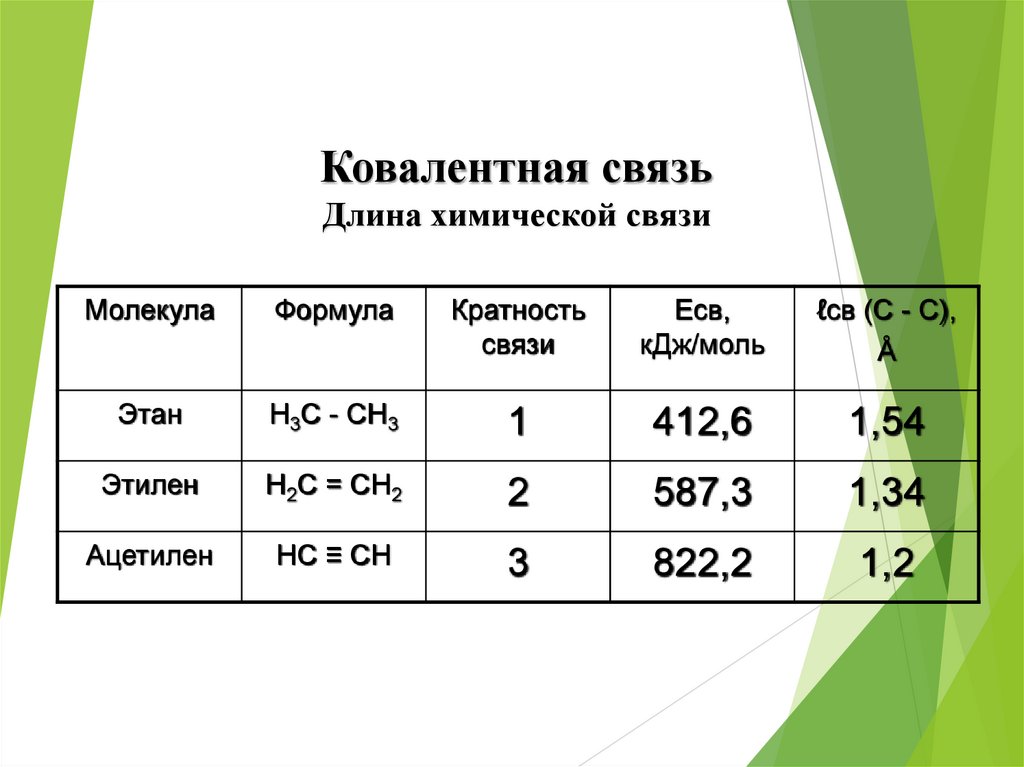
Ковалентная связьДлина химической связи
Молекула
Формула
Кратность
связи
Есв,
кДж/моль
ℓсв (С - С),
Å
Этан
Н3С - СН3
1
412,6
1,54
Этилен
Н2С = СН2
2
587,3
1,34
Ацетилен
НС ≡ СН
3
822,2
1,2
37.
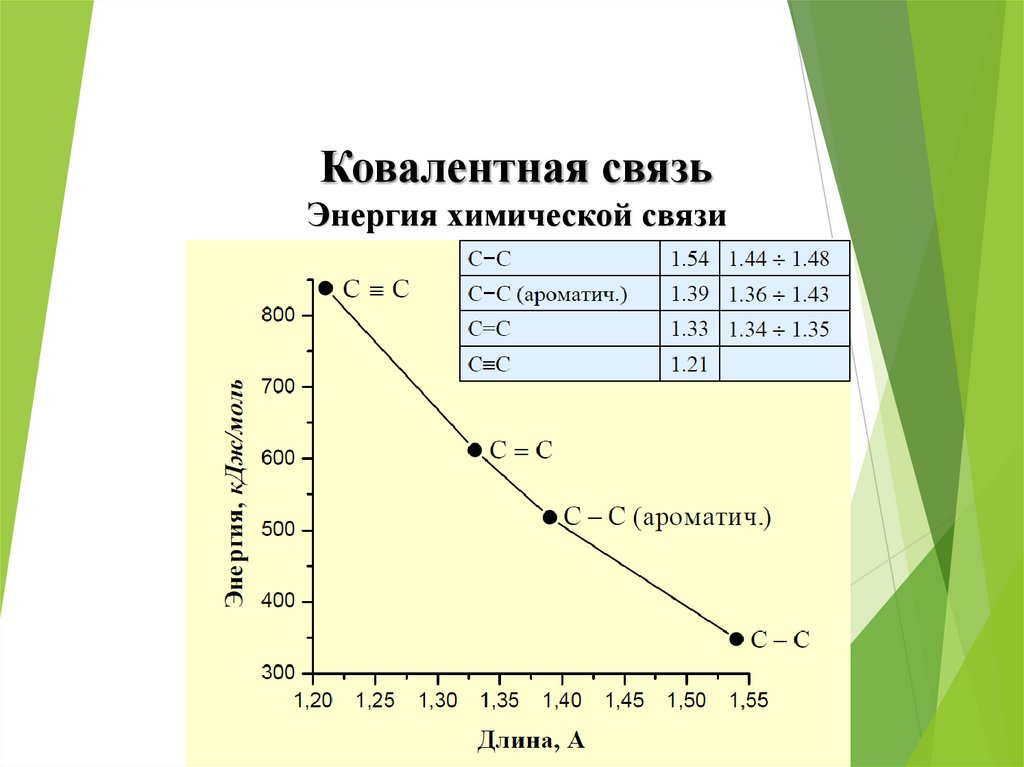
Ковалентная связьЭнергия химической связи
38.
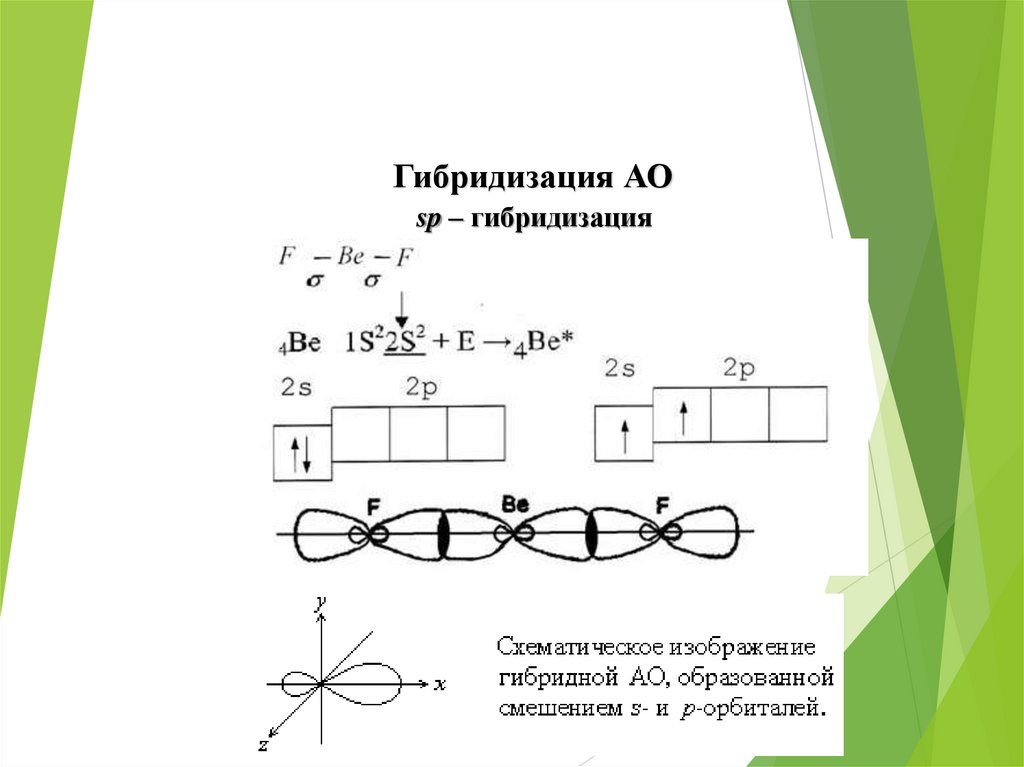
Гибридизация АОsp – гибридизация
39.
40.
41.
42.
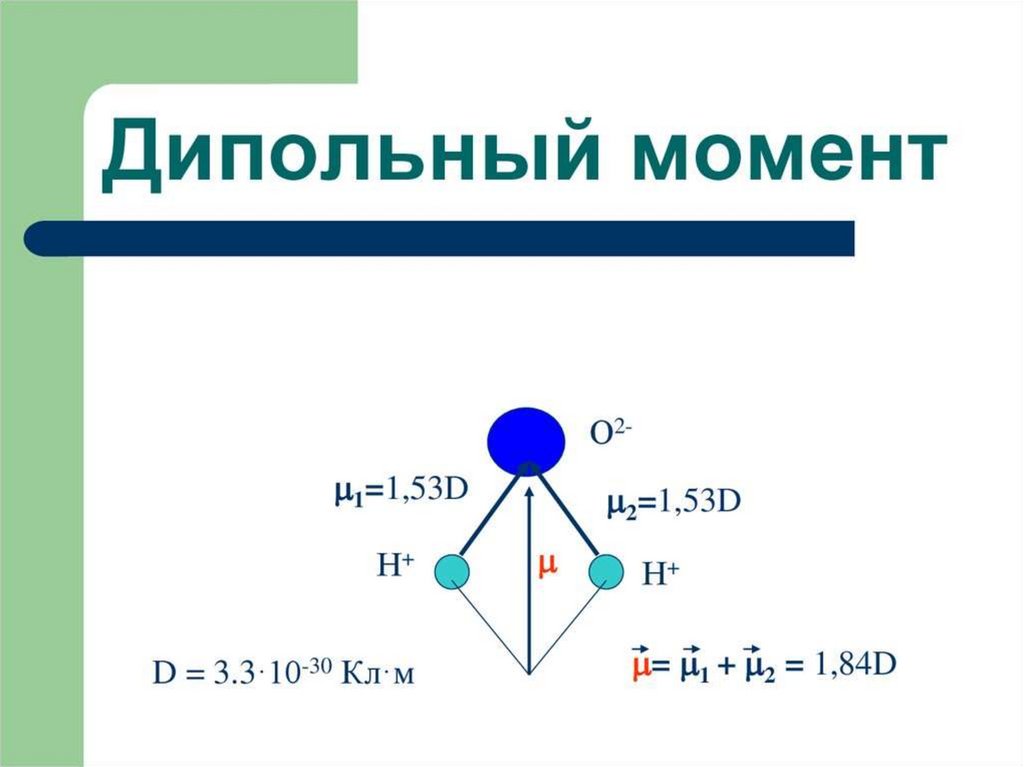
Полярность молекулq l
1 Д 0,33 10
29
Кл м
43.
Полярность молекул1
F
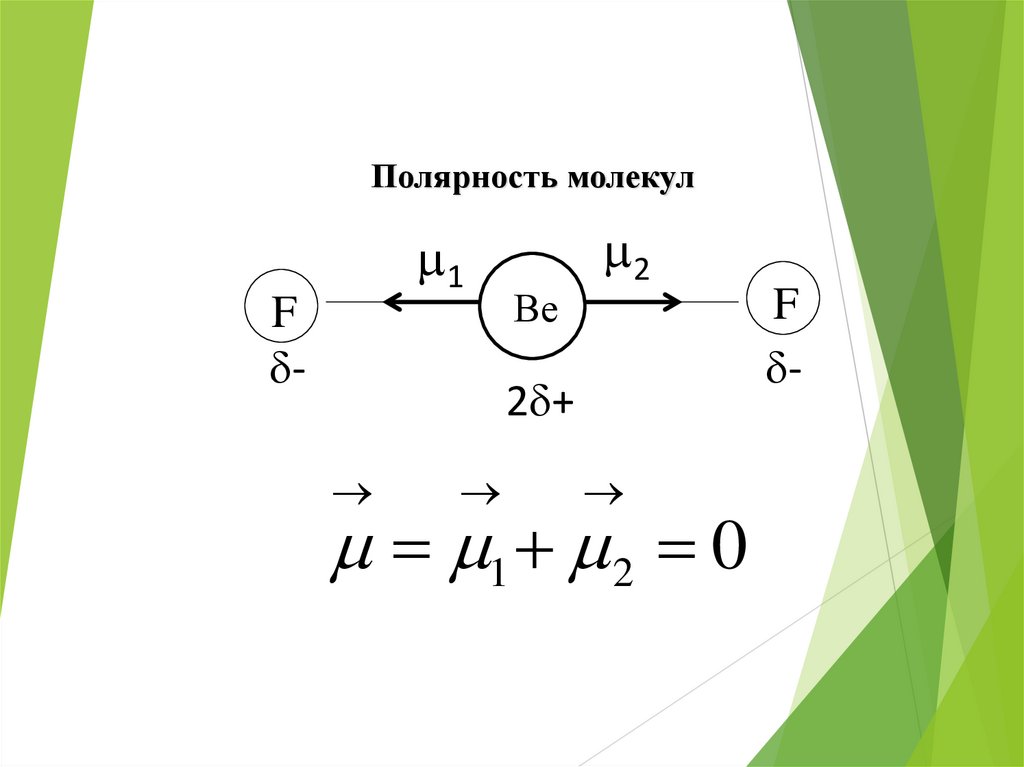
-
Ве
2
2 +
1 2 0
F
-
44.
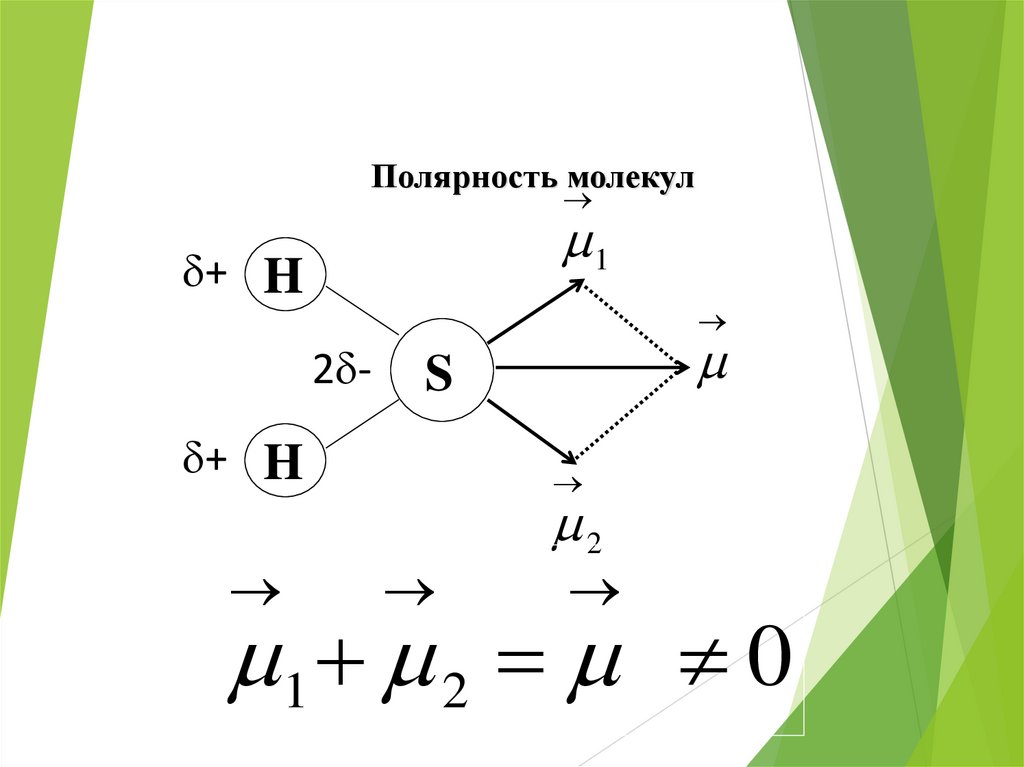
Полярность молекул1
+ H
2 -
+ H
S
2
1 2 0
45.
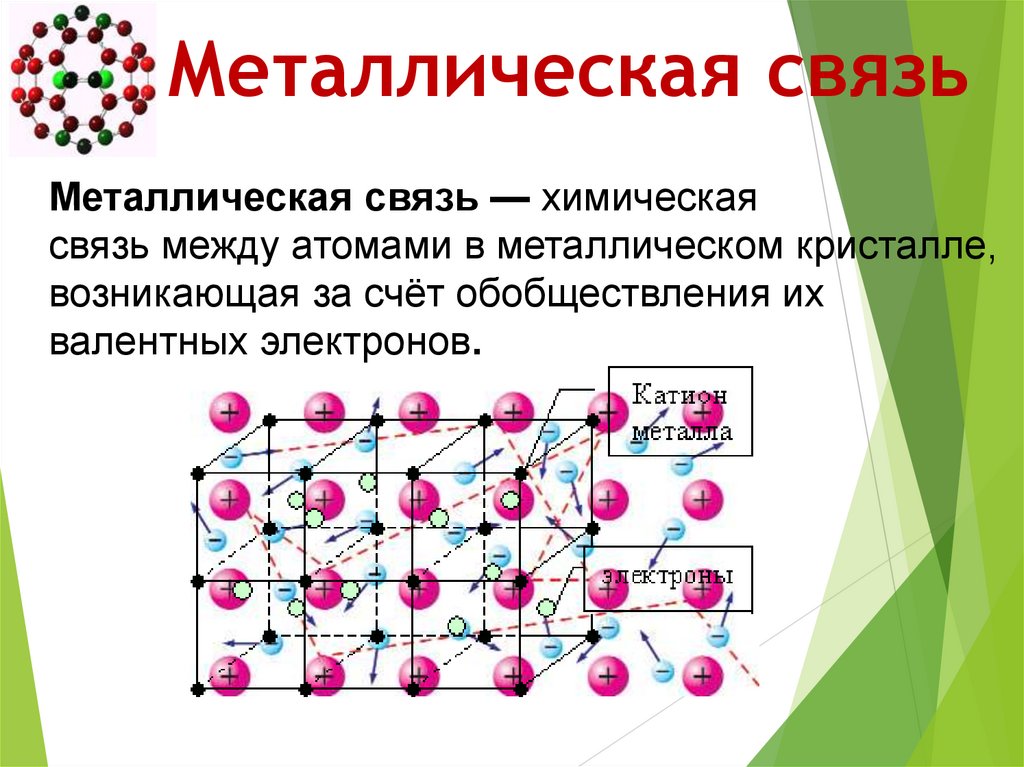
Металлическая связь46. Металлическая связь
Металлическая связь — химическаясвязь между атомами в металлическом кристалле,
возникающая за счёт обобществления их
валентных электронов.
47. Металлическая связь
Металлическая кристаллическая решетка и металлическаясвязь определяют такие свойства металлов: ковкость,
пластичность, электро- и теплопроводность,
металлический блеск, способность к образованию сплавов.
http://adamantsteel.ru/
48.
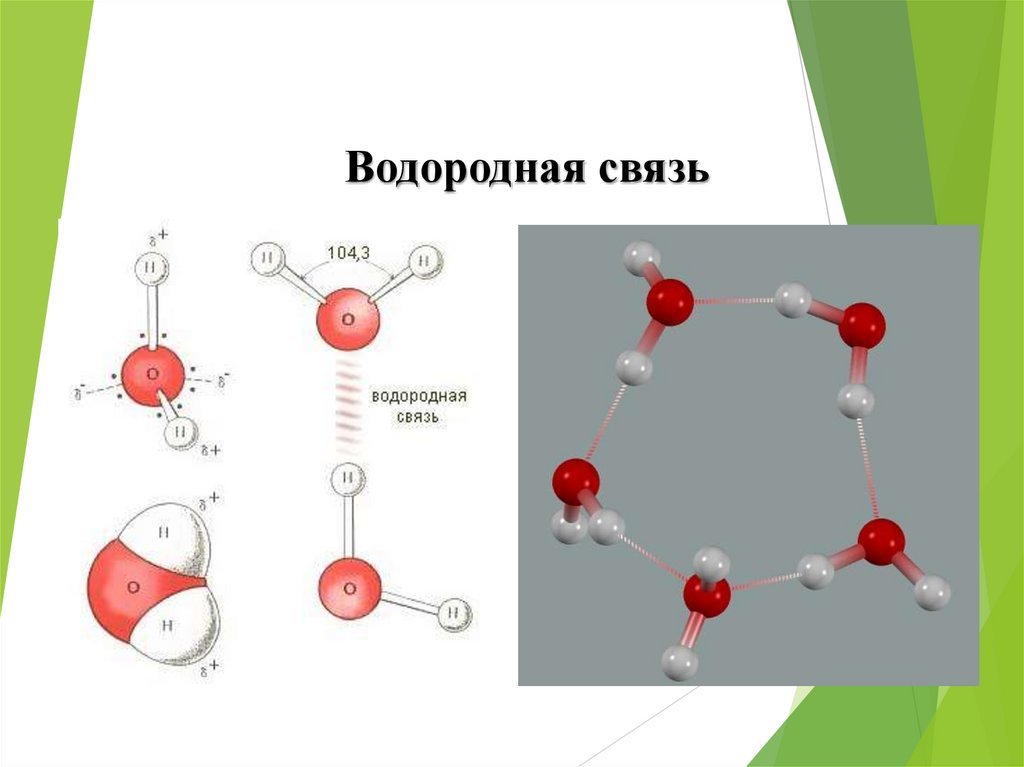
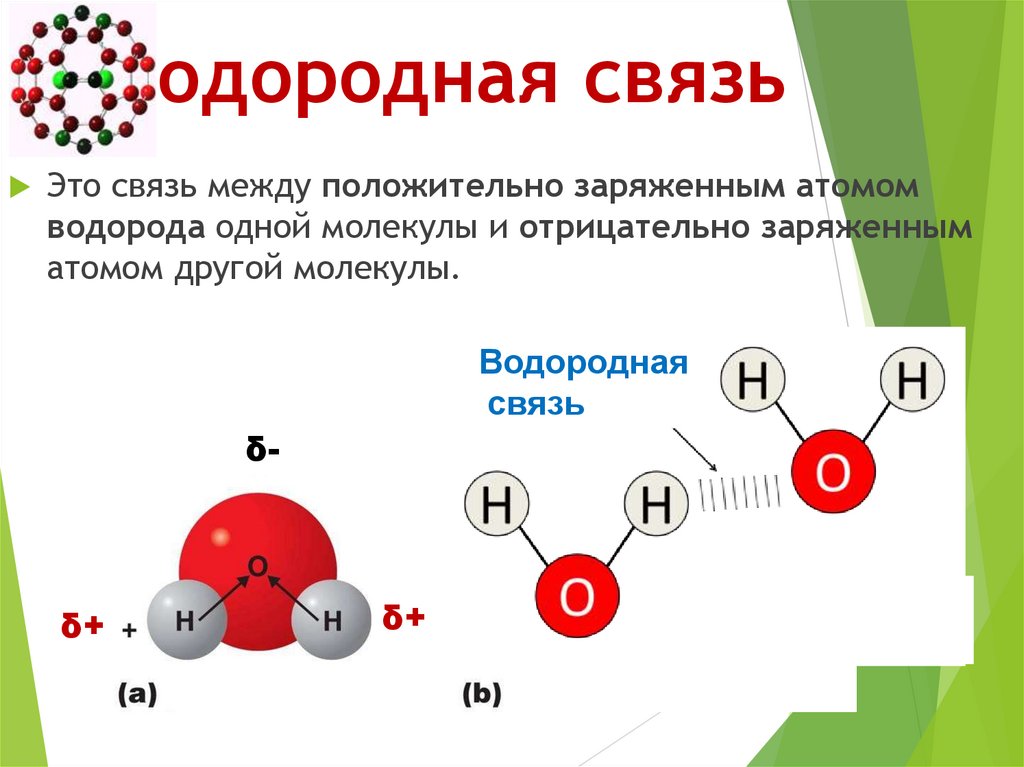
Водородная связь49. Водородная связь
Это связь между положительно заряженным атомомводорода одной молекулы и отрицательно заряженным
атомом другой молекулы.
Водородная
связь
δ-
δ+
δ+
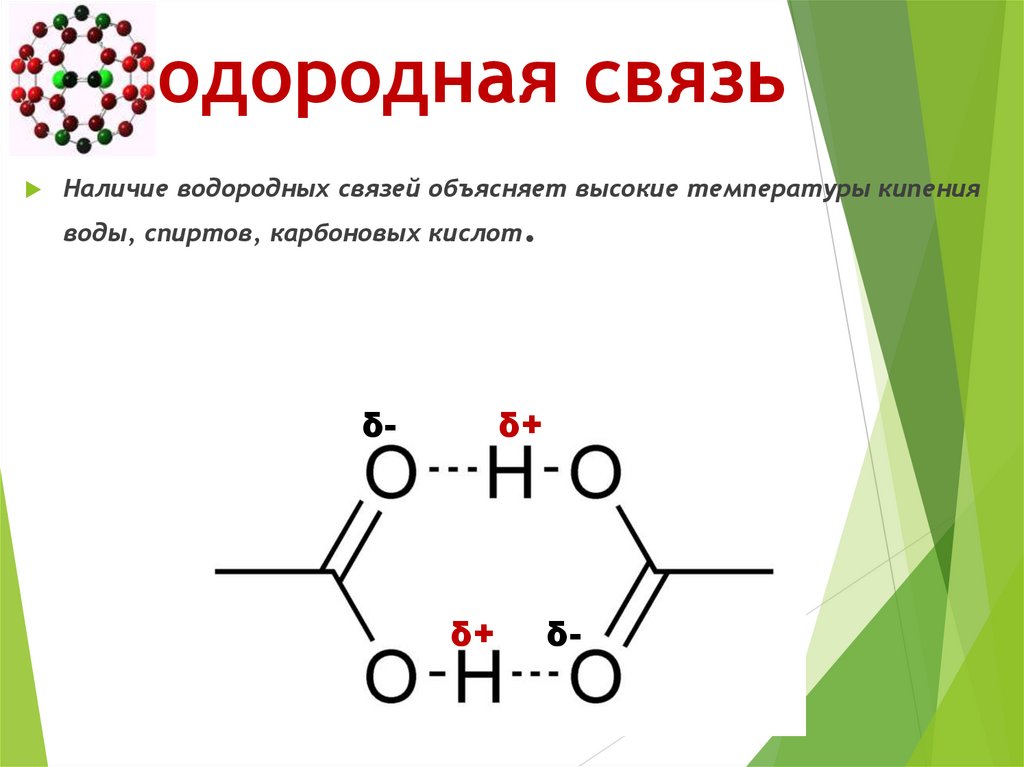
50. Водородная связь
Наличие водородных связей объясняет высокие температуры кипенияводы, спиртов, карбоновых кислот.
δ-
δ+
δ+
δ-
51. Механизм образования водородной связи
Электростатическоепритяжение атома
водорода, имеющего
частично положительный
заряд, и атома кислорода
(фтора или азота),
имеющего частично
отрицательный заряд
Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
Донорно-акцепторное
взаимодействие между
почти свободной
орбиталью атома водорода
и неподеленной
электронной парой атома
азота
52.
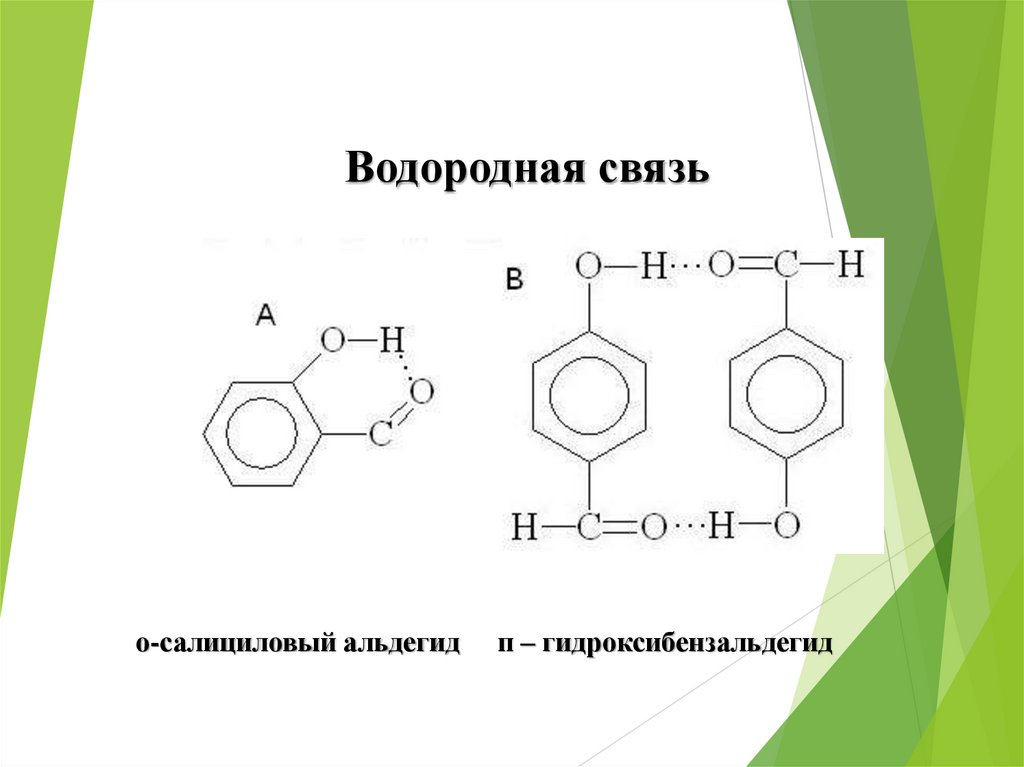
Водородная связьо-салициловый альдегид
п – гидроксибензальдегид
53.
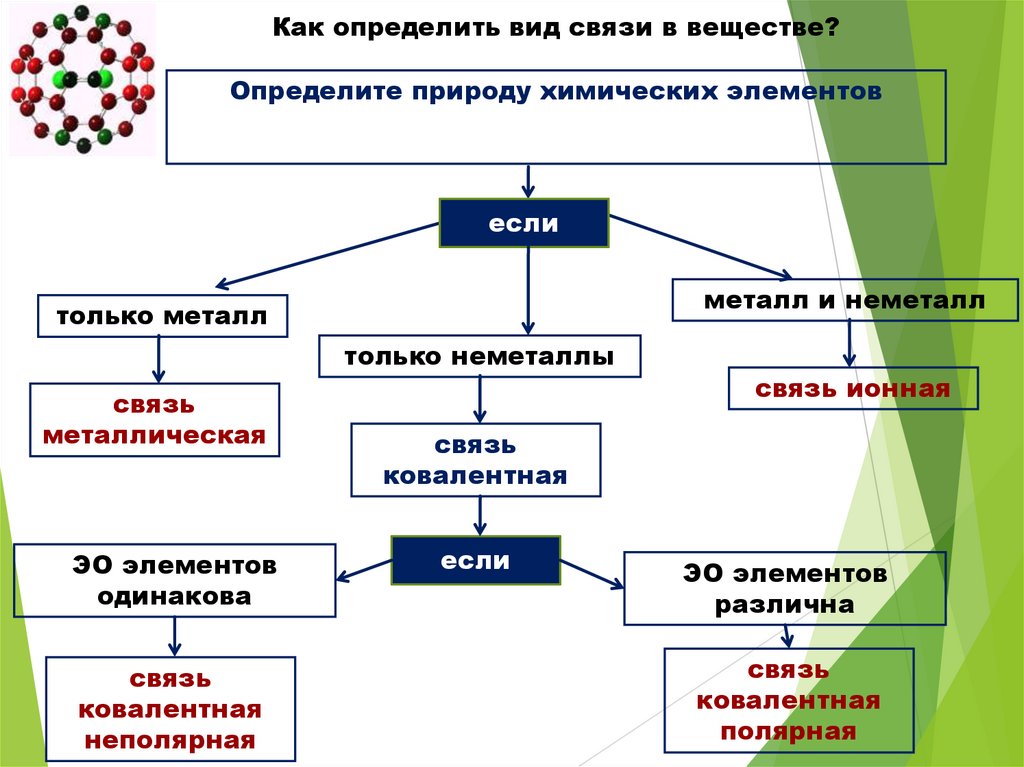
Как определить вид связи в веществе?Определите природу химических элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
54.
55.
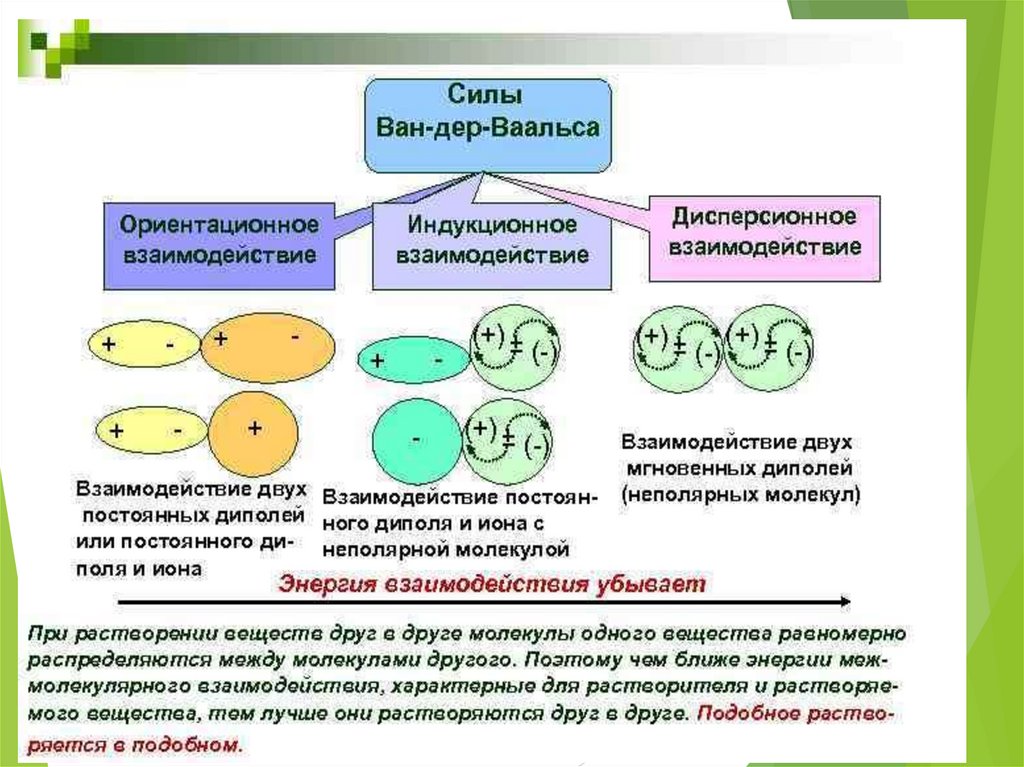
Силы ВандерВаальсаДиполь-дипольное взаимодействие:
2 4
Е 6
3r КТ
Индукционное взаимодействие:
2 L 2
Е 6
r
Дисперсионное взаимодействие:
Ян Дидерик Ван-дер-Ваа́льс
(23 ноября 1837 — 8 марта 1923)
3L2 h o
Е
4r 6



























 Химия
Химия








