Похожие презентации:
Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі
1. № 2 дәріс
ФЕРМЕНТТЕР.Ферментативті катализдің механизмі.
Ферменттердің жіктелуі. Гидролазалар,
лиазалар, трансферазалар және
окисдоредуктазалар класының негізгі
өкілдеріне жалпы сипаттама
2. Дәріс жоспары:
1. Ферменттер, жалпы қасиеттері.2. Ферментативті катализдің механизмі.
3. Ферменттердің номенклатурасы және
жіктелуі.
4. Гидролазалар.
5. Лиазалар.
6. Трансферазалар.
7. Оксидоредуктазалар.
3. Фермент
• Ферменттер – арнайылығы барнәруыздар, жасушаларда түзіліп,
химиялық үрдістерді тездетуге қабілетті
биологиялық катализаторлар.
• «Фермент» термині «fermentum» ашытқы латын сөзінен шыққан. Ағылшын
тіліндегі әдебиеттерде «энзим» сөзі
пайдаланылады, грек тілінінен «en zyme»
– ашытқыда деген мағына береді.
4. Ферменттердің жалпы қасиеттері:
• 1. құрылысының күрделілігі (ферменттер химиялықтабиғаты нәруыз болғандықтан, нәруыздарға тән
барлық қасиеттерді көрсетеді, алайда олардың
құрылысы күрделірек болады);
• 2. әсер ету қуаттылығы жоғары;
• 3.жоғары арнайылығы;
• 4. ағзада жайлы жағдайда әсер етеді ( tо 37-45о,
қысым 1 атм.);
• 5. активтілігін реттеуге болатын заттар (фермент пен
субстрат концентрациясы, орта рН-ы, температура,
эффекторлар).
5.
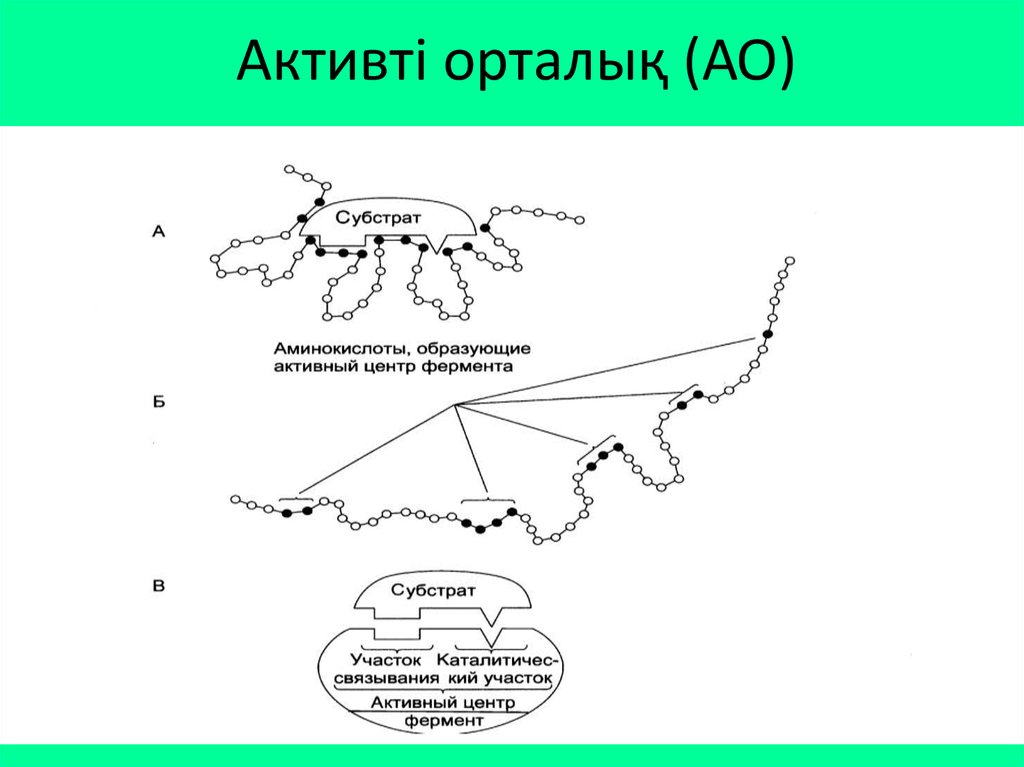
Құрылысының күрделілігіФерменттің нәруыздан айырмашылығы активті
орталығының болуында, активті орталығы
арқылы фермент өз субстратын танып, онымен
байланысып, реакцияны тездетеді.
Активті орталық – ферменттердің беткі
жағына орналасқан амин қышқылдарының
функционалды
топтарының
белгілі
бір
шектелген кеңістікке шоғырлануы.
Субстрат – фермент әсер ететін зат.
6.
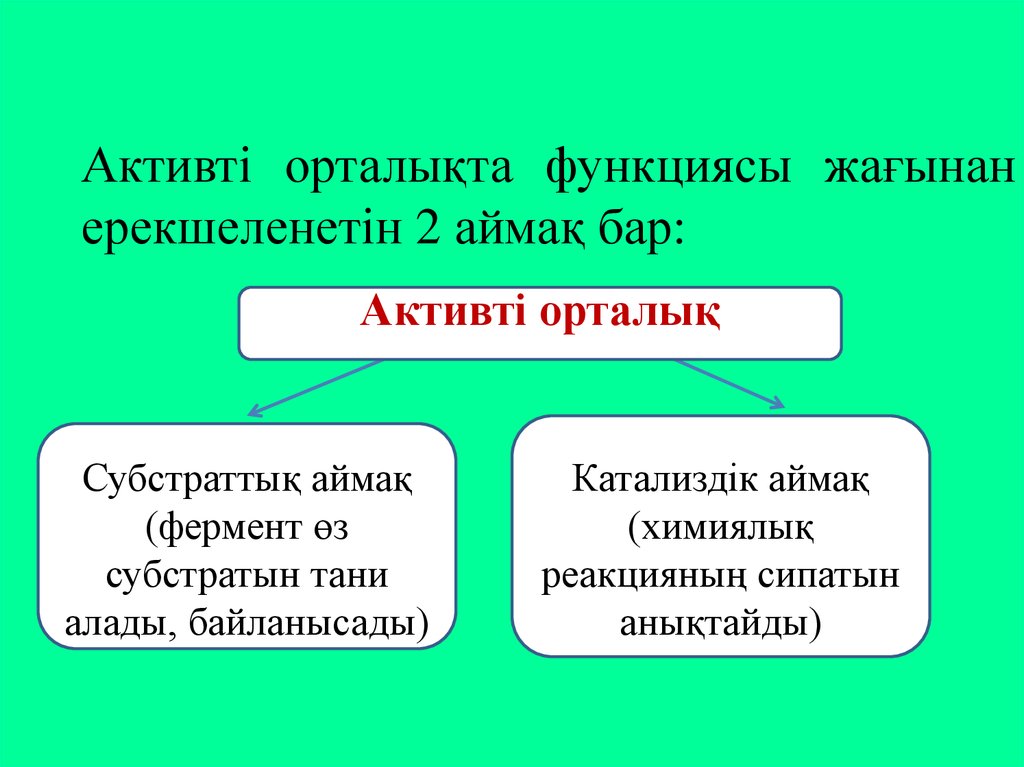
Активті орталықта функциясы жағынанерекшеленетін 2 аймақ бар:
Активті орталық
Субстраттық аймақ
(фермент өз
субстратын тани
алады, байланысады)
Катализдік аймақ
(химиялық
реакцияның сипатын
анықтайды)
7. Активті орталық (АО)
8. Ферменттер
• Біркомпонентті• жай нәруыз –
фермент-протеин
Мысалы: пепсин,
трипсин , αамилаза.
• Екікомпонентті –
фермент-протеид
Апофермент (жай
нәруыз) және
простетикалық
топтан, яғни
коферменттен
тұрады
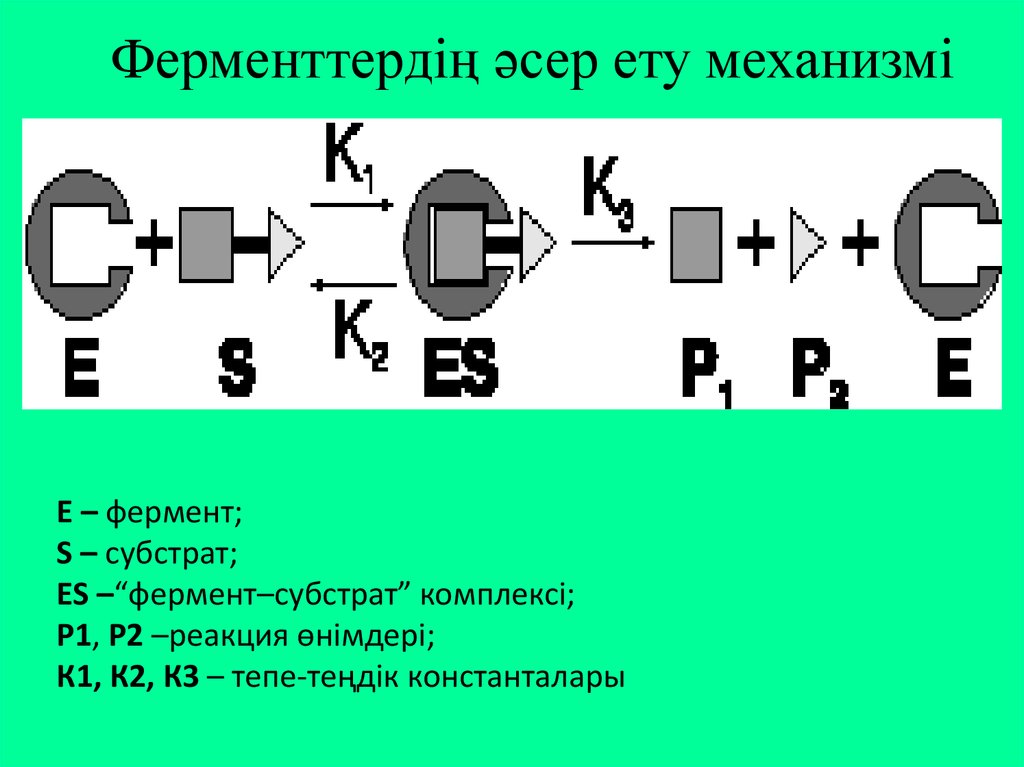
9. Ферменттердің әсер ету механизмі
3 сатыдан тұрады:І. Фермент-субстрат комплексінің түзілуі.
Субстрат ферменттің активті орталығымен
байланысады.
Бұл
әрекеттесу
субстраттың
химиялық табиғатына тәуелді: егер субстратта
зарядталған топтар болса, онда бұл комплекстің
түзілуі иондық байланыс есебінен түзіледі. Ал
ондай топтар болмаса, сутектік байланыс немесе
гидрофобтық әрекеттесу есебінен іске асады.
10. ІІ. Фермент-реакция өнімі комплексінің түзілуі
Ферменттің активті орталығындағы активтітоптар субстраттағы байланыстарды әлсірете
отырып, оған әсер етеді. Бұл кезде субстраттың
конфигурациясы
өзгеріп,
субстрат
молекуласының деформациясы, полярлануы
жүреді, активтену энергиясы төмендеп, субстарт
ыдырайды. Бұл саты өте қысқа уақытта өтеді.
11. ІІІ. Фермент-реакция өнімі комплексінің ыдырауы, бос ферменттің бөлінуі.
ІІІ сатысы баяу жүреді, бүкіл реакцияжылдамдығы осы сатыға байланысты.
12. Ферменттердің әсер ету механизмі
Е – фермент;S – субстрат;
ES –“фермент–субстрат” комплексі;
Р1, Р2 –реакция өнімдері;
К1, К2, К3 – тепе-теңдік константалары
13. Ферменттердің номенклатурасы мен жіктелуі.
• Қазіргі уақытта барлық ферменттер класқажіктеледі. Әр класс ферменттері топтарға,
топтар топшаларға бөлінеді.
• Ферменттің аталуы субстраттың атына
немесе катализдейтін реакция атына “аза”
деген жалғау қосылып оқылады. Кейбір
ферменттердің тривиальды аттары сақталған.
14. 1961 жылдан бері әрбір фермент 4 санды шифр бойынша белгіленеді:
Мысалы: ұйқы безінің липазасы ЕС 3.1.1.3 депшифрланады, мұндағы:
"3" класты - гидролазалар класын,
"1" топты - эстеразалар тобын (күрделі эфирлік
байланысты үзеді),
"1" топшаны – карбоэстеразалар топшасын
(карбон қышқылынан түзілген күрделі эфирлік
байланысты үзеді),
"3" –ферменттің осы топшадағы реттік санын
көрсетеді.
15. Ферменттердің жіктелуі
Барлық белгілі ферменттер катализдейтін реакциятүріне байланысты 6 класқа бөлінеді:
Оксидоредуктазалар
Трансферазалар
Гидролазалар
Лиазалар
Изомеразалар
Лигазалар (синтетазалар)
16.
Энзимдердің 6
класы
бөлінген
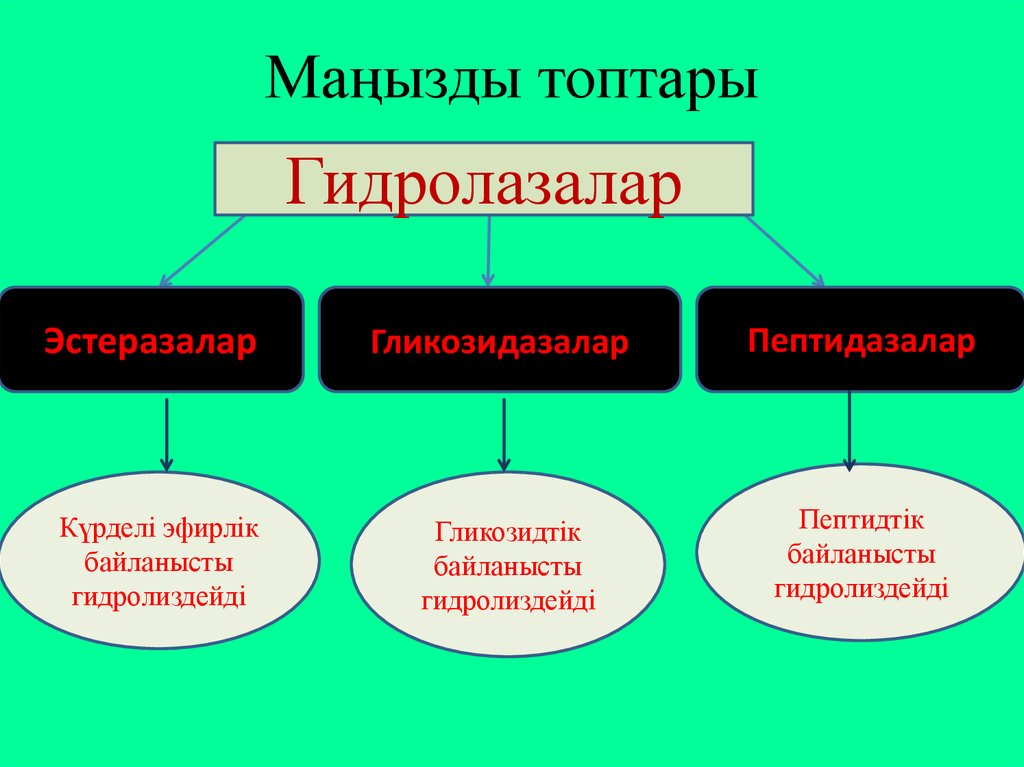
17. Гидролазалар класы
Гидролазалар – судың қатысуымен күрделізаттардың мономерлерге дейін ыдырауын
катализдейтін ферменттер.
Гидролазалар
(карбоксипептидазадан
басқасы) – біркомпонентті ферменттер,
жасушаларда,
ас
қорыту
сөлдерінде
кездеседі.
Гидролазалар 9 топқа бөлінеді, 3 тобын
қарастырамыз:
18. Маңызды топтары
ГидролазаларЭстеразалар
Гликозидазалар
Пептидазалар
Күрделі эфирлік
байланысты
гидролиздейді
Гликозидтік
байланысты
гидролиздейді
Пептидтік
байланысты
гидролиздейді
19. Лиазалар класы
Лиазалар – судыңқатысуынсыз
субстраттан белгілі бір топтардың (NH3,
СО2, альдегид, т.б) бөліну немесе қос
байланысқа
атом
топтарын
енгізу
реакцияларын катализдейтін ферменттер
класы.
Лиазалар – екікомпонентті, жасушалық
ферменттер (240 өкілі бар).
20.
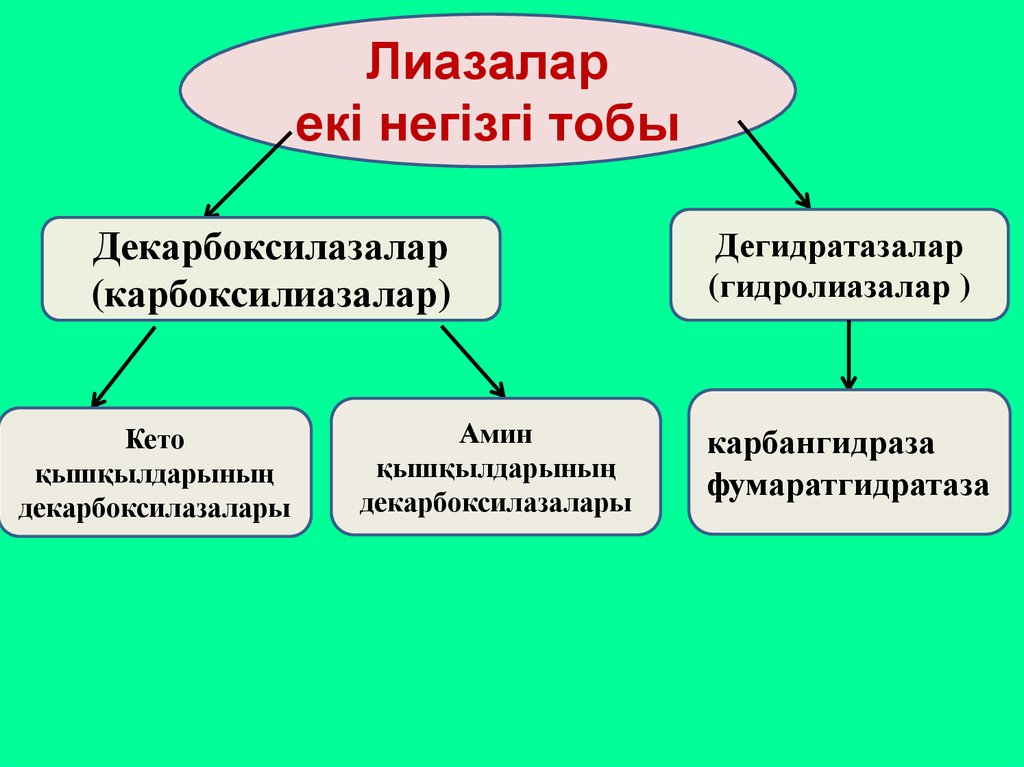
Лиазаларекі негізгі тобы
Декарбоксилазалар
(карбоксилиазалар)
Кето
қышқылдарының
декарбоксилазалары
Амин
қышқылдарының
декарбоксилазалары
Дегидратазалар
(гидролиазалар )
карбангидраза
фумаратгидратаза
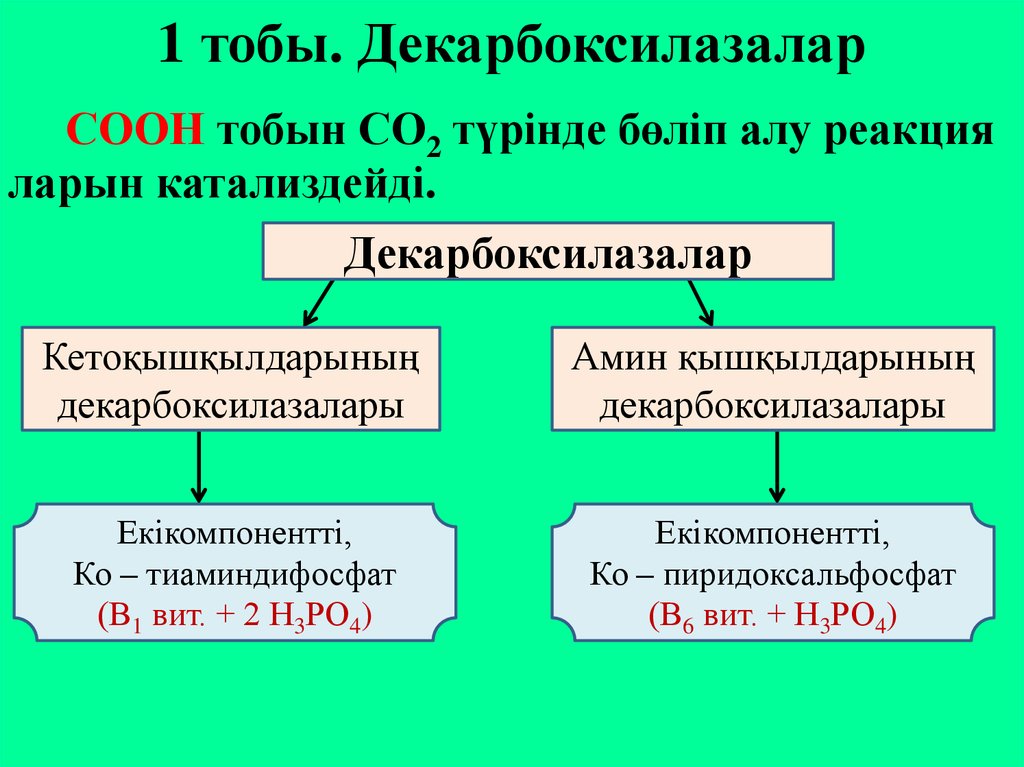
21. 1 тобы. Декарбоксилазалар
СООН тобын СО2 түрінде бөліп алу реакцияларын катализдейді.
Декарбоксилазалар
Кетоқышқылдарының
декарбоксилазалары
Амин қышқылдарының
декарбоксилазалары
Екікомпонентті,
Ко – тиаминдифосфат
(В1 вит. + 2 Н3РО4)
Екікомпонентті,
Ко – пиридоксальфосфат
(В6 вит. + Н3РО4)
22.
Кетоқышқылдарыныңдекарбоксилазалары
мультиферменттік
комплекстің құрамына кіреді, тотығудан
декарбоксилдену
реакциясын
катализдейді.
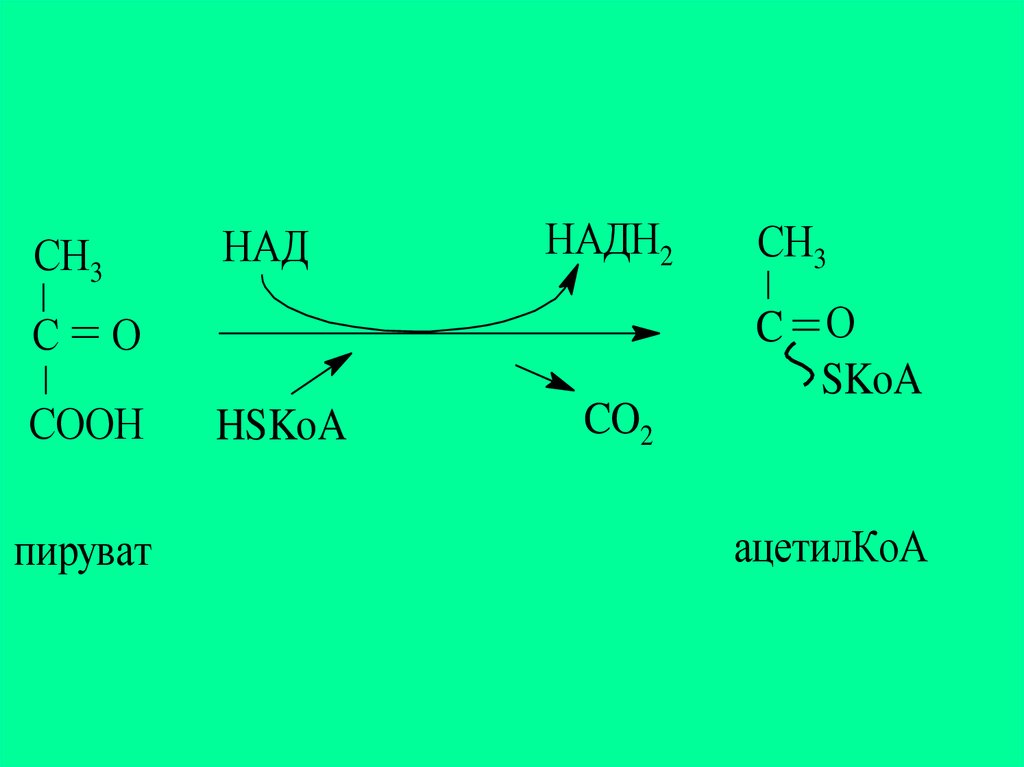
Өкілдері:
1.пируватдекарбоксилаза
(ПДК)
пируватдегидрогеназды мультиферменттік
комплекстің құрамына кіріп, ПЖҚ-ның
тотығудан декарбоксилдену реакциясын
катализдейді:
23.
НАДСН3
С
НАДН2
О
СOOН
пируват
HSKoA
CO2
СН3
C О
SKoA
ацетилКоА
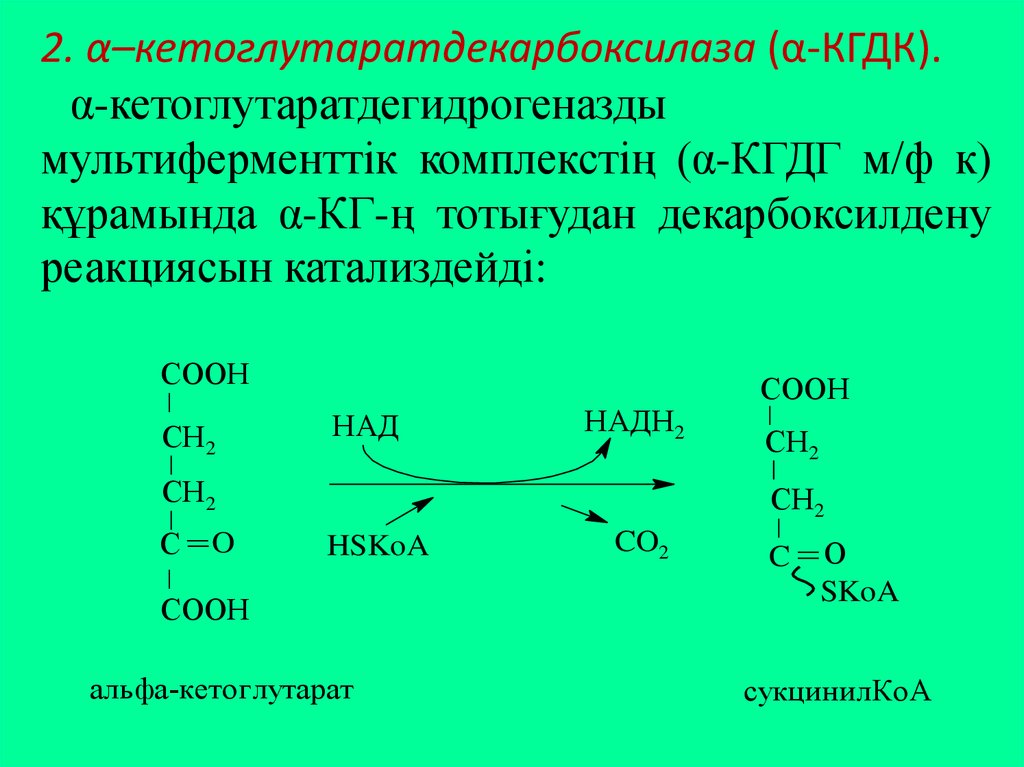
24.
2. α–кетоглутаратдекарбоксилаза (α-КГДК).α-кетоглутаратдегидрогеназды
мультиферменттік комплекстің (α-КГДГ м/ф к)
құрамында α-КГ-ң тотығудан декарбоксилдену
реакциясын катализдейді:
СOOН
СН2
НАД
НАДН2
СН2
С
O
СOOН
СН2
СН2
HSKoA
СOOН
альфа-кетоглутарат
CO2
C
О
SKoA
сукцинилКоА
25.
АҚ–ныңдекарбоксилазалары
екікомпонентті, Ко – пиридоксальфосфат
(В6 вит. + Н3РО4).
Бұл ферменттер
бактериялар үшін;
инфекциялық аурулар мен шіру үдерісінде
маңызы зор;
АҚ-ның аралық алмасуына қатысады.
АҚ-ның декарбоксилдену реакцияларын
(қайтымсыз) катализдейді, реакция өнімі –
биогенді аминдер (серотонин, гистамин,
ГАМҚ).
26.
Триптофанныңсеротонин түзіледі:
Триптофан
декарбоксилденуі
нәтижесінде
серотонин
5-гидрокситриптофан
СО2
СН2 СН NН2
НАДФН2 НАДФ
СН2 СН NН2
СOOН
НО
СOOН
NН
Триптофан
О2
Н2О
NН
5-гидрокситриптофан
СН2 СН2NН2
НО
СО2
NН
Серотонин
27.
Гистидиннен гистамин түзіледі:Гистидин
гистамин
СО2
СН2 СН СOOН
N
СН2 СН2 NН2
N
NН2
NН
Гистидин
СО2
NН
Гистамин
28.
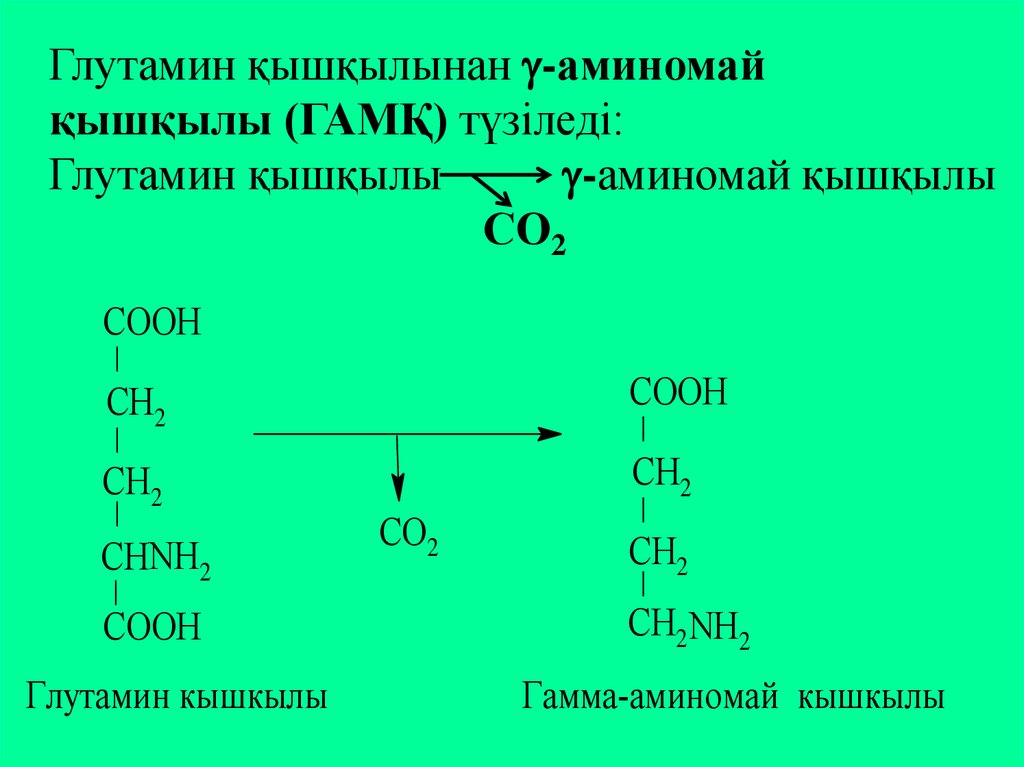
Глутамин қышқылынан -аминомайқышқылы (ГАМҚ) түзіледі:
Глутамин қышқылы
-аминомай қышқылы
СО2
СOOН
СН2
СOOН
СН2
СН2
СНNН2
СOOН
Глутамин кышкылы
СО2
СН2
СН2NН2
Гамма-аминомай кышкылы
29.
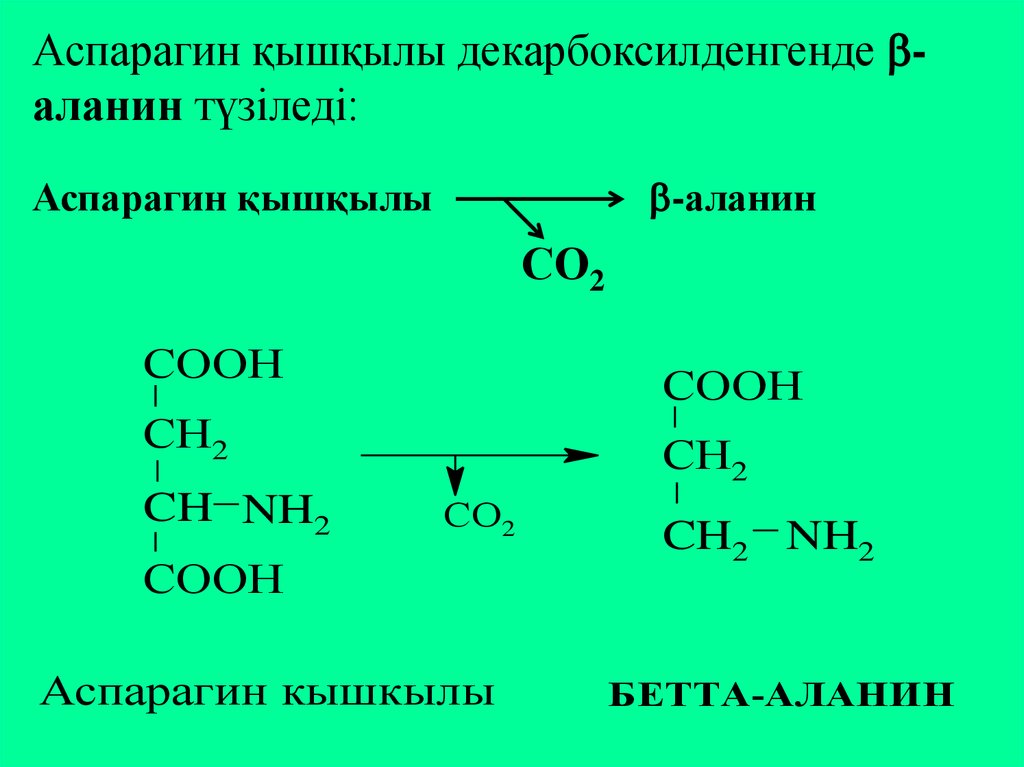
Аспарагин қышқылы декарбоксилденгенде аланин түзіледі:-аланин
Аспарагин қышқылы
СО2
CООН
CООН
CН2
CH NH2
CН2
СО2
CООН
Аспарагин кышкылы
CH2 NH2
БЕТТА-АЛАНИН
30.
2 тобы. Карбангидраза.Екікомпонентті, Ко-ң құрамында Zn 2+
бар. Катализдейтін реакциясы:
Н2О + СО2
Н2СО3
Негізінен эритроциттерде кездеседі,
СО2 тіндерден өкпеге тасымалдауға
қатысады. Бұл реакцияның бағыты
СО2 концентрациясына тәуелді. 1 л
қанда 2 г жуық фермент бар.
31. Трансферазалар класы
Трансферазалар – атом немесе атом топтарынбір қосылыстан екіншісіне тасымалдау
реакцияларын
катализдейтін
ферменттер
класы. Көбі екікомпонентті, жасушалық
ферменттер, тасымалдайтын топтарының
ерекшелігіне қарай 8 топқа бөлінеді.
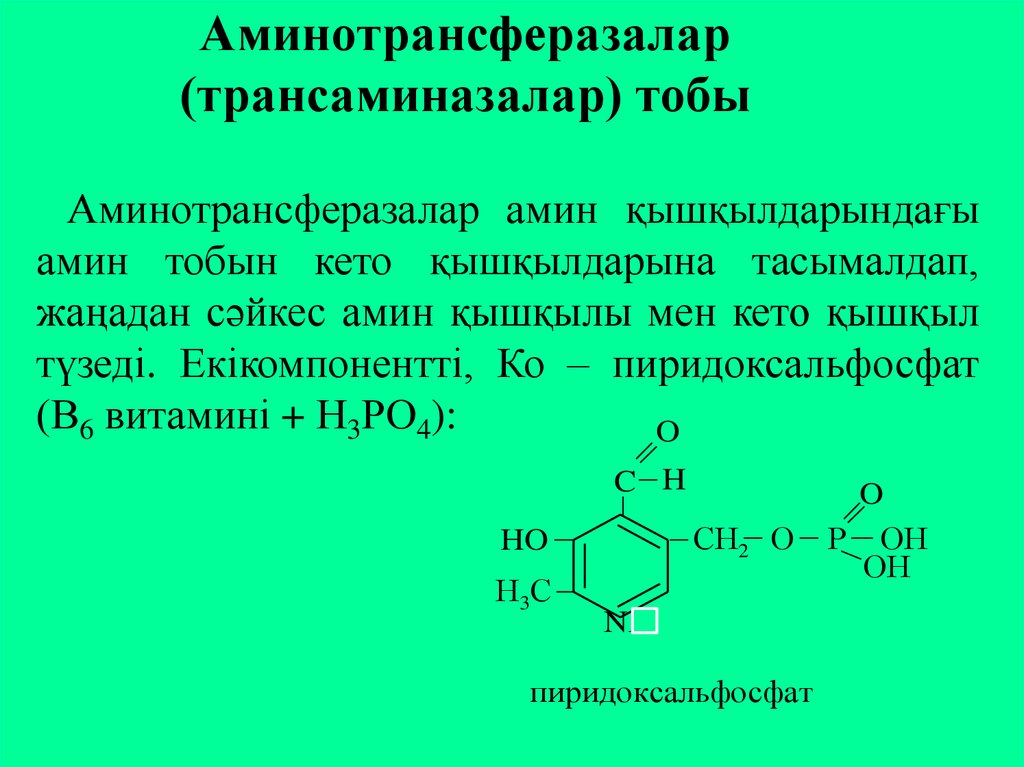
32. Аминотрансферазалар (трансаминазалар) тобы
Аминотрансферазалар амин қышқылдарындағыамин тобын кето қышқылдарына тасымалдап,
жаңадан сәйкес амин қышқылы мен кето қышқыл
түзеді. Екікомпонентті, Ко – пиридоксальфосфат
(В6 витамині + Н3РО4):
O
C H
СН2 O
HO
Н3С
NH
пиридоксальфосфат
O
P OН
OН
33.
Аминотрансферазалар катализдейтінреакцияларды қайта аминдену
(трансаминдену) деп атайды, реакциялар –
қайтымды.
Аминотрансферазалардың 20 -н астам түрі
бар, 2 өкіліне тоқталамыз:
1. Аланинаминотрансфераза (АЛТ)
2. Аспартатаминотрансфераза (АСТ)
34.
АЛТ және АСТ органдық арнайылығы барферменттер.
Бауыр ауруларында (гепатит, сарғыштану)
қанда АЛТ активтілігі артады.
Миокард инфарктысы кезінде қанда АСТ
активтілігі артады.
Сондықтан бұл ферменттерді анықтаудың
диагностикалық маңызы бар.
35.
Оксидоредуктазалар–
организмдегі тотығу-тотықсыздану
реакцияларын
катализдейтін
ферменттер класы.
Екікомпонентті
ферменттер,
жасушаларда кездеседі.
90 тобы бар, негізгі 4 тобын
қарастырамыз.
36.
ОксидоредуктазаларДегидрогеназалар
(аэробты, анааэробты)
Цитохромдар
Каталаза,
пероксидазалар
Оксигеназалар
37. Дегидрогеназалар (ДГ)
ДГ субстраттан сутегін, гидрид ионын (Н), электрондарды (е-) бөліп шығару арқылытотығу реакцияларын катализдейді.
сутекті (электронды) беруші зат –
сутектің (электронның) доноры,
сутекті (электронды) қосып алушы зат –
сутектің (электронның) акцепторы.
Реакция барысында Н немесе ежоғалтқан қосылыс тотығып, қосып алған
қосылыс тотықсызданады.
38.
ДГ-ң саны 150-ден асады.Негізгі өкілдері:
1)Пиридин ферменттері (ПФ);
2)Флавин
ферменттері
немесе
флавопротеиндер (ФП).
39. Пиридин ферменттері (ПФ)
ПФ – екі компонентті ферменттер.Ко:
никотинамидадениндинуклеотид (НАД)
никотинамидадениндинуклеотидфосфат
(НАДФ).
ПФ-нде апофермент пен кофермент Zn2+
арқылы әлсіз байланысқан.
40. ПФ коферменттерінің құрамы:
НАД-ң құрамы: • НАДФ -ң НАД -н
1. Никотинамид (РР
айырмашылығы:
вит.);
АМФ –ң
2. рибоза;
құрамындағы
3. фосфор
рибозаның 2/ ОН
қышқылы;
тобына фосфор
4. АМФ.
қышқылы қалдығы
қосылған.
41.
НАДМитохондрияда
кездеседі
Биологиялық
тотығуға (БТ)
қатысады, тіндік
тыныс алуды,
энергия бөлінуін
қамтамасыз етеді.
НАДФ
Цитоплазмада, микросомада
кездеседі
Биологиялық тотығуға
қатыспайды,
тотықсыздандырғыш ретінде:
• май қышқылдарының,
• холестеролдың,
• стероидты гормондардың
синтезіне;
• улы заттардың
детоксикациясына,
•гемнің ыдырауына қатысады.
42.
ПФ тотыққан және тотықсызданғанформада болады.
ПФ – біріншілік ДГ, яғни субстратты
тікелей тотықтырады.
ПФ құрылысы жағынан күрделі
болғанымен, іс жүзінде никотинамид
қана
тотығу-тотықсыздану
реакциясына қатысады. Қалған бөлігі
реакция барысында коферменттің
тұрақтылығын сақтап, реакцияның
ақаусыз жүруін қамтамасыз етеді.
43.
Никотинамид субстратты тотықтырады, өзітотықсызданады, яғни субстраттан бөлінген
Н атомын С4 орнына, ал 2е--ды 1-ші
орындағы азот ионына қосып алады.
Нәтижесінде никотинамидтегі 3 қос
байланыс 2 қос байланысқа, ал азот атомы
бейтарап
күйге
тотықсызданады.
Кофермент пен апофермент бөлініп кетеді:
ПФ (НАД)
тотыққан
SH2
S
НАДН2 + АпоЕ
тотықсызданған
44.
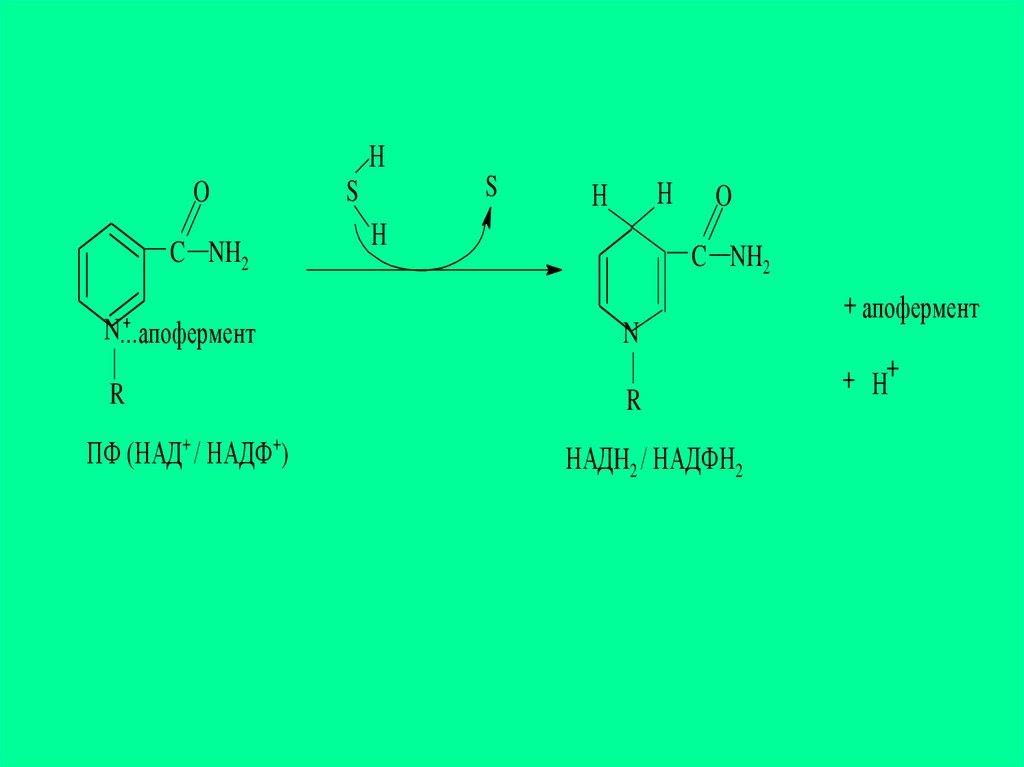
НO
C NH2
+
N...апофермент
R
ПФ (НАД+ / НАДФ+)
S
S
Н
Н
Н
O
C NH2
N
R
НАДH2 / НАДФH2
+ апофермент
+ Н+
45. Флавин ферменттері немесе флавопротеиндер (ФП).
ФП – екікомпонентті,Ко – флавинмононуклеотид (ФМН) және
флавинадениндинуклеотид (ФАД).
Ко-нің
құрамына
В2
витамині
(рибофлавин) кіреді.
Апофермент пен кофермент берік
байланысқан.
46.
Ко ФМН болатын ДГКо ФАД болатын ДГ
ФМН құрамы:
рибофлавин
(В2
витамині);
фосфор қышқылы
Екінші реттік ДГ,
субстратпен тікелей
әрекеттеспейді, сутегін
тотықсызданған ПФ-нен
(ПФ-НАДН2) қосып
алады.
БТ-ға қатысады.
ФАД-тың ФМН-нен
айырмашылығы:
ФМН-дегі 5/-фосфатқа АМФ
байланысқан
Бірінші реттік ДГ,
субстраттан сутегін тікелей
қосып алады. БТ-ға
қатысады.
Мысалы:
сукцинатдегидрогеназа (СДГ)
ферменті янтар қышқылын
фумар қышқылына дейін
тотықтырады, Ко ФАД
ФАДН2-ге тотықсызданады.
47.
ФП тотыққан күйінде сары түс береді,сондықтан оларды ХП-ге, соның ішінде
тыныс алу ферменттеріне жатқызады.
Тотықсызданған күйде түссізденеді.
ФП-нің тотығу-тотықсыздану потенциалы
(ТТП) жоғары, сондықтан олар ПФ-ны
тотықтырады, өзі тотықсызданған формаға
айналады:
НАДН2 НАД
ФП (ФМН)
ФПН2 (ФМНН2)
тотыққан
тотықсызданған
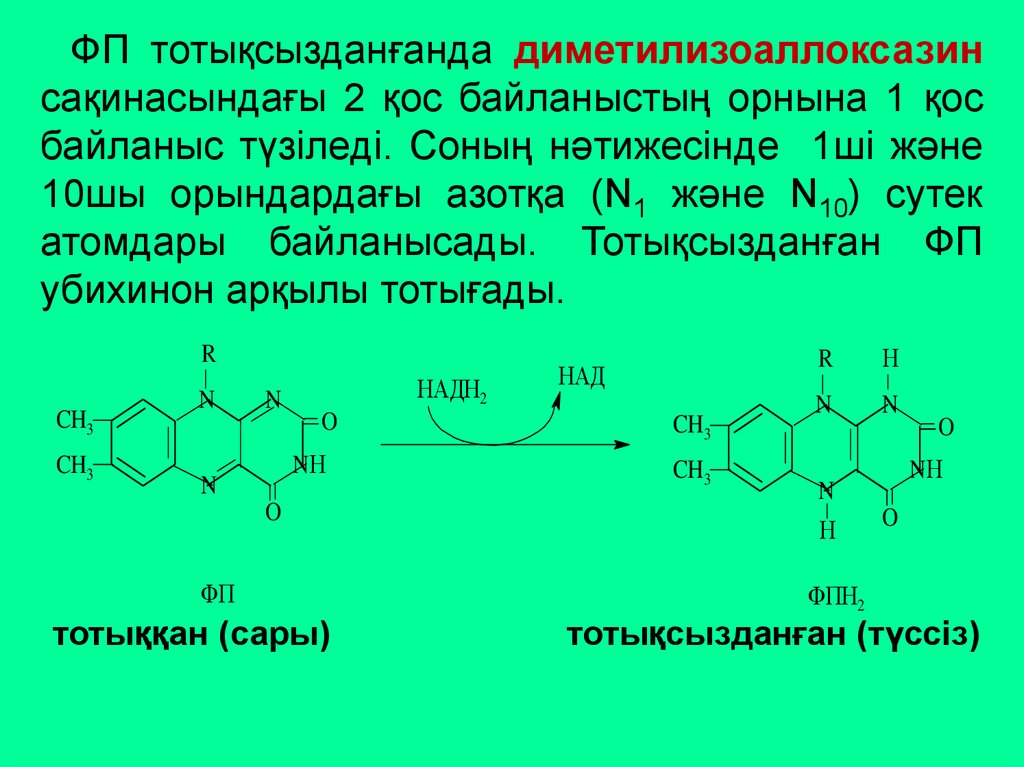
48.
ФП тотықсызданғанда диметилизоаллоксазинсақинасындағы 2 қос байланыстың орнына 1 қос
байланыс түзіледі. Соның нәтижесінде 1ші және
10шы орындардағы азотқа (N1 және N10) сутек
атомдары байланысады. Тотықсызданған ФП
убихинон арқылы тотығады.
R
CH3
CH3
N
N
НАДН2
O
NН
N
O
ФП
тотыққан (сары)
НАД
CH3
CH3
R
Н
N
N
NН
N
Н
ФПН2
O
O
тотықсызданған (түссіз)
49.
КейбірФП
оттегімен
тікелей
әрекеттесіп, сутегінің асқын тотығын
(Н2О2)
түзеді. Реакцияның сипаты
дегидрлену емес, оттегімен тотығу
болғандықтан, оларды оксидазалар
деп есептеуге болады. Мысалы,
ксантиноксидаза, моноаминоксидаза
(МАО), диаминоксидаза (ДАО).
50.
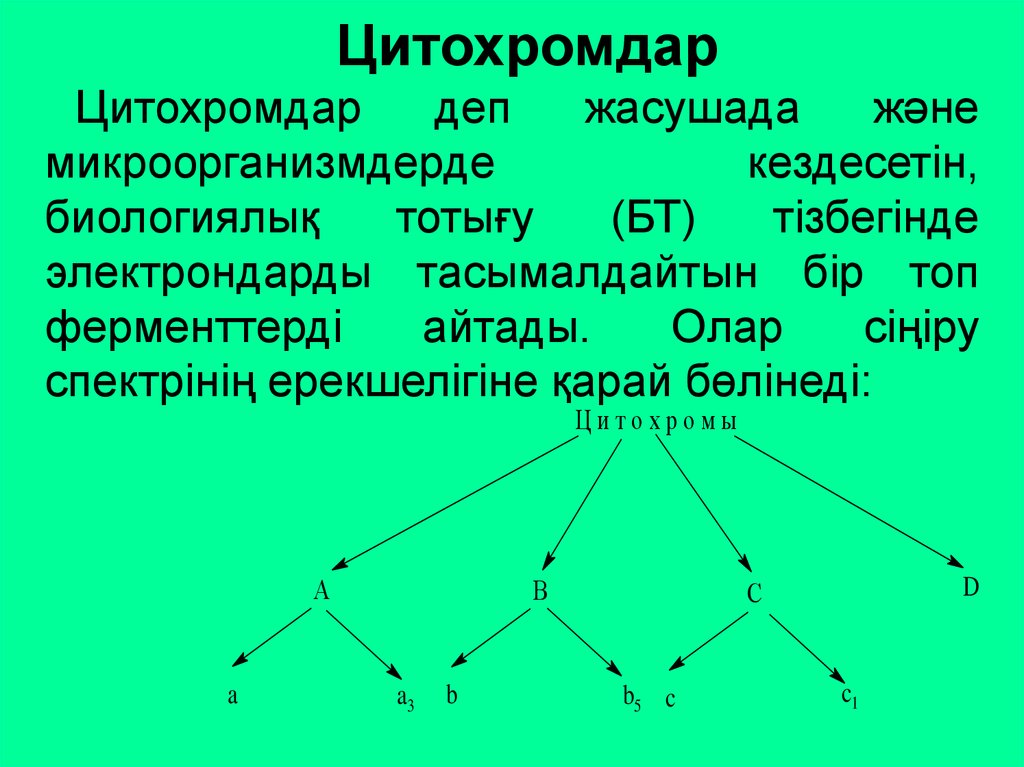
ЦитохромдарЦитохромдар
деп
жасушада
және
микроорганизмдерде
кездесетін,
биологиялық
тотығу
(БТ)
тізбегінде
электрондарды тасымалдайтын бір топ
ферменттерді
айтады.
Олар
сіңіру
спектрінің ерекшелігіне қарай бөлінеді:
Цитохромы
А
a
В
a3
b
D
С
b5 c
c1
51.
Цитохромдар (Цх) – екікомпонентті,Ко – гем және оның туындылары.
Гемнің құрамындағы темір ионы
ауыспалы валентті, сондықтан олар
электронды
қосып
алып,
тотықсызданған күйге (Fe2+) және
электронды жоғалтып, тотыққан күйге
(Fe3+) айналады.
тотыққан – ферри (Fe3+),
тотықсызданған – ферро (Fe2+).
52. Каталаза мен пероксидазалар
• Каталазаекікомпонентті,
Ко – 4 гем (Hb
геміндей, ерекшелігі
Ғе3+). Каталаза жануар
организмінде қан
құрамында кездеседі,
жасушаларды
пероксидтік тотығудан
қорғайды.
• Пероксидазалар
екікомпонентті,
Ко – 1 гем.
Пероксидаза
өсімдік
әлемінде кең тараған,
жануарлар организмінде
лейкоциттерде
миелопероксидаза,
сүтте лактатпероксидаза
бар.
2Н2О2 →2Н2О + О2
Н2О2 → Н2О + О
53. Оксигеназалар (Гидроксилазалар) тобы
Оксигеназалар – оттегін қосып алушыферменттер. Цитоплазмада, мембрананың
эндотелиалдық
жүйесінде,
митохондрияларда және микросомаларда
кездеседі.
Гидроксилазалар
екікомпонентті,
коферментінің құрамында С витамині бар.
54. Гидроксилазалардың ролі:
стероидтар, ксенобиотиктер және басқада циклді қосылыстардың алмасуында
маңызды роль атқарады,
холестерол мен адреналиннің синтезіне
қатысады.
Гидроксилазалар
моно–
диоксигеназалар
болып
2
бөлінеді.
және
топшаға
55. Оксигеназалар
Монооксигеназаларксенобиотиктерді
залалсыздандырудың
бірінші
сатысына
қатысады. Ол оттектің
бір атомын субстратқа,
екіншісін суға енгізу
реакцияларын
катализдейді:
RH + O2 + HAДФН + Н+→
ROH Н2О + НАДФ+
Диоксигеназалар
активті орталығында
темір
иондарының
электрондары арқылы
молекулалық
оттекті
активтендіріп,
оны
субстратқа
тікелей
енгізеді:
R + О2 → R О2
56. ӘДЕБИЕТТЕР:
Қазақ тілінде:1.Северин Е.С. (қазақ тіліне аударған және жауапты редакторы
А.Ж.Сейтембетова) «Биохимия», Мәскеу, 2014.
2. Сеитов З.С. Биологиялық химия, Алматы, 2012 ж.
3. Сейтембетов Т.С., Төлеуов Б.И., Сейтембетова А.Ж..
Биологиялық химия.-Қарағанды, 2007.
4. Тапбергенов С.О. Медициналық биохимия.-Павлодар.-2008.
5. Плешкова С.М. және басқалары Биохимияны студенттердің
өздігінен оқып-білуіне арналған оқу құралы
1Бөлім. Белоктар, ферменттер, энергия алмасуы, витаминдер.
2Бөлім. Заттар алмасуы және оның реттелуі.
3Бөлім. Адам ағзасындағы сұйықтықтар мен тіндер
биохимиясы.– Алматы, 2009 ж.
6.Биохимия пәнінен студенттердің өздігінен дайындалауына
арналған тест сұрақтары – Алматы, 2007
57. ӘДЕБИЕТТЕР:
Орыс тілінде:1.
2.
3.
4.
Северин Е,С. «Биохимия», М.: ГЭОТАР-МЕДИА, 2013г.
Сеитов З.С. «Биохимия», Алматы, 2012 г.
Harper's Illustrated Biochemistry, 29e, 2012 y.
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия
человека. 2003 г.
5. Кольман Я., Рем К-Г. Наглядная биохимия.- М.: Мир, 2004 г.
6. Шарманов Т.Ш., Плешкова С.М. «Метаболические основы
питания с курсом общей биохимии», г. Алматы, 1998г.












































 Химия
Химия








