Похожие презентации:
Инвазивные и неинвазивные методы диагностики
1. АО «Медицинский университет Астана» Кафедра внутренних болезней
*СРИ
Тема: Инвазивные и неинвазивные методы
диагностики Helicobacter pylori
Проверила:Айнабекова Б.А.
Выполнила:Тоганбаева Н. 622гр ВБ
Астана 2017
2. План:
*Введение
1.
2.
3.
4.
5.
6.
Микробиологическая характеристика HР
Патогенные свойства и пути инфицирования
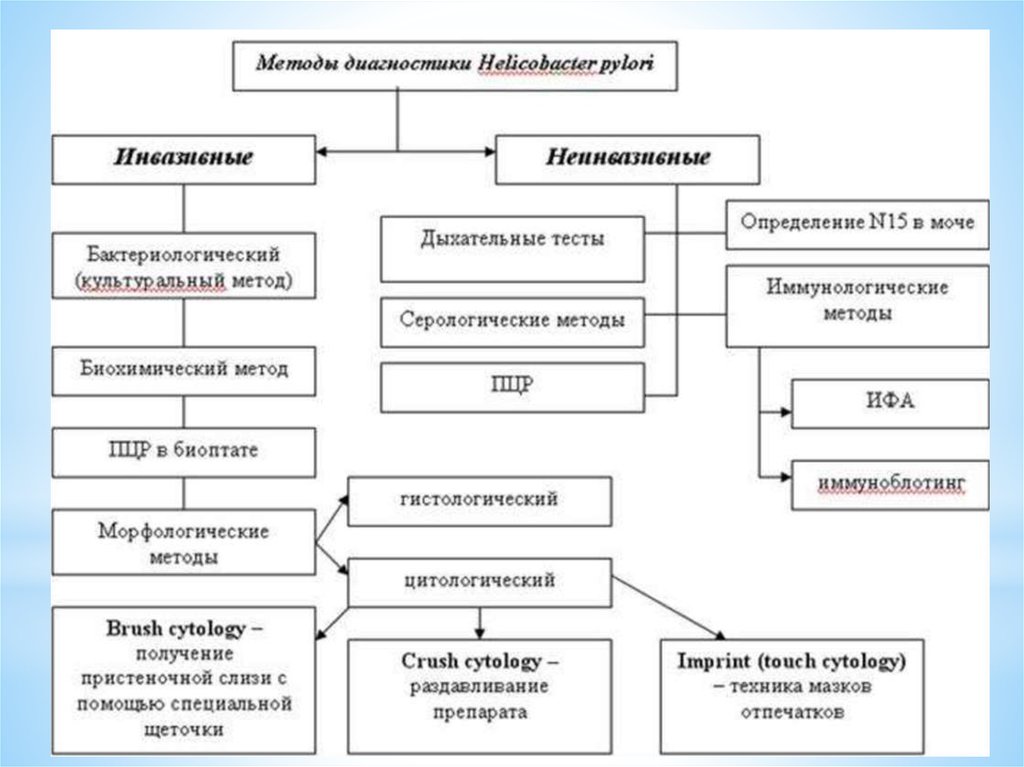
Инвазивные методы выявления Hp
Неинвазивные методы диагностики Hp
Специфичность и чувствительность методов
Методика проведения дыхательного уреазного теста
Заключение
Список использованной литературы
3. Введение
*Helicobacter pylori впервые была описана учёными из Австралии Барри
Маршаллом и Джеем Уорреном в начале 80-х годов прошлого столетия.
Причём Маршалл лично на себе провёл эксперимент, фтем самым
причину возникновения болезни
Бактерия Хеликобактер пилори – это патогенный микроорганизм
палочковидной формы с несколькими жгутиками на конце.
Хеликобактер образует колонии внутри желудочных складок,
поражая поверхность слизистого эпителия, с локализацией в защитном
слое внутренней оболочки желудка. Helicobacter паразитирует при
условии нормальной кислотности желудочного сока, верхний и нижний
уровень выживаемости при рН от 4 до 8, хорошо размножается при рН
от 6 до 8. Излюбленное место обитания – зона привратника, то есть
нижний отдел желудка. В итоге, Хеликобактер повышает кислотность
желудка в месте поражения, вызывая окислительный стресс, что ведёт
к программированию самоуничтожения клеток эпителия.
4.
5.
Helicobacter pylori с точки зрения современной медицины – этоодин из самых распространённых возбудителей заболеваний ЖКТ.
Хеликобактер опасна тем, что она может быть причиной ряда
болезней: гастрита, дуоденита, язвы желудка и 12-ти перстной кишки,
рака желудка.
Helicobacter pylori - микроаэрофильная грамотрицательная бактерия,
имеющая изогнутую S-образную или слегка спиралевидную форму.
При культивировании на искусственных питательных средах
принимает форму палочки, а при длительной культивации коккоидную форму .
Длина бактерии составляет 2,5-3,5 мкм, ширина - 0,5-1,0 мкм.
Наиболее благоприятными условиями существования геликобактера
являются температура 37-42oС и рН среды 6-8 . При более низких
значениях рН (4-6) бактерии сохраняют свою жизнеспособность, но
прекращают рост и размножение .
6.
7.
8.
* 1. Бактериологические:- обнаружение бактерий в мазках-отпечатках;
- выделение культуры НР
Бактериологический метод позволяет культивировать НР, используя
биоптаты СОЖ
* Культуральное исследование и стандартное определение
чувствительности Helicobacter pylori к антибиотикам перед
терапией первой линии важно проводить в регионах или
популяциях с высокой резистентностью к кларитромицину (более
15-20%)
* Бактериологический метод с определением чувствительности к
антибиотикам также необходимо применять при неэффективности
терапии второй линии . Специфичность метода составляет
практически 100%, чувствительность — 76-90%
9.
* Большим успехом в деле культивирования НР стало создание транспортныхсред, которые позволяют продлить срок транспортировки биоптата из
эндоскопического кабинета в микробиологическую лабораторию до 1 сут
(среды Стюарта, Кэри-Блер, Bio-Merieux). Следующий шаг - посев
биоптата на неселективные (например, агар Колумбия) и селективные
среды (селективная добавка может содержать ванкомицин, триметоприм,
полимиксин, подавляющие рост сопутствующей микрофлоры). Инкубация
посевов проводится при температуре 370С и влажности 98% в
микроаэрофильных условиях в течение 3-10 сут. НР растет в атмосфере 5%
кислорода, 5-10% углекислого газа, остальное количество составляет азот
Рост культуры НР происходит, как правило, на 3-й сутки. При появлении
колоний, сходных по морфологии с НР (диаметр до 0,5-2 мм, в виде "капель
росы", при сплошном росте образуют прозрачную пленку), проводится их
идентификация [46]. Для идентификации их окрашивают по Граму (под
микроскопом при наличии НР обнаруживают грамотрицательные
изогнутые палочки) и осуществляют биохимическое типирование
(уреазная, каталазная, оксидазная активность, НР не ферментирует глюкозу,
не продуцирует нитраты, не образует индол).
10. 2 Биохимический метод:
*- уреазный2 Биохимический метод:
тест с биоптатами;
- анализ выдыхаемого воздуха (аэротест, при котором в
выдыхаемом воздухе определяется содержание 13С или 14С после
принятия пациентом внутрь мочевины, предварительно меченной
указанными изотопами).
Основой быстрого уреазного теста является определение
Helicobacter pylori по уреазной активности микроорганизма в
биоптатах слизистой оболочки желудка. Helicobacter pylori
продуцирует уреазу, под влиянием которой происходит гидролиз
мочевины с образованием иона аммония. При этом увеличивается
рН среды, что можно зафиксировать с помощью изменения цвета
индикатора. Биоптаты слизистой оболочки желудка помещают в
раствор, содержащий мочевину и индикатор, изменение цвета
которого косвенно свидетельствует о наличии Helicobacter pylori.
Специфичность - 96%, чувствительность - 95%.
- . В настоящее время выпускаются уреазные тесты промышленного
производства: "CLO-тест", "Де-Нол-тест", "PyloriTek", "CUTтест", "ХЕЛПИЛ-тест", "Campy-test
11.
12.
13. 3. Морфологические: - цитологический - выявление НР в биоптате при окраске по Романовскому-Гимзе, по Граму и др.; -
*- Гистологический метод выявления НР считают "золотым
стандартом" диагностики инфекции
- Основой гистологического метода является микроскопическое
морфологическое и морфометрическое исследование парафиновых
срезов, окрашенных различными способами: гематоксилинэозином, по Гимзе, толуидиновым синим, по Вартину-Старри и др.
- -специфичность метода составляет 93-94%, чувствительность - 95%
. С использованием метода ПЦР возможно выделение
высокопатогенных и низкопатогенных штаммов Helicobacter pylori.
- Существенным недостатком гистологического метода является
длительный срок ожидания результатов, составляющий 5-7 дней
14. Цитологический метод:
*Цитологический метод:
* цитологического исследования используют мазки-отпечатки (1-2 и
более), полученные при эндоскопии из биоптатов антрального
отдела СОЖ. Биоптат берут прицельно из участков с наиболее
выраженными визуально отклонениями от нормы (гиперемия, отек),
но не из дна или язв и эрозий Высушенные мазки окрашивают по
Паппенгейму либо после фиксации метанолом смесью азура и
эозина или готовым красителем Романовского-Гимзы. Приведенные
методы окраски позволяют выявлять морфологические особенности
строения ядер и цитоплазмы клеток слизистой оболочки,
присутствие НР, ориентировочно оценивать количество
микроорганизмов. Однако цитологический метод не дает полной
информации о структуре исследуемой слизистой оболочки.
Диагностическая чувствительность цитологического метода
составляет 80-90%, специфичность - 100%
Предложенные способы выявления НР цитологическим методом в
желудочном соке полученном натощак, имеют низкие
чувствительность и специфичность, поэтому в настоящее время не
применяются.
15.
16. ПЦР
*ПЦР* ПЦР используется для амплификации ДНК и позволяет в
считанные часы размножить in vitro специфический участок ДНК
(т. е. любой интересующий нас ген) более чем и 200.000 раз. Чтобы
провести реакцию, достаточно иметь ДНК-материал I клетки;
количество амплифицированной с помощью ПЦР ДНК столь
велико, что эту ДНК можно просто окрашивать. Необходимым
условием для проведения ПЦР является знание нуклеотидной
последовательности амплифицируемой области ДНК для
правильного подбора искусственно синтезированных праймеров
Уникальность метода ПЦР состоит не только в высокой
чувствительности и специфичности для выявления НР. но и в том,
что материалом для него служат и биоптаты СОЖ, и желудочный
сок, и смывы ротовой полости, и зубной налет, и копрофильтраты
Диагностическая чувствительность ПЦР для выявления НР в
биоптатах СОЖ составляет 88-95,4%, специфичность - 100% в
копрофильтратах - соответственно 61,4-93,7 и 100%
17.
. Уреазный дыхательный тест, основанный наопределении 13С-мочевины, является лучшим тестом для диагностики
инфекции Helicobacter pylori . Это быстрый и высокоточный метод
определения инфицированности Helicobacter pylori слизистой оболочки
желудка по уреазной активности микроорганизма: способности уреазы
разлагать мочевину до NH4+ и HCO3- с последующим образованием из
HCO3- углекислого газа, который, попадая в кровоток, затем выделяется
через легкие и может быть определен спектрометром в выдыхаемом
воздухе. Специфичность метода - 93-100%, чувствительность - 95-97% . В
последние годы была разработана новая методика определения антигенов
Helicobacter pylori в кале, в которой вместо поликлональных антител
используются моноклональные . Этот метод является высокоточным
методом как для первичной диагностики Helicobacter pylori, так и для
контроля лечения.
18.
19.
Серологические методы:- реакция
связывания комплемента;
- реакция непрямой гемагглютинации;
- метод иммуноферментного анализа (ИФА);
- иммуноблоттинг;
- обнаружение НР в кале;
- обнаружение НР в слюне или транссудате
десен.
-Western-blot
20. ИФА
*ИФА* Метод неинвазивный и косвенный, в крови больного определяют
антитела к НР, относящиеся к IgA, IgM, чаще всего - к IgG.
Одними из первых метод ИФА применили В. Rathbone и соавт. ,
которые использовали в качестве антигена препарат из цельных
клеток НР, обработанных формалином. В дальнейшем для ИФА
и качестве антигена стали применять препараты термической
инактивации или ультразвуковой дезинтеграции НР. При
использовании этого метода в общем титре антител наиболее
ценным является определение уровней IgG- и lgA-антител к НР.
Чувствительность метода колеблется от 87 до 98%,
специфичность - от 75 до 100%
* Преимуществом метода ИФА является меньшая травматичность
по сравнению со всеми другими методами, где нужно получение
биоптата СОЖ. Кроме того, для анализа требуется несколько
микролитров сыворотки, в оборудованной лаборатории можно
одновременно выполнить десятки исследований и получить
результаты в короткие сроки (2,5-3 ч).
21. Western-blot
* Western-blot* Western-blot - встречная преципитация в геле антител в сыворотке
крови больного с различными белками НР, меченными зондами,
подвергнутыми разделению по молекулярной массе с помощью
электрофореза и нанесенными на нитроцеллюлозу. С помощью
данного метода штаммы НР в настоящее время подразделяют на 4
серотипа в зависимости от выработки микроорганизмами
цитотоксина VacA и цитотоксинассоциированного белка CagA: тип
I (CagA+, VacA+), тип Iа (CagA+, VacA-), тип Ib (CagA-, VacA+),
тип II (CagA-, VacA-) [65]. В своих исследованиях М. Plebani и
соавт. , В. Д. Пасечников и соавт. показали, что инфицирование
CagA-позитивными (серотип Iа) штаммами НР является фактором
риска развития выраженного воспалительного ответа в СОЖ.
Определение типа штаммов НР у инфицированных имеет важное
прогностическое значение.Пациенты с выявленными у них
штаммами CagA+ HP в значительно большей степени подвержены
риску развития язвенной болезни и рака желудка, чем
инфицированные штаммами CagA.
22.
*Метод"у постели больного". Они основанына латекс-агглютинации или твердофазном ИФА и выявляют
lgA-антитела к НР. Для проведения исследования нужна капля
крови, взятой из пальца, результат считывается буквально через
несколько минут, никаких дополнительных реактивов не
требуется. Диагностическая чувствительности таких тестов
составляет 94%. специфичность - 98% . Благодаря уникальной
простоте выполнения эти методы незаменимы в небольших
больницах или амбулаториях, где потребность в диагностике
определяется единичными анализами или в кабинете семейного
врача
23.
Тест-система «ГастроПанель», которая позволяетопределять в сыворотке крови уровни гастрина-17 (G-17), пепсиногенаI (PGI), пепсиногена-II (PGII), а также специфических
иммуноглобулинов класса G (IgG) к Helicobacter pylori . Тесты
основаны на технологии иммуноферментного анализа . Гастрин-17
вырабатывается G-клетками антрального отдела желудка, и при
атрофии в этом отделе уровень гастрина снижается.
В случае атрофического гастрита тела желудка при отсутствии
атрофии в антруме содержание гастрина-17 возрастает (> 10 пмоль/л) в
связи с включением механизма отрицательной обратной связи
регуляции кислотопродукции через гастрин. При атрофии тела желудка
снижается уровень сывороточного пепсиногена-I, который
продуцируется главными клетками тела желудка. Пепсиноген-II
вырабатывается во всех отделах желудка и в двенадцатиперстной
кишке, и при атрофическом гастрите тела желудка снижается
отношение пепсиноген-I/пепсиноген-II. Повышение уровня антител
IgG к Helicobacter pylori до 42 ЕIU (EIU — иммуноферментные
единицы) и более свидетельствует о наличии хеликобактерной
инфекции.
24.
Исключением является метод выявления антител к Нelicobacter pyloriв крови, который может быть критерием наличия инфекции на фоне
приема антисекреторных препаратов, поскольку титр антител в крови
сохраняется длительно. По этой же причине его не следует использовать
для оценки эффективности эрадикации. Контрольное исследование для
оценки эрадикации любым методом, кроме иммунологических, должно
проводиться не ранее, чем через 4 недели после окончания лечения
антибиотиками, препаратами висмута и ингибиторами протонной помпы.
Между тем каждый из применяемых методов имеет свои недостатки.
Возможно получение ложноотрицательных результатов при
серологическом исследовании сыворотки крови – вследствие
перекрестного реагирования антител; при быстром уреазном тесте – из-за
контаминации другими уреазопродуцирующими бактериями (протей,
псевдомонады, стрептококки, грибы рода Candida) или при наличии
уреазонегативных штаммов Нelicobacter pylori; при гистологическом
исследовании – из-за схожести морфологии ряда микроорганизмов; при
бактериологическом исследовании – из-за сложностей культивирования
Нelicobacter pylori или снижение эффективности выделения Нelicobacter
pylori в случаях низкой обсемененности .
25.
Как подготовиться к проведению дыхательного хелик-теста:* Обследование должно проводиться утром натощак: перед обследованием
необходимо исключить прием пищи и воды. Последний прием пищи должен
быть не менее чем за 12 часов до исследования. Последний прием пищи должен
быть «легким», необходимо исключить такие продукты как мясо, рыбу и грибы.
* Нельзя принимать:
* - антибиотики в течение 4-6 недель перед обследованием;
* - антациды (ингибиторы протонной помпы или Н2-блокаторы),
противовоспалительные средства, антисекреторные препараты, препараты
висмута и анальгетики в течение 14 дней перед обследованием.
* Нельзя принимать крепкие спиртные напитки в течение 3-х суток перед
обследованием.
* Нельзя есть бобовые (фасоль, горох, чечевицу, сою) в течение 3-х суток перед
обследованием.
* В день обследования необходимо отказаться от жевательной резинки.
* Нельзя курить за 3 часа до обследования; после курения необходимо почистить
зубы и тщательно прополоскать рот.
* Утром перед обследованием необходимо почистить зубы и тщательно
прополоскать рот.
26.
Как проводится дыхательный Хелик-тест:* Тщательно прополощите рот водой.
* Врач даст Вас индикаторную трубку. Поместите ее в ротовую полость. Ваш
рот должен быть приоткрыт, дышите ровно. Не касайтесь трубкой языка и
нёба, чтобы в нее не попала слюна. Если во рту накопилась слюна, можно
вынуть индикаторную трубку изо рта, проглотить слюну и поместить ее
обратно.
* По истечении 6 минут обследования врач попросит Вас вынуть
индикаторную трубку изо рта, выпить раствор карбамида, а затем
тщательно прополоскать рот водой.
* Снова поместите индикаторную трубку в ротовую полость на 6 минут.
* После этого отдайте индикаторную трубку врачу.
27. Заключение
*Инфицирование H.pylori приводит к увеличению риска развития
не только язвенной болезни, но и рака желудка .
Колонизация H.pyloriслизистой оболочки желудка неизменно
сопровождается возникновением воспаления и хронического гастрита,
хотя это часто протекает бессимптомно. Однако у большинства
инфицированных не развивается более тяжелых поражений желудочнокишечного тракта. Вероятно, исход инфекции определяется
комбинированным влиянием факторов, включая вариабельность
микроорганизмов и ответа хозяина на инфекцию, воздействие
окружающей среды. Штаммы H.pylori высокогетерогенны, и сagA(+)
штаммы вызывают наиболее выраженное воспаление и высокий
уровень секреции цитокинов , что предопределяет важную роль сagA в
развитии рака желудка.
28. Список использованной литературы
*1.Ивашкин В.Т., Лапина Т.Л. Гастроэнтерология XXI века. РМЖ 2000; 17:697-703.
2.Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней
желудка и кишечника. Москва: Триада-Х; 1998.
3.Periti P., Tonelli F., Capurso L., Nicoletti P. Managing Helicobacter pylori infection in
the new millennium: a review. J Chemotherapy 1999; 11(Suppl
4):3-55.4.Marshall B.J. Unidentified curved bacilli on gastric epithelium in active chronic
gastritis. Lancet 1983; 1:1273-5.
5.Marshall B.J., McGechie D.B., Rogers P.A., Glancy R.J. Pyloric campylobacter infection
and gastroduodenal disease. Med J Aust 1985; 142:436-9.
6.Goodwin C.S., Armstrong J.A., Chilvers T., et al. Transfer of Campylobacter
pylori and Campylobacter mustelae to Helicobacter gen. nov. as Helicobacter
pylori comb. nov. and Helicobacter mustelae comb. nov., respectively. Int J System
Bacteriol 1989; 39:397-405.
7.Ernst P.B., Gold B.D. The Disease Spectrum of Helicobacter pylori: the
immunopathogenesis of gastroduodenal ulcer and gastric cancer. Ann Rev Microbiol
2000; 54:615-40.
8.Blaser M.J. Clinical review. Science, medicine, and the future. Helicobacter pylori and
gastric diseases. BMJ 1998; 316:1507-10.


























 Медицина
Медицина








