Похожие презентации:
Растворы. Классификация дисперсных систем
1. РАСТВОРЫ
Лекция 52.
Сложные химические системы могут быть получены из чистых химических веществ в результате
дробления и перемешивания исходных фаз (диспергирования).
Дисперсные системы – это системы, состоящие из сплошной среды (называемой
дисперсионной средой) с распределенным в ней веществом (дисперсной фазой), которое
состоит из отдельных частиц с большой удельной поверхностью.
Растворы – это гомогенные системы переменного состава, образованные не менее чем
двумя компонентами
Растворитель - тот компонент, который находится в жидкой фазе и, как правило, превалирует
количественно
Образование раствора является самопроизвольным процессом, неизбежно протекающем
при контакте фаз. Это - принципиальное следствие Второго Начала термодинамики, поскольку
общая энтропия при смешении растет
Энергетической характеристикой процесса растворения является изменение энергии Гиббса в
ходе этого процесса.
Процессы
при растворении
Отрицательна
при любом
значении
энтальпии.
может быть как
положительной,
так и
отрицательной.
абсолютно нерастворимых
веществ нет
Положительна
и очень велика
эндотермический процесс разрушения
связей в растворяемом
веществе
экзотермический процесс образования
сольватов
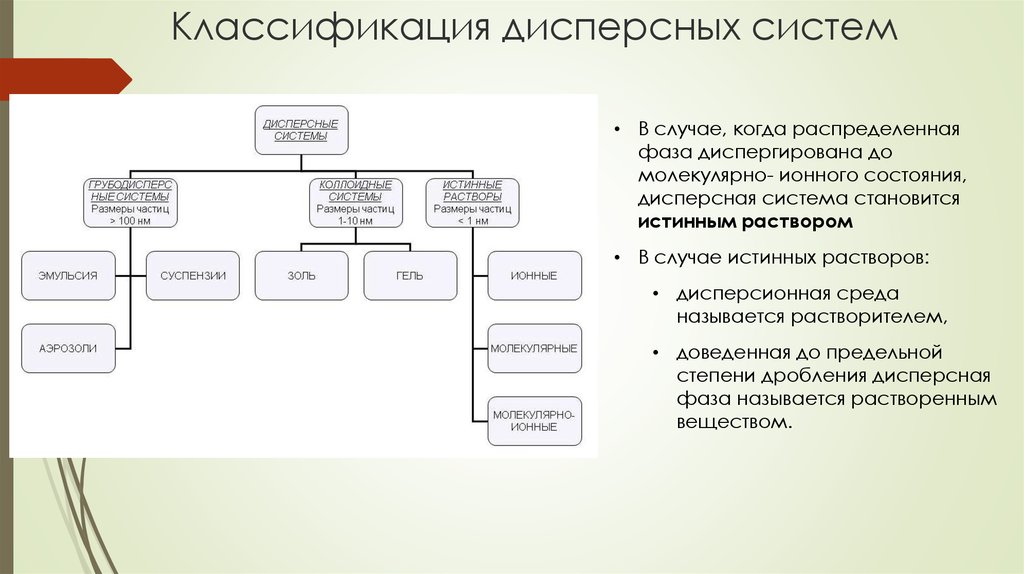
3. Классификация дисперсных систем
• В случае, когда распределеннаяфаза диспергирована до
молекулярно- ионного состояния,
дисперсная система становится
истинным раствором
• В случае истинных растворов:
• дисперсионная среда
называется растворителем,
• доведенная до предельной
степени дробления дисперсная
фаза называется растворенным
веществом.
4. Дисперсные системы
Суспензии (suspensio) — это такие системы, которые состоят из раздробленного твердоговещества и жидкой фазы. Размер частиц в них колеблется от 0,1 до 50 мкм и более
(грубодисперсные системы). Суспензии гетерогенны, но в отличие от коллоидных
растворов это мутные жидкости, частицы которых видны под обычным микроскопом. Эти
жидкости седиментируют, их частицы задерживаются даже крупнопористыми
фильтрующими материалами. Они не склонны к диализу и диффузии.
Эмульсии (emulsus) представляют собой дисперсные системы, в которых и дисперсная
фаза, и дисперсионная среда представлены взаимонерастворимыми или мало
взаиморастворимыми жидкостями. Эмульсии относятся к грубодисперсным системам, в
которых размер дисперсных частиц (капелек) колеблется в пределах от 1 до 150 мкм, но в
некоторых случаях они бывают и более высокодисперсными
Золи - жидкая (лиозоль) или газообразная (аэрозоль) дисперсионная среда, в объеме
которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа
или мелких твердых частиц
Гели - состоят, по крайней мере, из двух компонентов, один из которых образует
непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса,
пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной
средой.
5.
Процесс растворения твердого тела в жидкости является результатом явлениясольватации – взаимодействия молекул растворителя с частицами
растворяемого вещества.
В результате этого взаимодействия возникают сольваты – образования
молекулярных размеров, представляющие собой ассоциаты частиц
растворяемого вещества (A) с молекулами растворителя (R):
В случае, когда растворителем является вода, процесс называется
гидратацией, а ассоциаты – гидратами.
Процесс сольватации может приводить к распаду молекул растворяемого
вещества на заряженные частицы - электролитическая диссоциация.
6.
Концентрации (размерные величины)ХАРАКТЕРИСТИКИ РАСТВОРОВ
Процентная концентрация (массовая) – количество граммов растворенного вещества в 100
граммах раствора [%], или количество миллиграммов вещества в 100 граммах раствора
[мг%]
Процентная концентрация (объемная) – количество миллилитров растворенного вещества в
100 миллилитров раствора [об.%]
Молярная концентрация (молярность) – количество молей растворенного вещества в литре
раствора [моль/л]
Массовая концентрация – масса растворенного вещества в литре раствора [г/л]
Моляльная концентрация (моляльность) – количество молей растворенного вещества в 1000
граммах растворителя. [моль/1000 г р-рителя]
Нормальная концентрация (нормальность) – количество молей химического эквивалента
растворенного вещества в литре раствора [моль-экв/л]
Доли (безразмерные величины)
Мольная доля – отношение числа молей растворенного компонента к общему числу молей
раствора.
Массовая доля – отношение массы растворенного компонента к общей массе раствора.
Объемная доля (для смесей газов и растворов ж-ж) – отношение объема растворенного
компонента к сумме объемов растворителя и растворенного вещества до начала процесса
растворения.
7.
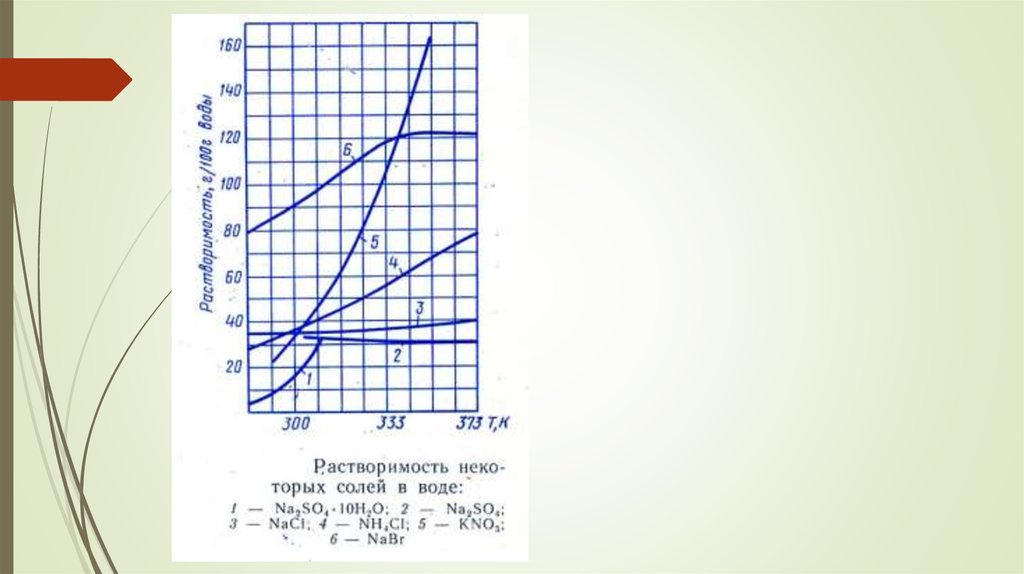
Растворимость - предельное количество растворяющегося в растворе вещества.[г/100г растворителя].
Чем более похожи по характеру и энергетике химических связей растворитель и
растворяемое вещество, тем растворимость, как правило, больше («подобное
растворяется в подобном»)
РАСТВОРЫ
AmBn mAn+ + nBm-
ненасыщенные
содержание
растворенного
вещества в
растворе меньше
растворимости
насыщенные
содержание
растворенного
вещества в
растворе равно
растворимости
пересыщенные
содержание
растворенного
вещества в
растворе больше
растворимости
8. Понятие об идеальных растворах
Идеальный раствор – это раствор, при образовании которого не изменяется внутренняяэнергия системы ( ∆Us = 0), растворение не сопровождается тепловым эффектом (∆Hs =0) и
остается постоянным объём системы ( ∆Vs = 0).
Для газов, объем которых при переходе в раствор значительно уменьшается (имеется в виду
объем чистого газа и объем раствора, содержащего то же количество компонента),
зависимость растворимости от давления характеризуется законом Генри:
где Pk – парциальное давление k-го газообразного компонента, находящегося над раствором,
Kk – константа Генри для этого компонента.
Влияние температуры на процесс растворения имеет сложный характер и зависит от знака
теплового эффекта процесса растворения.
Для экзотермического процесса растворения газов с ростом температуры растворимость
уменьшается
Для твердых тел возможно как увеличение, так и уменьшение растворимости с ростом
температуры
9.
10. Коллигативные свойства растворов
Коллигативные (общие) свойства растворов – свойства, которыене зависят от природы растворенного вещества
Поведение насыщенного пара
Явление осмоса
при растворении нелетучего компонента в поверхностном слое
жидкости концентрация молекул растворителя уменьшается,
уменьшается и давление ее пара P по сравнению с давлением
насыщенного пара над чистым растворителем P0
Закон Рауля: Отношение понижения давления пара растворителя
над раствором нелетучего вещества к давлению пара чистого
растворителя равно мольной доле растворенного вещества.
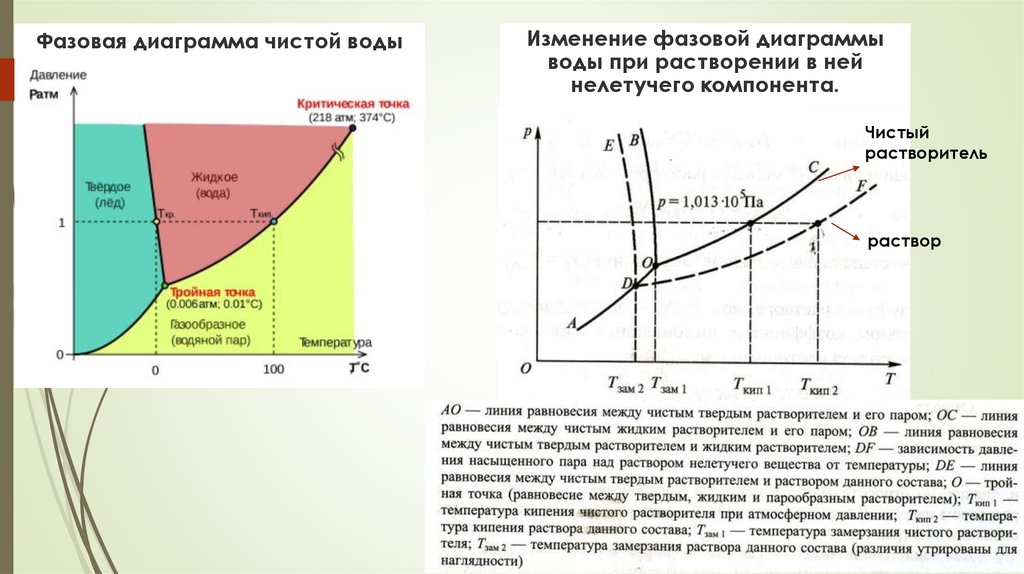
11. Фазовая диаграмма чистой воды
Изменение фазовой диаграммыводы при растворении в ней
нелетучего компонента.
Чистый
растворитель
раствор
12. Следствия из закона Рауля
повышение температуры кипения раствора по сравнению стемпературой кипения чистого растворителя
Tкип.= Tкип Т0кип
Tкип.= Екип. Сm
Екип.– эбулиоскопическая постоянная растворителя
для воды
Екип.= 0,52, Т0кип = 373,1 К
для этилового спирта Екип = 1,20 Т0кип = 351,4 К
Сm - моляльная концентрация раствора
Температура
кипения раствора
выше температуры
кипения чистого
растворителя
понижение температуры кристаллизации растворителя из раствора по
сравнению с температурой кристаллизации чистого растворителя
Tкрист.= Т0крист. Tкрист.
Tкрист.= Ккрист. Сm
Ккрист.– криоскопическая постоянная растворителя
для воды
Ккрист.= 1,86,
Т0крист. = 273,1 К
для камфоры
Ккрист. = 40
Т0крист. = 447,4 К
Для растворов
неэлектролитов
Температура
замерзания
раствора ниже
температуры
замерзания чистого
растворителя
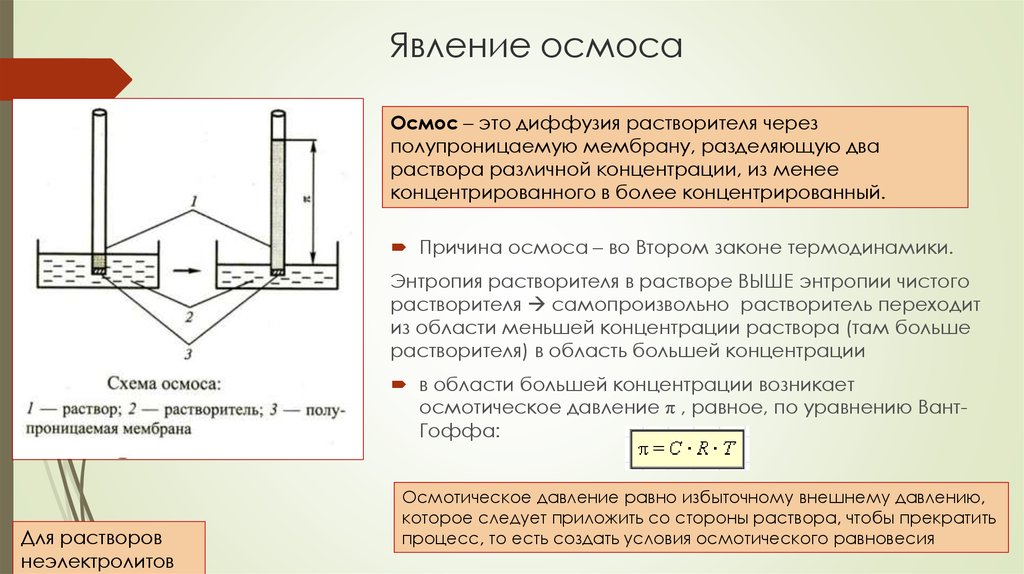
13. Явление осмоса
Осмос – это диффузия растворителя черезполупроницаемую мембрану, разделяющую два
раствора различной концентрации, из менее
концентрированного в более концентрированный.
Причина осмоса – во Втором законе термодинамики.
Энтропия растворителя в растворе ВЫШЕ энтропии чистого
растворителя самопроизвольно растворитель переходит
из области меньшей концентрации раствора (там больше
растворителя) в область большей концентрации
в области большей концентрации возникает
осмотическое давление π , равное, по уравнению ВантГоффа:
Для растворов
неэлектролитов
Осмотическое давление равно избыточному внешнему давлению,
которое следует приложить со стороны раствора, чтобы прекратить
.
процесс,
то есть создать условия осмотического равновесия
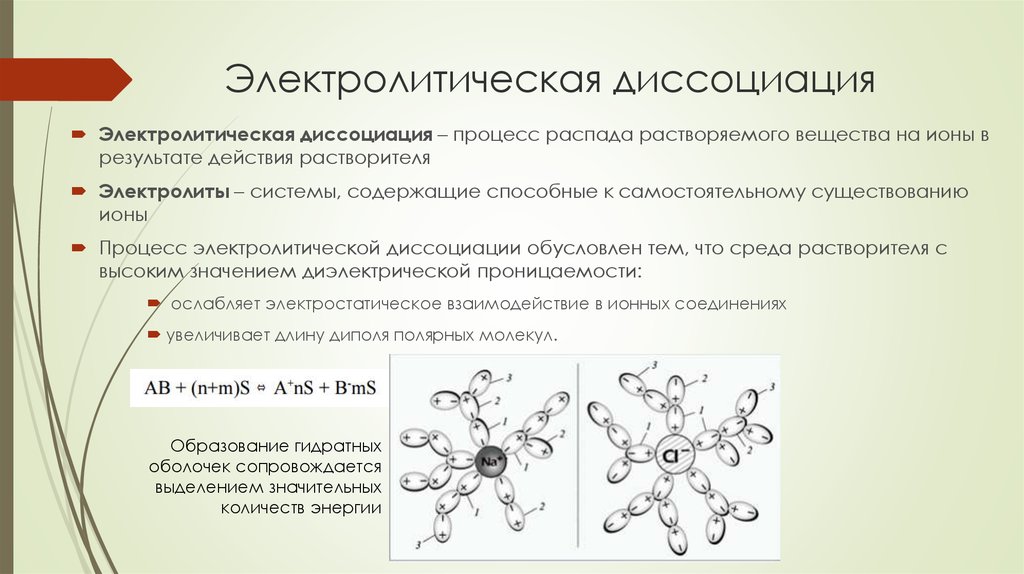
14. Электролитическая диссоциация
Электролитическая диссоциация – процесс распада растворяемого вещества на ионы врезультате действия растворителя
Электролиты – системы, содержащие способные к самостоятельному существованию
ионы
Процесс электролитической диссоциации обусловлен тем, что среда растворителя с
высоким значением диэлектрической проницаемости:
ослабляет электростатическое взаимодействие в ионных соединениях
увеличивает длину диполя полярных молекул.
Образование гидратных
оболочек сопровождается
выделением значительных
количеств энергии
15. Количественные характеристики электролитической диссоциации
Константа электролитической диссоциации Кe.d.:Степень электролитической диссоциации α - отношение числа
распавшихся на ионы частиц к общему числу перешедших в
раствор молекул
Коэффициент диссоциации i - количество частиц, в среднем
возникающее при переходе в раствор одной молекулы
растворенного вещества,
n - число ионов, образующихся при полной
Tкип.= i Екип. Сm
диссоциации растворенного вещества
Tкрист.= i Ккрист. Сm
π.= i C R T
i – изотонический коэффициент Вант-Гоффа,
численно равен коэффициенту диссоциации
16.
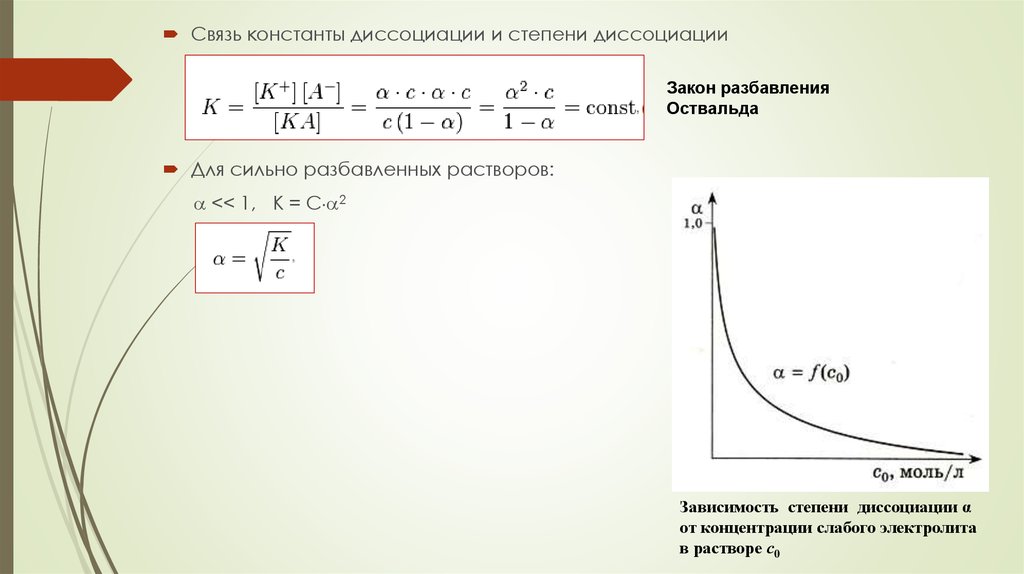
Связь константы диссоциации и степени диссоциацииЗакон разбавления
Оствальда
Для сильно разбавленных растворов:
<< 1, K = C 2
Зависимость степени диссоциации α
от концентрации слабого электролита
в растворе с0
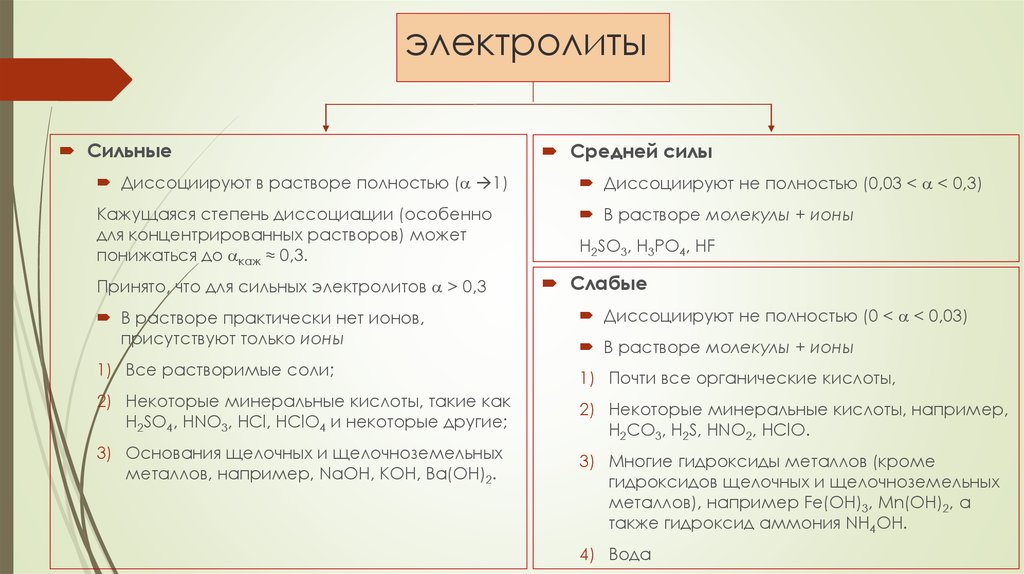
17. электролиты
СильныеСредней силы
Диссоциируют в растворе полностью ( 1)
Диссоциируют не полностью (0,03 < < 0,3)
Кажущаяся степень диссоциации (особенно
для концентрированных растворов) может
понижаться до каж ≈ 0,3.
В растворе молекулы + ионы
Принято, что для сильных электролитов > 0,3
H2SO3, H3PO4, HF
Слабые
В растворе практически нет ионов,
присутствуют только ионы
Диссоциируют не полностью (0 < < 0,03)
1) Все растворимые соли;
1) Почти все органические кислоты,
2) Некоторые минеральные кислоты, такие как
H2SO4, HNO3, HCl, HClO4 и некоторые другие;
3) Основания щелочных и щелочноземельных
металлов, например, NaOH, KOH, Ba(OH)2.
В растворе молекулы + ионы
2) Некоторые минеральные кислоты, например,
H2CO3, H2S, HNO2, HClO.
3) Многие гидроксиды металлов (кроме
гидроксидов щелочных и щелочноземельных
металлов), например Fe(OH)3, Мn(OH)2, а
также гидроксид аммония NH4OH.
4) Вода
18. Электролитическая диссоциация воды
Вода – слабый электролит: при 18 °С степень диссоциации воды равна 1,5 10-9молярная концентрация воды в воде
CH2O=Const =55,56 моль/л
ионное
произведение
воды.
Квод = 10-14 моль2 /л2 при 298 К
pH= -lgCH+
pОH= -lgCОН+
pH + рОН= 14











 Химия
Химия








